







Preview text:
Nội dung
Chương 5. Điện cực và đo điện thế............................................................................................ 1
5.1. Các điện cực so sánh ....................................................................................................... 1
5.1.1. Điện cực so sánh bạc-bạc clorua .............................................................................. 2
5.1.2. Điện cực calomen .................................................................................................... 2
5.2. Điện thế tiếp xúc (liquid-junction potentials) ................................................................. 3
5.3. Các điện cực chỉ thị ......................................................................................................... 4
5.3.1. Các điện cực kim loại .............................................................................................. 5
5.3.2. Các điện cực màng ................................................................................................... 6
5.3.3. Các sensor hóa học dạng rắn .................................................................................. 12
5.4. Câu hỏi ôn tập ............................................................................................................... 12
Chương 5. Điện cực và đo điện thế
Các nhà hóa học thông minh đã thiết kế ra các điện cực. Các điện cực này phản hồi chọn lọc
với chất cần phân tích trong dung dịch (pha lỏng) hay trong pha khí. Kích thước của các điện
cực chọn lọc ion chỉ cỡ kích thước của cái bút viết. Các nhà hóa học thực sự rất thông minh
khi tạo ra các điện cực bán dẫn cảm biến ion kích thước siêu nhỏ cỡ vài trăm micromet và có
thể đưa vào các mạch máu. Việc sử dụng các điện cực để đo điện thế từ đó cho ta thông tin
về hóa học được gọi là đo điện thế.
Trong trường hợp đơn giản nhất, chất phân tích là các hạt có hoạt tính điện (electroactive) và
là một phần của pin galvanic. Một điện cực, chả hạn như thanh Pt có thể nhúng vào một dung
dịch chưa biết nồng độ, điện cực này có thể truyền electron tới hoặc từ chất phân tích. Do
điện cực này phản hồi với chất phân tích nên nó được gọi là điện cực chỉ thị. Chúng ta nối
nửa pin này với nửa pin còn lại qua 1 cầu muối. Nửa thứ hai của pin có thành phần cố định,
nó có điện thế là không đổi. Bởi vì điện thế của nó không đổi nên nửa thứ hai của pin được
gọi là điện cực so sánh. Điện thế của pin là sự khác nhau giữa thế của điện cực chỉ thị và điện cực so sánh.
5.1. Các điện cực so sánh
Một điện cực so sánh lý tưởng là điện cực có điện thế đã được biết trước chính xác,
không đổi và hoàn toàn không nhạy cảm với chất phân tích. Ngoài ra, điện cực này phải 1
chắc chắn, dễ dàng lắp ráp và duy trì được thế không đổi khi có các dòng điện nhỏ chạy qua.
5.1.1. Điện cực so sánh bạc-bạc clorua
Điện cực bạc-bạc clorua trên hình 5-1 dựa trên phương trình AgCl(r) + e– ⇋ Ag(r) + Cl– E° = +0,222V
Ess (KCl bão hòa) = + 0,222 + = + 0,197V
Thế khử tiêu chuẩn E° cho phản ứng này là +0,222V. Nếu pin được bão hòa với KCl ở
25°C, thế này là +0,197V.
Hình 5-1. Điện cực so sánh bạc-bạc clorua
5.1.2. Điện cực calomen
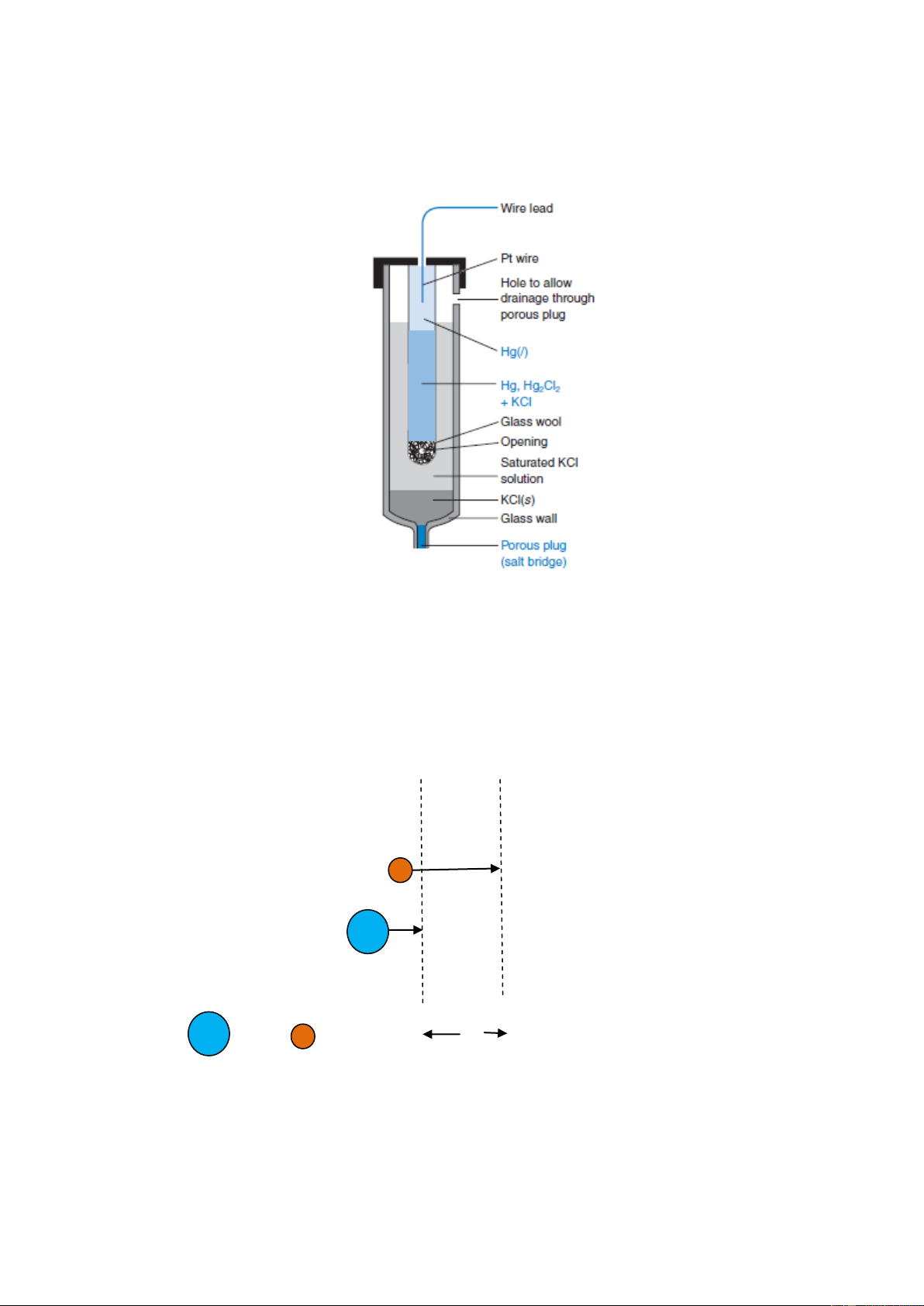
Điện cực calomen trên hình 5-2 dựa trên phản ứng điện cực ½ Hg2Cl2(r) + e– ⇋ Hg(l) + Cl– E° = +0,268V
Thủy ngân (I) clorua (calomen)
Ess. (KCl bão hòa) = + 0,268 + = + 0,241V
Thế khử tiêu chuẩn E° cho phản ứng này là +0,068V. Nếu pin được bão hòa với KCl ở
25°C, thế này là +0,241V. Điện cực calomen bão hòa được viết tắt là S.C.E (saturated 2
calomel electrode). Sự thuận tiện trong việc sử dụng KCl là [Cl–] là không thay đổi khi chất lỏng bay hơi.
Hình 5-2. Điện cực calomen bão hòa
5.2. Điện thế tiếp xúc (liquid-junction potentials)
Điện thế tiếp xúc xuất hiện dọc theo lớp biên giữa các dung dịch điện ly có thành phần khác nhau. HCl 1M HCl 0,01M – + Cl– H+ Ej
Hình 5-3. Sơ đồ chỉ ra thế tiếp xúc E . Độ j
dài của mũi tên tỉ lệ với độ linh động của hai ion
Hình 5-3 chỉ ra một ví dụ đơn giản về tiếp xúc giữa dung dịch HCl 1M và dung dịch HCl
0,01M. Một màng xốp, ngăn cản hai dung dịch này khỏi sự trộn lẫn. Cả ion H+ và Cl– có xu 3
hướng khuếch tán từ phía có nồng độ cao đến phía có nồng độ thấp. Lực điều khiển các ion tỉ
lệ với hoạt độ giữa hai dung dịch.
Ở ví dụ đang xét, các ion hydro chuyển động nhanh hơn các ion Cl–, như đã được chỉ ra trên
hình vẽ và kết quả là có một sự phân cực về điện tích. Phía bên nồng độ thấp điện tích ở lớp
biên sẽ trở lên dương hơn. Phía bên nồng độ cao có điện tích ở lớp biên âm hơn do sự chuyển
động chậm hơn của các ion Cl–. Sự tăng điện tích ở lớp biên có xu hướng chống lại sự khác
nhau giữa tốc độ khuếch tán giữa hai ion và cân bằng đạt được nhanh chóng. Sự khác nhau về
điện thế được tạo ra do sự phân cực điện tích có thể một vài phần trăm của vôn.
Cường độ của thế tiếp xúc có thể giảm đi tối đa bằng cách sử dụng cầu muối giữa hai dung
dịch. Cầu muối sẽ hiệu quả nhất nếu độ linh động của ion âm và ion dương trong cầu muối là
xấp xỉ nhau và nếu nồng độ của chúng lớn. Dung dịch KCl bão hòa thỏa mãn cả hai yêu cầu
trên (bảng 5-1). Thế tiếp xúc của một cầu muối như vậy là vài milli vôn.
Bảng 5-1. Độ linh động của các ion trong nước ở 25°C Ion
Độ linh động, m2/V.s Ion
Độ linh động, m2/V.s H+ –8 –8 36,30×10 Fe(CN) 4– 6 11,45×10 Rb+ –8 –8 7,92×10 Fe(CN) 3– 6 10,47×10 K+ –8 –8 7,62×10 SO 2– 4 8,27×10 NH + –8 – –8 4 7,61×10 Br 8,13×10 La3+ –8 – –8 7,21×10 I 7,96×10 Ba2+ –8 – –8 6,59×10 Cl 7,91×10 Ag+ –8 – –8 6,42×10 NO 3 7,40×10 Ca2+ –8 – –8 6,12×10 ClO 4 7,05×10 Cu2+ –8 – –8 5,56×10 F 5,70×10 Na+ –8 – –8 5,19×10 HCO 3 4,61×10 Li+ –8 – –8 4,01×10 CH 3CO2 4,24×10 – –8 OH 20,50×10
Lưu ý rằng độ không đảm bảo về cường độ của thế tiếp xúc dọc theo cầu muối là nguyên
nhân hạn chế độ chính xác của phương pháp phân tích bằng đo điện thế.
5.3. Các điện cực chỉ thị
Một điện cực chỉ thị lý tưởng phản hồi nhanh chóng và lặp lại với sự thay đổi nồng độ
của một ion chất phân tích. Các điện cực chỉ thị được chia làm ba loại: kim loại, màng và
các bóng bán dẫn chọn lọc ion. 4
5.3.1. Các điện cực kim loại
Điện cực kim loại phổ biến nhất là điện cực platin, là loại điện cực trơ – nó không tham
gia vào phản ứng. Điện cực này có nhiệm vụ đơn giản là chuyển các electron vào hay từ
các phần từ trong dung dịch. Các điện cực vàng có phần trơ hơn Pt. Có nhiều loại cacbon
được sử dụng làm điện cực chỉ thị vì tốc độ của nhiều phản ứng oxy hóa khử trên bề mặt
điện cực cacbon rất nhanh. Điện cực kim loại làm việc tốt khi có bề mặt sạch và rộng. Để
làm sạch điện cực, nhúng điện cực trong dung dịch HNO3 nóng và sau đó rửa lại bằng nước cất.
Hình 5-4 chỉ ra phương thức làm việc của điện cực Ag khi nó kết hợp với điện cực so
sánh để đo nồng độ Ag+. Phản ứng ở điện cực Ag là: Ag+ + e– ⇋ Ag(r) E° = +0,799V
Phản ứng ở điện cực so sánh là: ½ Hg2Cl2(r) + e– ⇋ Hg(l) + Cl– E° = +0,268V
Hình 5-4. Sử dụng điện cực Ag và điện cực so sánh calomen để xác định nồng độ [Ag+]
Thế của điện cực so sánh được cố định ở 0,241V bởi vì pin điện cực được bão hòa với
KCl. Phương trình Nernst cho toàn bộ pin bởi vậy sẽ là: 5 E = 0,558 + 0,05916log[Ag+] (5-1)
Điều này có nghĩa là thế của pin trên hình 5-4 cho phép xác định nồng độ [Ag+]. Lý tưởng
nhất là thê này thay đổi 59,16 mV (ở 25°C) cho mỗi sự thay đổi phần 10 của nồng độ [Ag+]. Ví dụ
100,0 ml dung dịch NaCl 0,1000M được chuẩn độ với AgNO3 0,1000M và thế của pin
trên hình 5-4 được điều khiển. Tính điện áp sau khi thêm được 65,0 ml AgNO3. Giải
Phản ứng chuẩn độ là Ag+ + Cl– = AgCl(r)
Thể tích tại điểm tương đương là 100,0 ml. Ở 65.0% của Cl– được kết tủa và 35.0% dư:
Để xác định thế của pin theo phương trình 5-1, chúng ta cần biết nồng độ [Ag+]
[Ag+][Cl–] = → [Ag+]= = = 8,5×10–9M
Bởi vậy điện thế của pin sẽ là:
E = 0,558 + 0,05916log(8,5×10–9) = 0,081V
5.3.2. Các điện cực màng
Các điện cực màng đôi khi còn được gọi là điện cực pIon bởi vì các số liệu nhận được
thường được biểu diễn dưới dạng hàm p- chẳng hạn pH, pCa hay pNO3.
5.3.2.1. Điện cực thủy tinh để đo pH
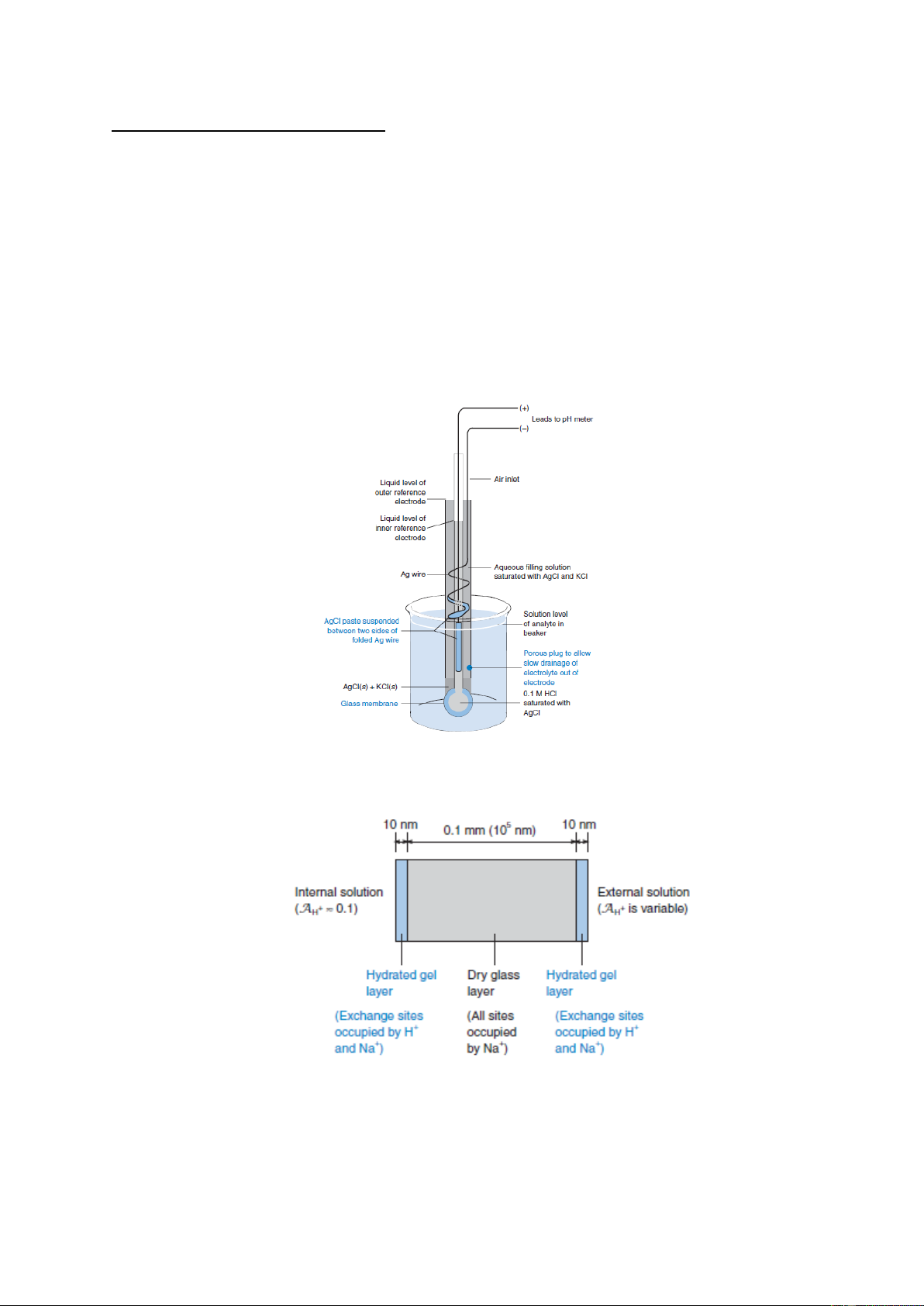
Điện cực thủy tinh được sử dụng để đo pH là loại điện cực phổ biến nhất trong các loại điện cực ion.
Một loại điện cực tổ hợp thủy tinh pH kết hợp cả thủy tinh và điện cực so sánh trong
cùng một thân, được chỉ ra trên hình 5-5. Sơ đồ của pin có thể viết như sau:
Ag(rắn)|AgCl(rắn) |Cl– (dung dịch) ||H+(dung dịch, ngoài)
H+(dung dịch, trong), Cl– (dung dịch) | AgCl(rắn) | Ag(rắn)
Điện cực so sánh ngoài (dd. phân tích)
H+bên trong điện cực Điện cực so sánh trong (màng thủy tinh) 6
Phản hồi của điện cực thủy tinh:
Eđiện cực = constant + β×0,05916 log ( ở 25°C (5-2)
Eđiện cực = constant – β× 0,05916 pH(bên ngoài) ở 25°C (5-3)
β: hiệu suất điện động (xấp xỉ bằng 1, thường thì >0,98), phần không đổi β gọi là thế bất đối
(bởi vì hai phía của một đối tượng thực là không giống hệt nhau và một điện thế nhỏ vẫn tồn
tại ngay cả hoạt độ của H+ là như nhau ở hai phía của màng. Chúng ta có thể xác định nó
bằng cách chuẩn hóa điện cực với dụng dịch có pH biết trước.
Hình 5-5. Sơ đồ điện cực tổ hợp thủy tinh
Hình 5-6. Sơ đồ mặt cắt ngang của lớp màng thủy tinh của điện cực pH 7
Chuẩn hóa điện cực thủy tinh:
Điện cực thủy tinh phải được chuẩn hóa với hai (hay nhiều hơn) dung dịch đệm chuẩn để pH
của dung dịch phân tích nằm trong phạm vi của dung dịch đểm chuẩn này.
Hồi qui các số liệu rời rạc (pH1, E1), (pH2, E2)... về phương trình bậc nhất, hệ số góc của
đường chuẩn này là β× 0,05916 mV/pH ở 25°C cho một điện cực. Dựa vào phương trình ta
có thể tính được pH của dung dịch phân tích khi đo được thế của dung dịch.
Thực tế chuẩn hóa điện cực thủy tinh là xây dựng mối quan hệ giữa tín hiệu đo được và pH
bằng cách thực hiện các phép đo với các dung dịch đã biết pH (hình 5-7).
Hình 5-7. Chuẩn hóa điện cực thủy tinh với các dung dịch đệm chuẩn
Các sai số trong phép đo pH bằng điện cực thủy tinh: -
Dung dịch chuẩn: Một phép đo pH không thể chính xác hơn dung dịch pH chuẩn,
thông thường các dung dịch pH chuẩn có sai số ±0,01 (ví dụ pH = 4,01; pH=7,01, pH = 10,01). -
Điện thế tiếp xúc: Điện thế tiếp xúc tồn tại trong các nút xốp gần đáy của điện cực
trên hình 5-5. Nếu thành phần các ion của chất phân tích là khác với các dung dịch
đệm chuẩn, thế tiếp xúc sẽ thay đổi mặc dù pH của hai dung dịch là giống nhau.
Hiệu ứng này gây nên một độ không đảm bảo ít nhất là ~0,01 đơn vị pH. -
Sự trôi thế tiếp xúc: Hầu hết các điện cực tổ hợp có điện cực so sánh Ag/AgCl chứa
KCl bão hòa. Hơn 350mg Ag /lit được hòa tan trong KCl chủ yếu dưới dạng và
. Trong các nút xốp, KCl bị pha loãng và AgCl có thể kết tủa. Nếu dung
dịch chất phân tích chứa chất khử, Ag có thể kết tủa trên nút xốp. Cả hai hiệu ứng 8
này đều gây ra sự thay đổi thế tiếp xúc và là nguyên nhân trôi nhẹ của giá trị pH đọc
được. Có thể hiệu chỉnh (bù) lỗi này bằng cách chuẩn hóa lại điện cực sau mỗi khoảng thời gian là 2h. -
Lỗi kiềm: khi nồng độ [H+] rất thấp và [Na+] là cao, điện cực phản hồi với Na+ và pH
được là thấp hơn giá trị pH thực. Lỗi này được gọi là “lỗi kiềm”. -
Lỗi axit: Trong axit mạnh, giá trị pH đo được sẽ cao hơn giá trị pH thực tế có thể do
thủy tinh đã bão hòa bởi H+ và không thể tiếp tục proton hóa. -
Thời gian cân bằng: cần thời gian nhất định để điện cực cân bằng với dung dịch. Một
dung dịch đêm tốt đòi hỏi khoảng 30s với sự khuấy trộn đủ. Một dung dịch đệm tồi
(gần điểm tương đương của một quá trình chuẩn độ) cần nhiều phút để điện cực cân bằng với dung dịch. -
Hydrat hóa thủy tinh: Điện cực đòi hỏi vài giờ ngâm trong dung dịch để phản hồi với H+ chính xác. -
Không được phép ngâm điện cực trong nước cất hay để khô (quá trình dehydrat hóa) -
Nhiệt độ: Thang đo pH phải được chuẩn hóa ở cùng nhiệt độ với nhiệt độ mà phép
đo sẽ được thực hiện. -
Làm sạch: Nếu một điện cực vừa mới tiếp xúc với các chất lỏng kỵ nước, chẳng hạn
như dầu, nó phải được làm sạch với một dung môi mà có thể hòa tan được chất
lỏng kỵ nước này và sau đó ngâm lại vào trong dung dịch nước.
5.3.2.2. Điện cực chọn lọc ion màng rắn
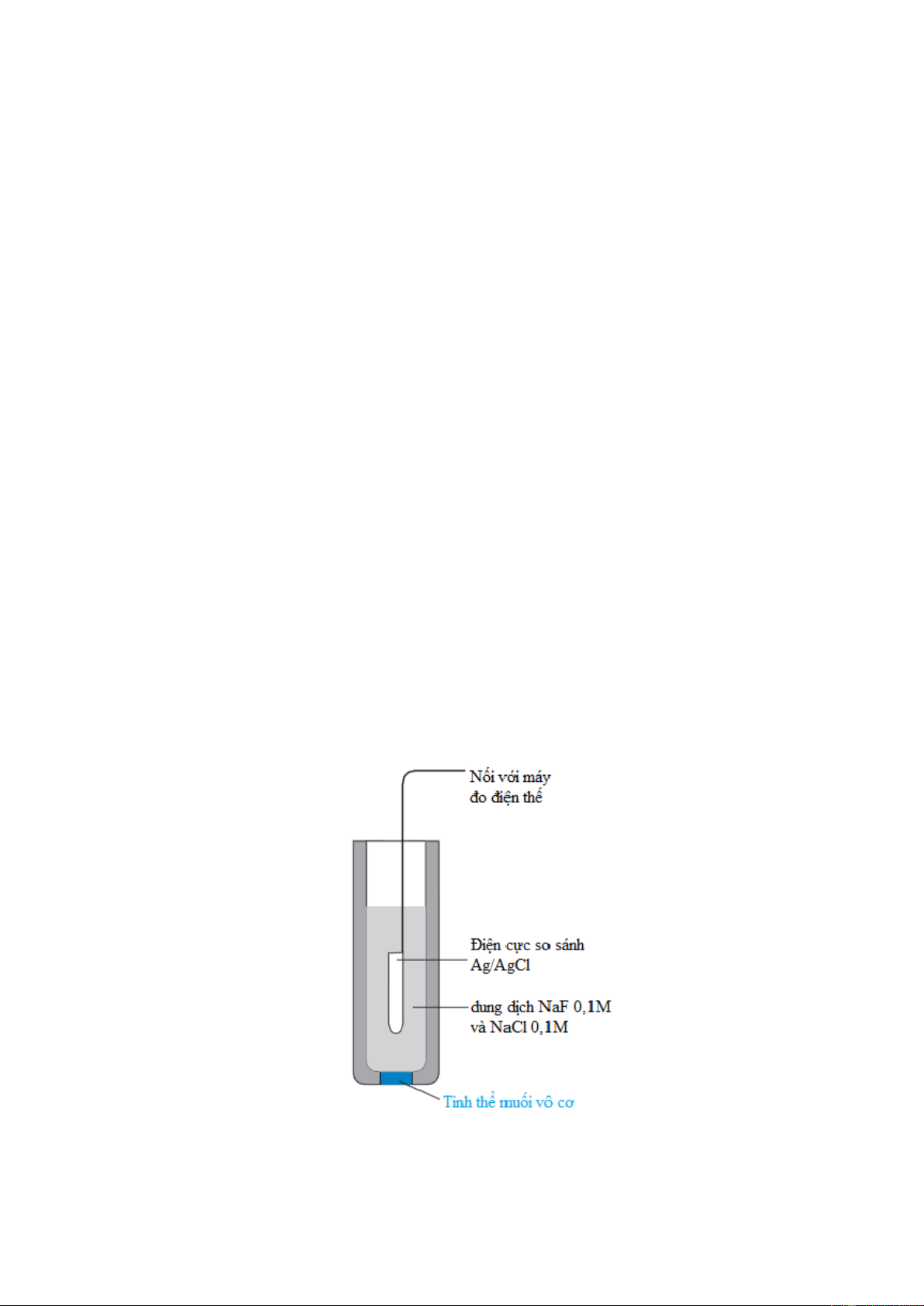
Hình 5-8. Sơ đồ điện cực chọn lọc ion rắn
sử dụng muối vô cơ ở dạng tinh thể làm màng chọn lọc ion 9
Điện cực chọn lọc ion màng rắn (solid-state ion selective electrode) dựa trên tinh thể vô
cơ được chỉ ra trên hình 5-8. Một loại điện cực phổ biến là điện cực Florua, sử dụng tinh
thể LaF3 thêm Eu2+ (droped). Thêm (doping) ở đây nghĩa là thêm một lượng nhỏ Eu2+
thay thế La3+. Dung dịch thêm chứa NaF 0,1M và NaCl 0,1M. Các điện cực Florua được sử
dụng để điều khiển và điều chỉnh sự Flo hóa các nguồn cung cấp nước của thành phố.
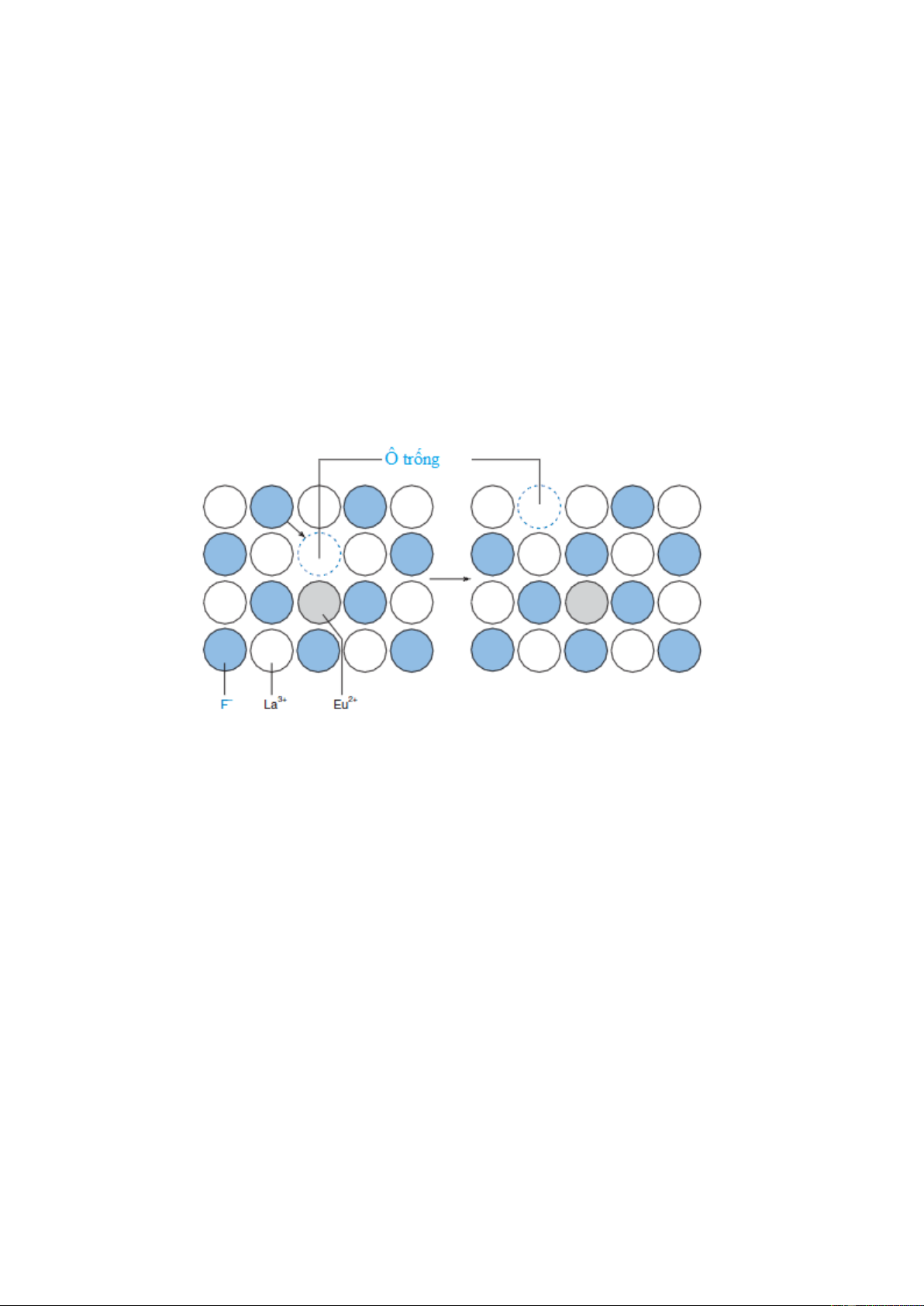
Để thực hiện một dòng điện nhỏ, F– di chuyển dọc theo tinh thể LaF3 như được chỉ ra
trên hình 5-9. Các chỗ trống ở anion được tạo ra trong tinh thể khi chúng ta thêm một
lượng nhỏ EuF2 vào LaF3. Các ion F– liền kề có thể nhảy vào các chỗ trống, để lại một chỗ
trống mới ở sau nó. Trong cách này, F– khuếch tán từ phía này sang phía khác.
Hình 5-9. Sự di chuyển của F- qua màng LaF3 bổ sung EuF2.
Bởi vì Eu2+ có điện tích nhỏ hơn La3+, các các vị trí trống xảy ra với tất cả Eu2+. Các anion F– liền kề có thể
nhảy vào các chỗ trống này, do đó có sự di chuyển ô trống từ nơi này sang nơi khác. Sự lặp lại của quá trình này
sẽ giúp F– di chuyển qua mạng tinh thể.
Tương tự như với điện cực màng thủy tinh đo pH, sự phản hồi của điện cực F– là:
Eđiện cực = constant – β× 0,05916 log( ở 25°C (5-4)
ở đây β xấp xỉ bằng 1,00. Với phạm vi nồng độ của F– từ 10–6M đến 1M, điện cực F– phản hồi
tuân theo hệ thức Nernst.
Ion nhiễu cho phép đo nồng độ F– là OH–. Ở pH thấp, F– bị chuyển thành HF (pKa = 3,17)
làm mất độ nhạy của điện cực.
Qui trình phân tích F– phổ biến là pha loãng dung dịch cần phân tích trong dung dịch đệm có
lực ion lớn chứa axetic axit, natri citrat, NaCl và NaOH và điều chỉnh pH đến 5,5. Dung dịch 10
đệm có tác dụng giữ các chất chuẩn và dung dịch phân tích ở lực ion không đổi, do vậy hệ số
hoạt độ của F– là không đổi cho tất cả các dung dịch. Eđiện cực =
β× 0,05916 log [F–] (5-5)
Phần này là không đổi bởi vì = cosnt khi lực ion là không đổi
Ở pH = 5,5, không có sự nhiễu do OH– và chỉ có một phần vô cùng nhỏ sự chuyển hóa từ F–
sang HF. Ligan citrat trong thành phần đệm lại tạo phức với Al3+ và Fe3+, những ion có thể
liên kết với F– và gây nhiễu cho quá trình phân tích.
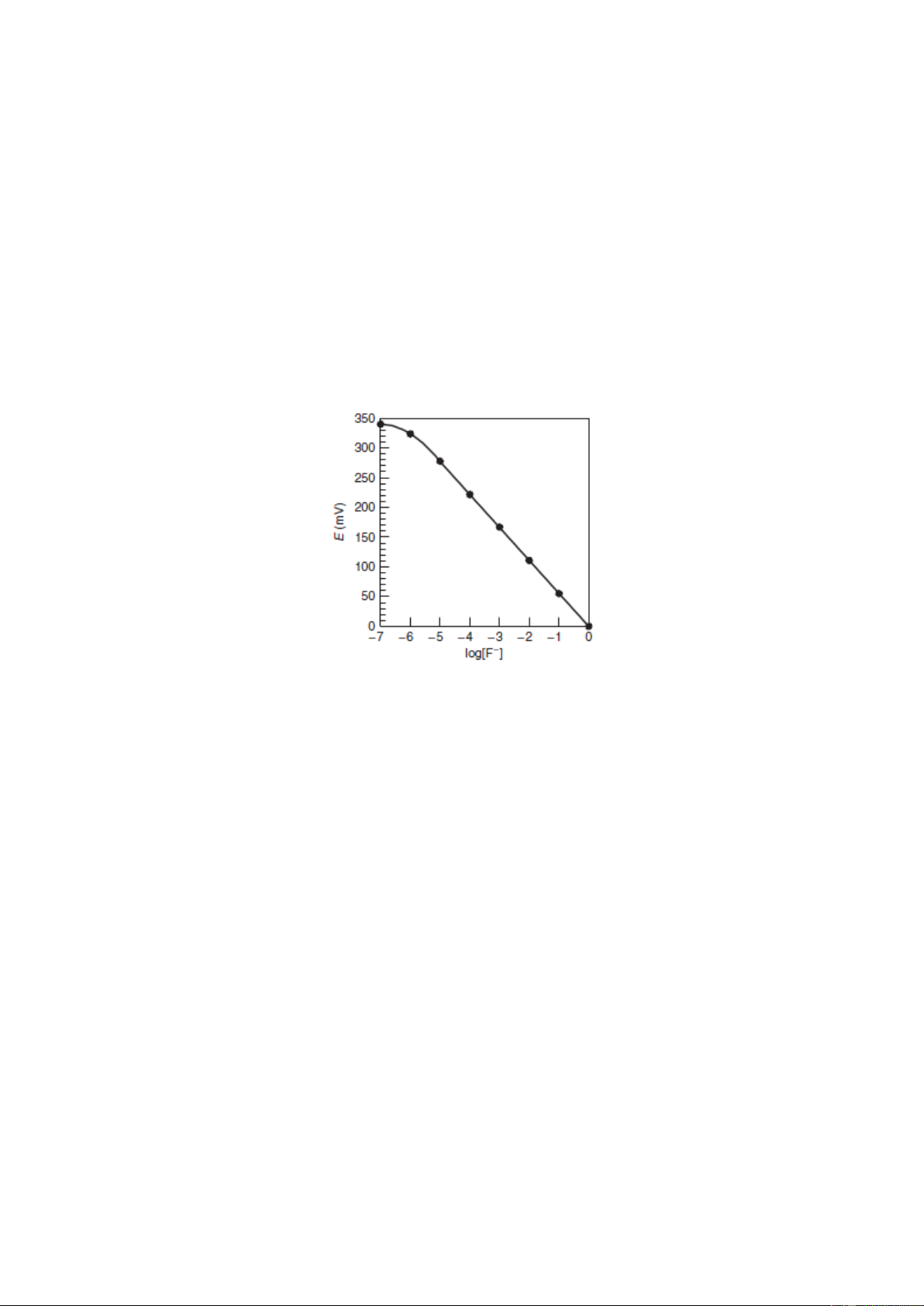
Hình 5-10. Chuẩn hóa điện cực màng rắn F–
Ví dụ: Người ta sử dụng điện cực F– nhúng vào các dung dịch chuẩn (giữ lực ion không đổi
với dung dịch NaNO3 0,1M, các điện thế đo được ứng với các nồng độ dung dịch chuẩn như sau: [F-], M E (mV) 1,00×10–5 100,0 1,00×10–4 41,5 1,00×10–3 –17,0
Bởi vì lực ion là không đổi, sự phản hồi phụ thuộc vào logarit của nồng độ F–. Hãy tính nồng
độ F– trong mẫu nếu điện thế đo được là 0,0 mV. Giải
Từ số liệu thực nghiệm chúng ta thu được hàm hồi qui
E (mV) = –58,5×log[F–] – 192,5 11
Do E = 0,0 mV → [F–] = 5,1×10–4M
5.3.3. Các sensor hóa học dạng rắn
Các sensor (cảm biến) hóa học được chế tạo với kỹ thuật tương tự như chế tạo các
“chip” vi điện tử. Các bóng bán dẫn (field effect transistor-FET) là sản phẩm thương mại
sẵn có, chẳng hạn như điện cực pH được chỉ ra ở hình 5-11.
Hình 5-11. Điện cực tổ hợp pH dựa trên hiệu ứng bán dẫn. Điện trở nhiệt (thermistor) cảm ứng
nhiệt độ và việc ứng dụng trong việc tự động bù nhiệt.
Các bóng bán dẫn cảm biến hóa học được thiết kế để phân tích các ion như H+, NH + – 4 , NO3 , CO2...
5.4. Câu hỏi ôn tập
1. Tại sao khi xác định nồng độ ion F– bằng phương pháp đo điện thế sử dụng điện cực màng
rắn chọn lọc ion, người ta thường dùng dung dịch đệm có lực ion lớn chứa axetic axit, natri
citrat, NaCl và NaOH để pha loãng và điều chỉnh pH đến 5,5?
2. Nguyên nhân nào làm xuất hiện thế tiếp xúc trong phương pháp đo điện thế? Giá trị điện
thế tiếp xúc ảnh hưởng như thế nào đến việc phân tích? Làm thế nào để làm giảm điện thế tiếp xúc?
3. Viết hệ thức Nernst cho điện cực màng thủy tinh? Tại sao phải chuẩn hóa điện cực thủy
tinh trước khi đo pH. Hãy giải thích các sai số gây ra khi sử dụng điện cực thủy tinh trong
môi trường pH quá cao và quá thấp.
4. Ý nghĩa khi sự phản hồi điện cực chỉ thị tuân theo hệ thức Nernst là gì? 12
5. Nêu định nghĩa điện cực chỉ thị, điện cực so sánh, điện cực kim loại. Lấy ví dụ cho mỗi
loại điện cực và nêu yêu cầu đòi hỏi với các điện cực này.
6. Với điện cực bạc-bạc clorua, chúng ta có E° = 0,222V, E(KCl bão hòa) = 0,197V. Hãy dự
đoán giá trị E của điện cực calomen nếu E° của nó là E° = 0,268V.
7. Sử dụng các giá trị điện thế cho dưới đây tính hoạt độ của Cl– trong KCl 1M
E° (điện cực calomen) = 0,268 V, E (điện cực calomen, KCl 1M) = 0,280V 13




