










Preview text:
Phần II: Các phương pháp phân tích điện hóa
Chương 5. Điện cực và đo điện thế
(Electrodes and Potentiometry) Tran Thi Thuy
Department of Analytical Chemistry
School of Chemical Engineering – Hanoi University of Science and Technology (HUST) Outline
5.1 Các điện cực so sánh
5.2 Điện thế tiếp xúc
5.3 Các điện cực chỉ thị
5.5. Câu hỏi ôn tập 11/11/2021 2 HUST SCE
Việc sử dụng các điện cực để đo điện thế từ đó cho
ta thông tin về hóa học được gọi là đo điện thế. 3 HUST SCE Pin galvanic: Điện cực chỉ thị Điện cực so sánh Cầu muối 4 HUST SCE
5.1. Các điện cực so sánh Một đ
iện cực so sánh lý tưởng là điện cực có điện thế đã
được biết trước chính xác, không đổi và hoàn toàn không
nhạy cảm với chất phân tích. Ngoài ra, điện cực này phải
chắc chắn, dễ dàng lắp ráp và duy trì được thế không đổi
khi có các dòng điện nhỏ chạy qua. 5 HUST SCE
5.1. Các điện cực so sánh
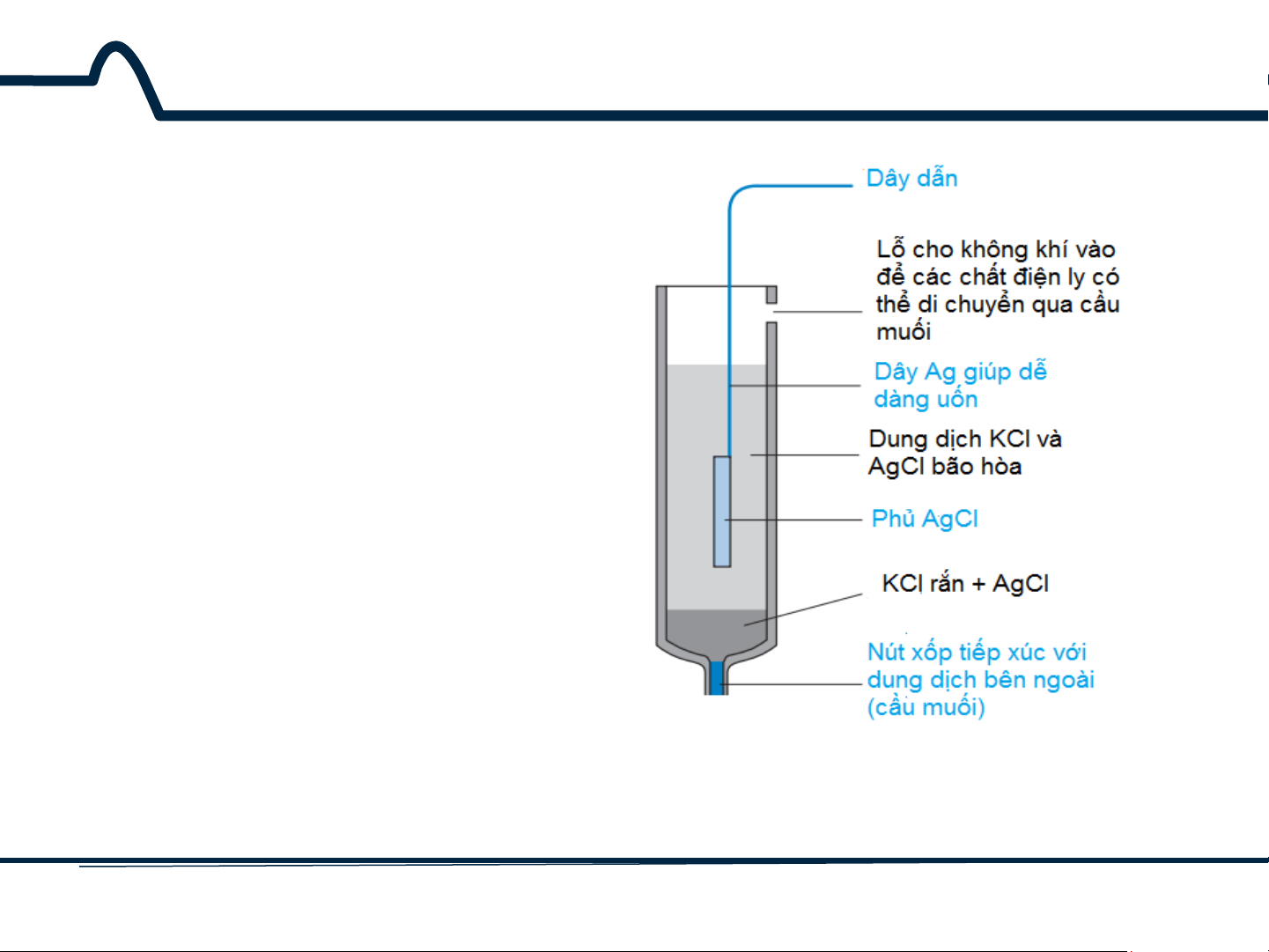
5.1.1. Điện cực so sánh bạc-bạc clorua
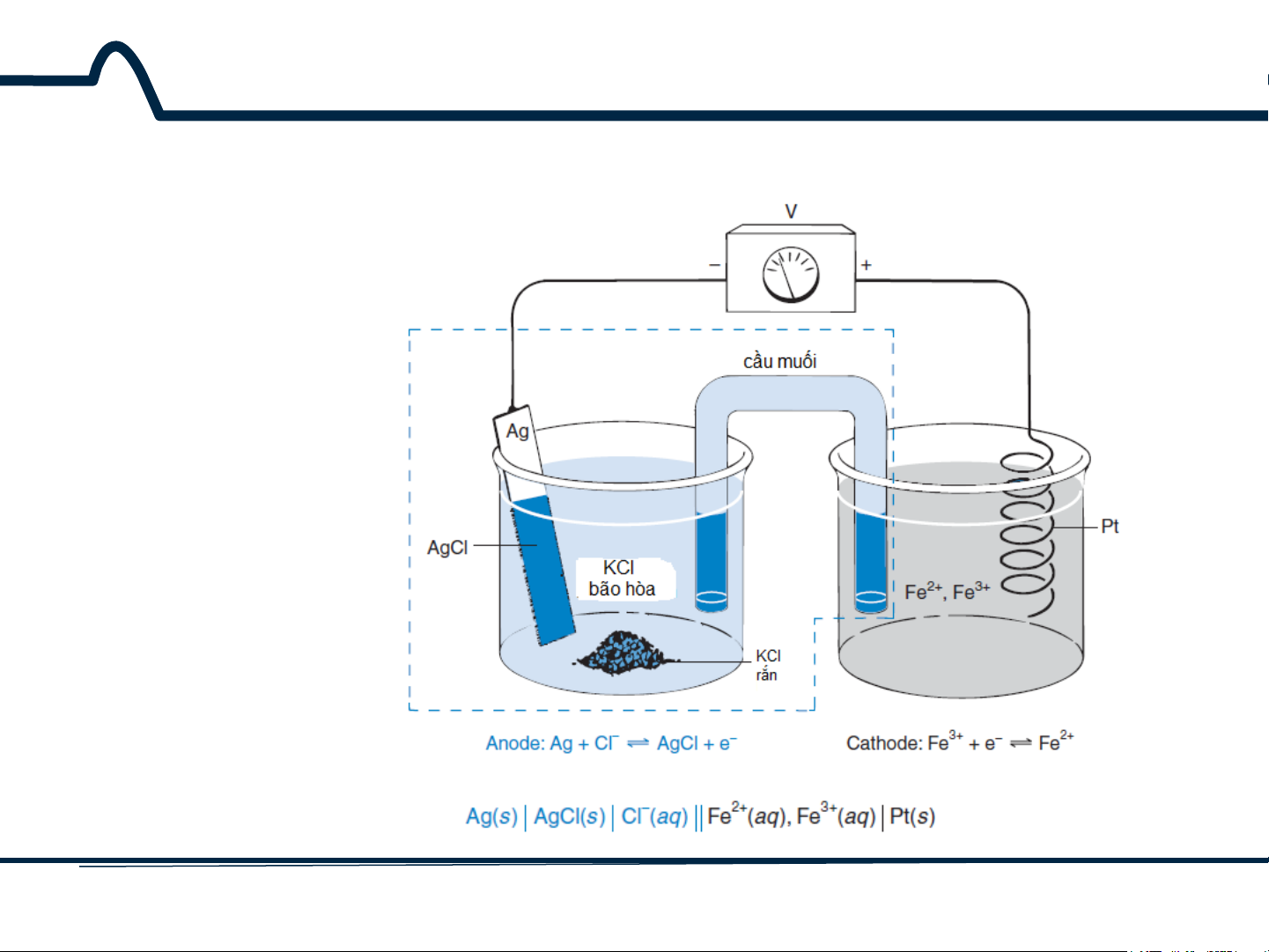
Điện cực bạc-bạc clorua trên hình 5-1 dựa trên phương trình
AgCl(r) + e– ⇋ Ag(r) + Cl– E° = +0,222V E log 1 = + 0,197V
ss (KCl bão hòa) = + 0,222 + 0,05916 1 [Cl−]
Thế khử tiêu chuẩn E° cho phản ứng này là +0,222V. Nếu
pin được bão hòa với KCl ở 25°C, thế này là +0,197V. 6 HUST SCE
5.1. Các điện cực so sánh
5.1.1. Điện cực so sánh bạc-bạc clorua
Hình 5-1. Điện cực so sánh bạc-bạc clorua 7 HUST SCE
5.1. Các điện cực so sánh
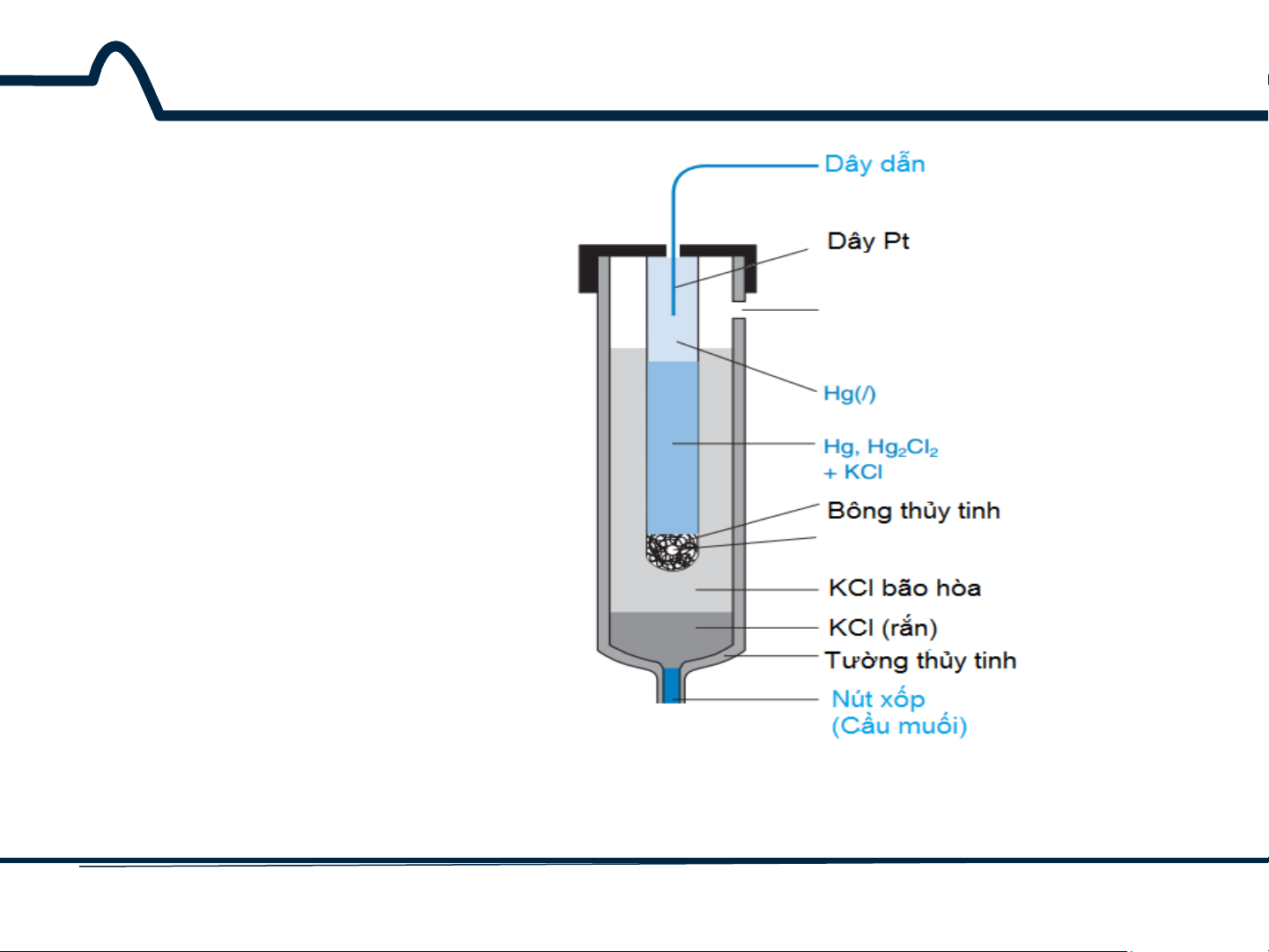
5.1.2. Điện cực calomen
Điện cực calomen trên hình 5-2 dựa trên phản ứng điện cực
½ Hg2Cl2(r) + e– ⇋ Hg(l) + Cl– E° = +0,268V
Thủy ngân (I) clorua (calomen)
Ess. (KCl bão hòa) = + 0,268 + 0,05916 log 1 = + 0,241V 1 [Cl−]
Thế khử tiêu chuẩn E° cho phản ứng này là +0,068V.
Nếu pin được bão hòa với KCl ở 25°C, thế này là
+0,241V. Điện cực calomen bão hòa được viết tắt là
S.C.E (saturated calomel electrode). Sự thuận tiện trong
việc sử dụng KCl là [Cl–] là không thay đổi khi chất lỏng bay hơi. 8 HUST SCE
5.1. Các điện cực so sánh
5.1.2. Điện cực calomen
Hình 5-2. Điện cực calomen bão hòa 9 HUST SCE
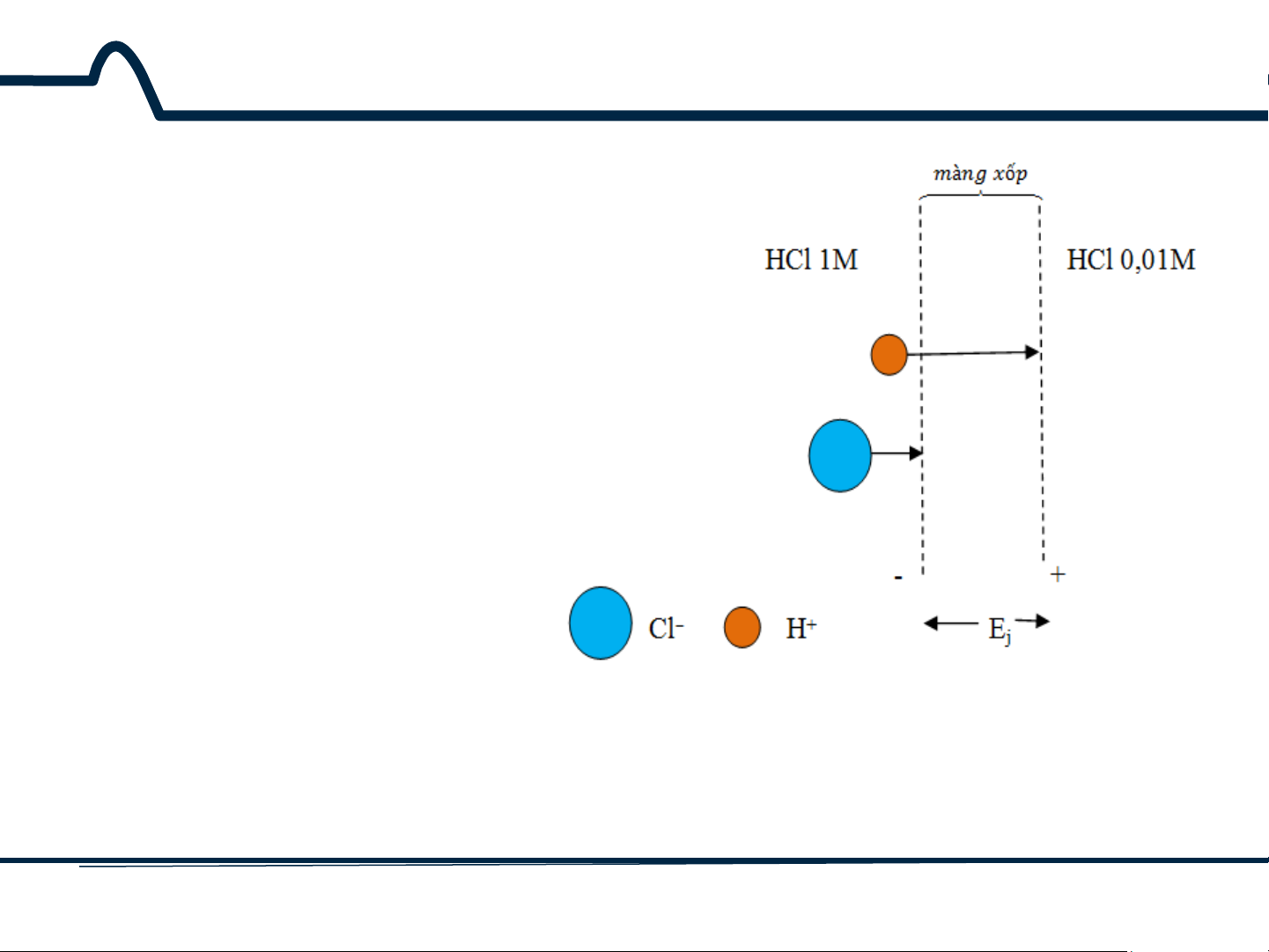
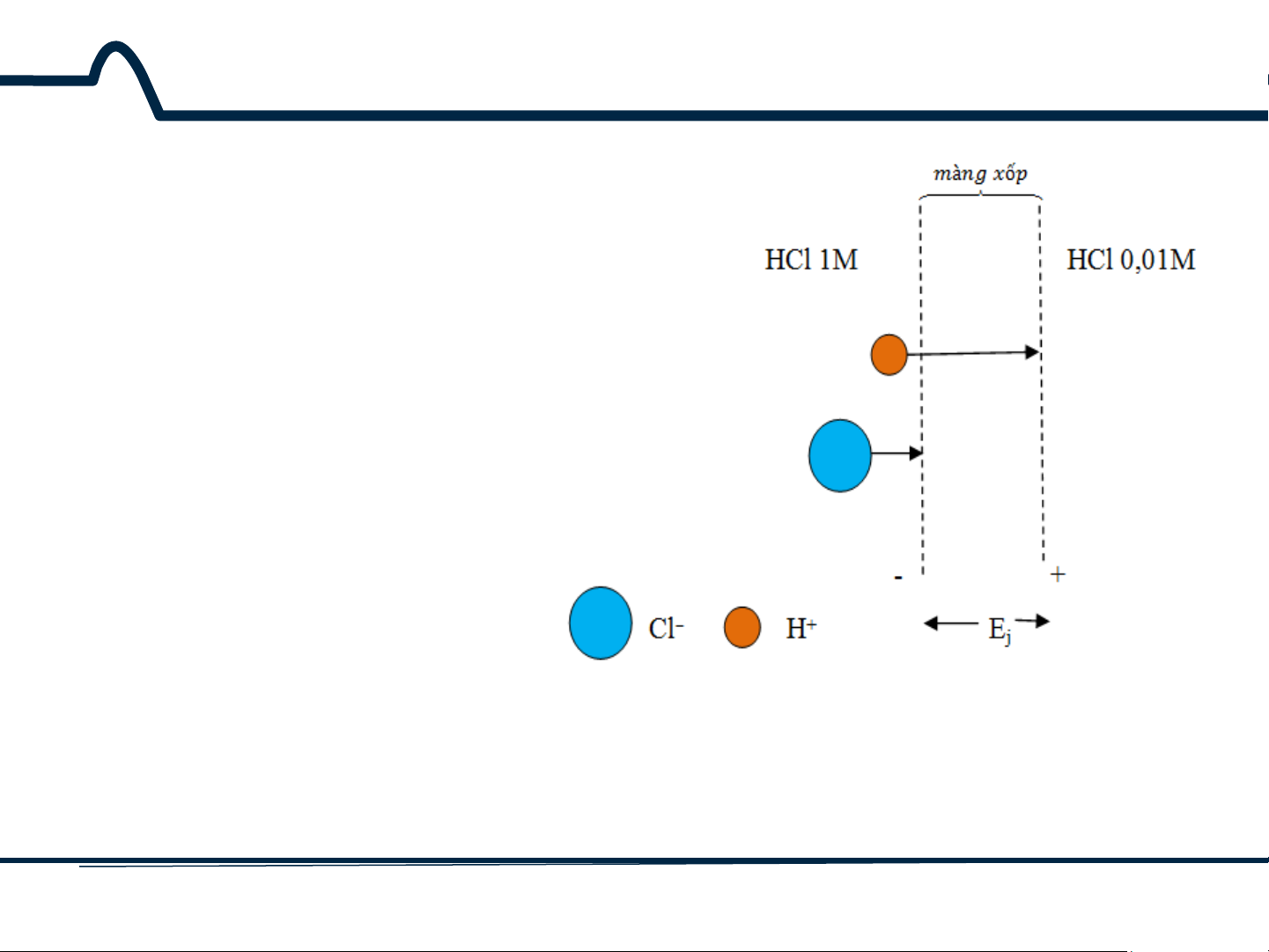
5.2. Điện thế tiếp xúc (liquid-junction potentials)
Điện thế tiếp xúc xuất hiện dọc
theo lớp biên giữa các dung dịch
điện ly có thành phần khác nhau.
Hình 5-3 chỉ ra một ví dụ đơn
giản về tiếp xúc giữa dung dịch
HCl 1M và dung dịch HCl 0,01M.
Một màng xốp, ngăn cản hai
dung dịch này khỏi sự trộn lẫn.
Cả ion H+ và Cl– có xu hướng
khuếch tán từ phía có nồng độ
cao đến phía có nồng độ thấp.
Lực điều khiển các ion tỉ lệ với
hoạt độ giữa hai dung dịch.
Hình 5-3. Sơ đồ chỉ ra thế tiếp xúc Ej.
Độ dài của mũi tên tỉ lệ với độ linh động của hai ion 10 HUST SCE
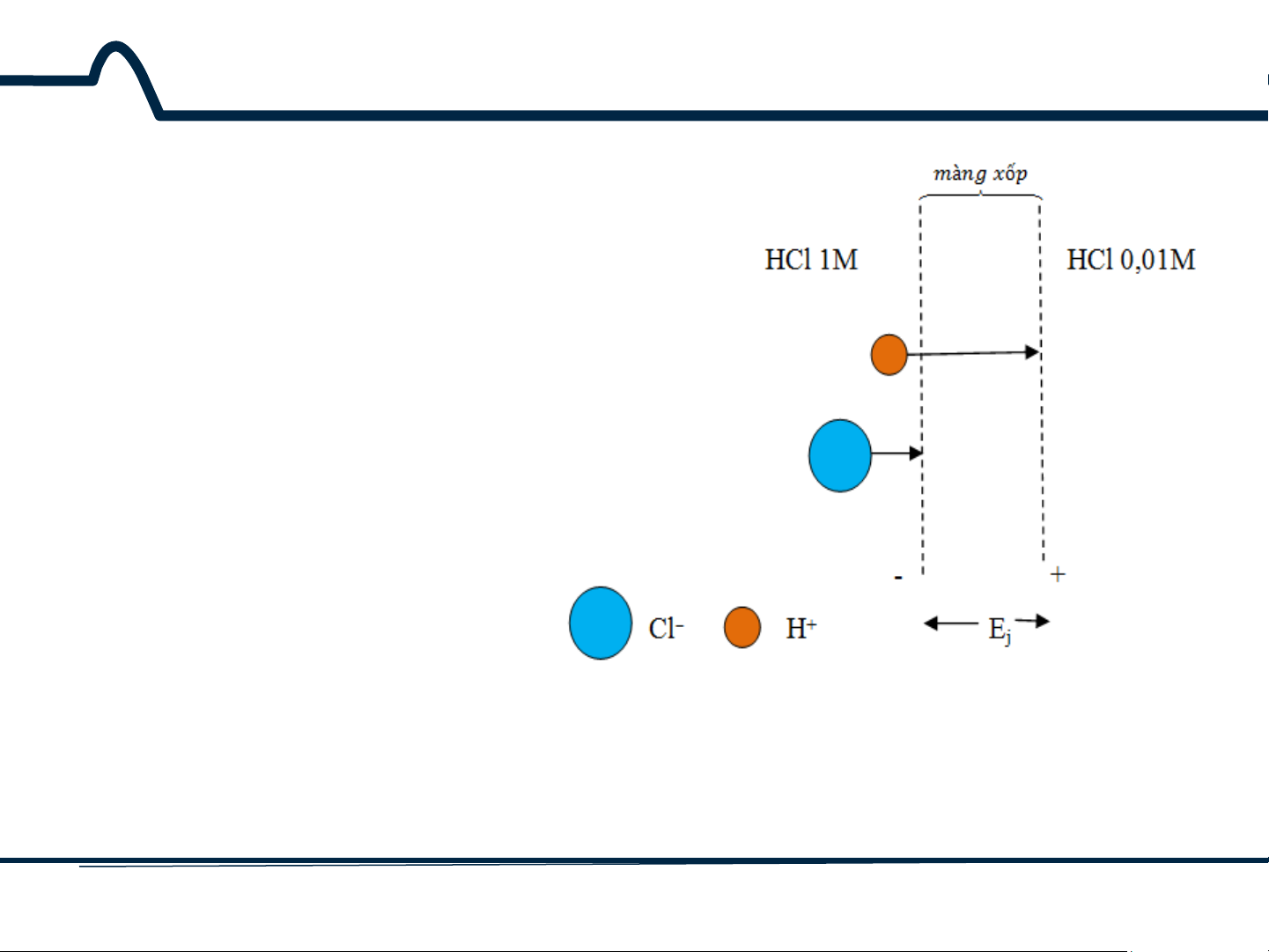
5.2. Điện thế tiếp xúc (liquid-junction potentials)
Ở ví dụ đang xét, các ion hydro
chuyển động nhanh hơn các ion
Cl–, như đã được chỉ ra trên hình
vẽ và kết quả là có một sự phân
cực về điện tích. Phía bên nồng
độ thấp điện tích ở lớp biên sẽ
trở lên dương hơn. Phía bên nồng
độ cao có điện tích ở lớp biên âm
hơn do sự chuyển động chậm
hơn của các ion Cl–. Sự tăng điện
tích ở lớp biên có xu hướng
chống lại sự khác nhau giữa tốc
độ khuếch tán giữa hai ion và cân
bằng đạt được nhanh chóng. Sự
khác nhau về điện thế được tạo
Hình 5-3. Sơ đồ chỉ ra thế tiếp xúc Ej.
ra do sự phân cực điện tích có
Độ dài của mũi tên tỉ lệ với độ linh
thể một vài phần trăm của vôn. động của hai ion 11 HUST SCE
5.2. Điện thế tiếp xúc (liquid-junction potentials)
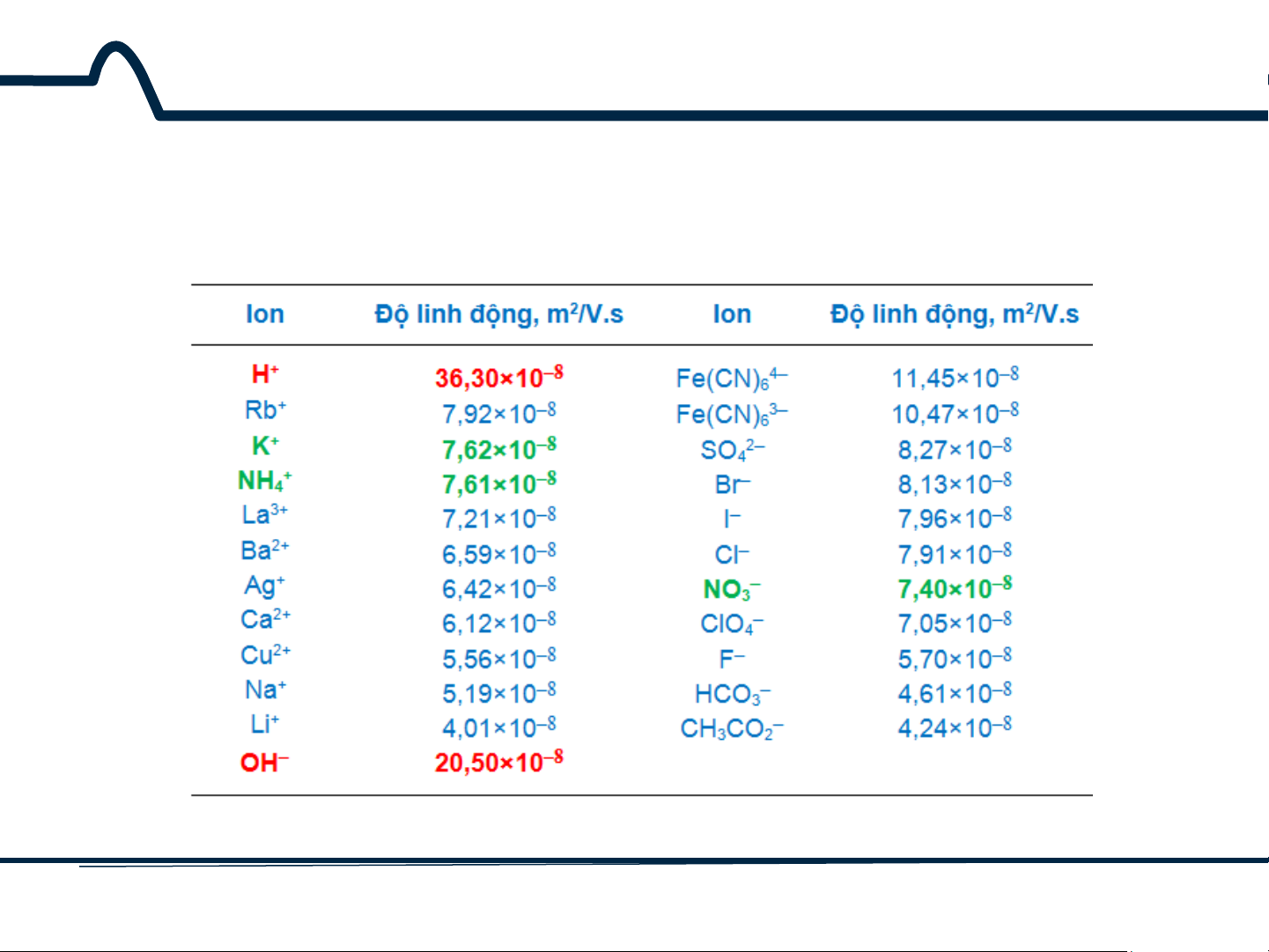
Cường độ của thế tiếp xúc có thể
giảm đi tối đa bằng cách sử dụng
cầu muối giữa hai dung dịch. Cầu
muối sẽ hiệu quả nhất nếu độ
linh động của ion âm và ion
dương trong cầu muối là xấp xỉ
nhau và nếu nồng độ của chúng
lớn. Dung dịch KCl bão hòa thỏa
mãn cả hai yêu cầu trên (bảng 5-
1). Thế tiếp xúc của một cầu
muối như vậy là vài milli vôn.
Lưu ý rằng độ không đảm bảo về
cường độ của thế tiếp xúc dọc
theo cầu muối là nguyên nhân
Hình 5-3. Sơ đồ chỉ ra thế tiếp xúc Ej.
hạn chế độ chính xác của phương
Độ dài của mũi tên tỉ lệ với độ linh
pháp phân tích bằng đo điện thế. động của hai ion 12 HUST SCE
5.2. Điện thế tiếp xúc (liquid-junction potentials)
Bảng 5-1. Độ linh động của các ion trong nước ở 25°C 13 HUST SCE
5.3. Các điện cực chỉ thị
Một điện cực chỉ thị lý tưởng phản hồi nhanh chóng và lặp lại
với sự thay đổi nồng độ của một ion chất phân tích. Các điện
cực chỉ thị được chia làm ba loại: + kim loại + màng
+ các bóng bán dẫn chọn lọc ion. 14 HUST SCE
5.3. Các điện cực chỉ thị
5.3.1. Các điện cực kim loại
Điện cực kim loại phổ biến nhất là điện cực platin, là
loại điện cực trơ – nó không tham gia vào phản ứng.
Điện cực này có nhiệm vụ đơn giản là chuyển các
electron vào hay từ các phần từ trong dung dịch. Các
điện cực vàng có phần trơ hơn Pt.
Có nhiều loại cacbon được sử dụng làm điện cực chỉ
thị vì tốc độ của nhiều phản ứng oxy hóa khử trên bề
mặt điện cực cacbon rất nhanh. Điện cực kim loại làm
việc tốt khi có bề mặt sạch và rộng. Để làm sạch điện
cực, nhúng điện cực trong dung dịch HNO3 nóng và
sau đó rửa lại bằng nước cất. Điện cực Pt
Điện cực tổ hợp Ag/AgCl 15 HUST SCE
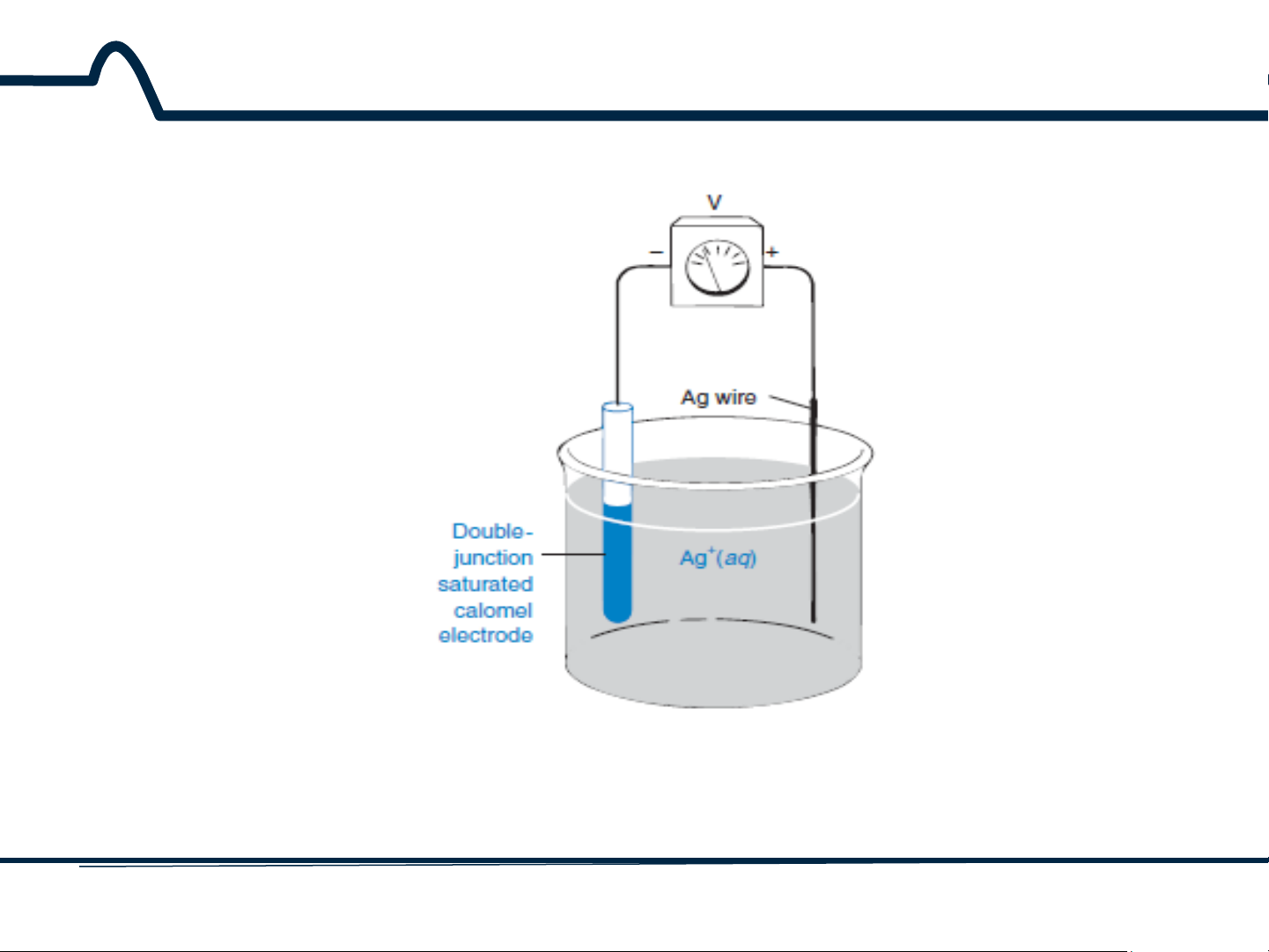
5.3. Các điện cực chỉ thị
5.3.1. Các điện cực kim loại Hình 5
-4 chỉ ra phương thức làm việc của điện cực Ag khi nó kết hợp với điện
cực so sánh để đo nồng độ Ag+. Phản ứng ở điện cực Ag là: Ag+ + e– ⇋ Ag(r) E° = +0,799V
Phản ứng ở điện cực so sánh là:
½ Hg2Cl2(r) + e– ⇋ Hg(l) + Cl– E° = +0,268V
Thế của điện cực so sánh được cố định ở 0,241V bởi vì pin điện cực được bão
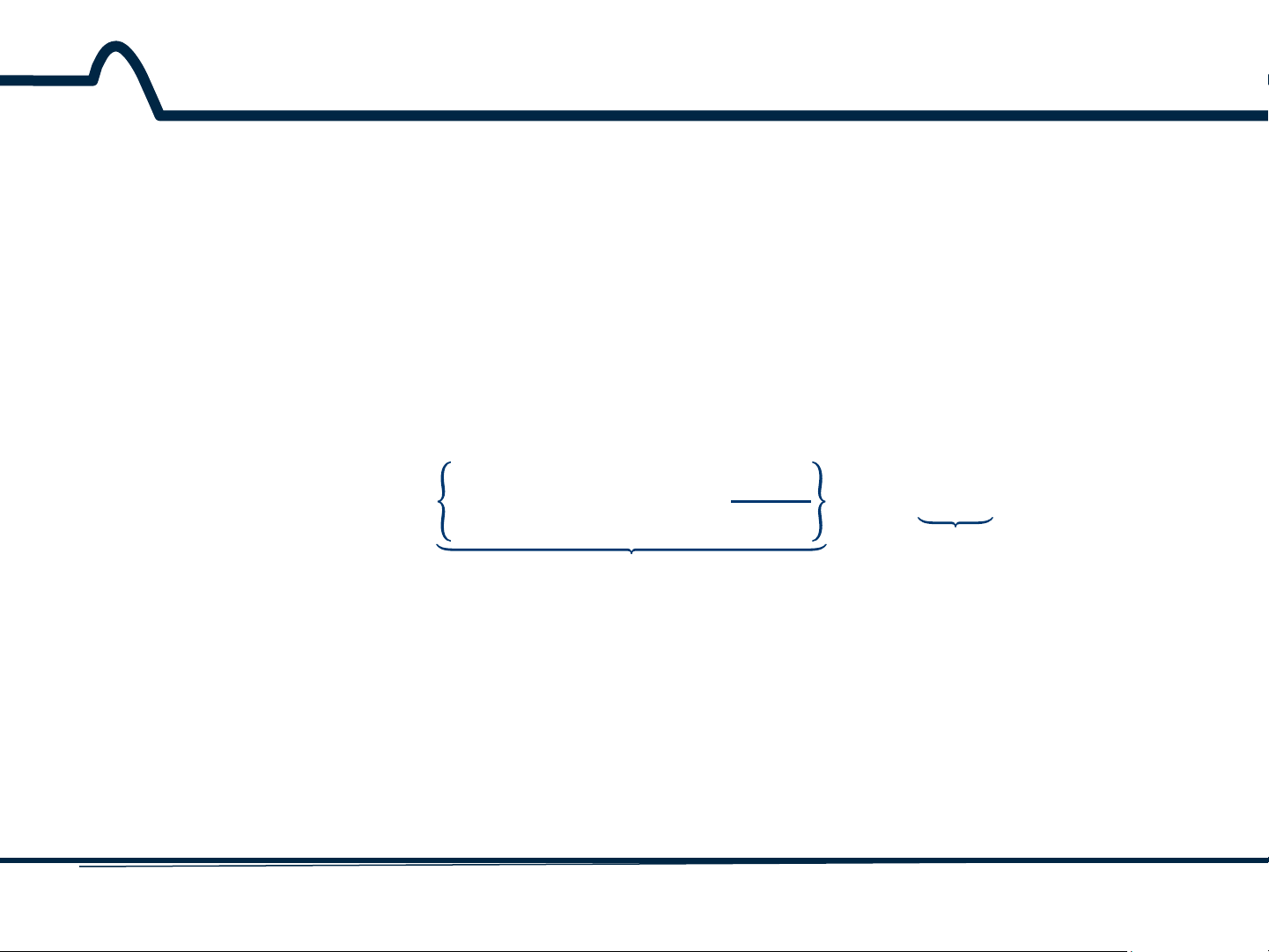
hòa với KCl. Phương trình Nernst cho toàn bộ pin bởi vậy sẽ là: 1
𝐸 = 𝐸+ − 𝐸− = 0,799 − 0,05916𝑙𝑜𝑔 − 0,241 [𝐴𝑔+]
𝑡ℎế 𝑐ủ𝑎 đ𝑖ệ𝑛 𝑐ự𝑐
𝑡ℎế 𝑐ủ𝑎 đ𝑖ệ𝑛 𝑐ự𝑐 𝑐ℎỉ 𝑡ℎị 𝐴𝑔|𝐴𝑔+
𝑠𝑜 𝑠á𝑛ℎ 𝑆.𝐶.𝐸 E = 0,558 + 0,05916log[Ag+]
Điều này có nghĩa là thế của pin trên hình 5-4 cho phép xác định nồng độ
[Ag+]. Lý tưởng nhất là thê này thay đổi 59,16 mV (ở 25°C) cho mỗi sự thay
đổi phần 10 của nồng độ [Ag+]. 16 HUST SCE
5.3. Các điện cực chỉ thị
5.3.1. Các điện cực kim loại
Hình 5-4. Sử dụng điện cực Ag và điện cực so sánh
calomen để xác định nồng độ [Ag+] 17 HUST SCE
5.3. Các điện cực chỉ thị
5.3.1. Các điện cực kim loại Ví dụ:
100,0 ml dung dịch NaCl 0,1000M được chuẩn độ với AgNO3 0,1000M và
thế của pin trên hình 5-4 được điều khiển. Tính điện áp sau khi thêm được 65,0 ml AgNO3. 18 HUST SCE
5.3. Các điện cực chỉ thị
5.3.1. Các điện cực kim loại
Bài tập: Một dung dịch được chuẩn bị bằng cách trộn 25,0
mL KI 0,200M với 25,0 mL NaCl 0,200M và được chuẩn độ
điện thế với dung dịch AgNO3 0,100 M:
Điện cực so sánh calomel bão hòa||dung dịch chuẩn độ|điện cực Ag
Cho biết tích số tan của AgI và AgCl: TAgI = 8,3.10–17; TAgCl = 1,82.10–10
(a) Hãy tính nồng độ [Ag+] khi thêm được 25,0 mL AgNO3 0,100 M
(b) Hãy tính nồng độ [Ag+] khi thêm được 75,0 mL AgNO3 0,100 M
(c) Viết phương trình thể hiện mối quan hệ giữa Epin và 19 HUST SCE [Ag+]
5.3. Các điện cực chỉ thị
5.3.2. Các điện cực màng
Các điện cực màng đôi khi còn được gọi là điện cực pIon
bởi vì các số liệu nhận được thường được biểu diễn dưới
dạng hàm p- chẳng hạn pH, pCa hay pNO3. 20 HUST SCE




