




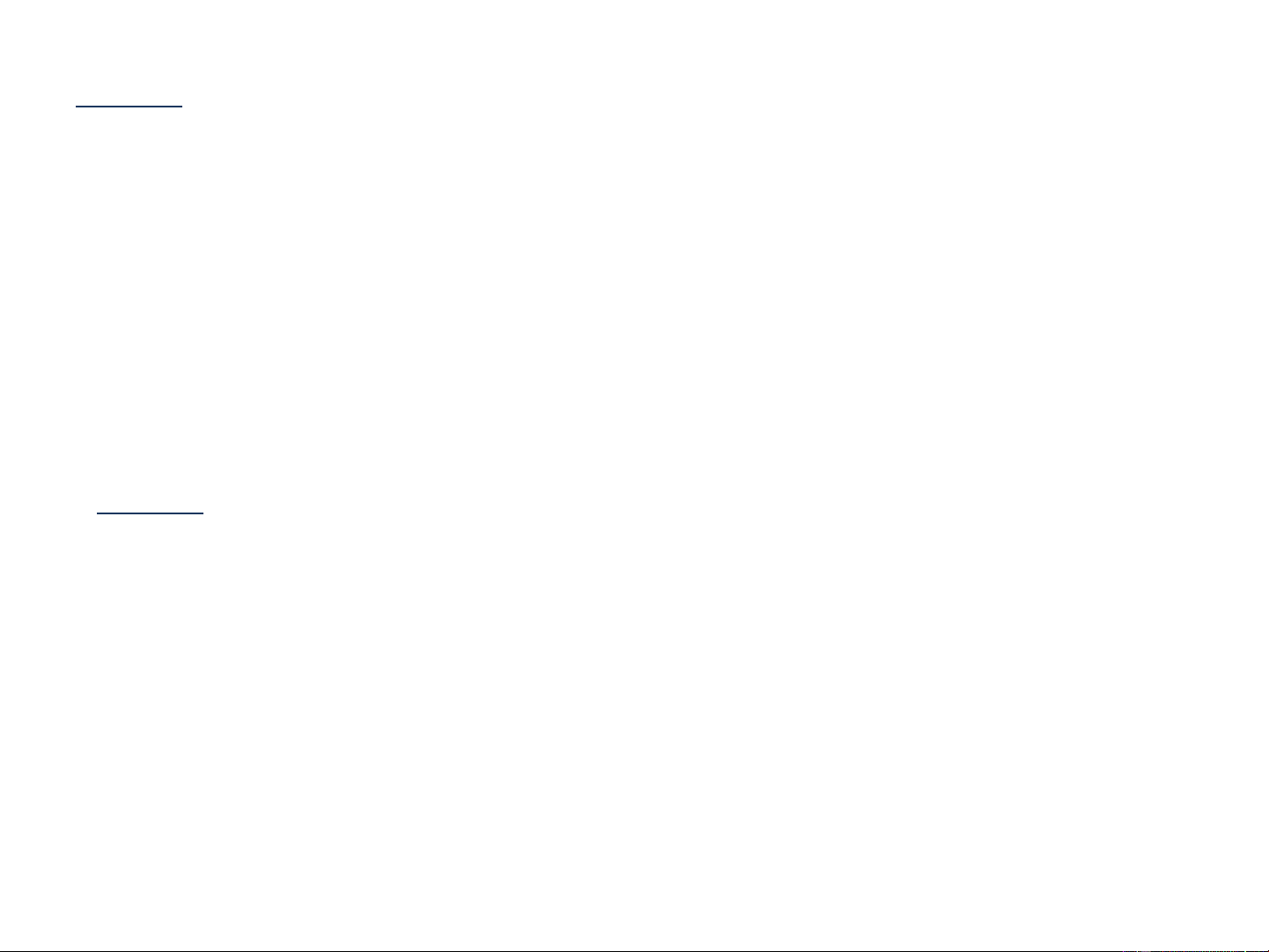







Preview text:
CHƯƠNG 5
ĐIỆN CỰC VÀ PHƯƠNG PHÁP PHÂN TÍCH ĐO ĐIỆN THẾ (Electrodes and Potentiometry)
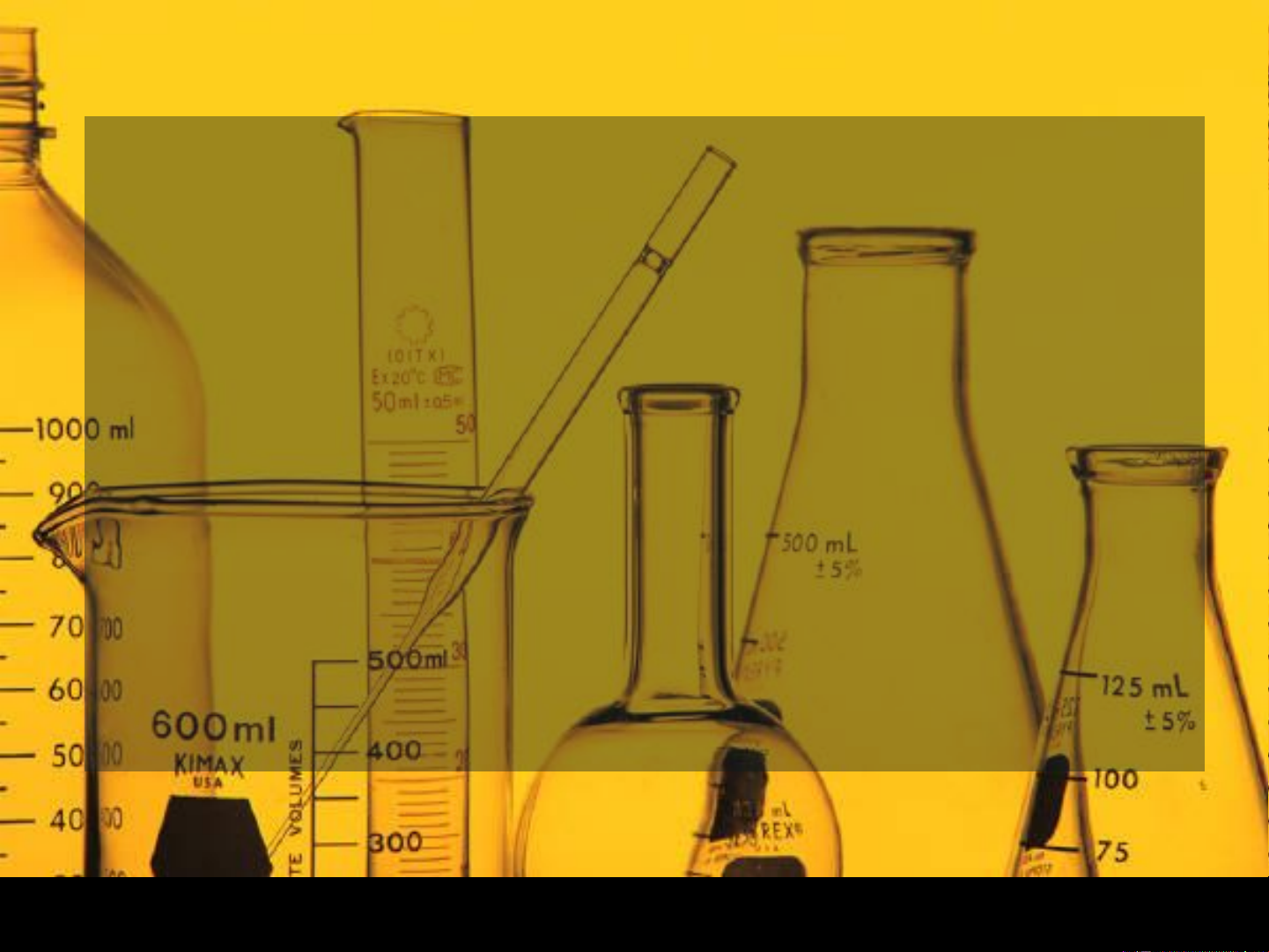
Electrodes and Potentiometry Platinium electrode 2+ 0.05916 [ Fe ] − E = 0.771 − log
− 0 222 − cell .
0.05916 log[ Cl ] 1 3+ [ Fe ] Potential of the cell Reference electrode, [Cl-] only depends on [Fe2+] & is constant [Fe3+] Pt wire is indicator electrode whose potential responds to [Fe2+]/[Fe3+] Reference electrode, [Cl-] is constant Unknown solution of [Fe2+] & [Fe3+]
Khái niệm: Phương pháp phân tích đo điện thế là phương pháp
xác định nồng độ các chất dựa vào sự thay đổi thế điện cực khi
nhúng vào dung dịch phân tích
o Một điện cực như thanh Pt có thể nhúng vào một dung dịch
chưa biết nồng độ, điện cực này có thể nhận electron hoặc
chuyển electron đến chất phân tích. Điện cực này phản hồi với
chất phân tích nên nó được gọi là điện cực chỉ thị.
o Chúng ta nối nửa pin này với nửa pin còn lại qua 1 cầu muối.
Nửa thứ hai của pin có thành phần cố định, nó có điện thế là
không đổi (được gọi là điện cực so sánh). Điện thế của pin là sự
khác nhau giữa thế của điện cực chỉ thị và điện cực so sánh.
Điện thế tiếp xúc (liquid-junction potentials )
o Điện thế tiếp xúc xuất hiện dọc theo lớp tiếp xúc giữa các dung dịch
điện ly có thành phần khác nhau.
o Điện thế này không lớn và xuất hiện cuối của cầu muối. Gây ảnh hưởng
trực tiếp đến độ chính xác của việc đo điện thế vì chúng ta thường không
biết giá trị của điện thế tiếp xúc góp phần và thế đo được là bao nhiêu.
5.1. Các điện cực so sánh (Reference Electrode) Yêu cầu:
✓ Bền theo thời gian
✓ Có điện thế đã biết trước chính xác
✓ Điện thế phải lặp lại
✓ Điện thế phải duy trì không đổi khi có dòng điện nhỏ chạy qua
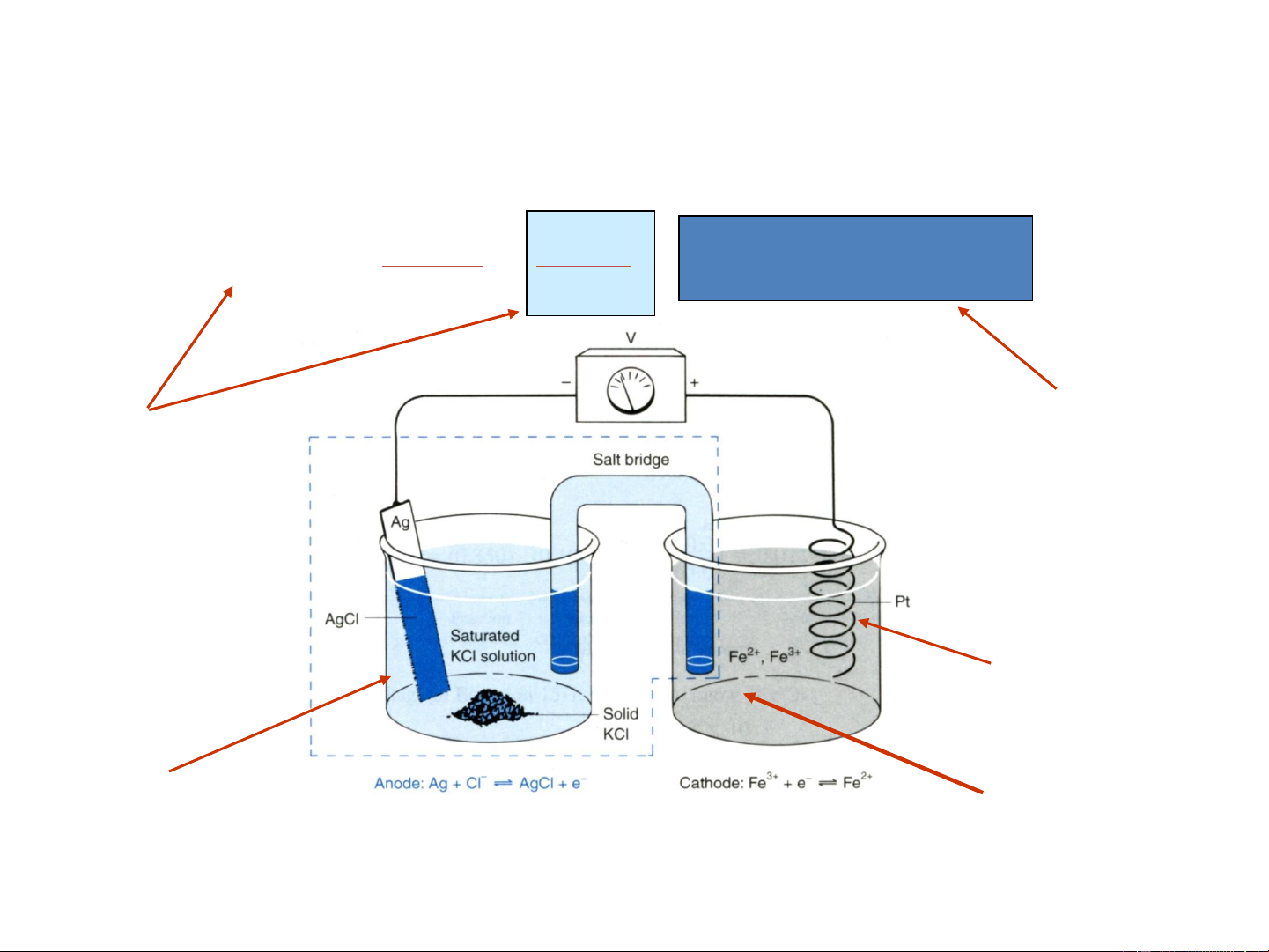
Điện cực so sánh bạc-bạc clorua
(Silver-Silver Chloride Reference Electrode)
Phương trình điện cực
Thế khử tiêu chuẩn E° cho phản
ứng này là +0,222V. Nếu pin được
bão hòa với KCl ở 25°C, Điện thế
của điện cực là:
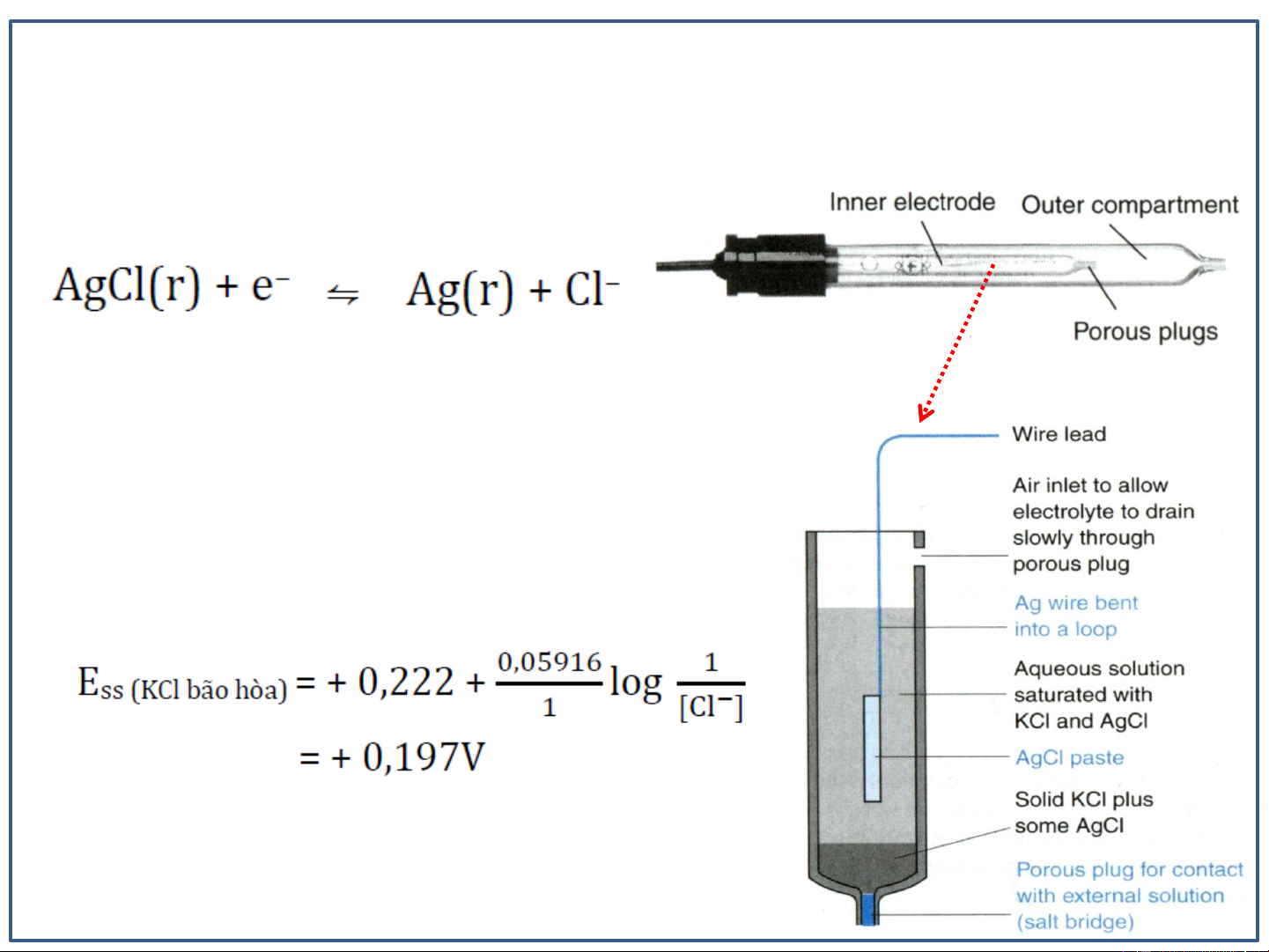
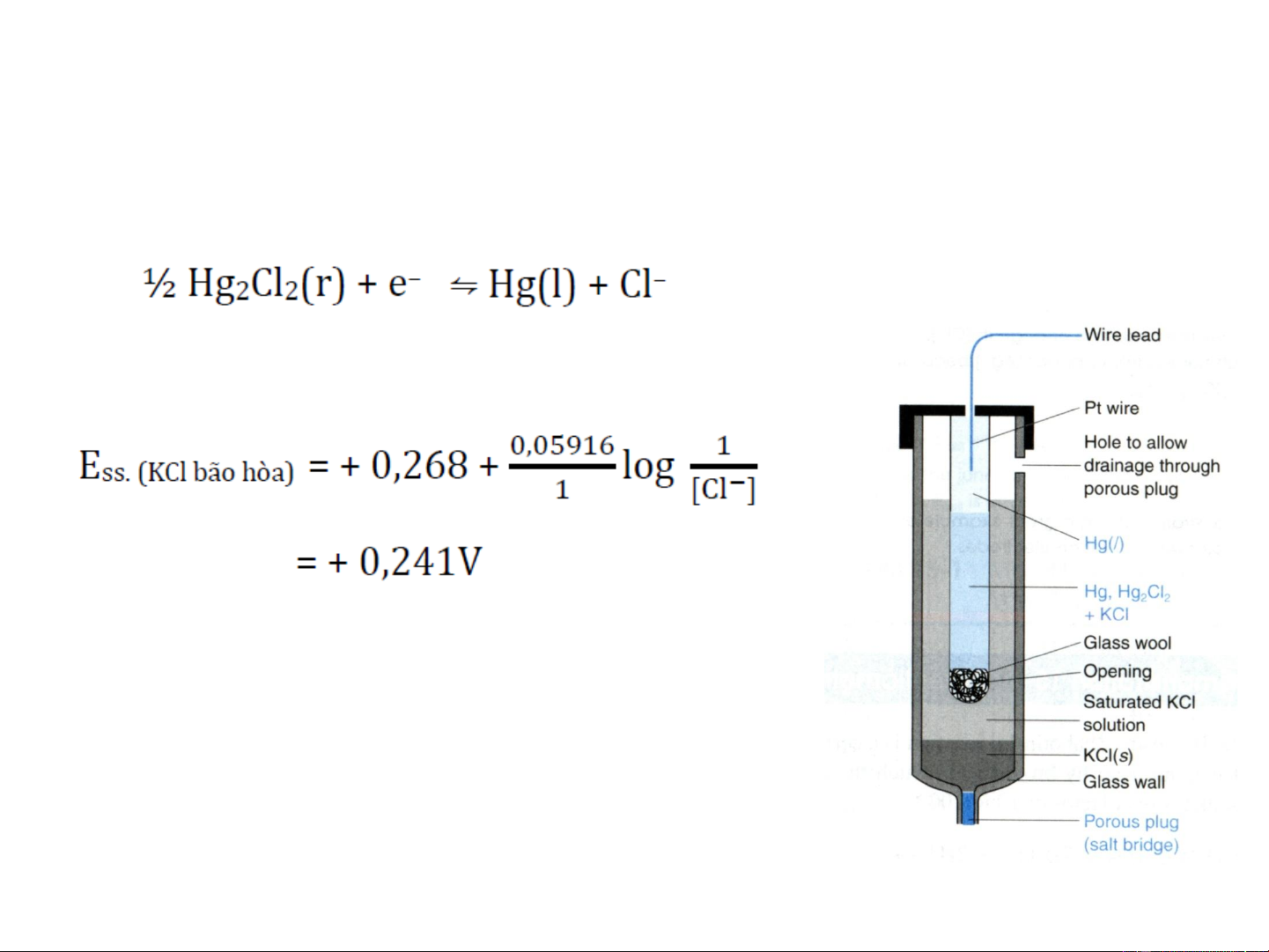
Điện cực calomen (Calomel electrode)
Điện cực calomen trên hình dựa trên phản ứng điện cực Eo = +0.268 V
o Điện cực calomen bão hòa được viết tắt là
S.C.E (saturated calomel electrode).
o Sự thuận tiện trong việc sử dụng KCl là [Cl-]
là không thay đổi khi chất lỏng bay hơi.
5.2. Các điện cực chỉ thị (Indicator Electrode)
o Một điện cực chỉ thị lý tưởng phản hồi nhanh chóng và lặp lại với sự
thay đổi nồng độ của một ion chất phân tích.
o Các điện cực chỉ thị được chia làm ba loại: kim loại, màng và các bóng
bán dẫn chọn lọc ion.
Các điện cực kim loại
Là loại điện cực trơ – nó không tham gia vào phản ứng. Điện cực này có
nhiệm vụ đơn giản là chuyển vào hay nhận các electron từ trong dung dịch.
➢ Điện cực kim loại phổ biến nhất là điện cực platin.
➢ Các điện cực vàng có phần trơ hơn Pt.
➢ Điện cực bạc.
➢ Có nhiều loại cacbon được sử dụng làm điện cực chỉ thị vì tốc độ của
nhiều phản ứng oxy hóa khử trên bề mặt điện cực cacbon rất nhanh.
Điện cực kim loại làm việc tốt khi có bề mặt sạch và rộng. Để làm sạch
điện cực, nhúng điện cực trong dung dịch HNO nóng và sau đó rửa lại 3 bằng nước cất.
Câu 1. Tính thế điện cực Ag khi tiếp xúc với các dung dịch sau: a) 0,015M I- và AgI ∣Ag; biết Eo = -0,151V bh AgI/Ag
b) 0,004M CN- và 0,06M Ag(CN) -∣Ag biết Eo = -0,31V 2 Ag(CN)2/Ag
Câu 2. Tính thế điện cực của các cặp sau:
a) IO - (0,194M), I (2,00.10-4M), H+ (3,5.10-3M) ∣Pt a) 1,02 V 3 2 biết Eo = 1,176V IO3-/I2 b) AgBr
, Br- (0,05M) ∣Pt ; biết Eo = 0,073V (bh) AgBr/Ag
Phương thức làm việc của điện cực bạc khi nó kết
hợp với điện cực so sánh để đo nồng độ Ag+.
Phản ứng ở điện cực bạc là:
Phản ứng ở điện cực so sánh là:
Thế của điện cực so sánh được cố định ở 0,241V bởi vì pin điện cực được
bão hòa với KCl. Do đó phương trình Nernst cho toàn bộ pin sẽ là:
Thế của pin chỉ phụ thuộc vào [Ag+] Addition of 100,0 and 103,0 mL of AgNO3
Các điện cực chọn lọc ion (Ion-Selective Electrode, ISE)
o Trong số các phương pháp phân tích điện hóa hiện đại, phương pháp
điện thế sử dụng điện cực màng chọn lọc ion đã và đang sẽ là một
phương pháp được ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau
như nghiên cứu cơ bản, nghiên cứu ứng dụng, phân tích môi trường và :
y tế.. Nhờ đặc tính chọn lọc với một hoặc nhóm ion nhất định.
o Điện cực chọn lọc ion khác với điện cực kim loại nó không bao gồm
quá trình oxy hóa khử.
o Một điện cực chọn lọc ion lý tưởng cấu tạo bằng một màng mỏng
trong đó chỉ có các ion phân tích mới có thể đi qua.
o Sự dịch chuyển ion từ nơi có nồng độ cao đến nơi có nồng độ thấp
thông qua sự liên kết chọn lọc với một số ví trị trong màng và tạo nên sự
chênh lệch về điện thế.
o Các điện cực màng đôi khi còn được gọi là điện cực pIon bởi vì các số
liệu nhận được thường được biểu diễn dưới dạng hàm p- chẳng hạn pH, pCa hay pNO . 3
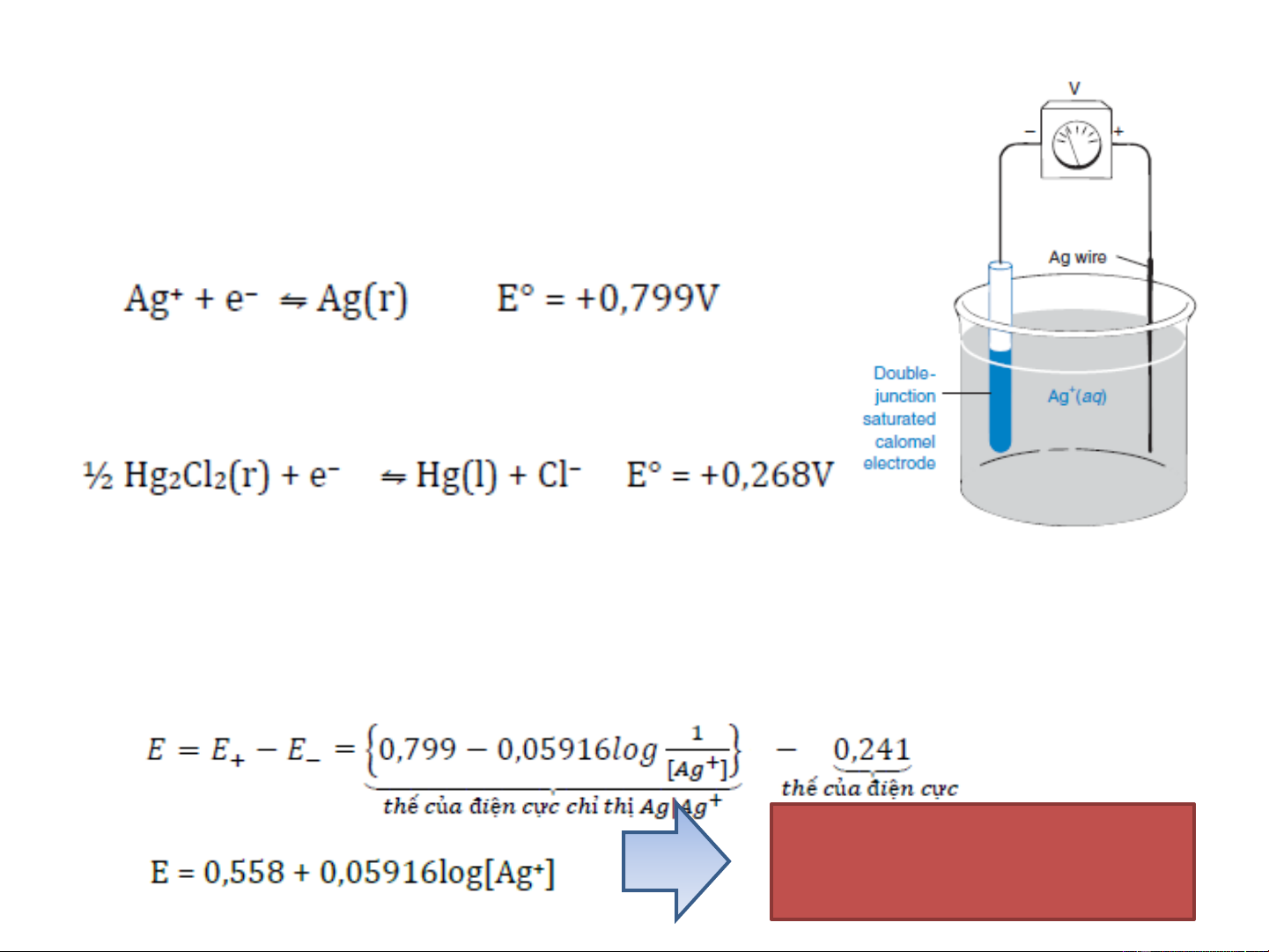
➢ C+ là ion cần phân tích.
➢ L là ligan tạo phức có thể mang ion, nó có thể
hòa tan trong màng chọn lọc ion.
➢ L được chọn sao cho có ái lực cao với ion cần
phân tích và ái lực thấp với các ion khác. Lý
tưởng nhất là L chỉ liên kết với C+ .
➢Thực tế L có thể liên kết với các
ion khác gây ảnh hưởng một phần
nào đó đến việc phân tích C+.
➢ Để cân bằng điện tích, màng chọn
lọc ion luôn có anion kỵ nước R- và
R- không bị hòa tan vào dung dịch.
➢ A- cũng không thể đi vào màng vì
nó không hòa tan trong dung môi hưu cơ.
➢ Màng chứa lượng dư L, hầu như ion phân tích trong màng liên kết với
L tạo LC+, nó cân bằng với một lượng nhỏ của C+ ở dạng tự do.
➢ C+ có thể khuyếch tán qua bề mặt của màng.
➢ Do đó một vài ion C+ có thể khuyếch tán từ màng vào dung dịch phân
tích, tại đó sẽ dư điện tích dương.
➢ Sự mất cân bằng này tạo ra một điện thế.
➢ Khi C+ khuyếch tán từ màng vào dung dịch thì sự thay đổi năng lượng tự do là:
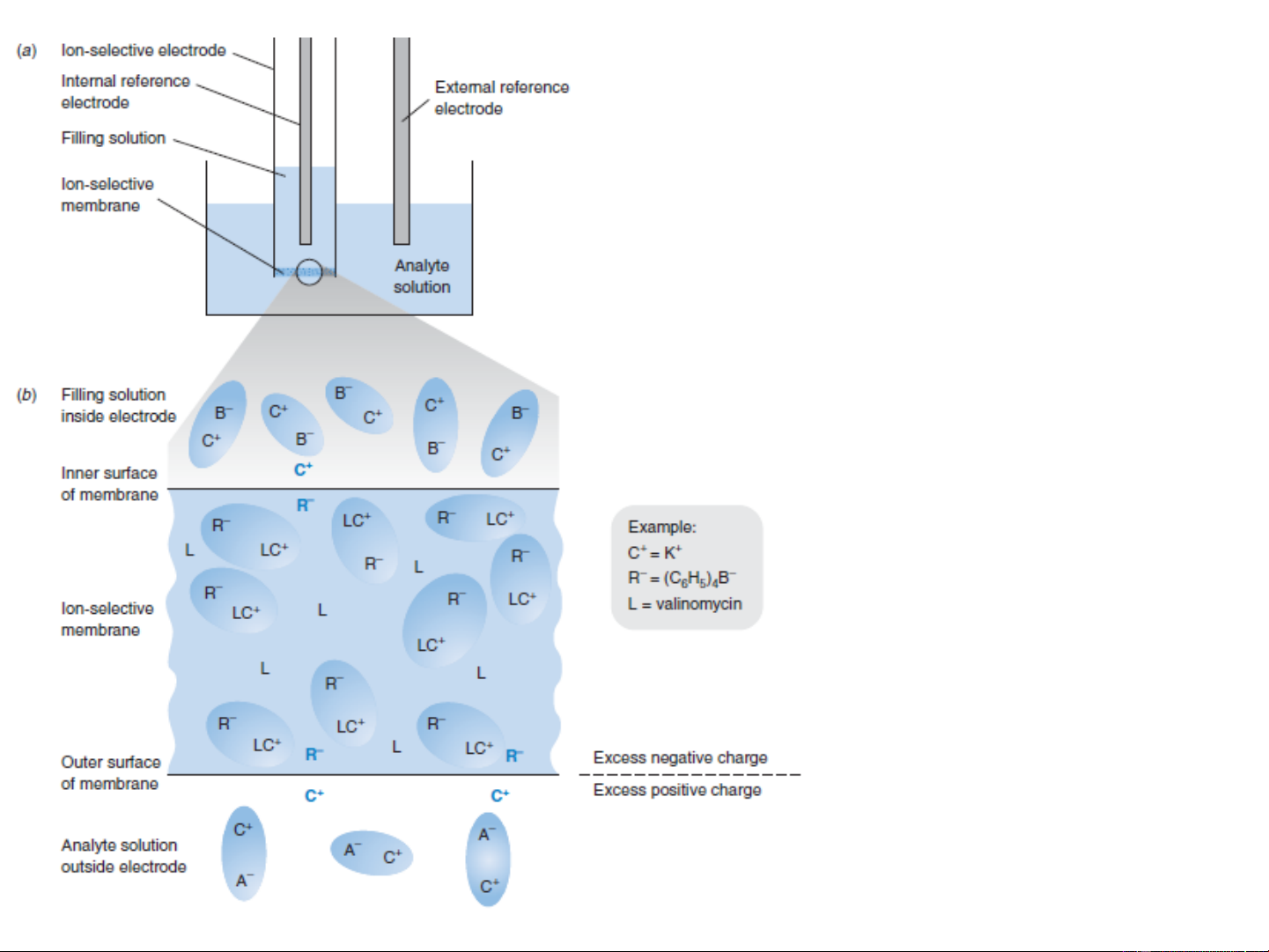
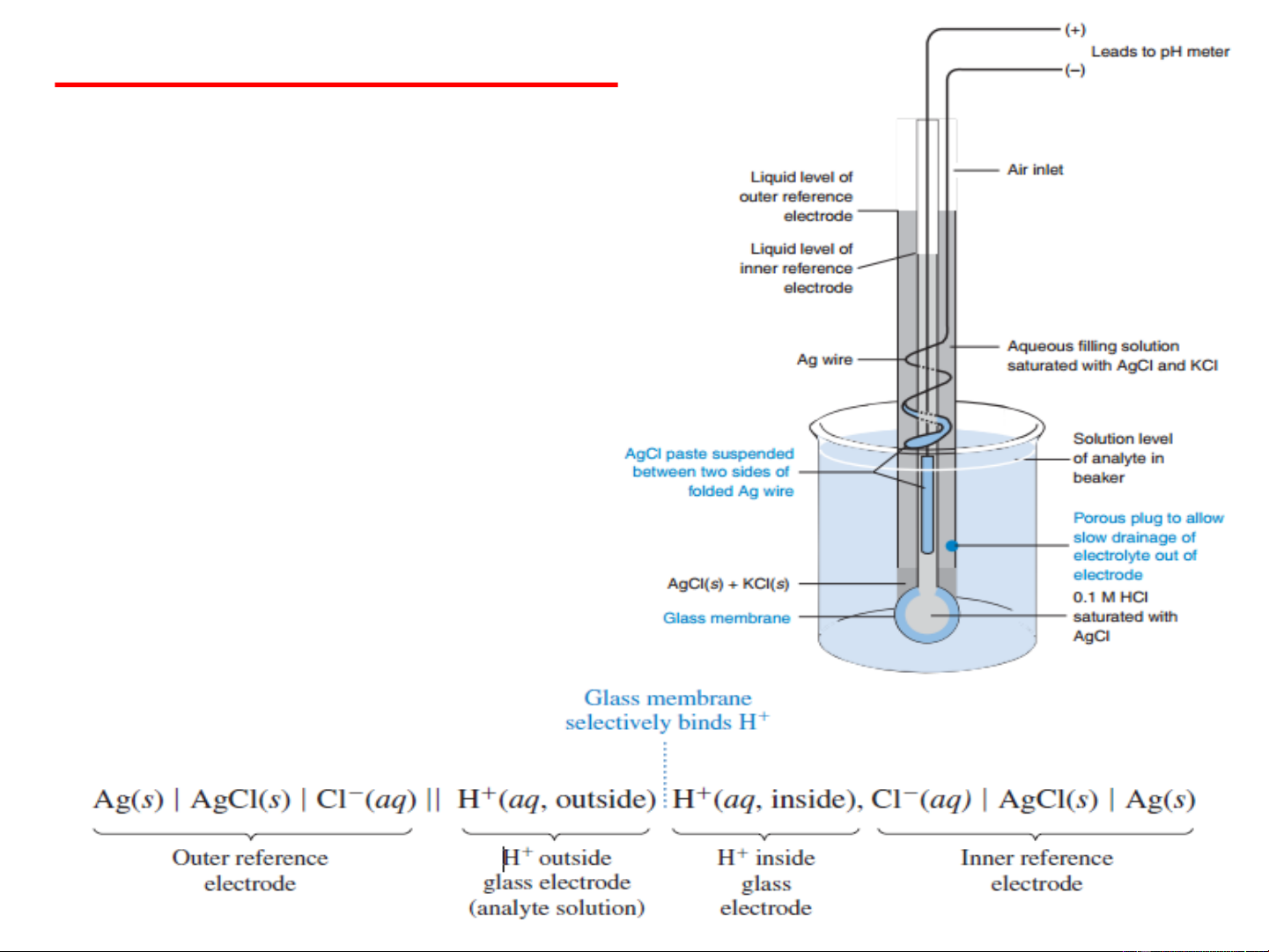
Điện cực thủy tinh để đo pH
o Điện cực thủy tinh được sử dụng để
đo pH là loại điện cực phổ biến nhất
trong các loại điện cực ion.
o Một loại điện cực tổ hợp thủy tinh pH
kết hợp cả thủy tinh và điện cực so
sánh trong cùng một thân.
o Sơ đồ của pin có thể viết như sau:




