






Preview text:
Nội dung
Chương 6. Phương pháp điện phân ........................................................................................................ 1
6.1. Sự điện phân và quá trình hóa học xảy ra khi điện phân............................................................. 2
6.2. Thế Ohm, sự phân cực nồng độ và quá thế ................................................................................. 4
6.2.1. Thế Ohm ................................................................................................................................ 4
6.2.2. Sự phân cực nồng độ (concentration polarization) .............................................................. 5
6.2.3. Quá thế (Overpotential) ........................................................................................................ 5
6.3. Phân tích bằng phương pháp điện phân ..................................................................................... 6
6.3.1. Điện phân với hai điện cực ................................................................................................... 8
6.3.2. Điều chỉnh điện áp điện phân với điện cực thứ ba ............................................................... 9
6.4. Câu hỏi ôn tập ............................................................................................................................ 10
Chương 6. Phương pháp điện phân (Electrogravimetric)
Trong phân tích bằng phương pháp điện phân, chất phân tích được định lượng dựa trên
khối lượng chất kết tủa rắn bám trên anot hay catot khi điện phân dung dịch tới hoàn
toàn. Sự tăng về mặt khối lượng của điện cực chỉ rõ cho chúng ta lượng chất phân tích có mặt là bao nhiêu.
Trong hô hấp và quang hóa, các electron được dịch chuyển trong một chuỗi các bước từ
một trung tâm oxy-hóa khử này sang một trung tâm oxy-hóa khử khác, trong đó năng
lượng được lưu giữ bởi các phân tử chung chẳng hạn như adenosin triphotphat (ATP-
coenzim được tạo bởi adenosin triphotphat với các nhóm photphat phụ, là hợp chất
quan trọng trong quá trình trao đổi chất). Sự hô hấp là tự phát được điều khiển bởi sự
dịch chuyển e- từ phân tử thức ăn (dạng khử) đến phân tử oxy (dạng oxy hóa). Quang
hóa là quá trình không tự phát, nó đòi hỏi năng lượng từ ánh sáng mặt trời để chuyển
hóa CO2 và H2O thành cacbohydrat và O2.
Trong phương pháp đo điện thế, chúng ta thấy rằng các phản ứng điện hóa tự phát với
dòng không đáng kể được điều chỉnh cho mục đích phân tích. Bây giờ, chúng ta sẽ xem
xét các phản ứng oxy-hóa khử không tự phát, được điều khiển bởi dòng bên ngoài đặt
vào, được sử dụng cho mục đích phân tích. 1
6.1. Sự điện phân và quá trình hóa học xảy ra khi điện phân Xét phản ứng: Catot Cu2+ + 2e– ⇋ Cu↓ Anot
H2O ⇋ ½ O2(k) + 2H+ + 2e–
2H2O + 2Cu2+ ⇋ Cu↓ + O2(k) + 4H+
E° = – (1,229–0,337) = –0,892V
Phản ứng xảy ra theo chiều từ phải qua trái (tự phát) vì thế tiêu chuẩn E°<0.
Giả sử chúng ta muốn điều chỉnh phản ứng này sang phải trong một dung dịch CuSO4
0,200M và [H+] = 1M, coi áp suất oxy = 1at. Thế của pin là: Epin = Ecatot – Eanot
Như vậy, ta phải đặt thế lớn hơn 0,913V thì chiều phản ứng mới diễn ra từ trái sang phải.
Mặt khác trong quá trình điện phân, nồng độ Cu2+ giảm, để điện phân hết Cu2+
([Cu2+]=10–6M) ta phải đặt thế lớn hơn 1,069V
Eđiện phân = –Epin = 1,069V 2
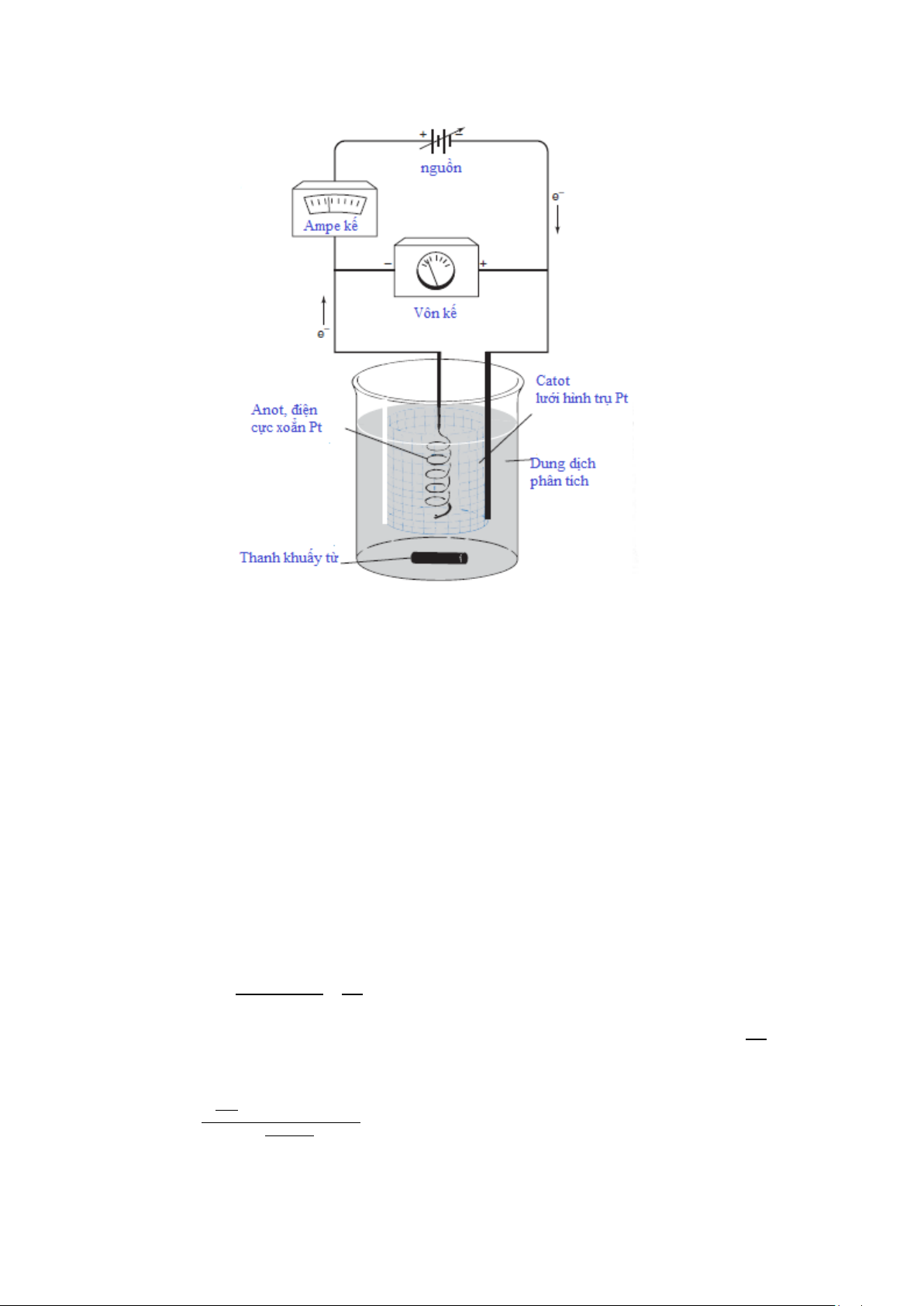
Hình 6-1. Sơ đồ thiết bị điện phân
Hình 6-1 chỉ ra một cặp điện cực Pt được nhúng vào dung dịch, thế lớn hơn 0,913V được
đặt vào. Ở catot (ở đó diễn ra sự khử) phản ứng ở đó là: Cu2+ + 2e– ⇋ Cu↓
Và ở anot (sự oxy hóa diễn ra), phản ứng là:
H2O – 2e– ⇋ ½ O2(k) + 2H+
Nếu dòng điện I chạy trong mạch với thời gian t, điện lượng đi qua bất kỳ điểm nào trong mạch sẽ là: = Số mol e– là: Mol e– = =
Nếu mỗi hạt (ion, phân tử, nguyên tử) trao đổi n electron thì số mol phản ứng = Số gam phản ứng: m = , (g) (6-1)
(6-1) là biểu thức của định luật điện phân Faraday 3
Ví dụ: Ở dòng I = 0,17A, t = 16 phút, có bao nhiêu gam PbO2 sẽ kết tủa?
Pb2+ + H2O ⇋ PbO2↓ + 4H+ + 2 e– ở anot 2H+ + 2 e– ⇋ H2(k) ở catot Số mol e– = = = 1,6×10–3 mol
2 mol e- cho mỗi mol PbO2 kết tủa, bởi vậy
Số mol PbO2 = ½ mol e– = 8,4×10–3 mol
= 8,4×10–3 (mol)×239,2 (g/mol) = 0,20g
6.2. Thế Ohm, sự phân cực nồng độ và quá thế
Ở phần trước, chúng ta xem xét pin điện hóa dưới điều kiện là bỏ qua sự thay đổi của
dòng. Đối với một pin hoạt động tốt, hay để quá trình điện phân xảy ra, dòng điện nhất
thiết phải thay đổi. Khi dòng thay đổi, có ba yếu tố làm giảm cường độ của điện áp đặt
vào pin galvanic và do đó làm tăng cường độ điện áp cần thiết đặt vào cho quá trình điện
phân. Ba yếu tố đó là thế Ohm, sự phân cực nồng độ và quá thế. 6.2.1. Thế Ohm
Bất kỳ 1 pin nào cũng có điện trở dòng điện. Điện áp cần thiết để ion có thể chạy trong
pin gọi là thế Ohm, được đưa ra bởi định luật Ohm. EOhm = IR (6-2)
Trong đó I là cường độ dòng điện, ampe và R là điện trở của pin, Ohm.
Nếu không có dòng chạy trong pin, sẽ không có thế Ohm vì I = 0. Nếu có dòng chạy trong
pin, điện áp đặt bên ngoài giảm bởi vì một phần năng lượng giải phóng bởi phản ứng
hóa học được dùng để thắng điện trở trong pin. Điện áp đặt vào trong pin điện phân
nhất thiết phải đủ lớn để thắng điện trở của pin và điều khiển phản ứng hóa học.
Giả sử khi vắng mặt của các ảnh hưởng khác như phân cực nồng độ, quá thế, điện áp của
pin galvanic bị giảm bởi IR và cường độ của điện áp đặt vào pin bị tăng bởi IR.
Thế đặt vào bên trong pin điện phân: Eđiện phân = –ENernst – IR 4
6.2.2. Sự phân cực nồng độ (concentration polarization)
Sự phân cực nồng độ xảy ra khi nồng độ của hạt tạo ra hay tiêu thụ ở một điện cực
không giống nhau ở bề mặt điện cực và trong dung dịch.
Sự phân cực nồng độ làm giảm cường độ điện áp của pin galvanic và làm tăng điện áp
cần thiết cho quá trình điện phân. Catot Cu2+ + 2e– ⇋ Cu↓
Trong quá trình điện phân, nếu ion Cu2+ chuyển động nhanh đến bề mặt điện cực bởi sự
khuếch tán và đối lưu, nồng độ Cu2+ sẽ như nhau trong toàn bộ dung dịch. Gọi nồng độ
của Cu2+ ở trong dung dịch là [Cu2+]o và nồng độ ở gần bề mặt điện cực là [Cu2+]s. Thế
của phương trình Cu2+ + 2e– ⇋ Cu↓ phụ thuộc [Cu2+]s chứ không phải là [Cu2+]o. Chúng ta viết: Ecatot = 0,339 + log[Cu2+] s (6-3)
Nếu [Cu2+]s = [Cu2+]o, thế của catot sẽ phù hợp với nồng độ của Cu2+ trong dung dịch.
Nếu dòng thay đổi nhanh tới mức mà Cu2+ không kịp tiến đến lân cận của điện cực và
[Cu2+]o sẽ lớn hơn [Cd2+]s. Đó chính là sự phân cực nồng độ. Kết quả là, thế của phương
trình (6-3) sẽ trở nên âm hơn và thế pin = (Ecatot – Eanot) trở nên âm hơn.
Sự phân cực nồng độ làm giảm cường độ điện áp pin galvanic và làm tăng điện áp đòi
hỏi cho quá trình điện phân.
Thế đặt vào trong pin điện phân Eđiện phân = –ENernst – IR – Ephân cực nồng độ
Các ion có thể chuyển động bởi sự khuếch tán, đối lưu và lực tĩnh điện. Tăng nhiệt độ sẽ
dẫn tới tăng tốc độ khuếch tán và bởi vậy làm giảm sự phân cực nồng độ. Tăng lực ion,
làm giảm lực tĩnh điện giữa ion và điện cực. Các yếu tố này đều có ảnh hưởng tới mức độ
phân cực. Cũng tương tự, điện cực có bề mặt lớn hơn, dòng có thể lớn hơn đi qua mà chưa có sự phân cực.
6.2.3. Quá thế (Overpotential)
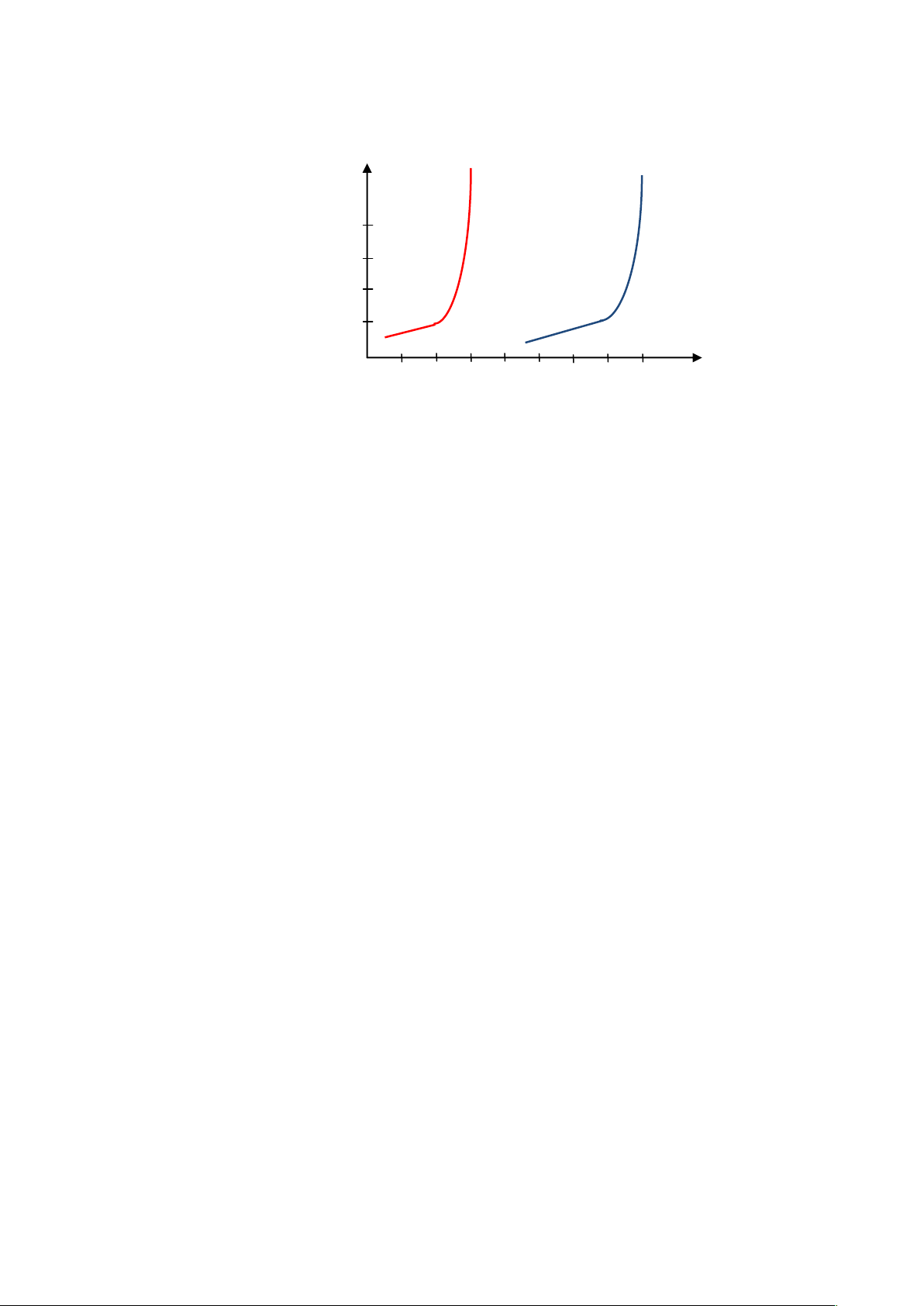
Hình (6-2) chỉ ra tính chất của catot Pt và Ag ở phản ứng khử H+ 5 H+ + 1e– ⇋ ½ H2(k) + H2O Pt Ag I, μA 2,0 1,5 1,0 0,5 0
–0,2 –0,3 –0,4 –0,5 –0,6 –0,7 –0,8 –0,9 Eđiện phân, V
Hình 6-2. Mối quan hệ dòng-thế của điện cực Pt và Ag trong môi trường dung dịch H2SO4
có pH = 3,2, không có O2. Trong cả hai trường hợp, điện cực calomen bão hòa được sử dụng.
Phản ứng này bắt đầu ở –0,35V ở điện cực Pt và –0,8V ở điện cực Ag. Điều gì diễn ra ở
đây? Nếu quá trình hóa học là như nhau, tại sao lại không đòi hỏi thế như nhau ở điện
cực khác nhau. Khi điện cực Hg được sử dụng với thực nghiệm này, thế khử bắt đầu ở tận –1,3V.
Dù sự phân cực nồng độ và thế Ohm đã được tính vào, vẫn cần một hiệu điện thế lớn
hơn để quá trình điện phân xảy ra. Sự khác nhau giữa thế tính (sau khi tính tới sự phân
cực nồng độ và thế Ohm) và thế để quá trình điện phân xảy ra được gọi là quá thế.
Thế đặt vào pin điện phân Eđiện phân = –ENernst – IR – Ephân cực nồng độ – Equá thế
Quá thế phụ thuộc vào:
- Bản chất của điện cực, các điện cực khác nhau, quá thế là khác nhau;
- Mật độ dòng càng lớn, quá trình điện phân xảy ra càng nhanh, quá thế sẽ càng
lớn. Quá thế trên bề mặt điện cực có diện tích lớn nhỏ hơn quá thế trên điện cực
có bề mặt nhỏ (liên quan đến mật độ dòng);
- Nhiệt độ tăng, quá thế giảm;
6.3. Phân tích bằng phương pháp điện phân
Trong phương pháp điện phân, chất phân tích được kết tủa trên bề mặt điện cực. Sự
tăng về mặt khối lượng trước và sau điện phân dung dịch đến hoàn toàn chỉ cho chúng
ta biết lượng chất phân tích có mặt là bao nhiêu. 6 Ví dụ
Một dung dịch chứa 0,40249g CoCl2.xH2O được điện phân để xác định lượng nước kết
tinh trong phân tử. Sau khi tiến hành phân tích người ta xác định được khối lượng
Coban bám trên điện cực Pt là 0,09937g. Hãy xác định x? Giải Co2+ + 2e– ⇋ Co↓
Hợp chất chỉ chứa CoCl2 và H2O, chúng ta có thể viết: = ⇿ = → x = 6
Vậy hợp chất có thành phần là CoCl2.6H2O
Thiết bị điên phân được minh họa trên hình 6-1. Các chất phân tích thường được kết tủa
trên điện cực sạch, trơ và có diện tích bề mặt lớn.
Các dấu hiệu nhận biết quá trình điện phân hoàn toàn hay chưa bao gồm: mất màu dung
dịch, không có dấu hiệu của chất kết tủa trên bề mặt điện cực mới ngập, hoặc định tính
sự có mặt của ion trong dung dịch.
Ví dụ như khi điện phân Cu2+ hoặc Co2+, màu của dung dịch mất dần đi trong quá trình
điện phân. Một cách khác là khi điện phân, người ta không nhúng toàn bộ điện cực vào
dung dịch. Để biết phản ứng điện phân đã diễn ra hoàn toàn hay chưa, người ta có thể
nhấc cao vị trí cốc điện phân lên, hoặc thêm nước để có thêm phần điện cực mới ngập.
Sau khi điện phân thêm 15 phút, nếu không thấy lớp sản phẩm điện phân ở phần điện
cực mới ngập thì có thể coi quá trình điện phân là hoàn toàn. Cách thứ ba là lấy một ít
dung dịch đang điện phân và kiểm tra định tính xem có còn ion kim loại đang điện phân không.
Phương pháp điện phân có thể coi là một phương pháp phân tích đơn giản nếu chúng ta
chỉ phân tích một ion kim loại trong một dung dịch trơ (không có ion gây nhiễu). Trong
thực tế, có thể có các yếu tố nhiễu cùng kết tủa trong quá trình điện phân. Nước có thể bị 7
điện phân, nó phân hủy thành H2 và O2 ở điện áp đặt vào bình điện phân đủ cao. Bọt khí
thoát ra ở điện cực có thể gây nhiễu quá trình kết tủa chất rắn. Bởi những yếu tố phức
tạp này, điều chỉnh điện áp đặt vào điện cực là rất quan trọng cho việc phân tích thành công.
6.3.1. Điện phân với hai điện cực
Khi không có sự phân cực nồng độ, điện áp cần thiết để quá trình điện phân xảy ra bao gồm: Eđiện phân
= – ENernst – IR – Equá thế
= – (Eanot – Ecatot) – IR – Equá thế (6-4)
Giả sử rằng chúng ta giữ điện áp cho quá trình điện phân dung dịch Cu2+ 0,10M trong
môi trường HNO3 1M là 2,0V. Do đồng được điện phân, nồng độ Cu2+ giảm. Cuối cùng, sự
phân cực nồng độ được thiết lập và Cu2+ không thể vận chuyển tới catot để duy trì dòng
ban đầu. Khi dòng giảm, cường độ của thế Ohm và quá thế ở phương trình (6-4) giảm.
Có thể coi Eanot = cosnt và kết quả làm nồng độ của dung môi lớn và bị oxy hóa ở anot.
Phản ứng oxy hóa ở anot là: H2O → ½ O2 + 2H+ + 2e–
Nếu Eđiện phân (là điện áp thực tế đặt vào bình điện phân) và Eanot là không đổi trong
phương trình (6-4) và nếu IR và quá thế giảm trong quá trình điện phân, thì Ecatot phải
trở nên âm hơn để giữ giá trị đại số cân bằng. Trên hình (6-3) thế catot giảm tới –0,4V,
với giá trị này H+ bị khử tới H2. Do thế catot giảm từ +0,3 đến –0,4V, các ion khác như
Co2+, Sn2+ và Ni2+ có thể bị khử. Tóm lại, khi điện áp đặt vào bình điện phân là không đổi,
thế catot trôi tới giá trị âm hơn và bất kỳ chất tan có thể dễ dàng bị khử hơn H+ có thể bị điện phân.
Để ngăn cản thế catot trở nên âm hơn và các ion nhiễu có thể bị khử, chất khử cực catot
chẳng hạn như NO3– được thêm vào dung dịch. Chất khử cực catot là chất có thể dễ dàng bị khử hơn H+
NO3– + 10H+ + 8e– → NH4+ + 3H2O 8
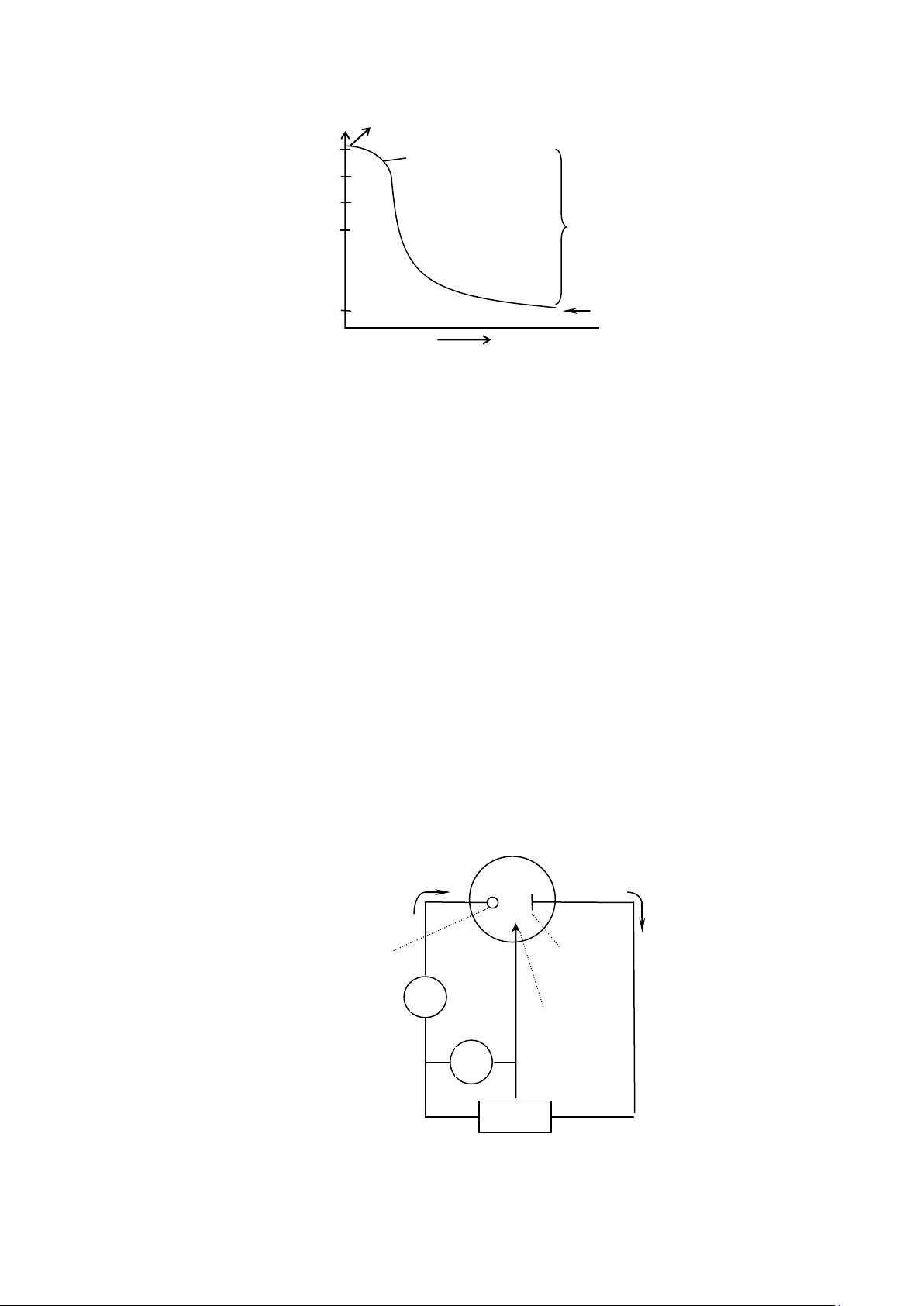
Ecatot,V Thế khử của Cu2+
0,3 Bắt đầu sự phân cực nồng độ B ấ t kỳ hạt gây nhiễu 0,2
nào có thể bị khử 0,1
trong miền điện thế
này đều có thể gây 0
nhiễu cho quá trình –0,2 phân tích –0,3 –0,4 Thế khử của H+ Thời gian
Hình 6-3. Ecatot thay đổi theo thời gian khi điện phân với hai điện cực khi điện áp đặt vào
điện cực là không đổi
6.3.2. Điều chỉnh điện áp điện phân với điện cực thứ ba
Quá trình điện phân với ba điện cực duy trì được thế ở catot không đổi và do vậy sẽ làm
tăng độ chọn lọc của phương pháp điện phân lên rất nhiều. Điện cực mà ở đó phản ứng
nghiên cứu xảy ra được gọi là điện cực làm việc. Điện cực calomen được sử dụng làm
điện cực so sánh cho điện cực làm việc. Điện cực phụ trợ (còn gọi là điện cực truy cập)
là điện cực cấp dòng phụ trợ cho điện cực làm việc. Có một dòng đáng kể giữa điện cực
làm việc và điện cực so sánh. Dòng chạy qua điện cực so sánh có thể bỏ qua, bởi vậy điện
thế của nó sẽ không bị ảnh hưởng bởi thế Ohm, sự phân cực nồng độ và quá thế. Nó thực
sự được duy trì bằng điện cực so sánh. Trong quá trình điện phân kiểm tra thế (hình 6-
4), điện áp giữa điện cực làm việc và điện cực so sánh được giữ không đổi bằng một thiết
bị được gọi là điều áp (potentiostat). e- e- Catot (điện Anot (trợ cực làm điện cực) việc) A Điện cực so sánh V calomen Điều biến
Hình 6-4. Mạch điện sử dụng cho quá trình điện phân với một điện cực thứ ba 9
Để hiểu tại sao khi thế catot là không đổi có thể tăng độ chọn lọc cho quá trình phân tích,
chúng ta hãy xem xét ví dụ khi điện phân dung dịch chứa Cu2+ 0,1M và Sn2+ 0,1M. Từ thế
khử tiêu chuẩn chúng ta có thể nói Cu2+ sẽ được điện phân trước Sn2+. Cu2+ + 2e– ⇋ Cu↓ E° = 0,339V Sn2+ + 2e– ⇋ Sn↓ E° = –0,141V
Thế catot tại đó Cu2+ có thể bị khử là:
Ecatot = 0,339 + log (0,1) = 0,31V
Nếu 99,99% Cu2+ được điện phân, nồng độ của Cu2+ còn lại là 10–5M và điện áp catot đòi
hỏi để quá trình khử tiếp tục là
Ecatot = 0,339 + log (10–5) = 0,19V
Khi thế catot là 0,19V, có thể coi quá trình điện phân Cu2+ là hoàn toàn. Câu hỏi ở đây là
liệu Sn2+ có bị khử hay không? Để kết tủa Sn từ dung dịch chứa Sn2+ 0,1M, điện áp catot
cần đặt vào bình điện phân là:
Ecatot, để khử ion thiếc) = –0,141 + log (0,1) = –0,17V
Do vậy, quá trình khử Sn2+ là không xảy ra.
6.4. Câu hỏi ôn tập
1. Trình bày sự điện phân và các quá trình hóa học xảy ra trong quá trình điện phân.
2. Trình bày các yếu tố ảnh hưởng đến điện áp cần thiết đặt vào bình điện phân để phản
ứng điện phân xảy ra.
3. Trình bày phương pháp điện phân với hai điện cực và nêu các ưu nhược điểm.
4. Trình bày phương pháp điện phân với việc kiểm tra thế điện cực. 10




