











Preview text:
Chương 6
PHƯƠNG PHÁP ĐIỆN PHÂN
VÀ ĐO ĐIỆN LƯỢNG
(Electrogravimetric and Coulometry)
Khái niệm phương pháp điện phân: Đây là phương pháp phân
tích đinh lượng điện hóa dựa trên khối lượng chất rắn bám trên
anot hay catot khi điện phân dung dịch tới hoàn toàn. Sự tăng
khối lượng của điện cực chỉ rõ cho chúng ta lượng chất phân
tích có mặt là bao nhiêu.
Phương pháp đo điện thế: Các phản ứng điện hóa tự phát với
dòng không đáng kể được điều chỉnh cho mục đích phân tích.
Phương pháp điện phân: Chúng ta sẽ xem xét các phản ứng oxy-
hóa khử không tự phát, được điều khiển bởi dòng bên ngoài đặt
vào sử dụng cho mục đích phân tích.
Advantages of gravimetric analysis: 1.
It is accurate and precise when using modern analytical balance. 2.
Possible sources of error are readily checked since filtrates can be tested
for completeness of precipitation and precipitates may be examined for the presence of impurities. 3.
It is an absolute method; it involves direct measurement without any form of calibration being required. 4.
Determination can be carried out with relatively inexpensive apparatus; the
most expensive items are a muffle furnace and sometimes platinum crucibles. 5.
Gravimetric analysis was used to determine the atomic masses of many
elements to six figure accuracy. 6.
Gravimetry provides very little room for instrumental error and does not
require a series of standards for calculation of an unknown.
Disadvantage of Gravimetric method: 1.
The chief disadvantage is that it requires meticulous time consuming. 2.
The chemist often prefers modern instrumental methods when they can be used. 3.
Gravimetric analysis usually only provides for the analysis of a single
element, or a limited group of elements, at a time. 4.
Methods are often convoluted and a slight mis-step in a procedure can
often mean disaster for the analysis (colloid formation in precipitation gravimetry, for example). 5.
Gravimetric analysis is based on the measurement of mass.
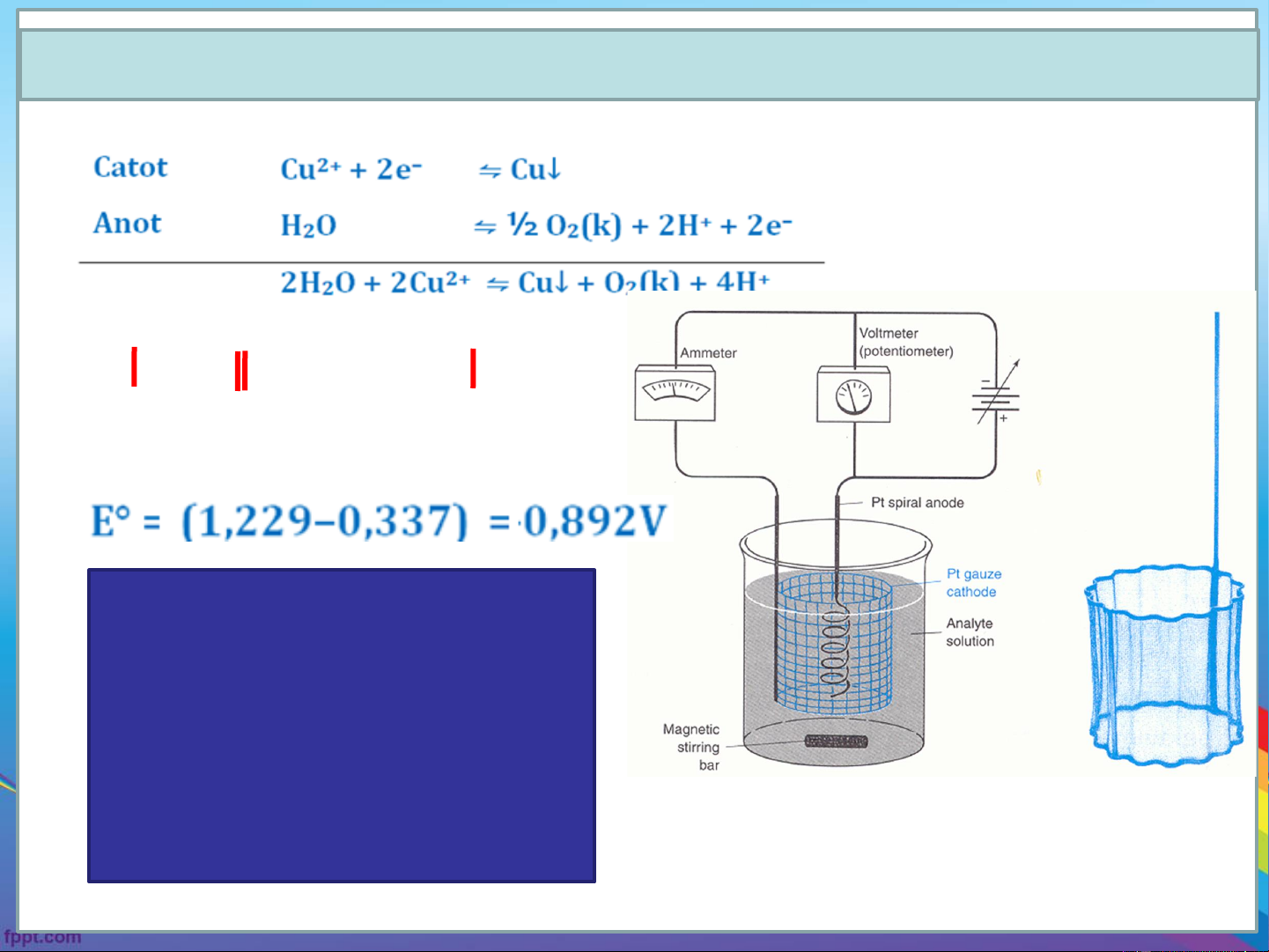
6.1. Sự điện phân và quá trình hóa học xảy ra khi điện phân Cu Cu2+ 2H+, 1/2O Pt 2 ∆EO = Eo – Eo ???? a k
Sơ đồ thiết bị điện phân ∆ ????
Chiều phản ứng từ
trái sang phải nếu không có điện áp bên ngoài ?????
Sơ đồ thiết bị điện phân
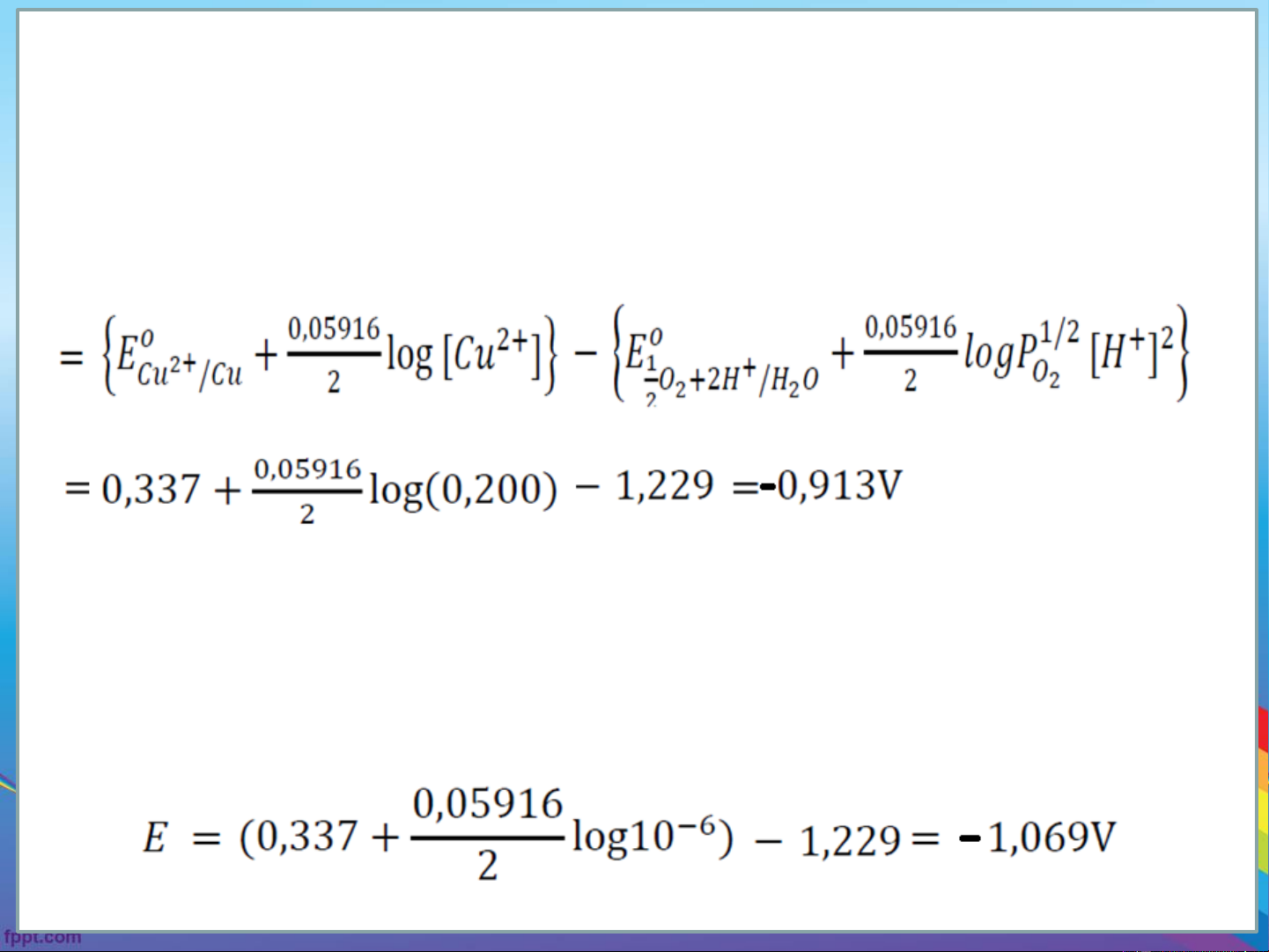
Ví dụ: Giả sử chúng ta muốn điều chỉnh phản ứng này sang phải trong một
dung dịch CuSO 0,200M và [H+] = 1M coi áp suất oxy = 1at. Thế của pin là: 4 Bài giải E (E ) = E - E pin cell k a
Như vậy, ta phải đặt thế lớn hơn 0,913V thì chiều phản ứng mới diễn ra từ trái sang phải.
• Như vậy ta phải đặt điện thế âm hơn -0,913V thì điện phân bắt đầu xảy ra
• Trong quá trình điện phân, nồng độ Cu2+ giảm, để điện phân hết Cu2+
([Cu2+] =10-6 M) ta phải đặt điện thế bằng:
6.2. Định luật Ohm, sự phân cực nồng độ, và quá thế
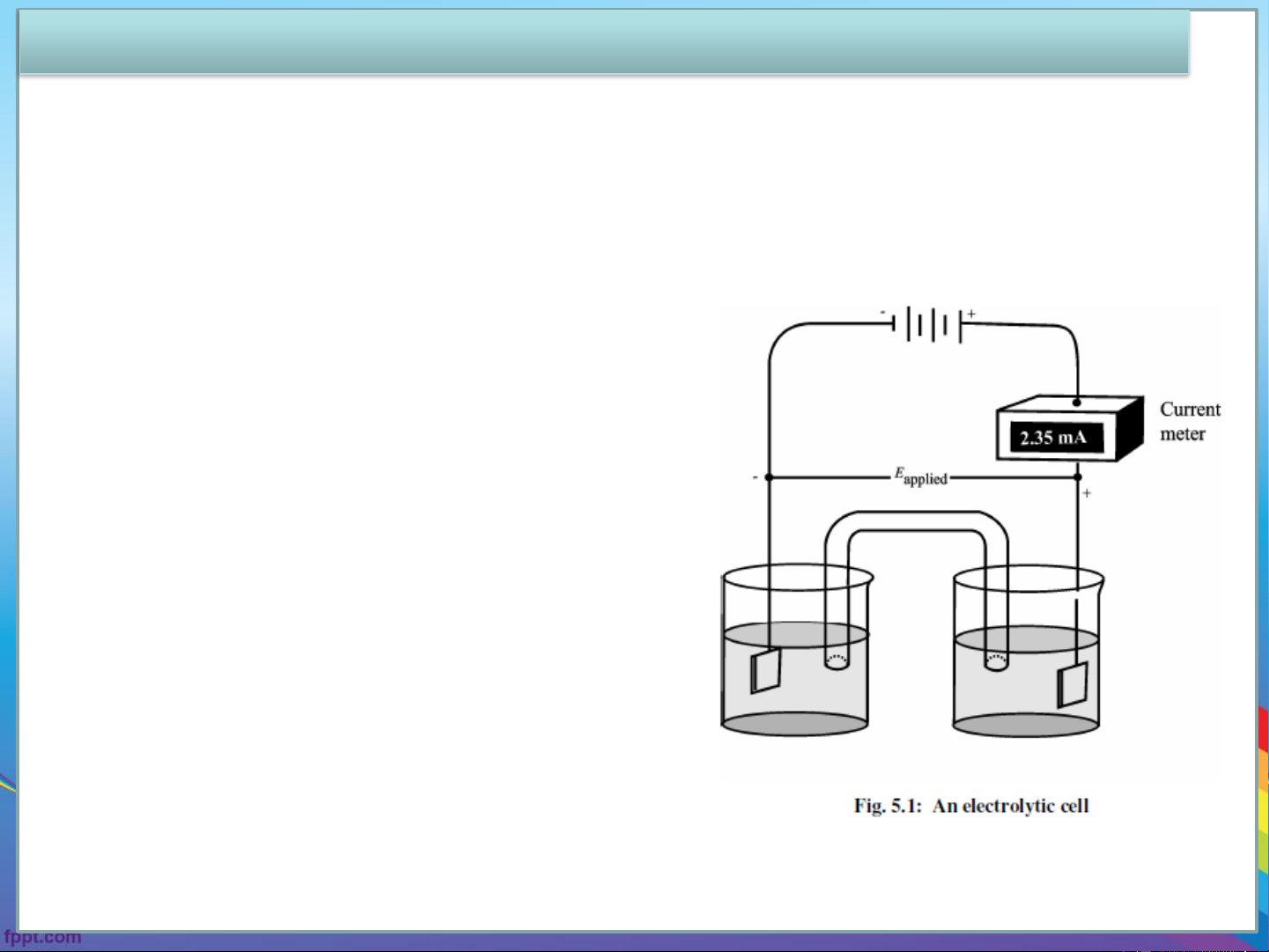
➢Consider the electrolytic cell shown in Fig. 5.1. A voltage E is applied applied
to the cell in such a way that a current flows through the cell. ➢When E > E
, there will be a flow of current in the circuit. applied cell
➢When there is a current, the potential of
the cell is less than the thermodynamic
potential because one or one of the
following phenomena are operating: IR drop, concentration polarisation and
kinetic(chemical) polarisation.
Định luật Ohm (Ohm’s Law)
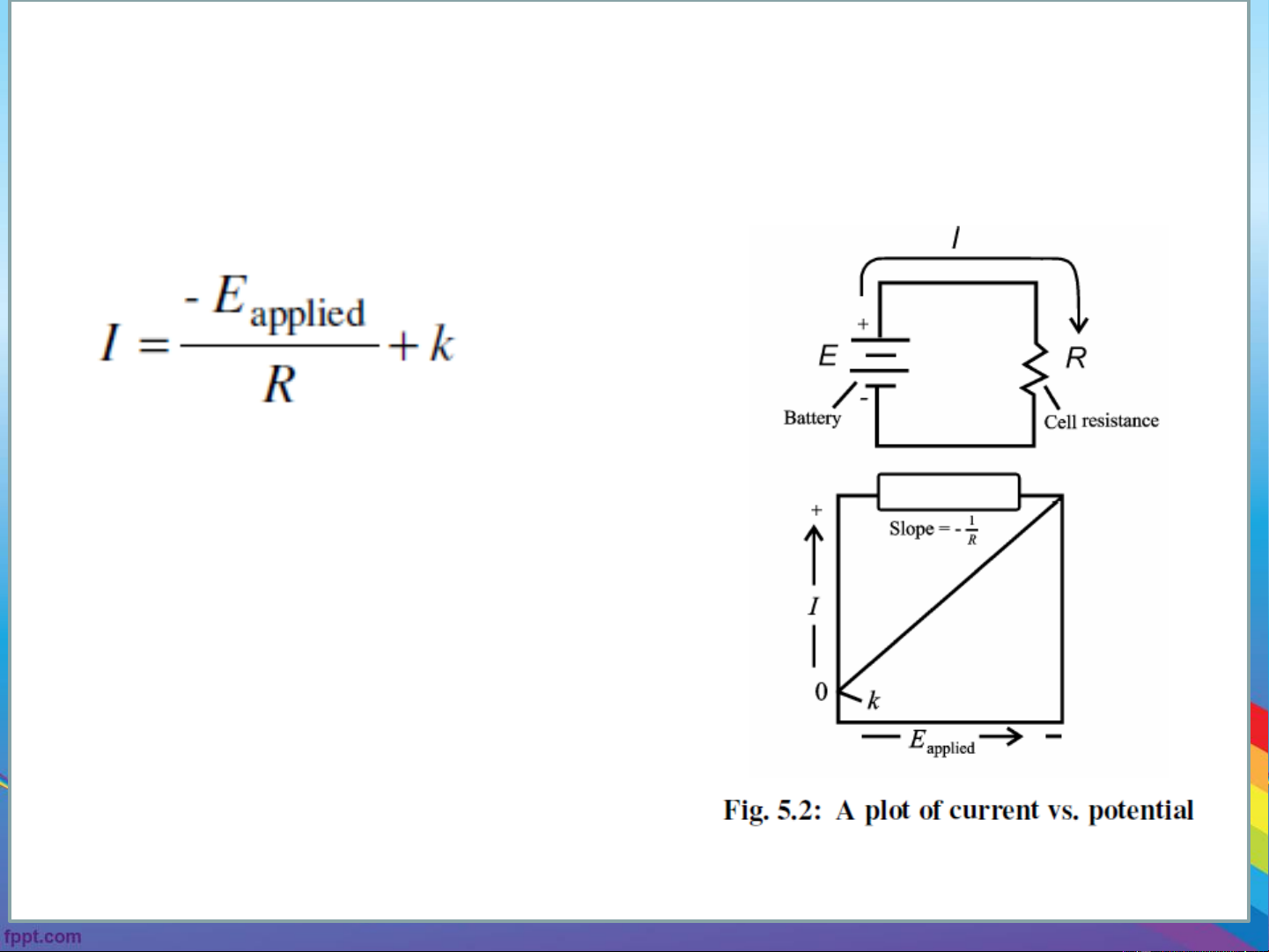
The relationship between voltage, current, and resistance is ohm’s Law: E = IR
where E is potential (voltage), I is current (in amperes) and R is
resistance (in ohms).
➢ We know that when applied potention, E = E , no current flows applied cell through the cell.
➢ When you gradually increase the applied potential, a small current
appears in the circuit. This current through the cell encounters resistance R
resulting in a potential drop of – IR volts. In other words, the applied
potential must be greater than the theoretical cell potential by – IR volts.
Thus, in the presence of a current, a cell potential must be modified by the
For small currents and brief periods of time, Ecathode and Eanode remain relatively constant durin additi g elec on trol of ysis. The the cell b termeha – viour
IR. can be represented by the reaction.
For small currents and brief periods of time, Ecathode and Eanode
remain relatively constant during electrolysis. The cell behaviour can be
represented by the reaction.
For small currents and brief periods of time, Ecathode and Eanode remain relatively
constant during electrolysis. The cell behaviour can be represented by the reaction.
where, k is a constant.
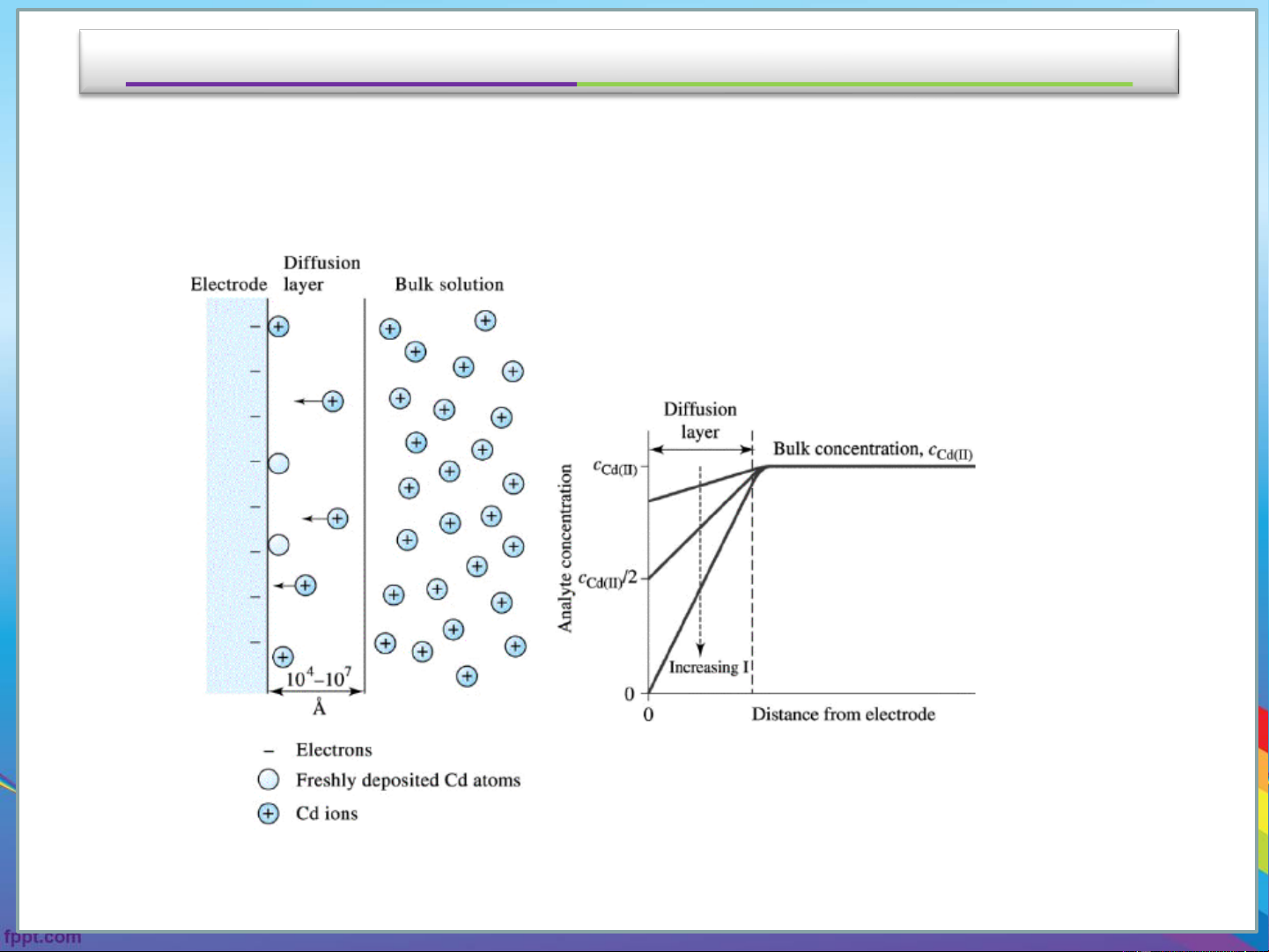
Sự phân cực nồng độ (concentration polarization)
Concentration polarization: due to a limited rate of mass transport from the
bulk solution to the surface of the electrode. .
Sự phân cực nồng độ làm giảm cường độ điện áp của pin galvanic
và làm tăng điện áp cần thiết cho quá trình điện phân.
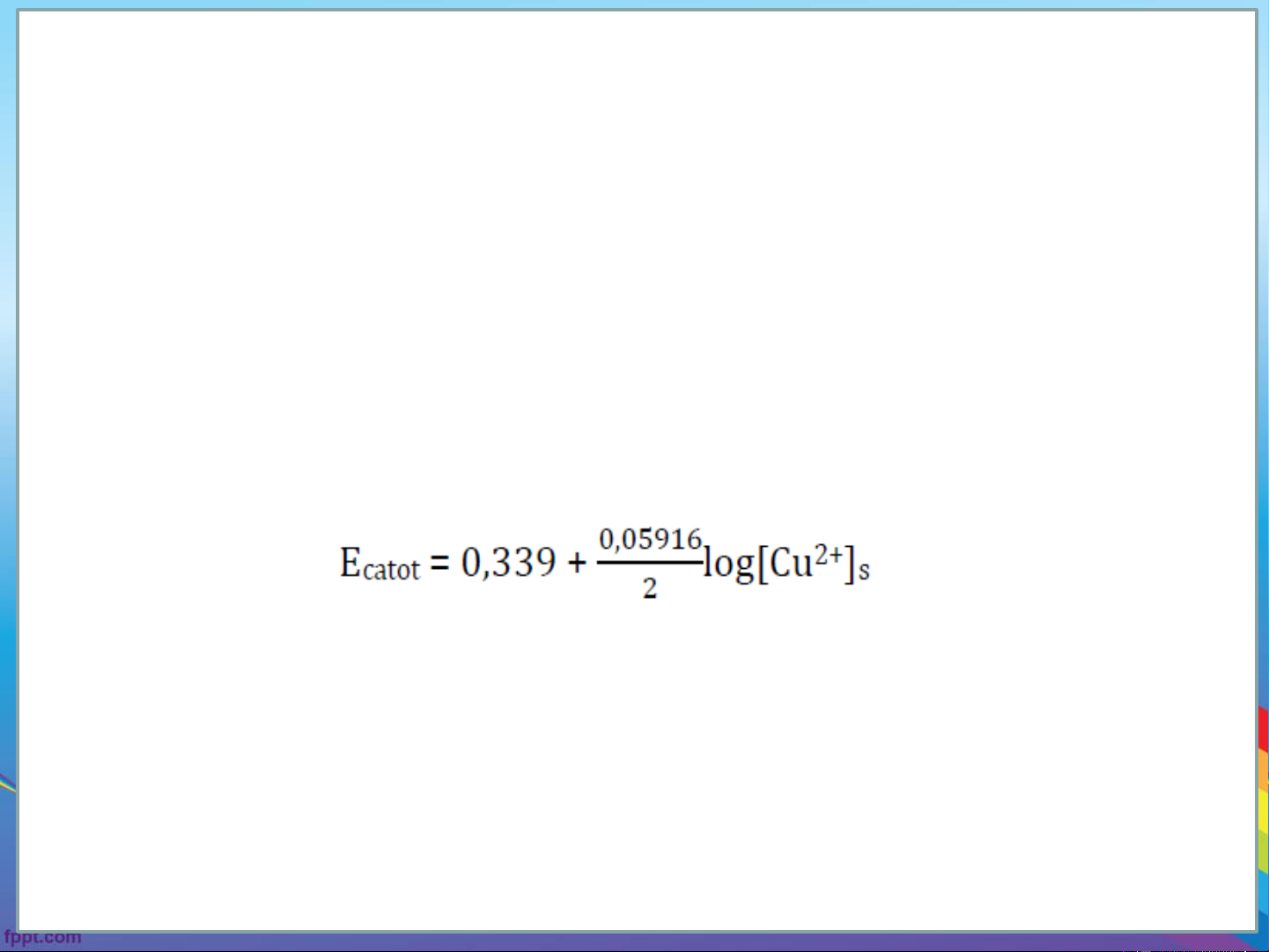
Ví dụ điện phân Cu2+ Catot
Cu2+ + 2e ⇋ Cu↓
Gọi nồng độ của Cu2+ ở trong dung dịch là [Cu2+] và nồng độ ở gần o
bề mặt điện cực là [Cu2+] . Thế của phương trình điện phân phụ s .
thuộc [Cu2+] chứ không phải là [Cu2+] . s o
Trong quá trình điện phân, nếu ion Cu2+ chuyển động nhanh đến bề
mặt điện cực bởi sự khuếch tán và đối lưu, nồng độ Cu2+ sẽ như
nhau trong toàn bộ dung dịch [Cu2+] = [Cu2+] . s o
Nếu dòng thay đổi nhanh tới mức mà Cu2+ không kịp tiến đến lân cận của
điện cực và [Cu2+] sẽ lớn hơn [Cu2+] . Đó chính là sự phân cực nồng độ. O s
Thế đặt vào trong pin điện phân: E = E - IR - E applied cell polarisation E = E
= - (E – E ) = (E – E ) cell nernst a k k a
➢ Các ion có thể chuyển động bởi sự khuếch tán, đối lưu và lực tĩnh điện.
Nếu dòng thay đổi nhanh tới mức mà Cu2+ không kịp tiến đến lân cận của điện cực và [Cu2+]o sẽ lớn hơn [Cd2+]s. Đó chính là sự phân
cực nồng độ. Kết quả là, thế của phương trình (6-3) sẽ trở nên âm hơn và thế pin = (Ecatot – Eanot) trở nên âm hơn.
Tăng nhiệt độ sẽ dẫn tới tăng tốc độ khuếch tán và bởi vậy làm giảm sự
phân cực nồng độ.
➢ Tăng lực ion làm giảm lực tĩnh điện giữa ion và điện cực. Các yếu tố này
đều có ảnh hưởng tới mức độ phân cực.
➢ Điện cực có bề mặt lớn hơn, dòng có thể lớn hơn đi qua mà chưa có sự phân cực.
Các biện pháp làm giảm sự phân cực nồng độ:
➢ Các ion có thể chuyển động bởi sự khuếch tán, đối lưu và lực tĩnh điện.
➢ Khuấy trộn, tăng nhiệt độ sẽ dẫn tới tăng tốc độ khuếch tán và
bởi vậy làm giảm sự phân cực nồng độ.
➢ Tăng lực ion, làm giảm lực tĩnh điện giữa ion và điện cực. Các
yếu tố này đều có ảnh hưởng tới mức độ phân cực. Cũng tương
tự, điện cực có bề mặt lớn hơn, dòng có thể lớn hơn đi qua mà
chưa có sự phân cực.
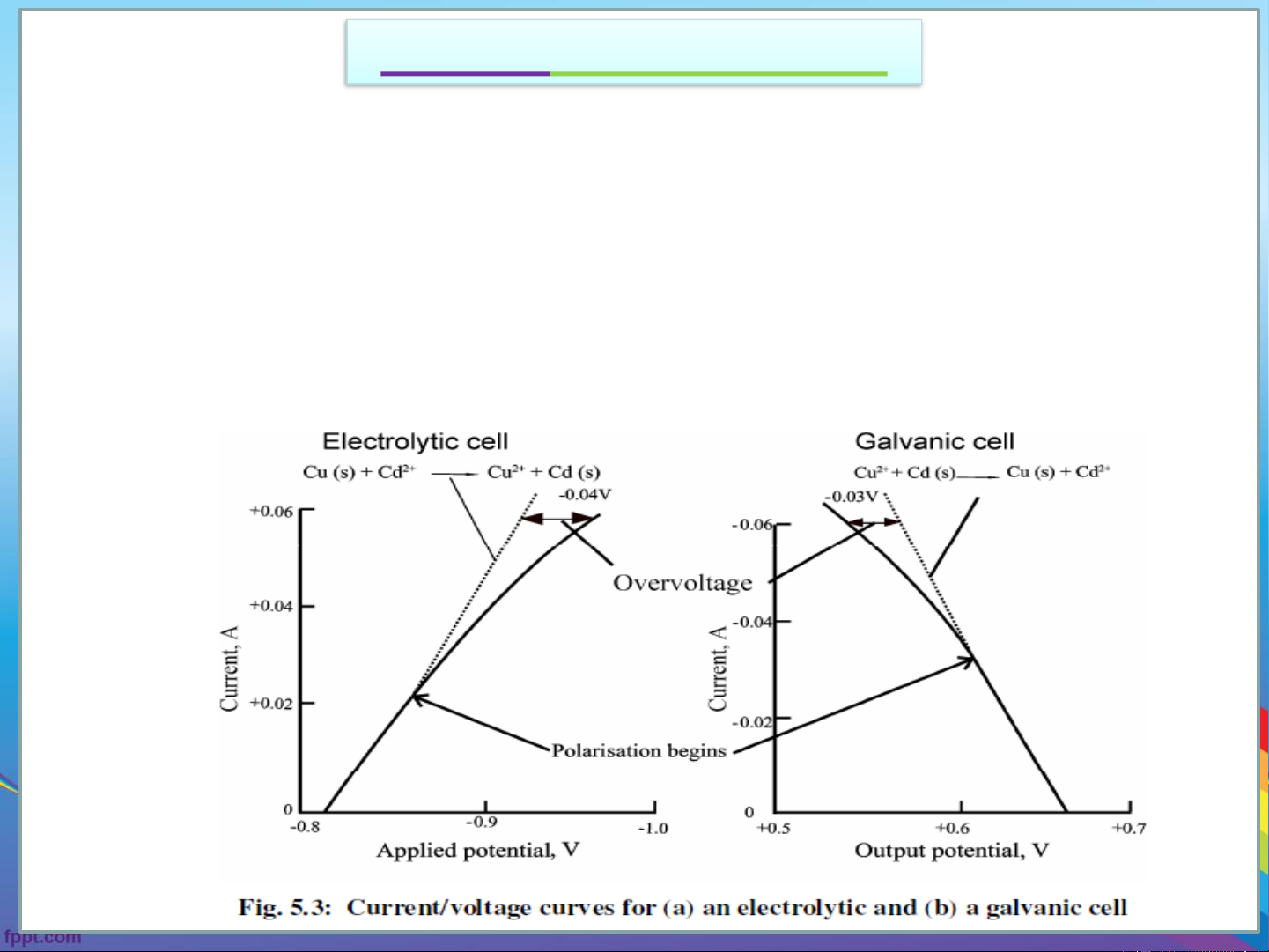
Quá thế (Overpotential,ƞ)
As shown in Fig. 5.2, a plot of current as a function of applied potential in an
electrolytic cell should be a straight line with a slope equal to the negative
reciprocal of the resistance. The plot is indeed linear with small currents as
in Fig.5.3a. As the applied voltage increases, the current deviates
significantly from linearity. Galvanic cells also behave in a similar way (Fig.5.3b).
As shown in Fig. 5.2, a plot of current as a function of applied potential in an
electrolytic cell should be a straight line with a slope equal to the negative reciprocal
of the resistance. The plot is indeed linear with small currents as in Fig.5.3a. As the
applied voltage increases, the current deviates significantly from linearity. Galvanic
cells also behave in a similar way (Fig.5.3b).
Dù sự phân cực nồng độ và thế Ohm đã được tính vào, vẫn cần một hiệu điện
thế lớn hơn để quá trình điện phân xảy ra. Sự khác nhau giữa thế tính được
(bao gồm cả thế phân cực nồng độ và thế Ohm) và thế để quá trình điện phân
xảy ra được gọi là quá thế.
Thế đặt vào pin điện phân: E = E – IR – E – E (E = ƞ + ƞ ) applied cell polarisation overpotential overpotential a k
Quá thế phụ thuộc vào:
✓ Bản chất của điện cực và thành phần phản ứng làm điện cực. Các điện cực
khác nhau, quá thế là khác nhau (quá thế trên bề mặt điện cực có diện tích lớn
nhỏ hơn quá thế trên điện cực có bề mặt nhỏ (liên quan đến mật độ dòng).
Quá thế trên bề mặt nhẵn bóng lớn hơn so với bề mặt nhám, ráp. Quá thế kim
loại thoát kim loại bé hơn khí thoát khí.
✓ Mật độ dòng càng lớn, quá trình điện phân xảy ra càng nhanh, quá thế sẽ càng lớn.
✓ Nhiệt độ tăng, quá thế giảm.
Ý nghĩa của mật độ dòng khi điện phân
Mật độ dòng j = I/S (A/Cm2)
❖ Nếu điện phân với mật độ dòng lớn (I lớn)
✓ Thời gian điện phân nhanh
✓ Chất lượng lớp kim loại bám trên điện cực xốp không chắc trên điện cực
✓ Có thể có H thoát ra cùng kim loại. 2
❖ Nếu điện phân với mật độ dòng nhỏ
✓ Thời gian điện phân lâu
✓ Lớp kim loại bám trên điện cực có dạng bột mịn bám chắc trên điện cực
Vậy phải điện phân với mật độ dòng trung bình từ 0,001 - 0,01 (A/cm2)
6.3. Định luật cơ bản về điện phân (Faraday)
➢ Khối lượng các chất thoát ra trên điện cực tỉ lệ thuận với lượng điện chạy qua dung dịch.
➢ Khi điện lượng chạy qua dung dịch như nhau thì trên điện cực sẽ thoát ra
lượng vật chất tương đương. 20




