











Preview text:
CHƯƠNG 7. PHƯƠNG PHÁP PHÂN TÍCH VÔN – AMPE (Voltammetry) Tran Thi Thuy
Department of Analytical Chemistry
School of Chemical Engineering – Hanoi University of Science and Technology (HUST) Outline
7.1. Đặc điểm chung 7.2 Điện cực đĩa quay
7.3 Phương pháp cực phổ
7.4 Phương pháp von-ampe xung vuông
7.5 Phương pháp von-ampe ngược
7.6 Câu hỏi ôn tập 12/9/2021 2 HUST SCE
7.1. Đặc điểm chung
Phươ ng pháp phân tích vôn-ampe là nhóm các phương
pháp dựa vào đường cong vôn-ampe, hay còn gọi là
đường cong phân cực, là đường cong biểu diễn mối quan
hệ giữa cường độ dòng điện với điện thế khi tiến hành
điện phân dung dịch phân tích.
Quá trình điện phân được thực hiện trong một bình điện
phân đặc biệt, trong đó có một điện cực có diện tích bé
hơn diện tích của điện cực kia nhiều lần. Điện cực có diện
tích bé được gọi là vi điện cực. Quá trình khử (hay oxy
hóa) chủ yếu xảy ra trên vi điện cực. 3 HUST SCE
7.1. Đặc điểm chung
Việc ứng dụng đường cong điện phân cực vào mục đích
phân tích đã được nhà bác học người Tiệp Khắc
Heyrovski tìm ra vào năm 1922. Do phát minh về
phương pháp phân tích dựa vào đường cong điện phân
cực và những đóng góp xây dựng phát triển phương
pháp phân tích, năm 1959 Heyrovski được tặng giải
thưởng Nobel về hóa học. 4 HUST SCE
7.1. Đặc điểm chung
Dùng phương pháp vôn-ampe người ta có thể xác định
được nhiều ion vô cơ, hợp chất hữu cơ. Quá trình phân
tích có thể được thực hiện trong môi trường nước và cả
môi trường không nước. Phép phân tích có thể được
thực hiện với độ nhạy, độ chọn lọc và độ chính xác rất cao. 5 HUST SCE
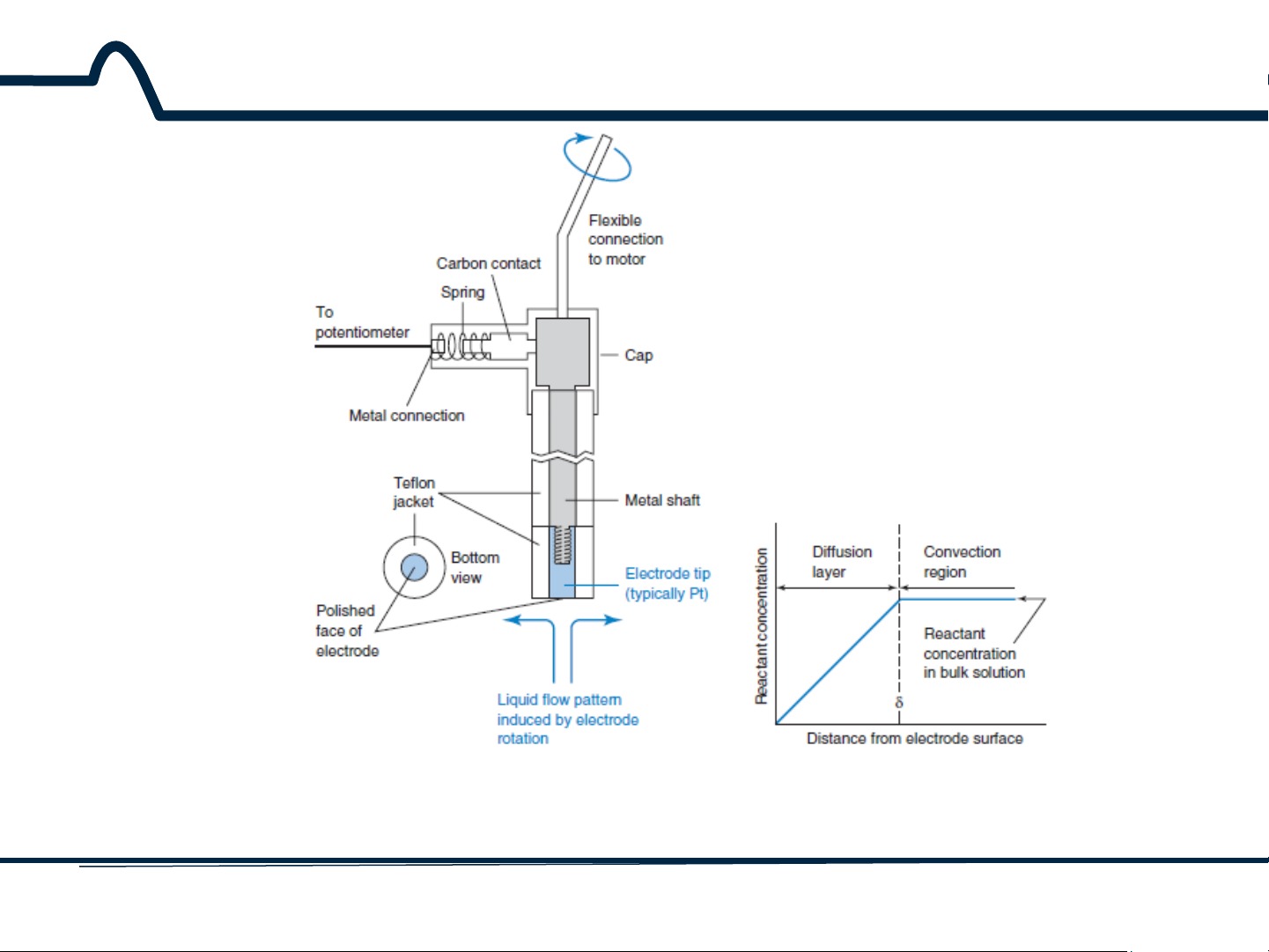
7.2. Điện cực đĩa quay
Hình 7-1 (a) Điện cực đĩa quay. Chỉ bề mặt dưới cùng của điện cực được đánh bóng, nó có đường kính phổ
biến là 5 mm, tiếp xúc với dung dịch. (b) Sơ đồ nồng độ của chất phân tích gần bề mặt của điện cực đĩa
quay khi điện thế đủ lớn để giảm nồng độ chất phân tích về 0 ở bề mặt điện cực. 6 HUST SCE
7.2. Điện cực đĩa quay
Một phân tử có ba cách để tiếp cận bề mặt điện cực:
(1)khuếch tán (diffusion) qua gradien nồng độ;
(2) đối lưu (convection), là chuyển động của chất lỏng trong
dung dịch bằng khuấy hoặc đun sôi;
(3) sự di chuyển (migration), là lực hút hoặc lực đẩy của một
ion bởi một bề mặt tích điện.
Một điện cực làm việc phổ biến cho phép đo cường độ dòng là
đĩa quay điện cực, trong đó sự đối lưu và khuếch tán kiểm soát
dòng của chất phân tích đến điện cực. 7 HUST SCE
7.2. Điện cực đĩa quay
Khi điện cực trong Hình 7-1a được quay với khoảng 1000 vòng
quay mỗi phút, một dòng xoáy được thiết lập để đưa chất
phân tích đến gần điện cực rất nhanh bằng cách đối lưu. Nếu
điện thế là đủ lớn, chất phân tích phản ứng rất nhanh ở điện
cực, làm giảm nồng độ ngay tại bề mặt đến gần 0.
Gradient nồng độ kết quả được biểu diễn dưới dạng giản đồ
Hình 7-1b. Chất phân tích phải đi qua quãng đường ngắn cuối
cùng (khoảng 10-100 μm) bằng cách tự khuếch tán. 8 HUST SCE
7.2. Điện cực đĩa quay
Tốc độ mà chất phân tích khuếch tán từ trong dung dịch (bulk
solution) đến bề mặt của điện cực là tỷ lệ với sự chênh lệch
nồng độ giữa hai vùng:
Dòng giới hạn tỉ lệ với tốc độ khuếch tán tỉ lệ với [C]o – [C]s
ở đây [C]o là nồng độ trong dung dịch và [C]s là nồng độ ở bề mặt của điện cực.
Ở điện thế đủ lớn, tốc độ của phản ứng ở điện cực nhanh tới mức [C]s<< [C]o
Dòng giới hạn = dòng khuếch tán tỉ lệ với [C]o 9 HUST SCE
7.2. Điện cực đĩa quay
Dòng giới hạn được gọi là dòng khuếch tán vì nó được điều
chỉnh bởi tốc độ chất phân tích có thể khuếch tán đến điện cực.
Dòng giới hạn = dòng khuếch tán tỉ lệ với [C]o
Tỷ lệ của dòng khuếch tán với nồng độ trong dung dịch là cơ
sở để phân tích định lượng bằng phương pháp đo ampe
(amperometry) và phương pháp cực phổ (voltammetry). 10 HUST SCE
7.2. Điện cực đĩa quay
Điện cực đĩa quay càng quay nhanh thì lớp khuếch tán trong
hình 7-1b càng mỏng và dòng khuếch tán càng lớn. Một điện
cực Pt quay nhanh có thể đo nồng độ H 2O2 20 nM trong nước
mưa. H2O2 bị oxy hóa thành O2 ở +0,4V (so với S.C.E.) ở bề
mặt Pt và dòng tỷ lệ với [H2O2] trong nước mưa. 11 HUST SCE
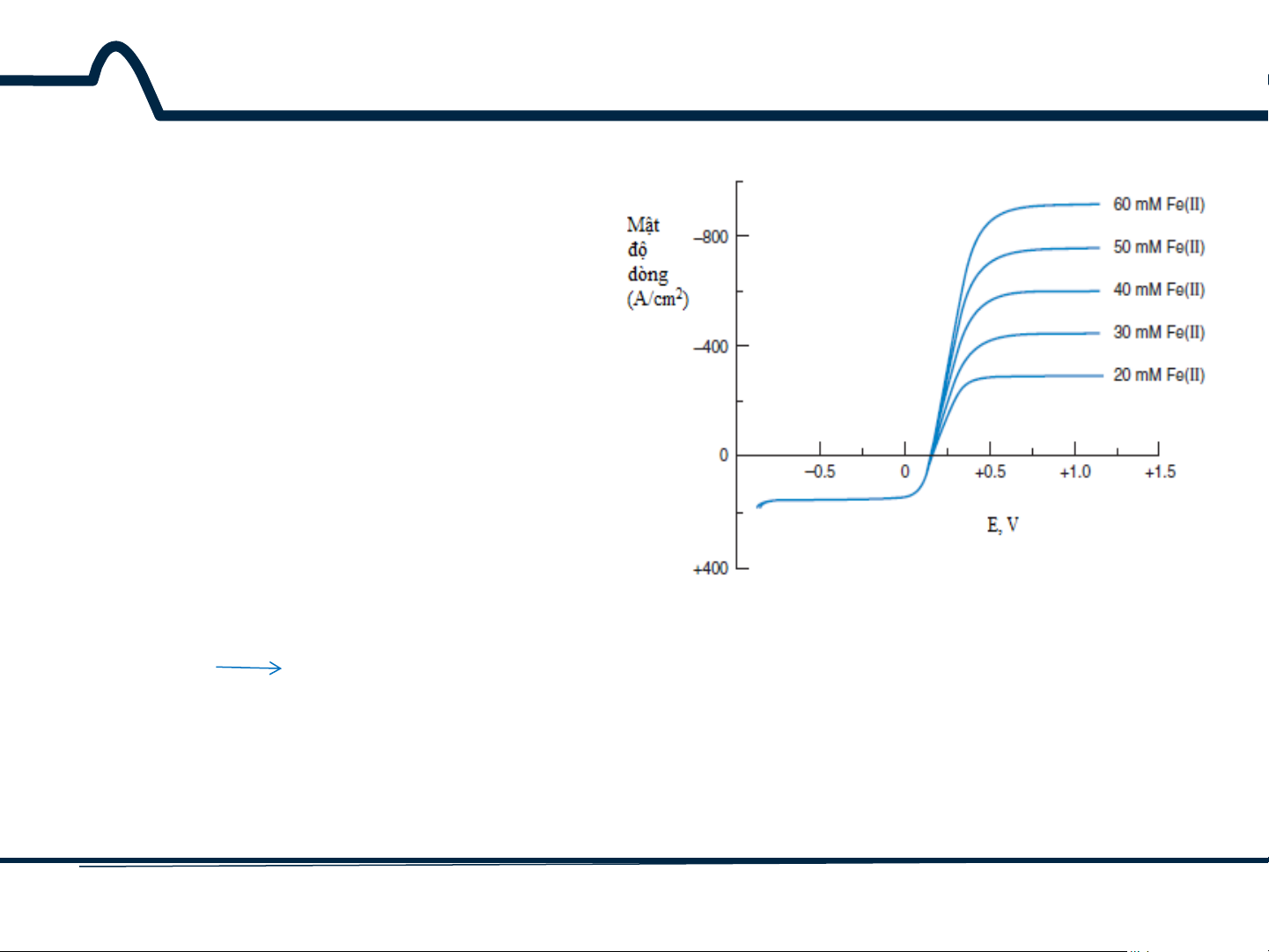
7.2. Điện cực đĩa quay Đường cong von-ampe trên hình 7-
2 là đường cong mô tả mối quan hệ
dòng và thế của điện cực làm việc
trong quá trình oxy hóa hay khử của hỗn hợp Fe(CN)3− 4− 6 / Fe(CN)6
xảy ra trên điện cực đĩa quay.
Theo qui ước, dòng là dương khi
chất phân tích bị khử trên điện cực
làm việc. Giới hạn của dòng khuếch
tán cho quá trình oxy hóa Fe(CN) 4– 6
xảy ra ở điện thế lớn hơn 0,5V (điện
cực so sánh là calomen bão hòa). 4– 3–
Hình 7-2. Đường cong vôn-ampe cho hỗn hợp 10 Fe(CN)6 Fe(CN)6 + e– mM K Ferrocyanide Ferricyanide
3Fe(CN)6 và 20-60mM K4Fe(CN)6 trong dung (xyanua sắt II) (xyanua sắt III)
dịch Na2SO4 0,1M trên điện cực đĩa quay cacbon
Ở vùng này, dòng được điều khiển bởi tốc độ
thủy tinh. Tốc độ quay 2000 vòng/phút, điện thế khuếch tán của Fe(CN)4− 6 tới điện cực. quét 5mV/s 12 HUST SCE
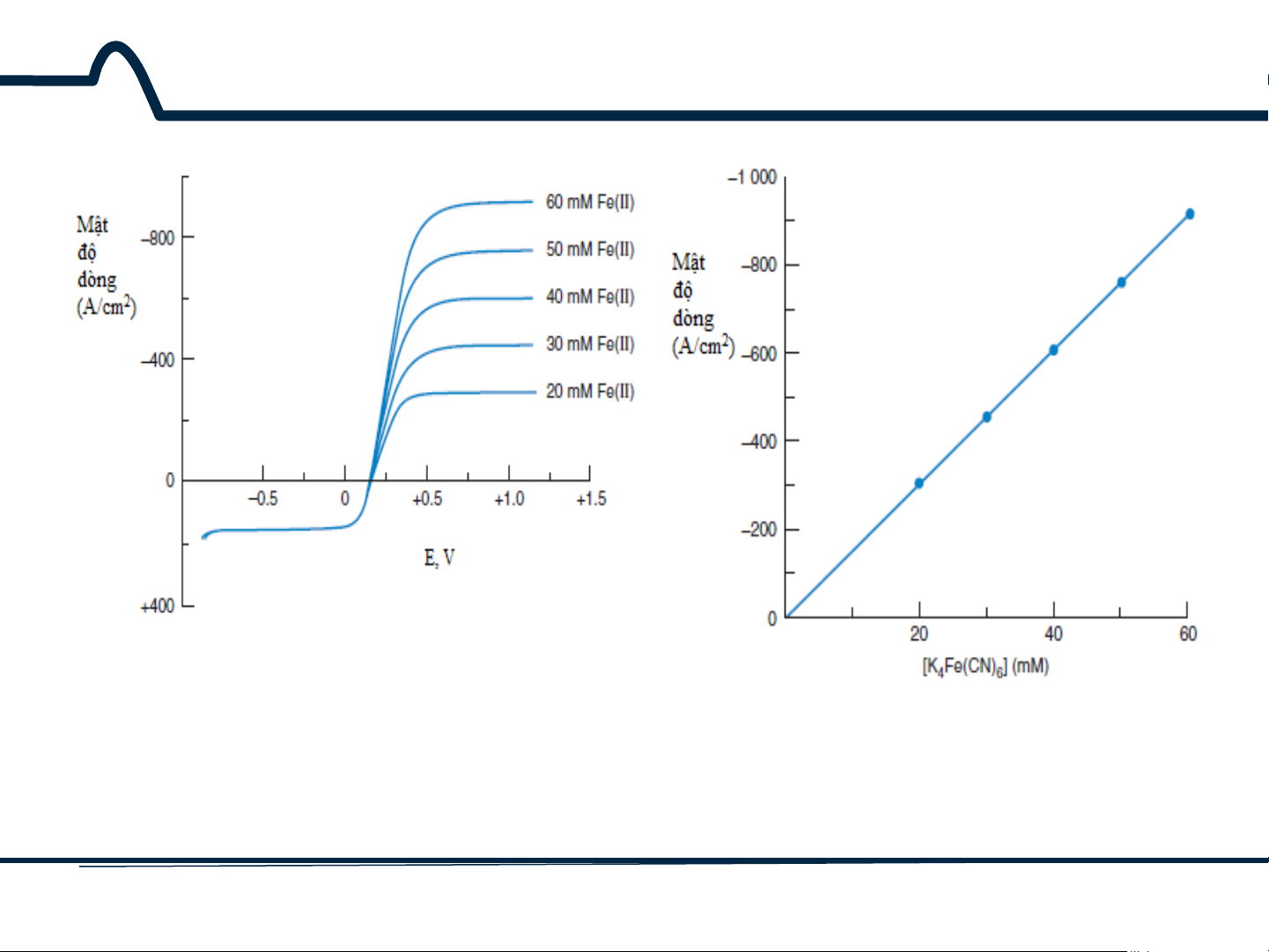
7.2. Điện cực đĩa quay
Hình 7-2. Đường cong vôn-ampe cho hỗn hợp
K3Fe(CN)6 10 mM và K4Fe(CN)6 20-60mM trong
Hình 7-3. Sự phụ thuộc dòng giới hạn
dung dịch Na2SO4 0,1M trên điện cực đĩa quay vào nồng độ K4Fe(CN)6
cacbon thủy tinh. Tốc độ quay 2000 vòng/phút, điện thế quét 5mV/s 13 HUST SCE
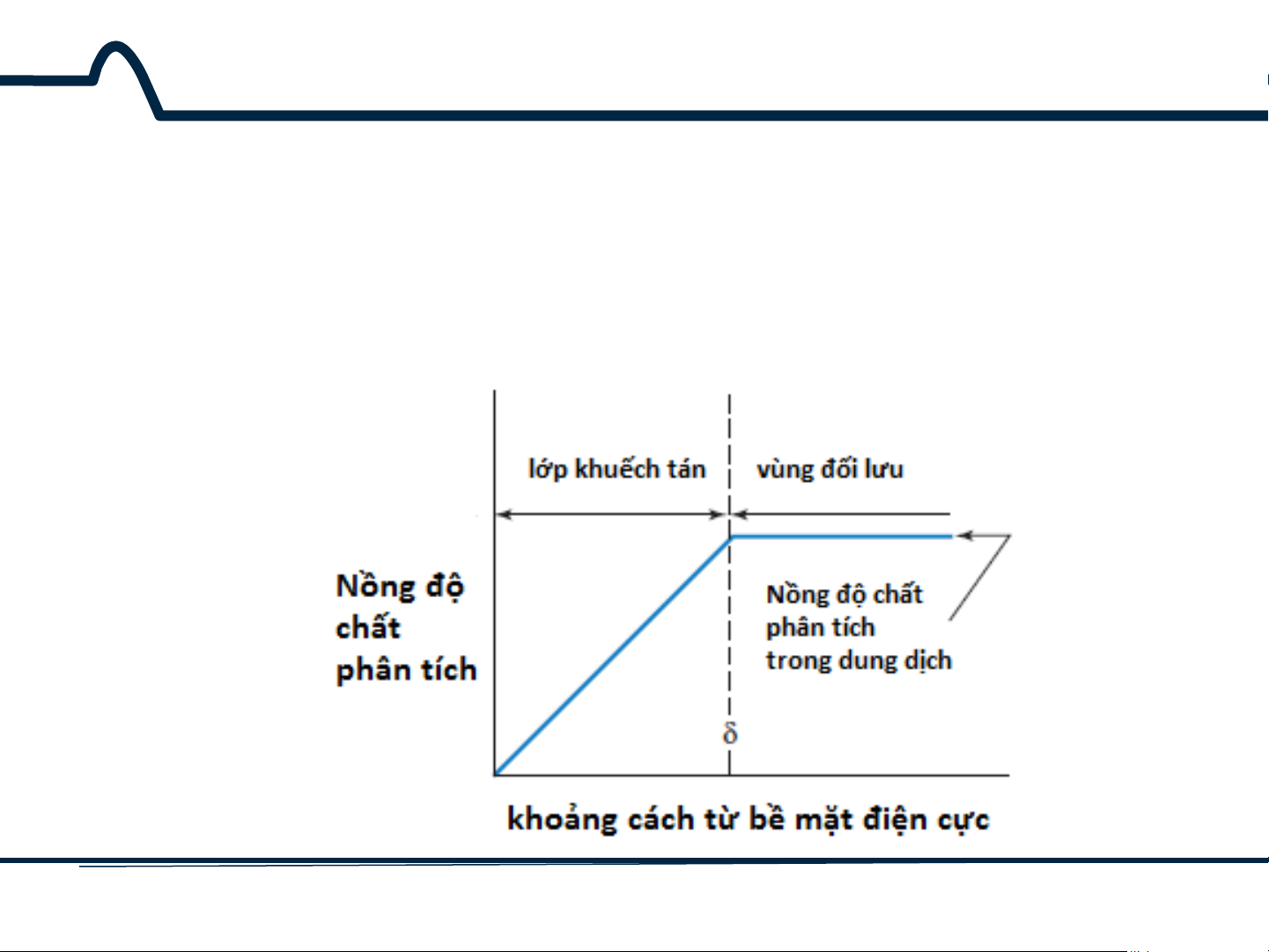
7.2. Điện cực đĩa quay
Bài tập: Đối với điện cực đĩa quay hoạt động khi áp thế đủ
lớn, tốc độ phản ứng oxy hóa khử bị chi phối bởi tốc độ chất
phân tích khuếch tán qua lớp khuếch tán đến điện cực (hình
vẽ minh họa được đưa ra dưới đây) 14 HUST SCE
7.2. Điện cực đĩa quay Bài tập:
Chiều dày của lớp khuếch tán là:
Trong đó: D là hệ số khuếch tán của chất phản ứng, ν là độ nhớt động
học của chất lỏng (= độ nhớt/tỉ trọng = m2/s), và ω là tốc độ quay
(radians/s) của điện cực. Có 2π radian trong một vòng tròn. Mật độ dòng (A/m2) sẽ là:
với n là số electron trong nửa phản ứng, F là Hằng số Faraday, và C0 là
nồng độ của chất hoạt động điện cực bên trong dung dịch (mol/m3, không phải mol/L). 15 HUST SCE
7.2. Điện cực đĩa quay Bài tập: 4−
Xem xét quá trình oxy hóa Fe(CN)6 trong dung dịch
K3Fe(CN)6 10,0 mM và K4Fe(CN)6 50,0 mM ở 0,90 V (so với
S.C.E.) với tốc độ quay là số vòng quay 2,00 103 mỗi phút.
Hệ số khuếch tán của Fe(CN)4−
6 là 2,5×10–9 m2/s, và độ nhớt
động học là 1,1×10–6 m2/s. Tính chiều dày của lớp khuếch tán và mật độ dòng.
(Nếu tính toán cẩn thận, mật độ dòng điện sẽ giống như giá trị trong hình 7-3) 16 HUST SCE
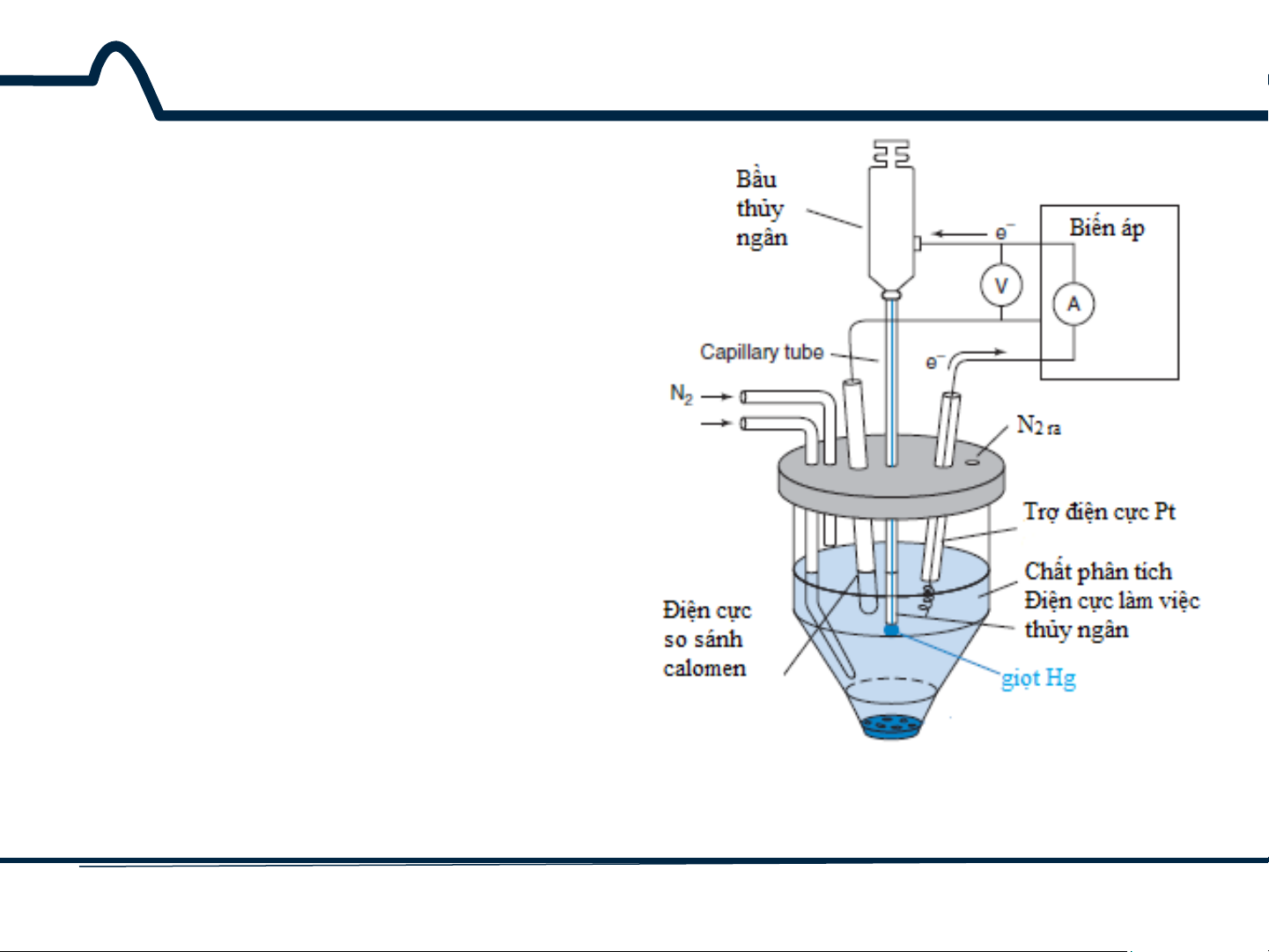
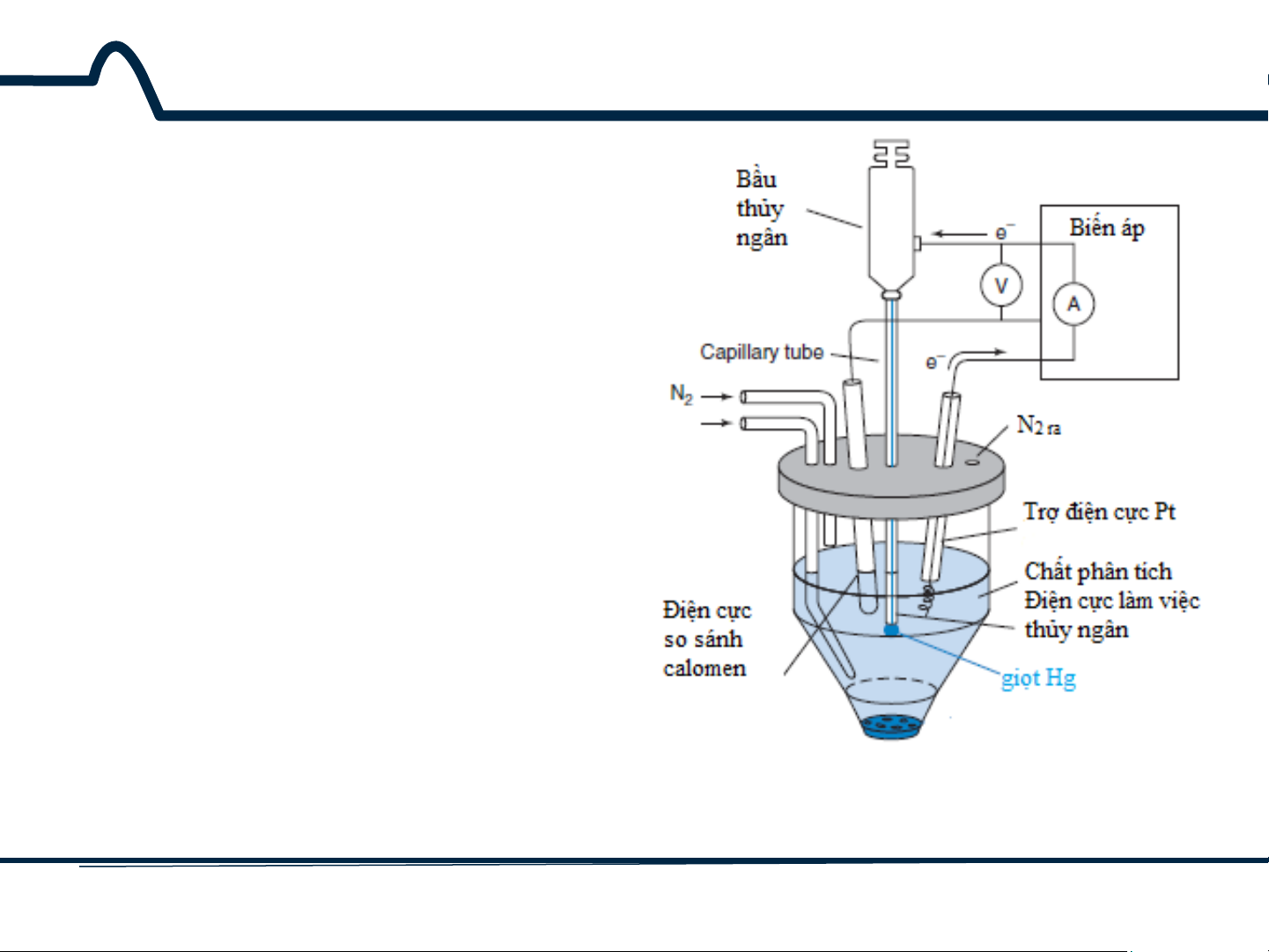
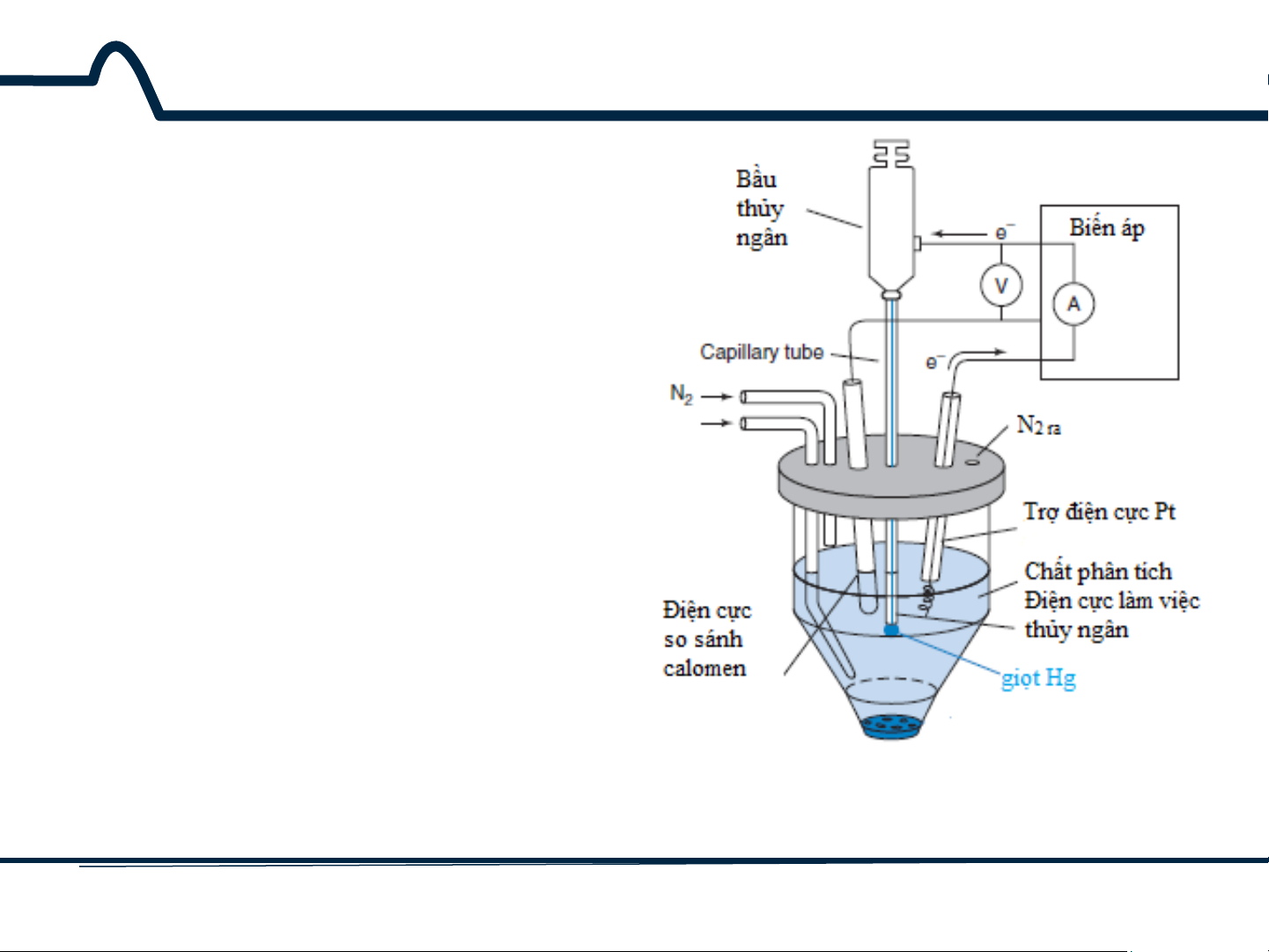
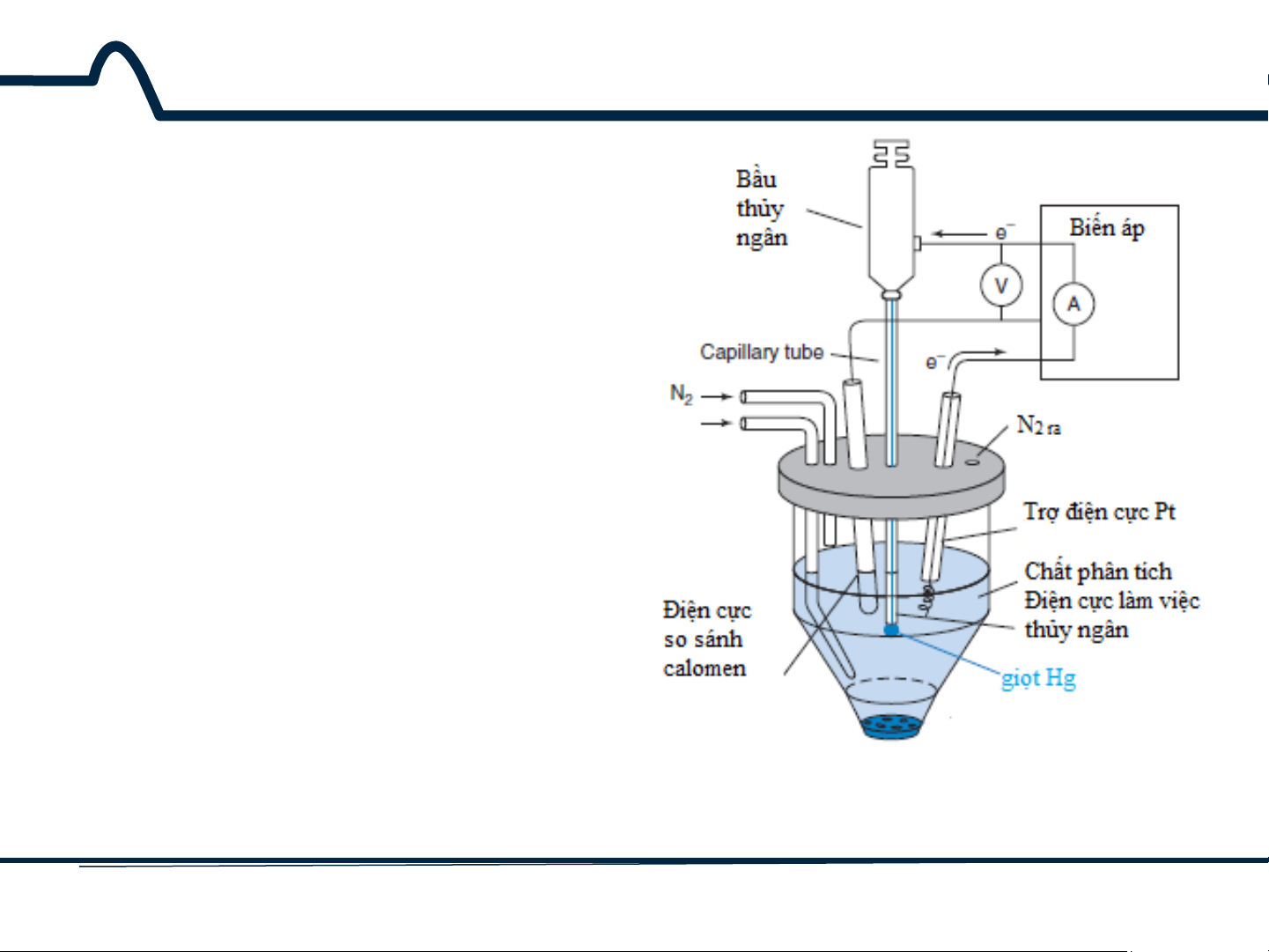
7.3. Phương pháp cực phổ Phương pháp von- ampe dựa trên quá trình điện phân với điện cực giọt thủy ngân được gọi là phương pháp cực phổ (hình 7-4).
Hình 7-4. Thiết bị vôn-ampe với điện cực làm việc Hg 17 HUST SCE
7.3. Phương pháp cực phổ
Phương pháp cực phổ đã
được thay thế phần lớn bằng điện cực rắn do
nguy cơ độc tính của thủy ngân. Các nguyên tắc
được mô tả đối với điện cực thủy ngân áp dụng cho các điện cực khác.
Hình 7-4. Thiết bị vôn-ampe với điện cực làm việc Hg 18 HUST SCE
7.3. Phương pháp cực phổ Tuy nhiên, với phương pháp von-apme ngược,
thủy ngân vẫn là loại điện cực được lựa chọn.
Hình 7-4. Thiết bị vôn-ampe với điện cực làm việc Hg 19 HUST SCE
7.3. Phương pháp cực phổ
Bộ phân phối treo một giọt
thủy ngân ở đáy ống mao dẫn.
Sau khi dòng điện và điện áp
được đo, giọt Hg sẽ được loại
bỏ bằng rơi cơ học. Sau đó
một giọt Hg được tạo ra và
phép đo tiếp theo được thực
hiện. Giọt Hg mới thể hiện độ
lặp cao về tính chất dòng-thế.
Dòng đối với các điện cực
khác, ví dụ như Pt, phụ thuộc
vào điều kiện bề mặt.
Hình 3-4. Thiết bị vôn-ampe với điện cực làm việc Hg 20 HUST SCE




