






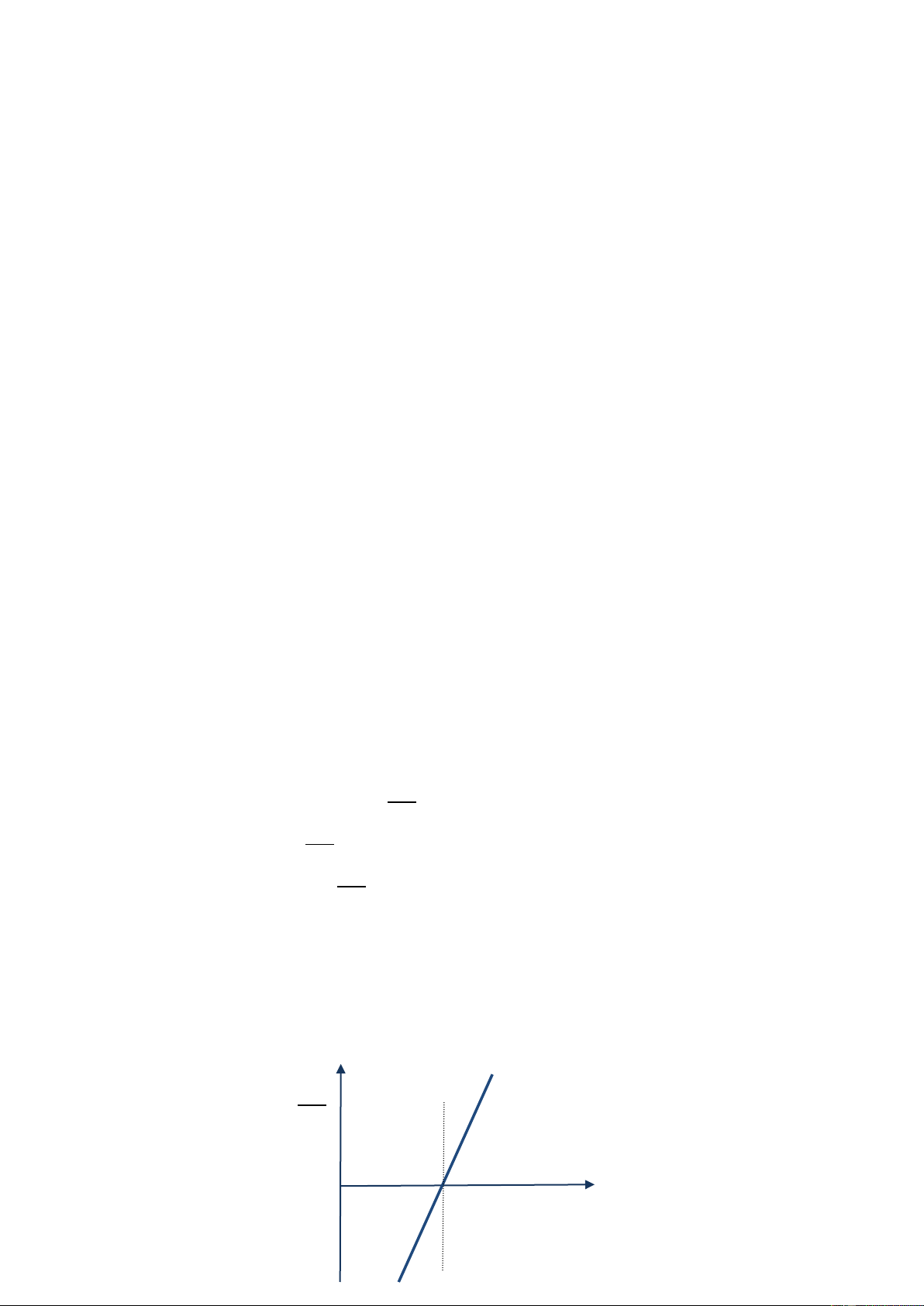

Preview text:
Nội dung
Chương 7. Phương pháp phân tích vôn-ampe............................................................................ 1
7.1. Cơ sở của phương pháp .................................................................................................. 1
7.1.1. Đặc điểm chung ....................................................................................................... 1
7.1.2. Quá trình xảy ra trên điện cực thủy ngân ................................................................. 3
7.1.3. Điện thế nửa sóng và phương trình sóng cực phổ ................................................... 9
7.1.4. Các cực đại trên sóng cực phổ ............................................................................... 10
7.1.5. Phương trình Inkovich ........................................................................................... 10
7.2. Các phương pháp vôn-ampe trực tiếp ........................................................................... 11
7.2.1. Điện thế nửa sóng E1/2 và phân tích cực phổ định tính .......................................... 11
7.2.2. Phương pháp cực phổ dòng một chiều ................................................................... 12
7.2.3. Phương pháp đo vi phân ........................................................................................ 13
7.2.4. Cực phổ xung ......................................................................................................... 14
7.2.5. Phương pháp vôn-ampe ngược (vôn-ampe hòa tan- stripping analysis) .............. 16
7.3. Câu hỏi ôn tập ............................................................................................................... 18
Chương 7. Phương pháp phân tích vôn-ampe
7.1. Cơ sở của phương pháp
7.1.1. Đặc điểm chung
Phương pháp phân tích vôn-ampe là nhóm các phương pháp dựa vào đường cong vôn-ampe,
hay còn gọi là đường cong phân cực, là đường cong biểu diễn mối quan hệ giữa cường độ
dòng điện với điện thế khi tiến hành điện phân dung dịch phân tích. Quá trình điện phân được
thực hiện trong một bình điện phân đặc biệt, trong đó có một điện cực có diện tích bé hơn
điện tích của điện cực kia nhiều lần. Điện cực có diện tích bé được gọi là vi điện cực. Quá
trình khử (hay oxy hóa) chủ yếu xảy ra trên vi điện cực.
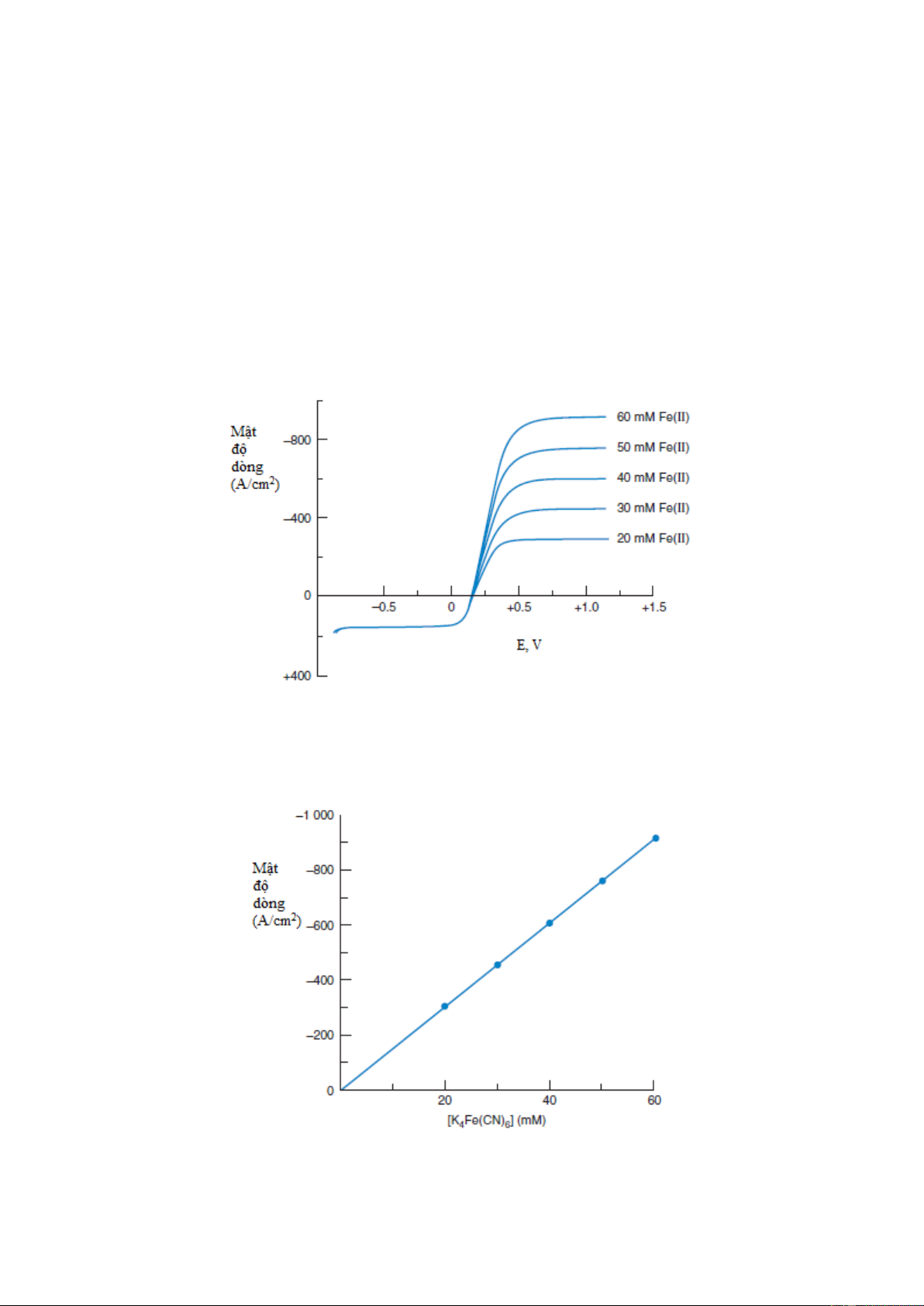
Ví dụ, đường cong vôn-ampe trên hình 7-1 là đường cong mô tả mối quan hệ dòng và thế của
điện cực làm việc trong quá trình oxy hóa hay khử của hỗn hợp Fe(CN) 3– 4– 6 /Fe(CN)6 xảy ra
trên điện cực đĩa quay. Theo qui ước, dòng là dương khi chất phân tích bị khử trên điện cực 1
làm việc. Giới hạn của dòng khuếch tán cho quá trình oxy hóa Fe(CN) 4– 6 xảy ra ở điện thế
lớn hơn 0,5V (điện cực so sánh là calomen bão hòa). – Fe(CN) 4– 3– 6 → Fe(CN)6 + e Ferroxyanide Ferricyanide (xyanua sắt II) (xyanua sắt III)
Ở vùng này, dòng được điều khiển bởi tốc độ khuếch tán của Fe(CN) 4– 6 tới điện cực. Hình 7-
2 chỉ ra dòng này tỉ lệ với nồng độ [Fe(CN) 4– 6 ] trong dung dịch.
Hình 7-1. Đường cong vôn-ampe cho hỗn hợp 10 mM K3Fe(CN)6 và 20-60mM K4Fe(CN)6 trong dung dịch
Na2SO4 0,1M trên điện cực đĩa quay cacbon thủy tinh. Tốc độ quay 2000 vòng/phút, điện thế quét 5mV/s.
Hình 7-2. Sự phụ thuộc dòng giới hạn vào nồng độ K4Fe(CN)6 2
Việc ứng dụng đường cong điện phân cực vào mục đích phân tích đã được nhà bác học người
Tiệp Khắc Heyrovski tìm ra vào năm 1922. Do phát minh về phương pháp phân tích dựa vào
đường cong điện phân cực và những đóng góp xây dựng phát triển phương pháp phân tích,
năm 1959 Heyrovski được tặng giải thưởng Nobel về hóa học. Dùng phương pháp vôn-ampe
người ta có thể xác định được nhiều ion vô cơ, hợp chất hữu cơ. Quá trình phân tích có thể
được thực hiện trong môi trường nước và cả môi trường không nước. Phép phân tích có thể
được thực hiện với độ nhạy, độ chọn lọc và độ chính xác rất cao.
7.1.2. Quá trình xảy ra trên điện cực thủy ngân
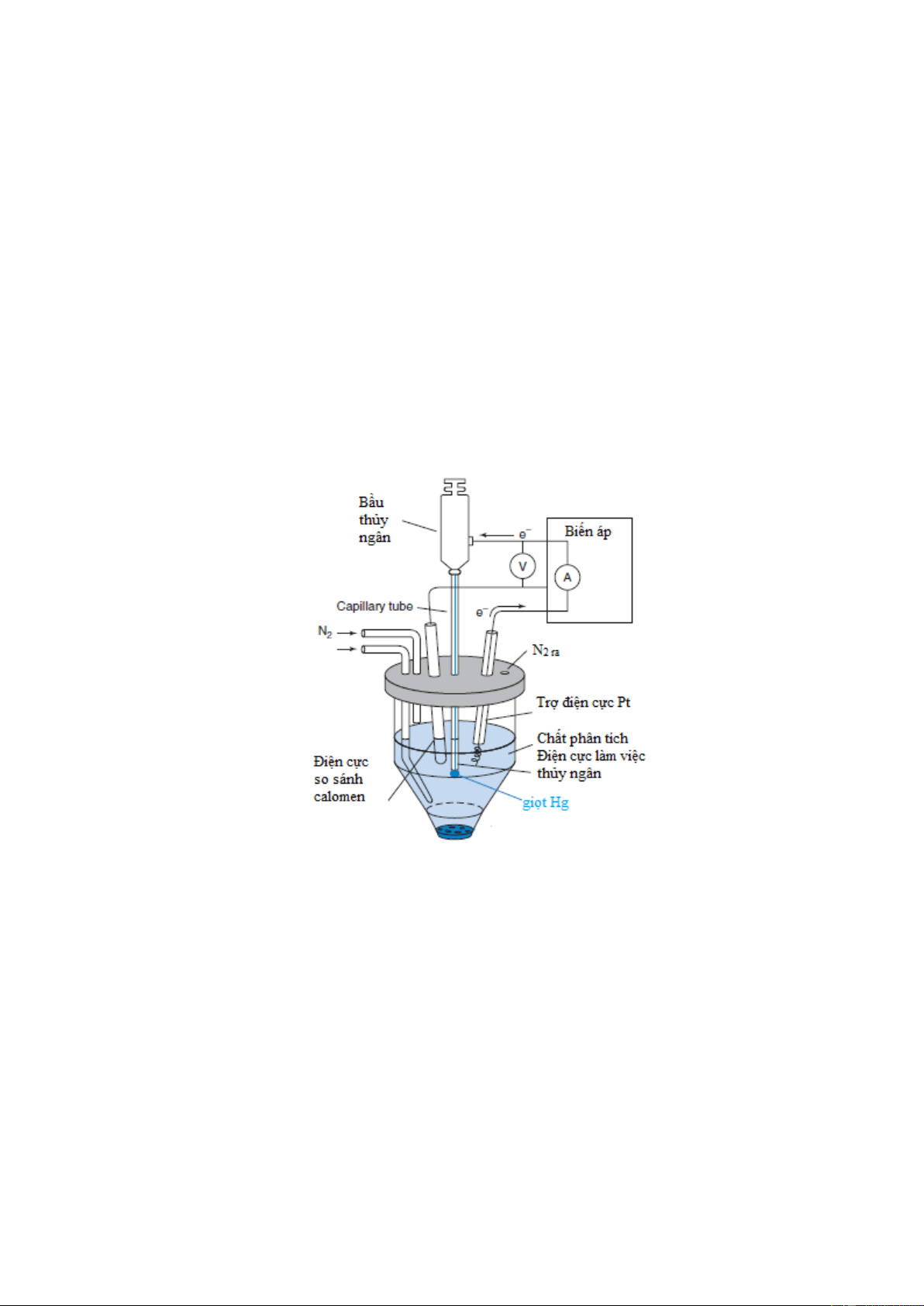
Phương pháp vôn-ampe dựa trên quá trình điện phân với điện cực giọt thủy ngân được gọi là
phương pháp cực phổ (hình 7-3).
Hình 7-3. Thiết bị vôn-ampe với điện cực làm việc Hg
Một số lượng lớn các phản ứng được nghiên cứu với điện cực thủy ngân là các phản ứng
khử. Ở bề mặt điện cực Pt, sự khử H+ xảy ra với nhiều chất phân tích.
2H+ + 2e– → H2(khí) E° = 0,000V
Bảng 7-1 chỉ ra rằng quá thế cho sự thoát H2 trên bề mặt điện cực Hg là rất lớn. Trong
môi trường trung tính hay kiềm, thậm chí các cation kim loại kiềm (nhóm I) bị khử dễ
dàng hơn H+. Hơn nữa, sự khử của một ion kim loại trên điện cực Hg ở dạng hỗn hống là
dễ dàng hơn sự khử trên bề mặt điện cực rắn. 3 K+ + e– → K(rắn) E° = –2,936 V
K+ + e– + Hg → K(hỗn hống Hg) E° = –1,975 V
Điện cực thủy ngân không thuận lợi cho việc nghiên cứu phản ứng oxy hóa bởi vì Hg dễ
bị oxy hóa trong môi trường không tạo phức ở thế gần 0,25V (được so sánh với điện cực
calomen bão hòa). Nếu nồng độ Cl– là 1M, Hg bị oxy hóa gần giá trị 0V bởi vì Hg(II) được
ổn định bởi Cl– do tạo phức: Hg lỏng + 4Cl– ⇋ + 2e–
Để nghiên cứu các phản ứng oxy hóa bằng phương pháp vôn-ampe, các điện cực làm
việc như Pt, Au, C hay kim cương trong dung dịch nền thích hợp được sử dụng.
Bảng 7-1. Quá thế (V) của quá trình thoát khí ở các mật độ dòng khác nhau ở 25°C Điện 10 A/m2 100 A/m2 1000 A/m2 10 000 A/m2 cực H2 O2 H2 O2 H2 O2 H2 O2 Pt 0,0154 0,0398 0,0300 0,521 0,0405 0,638 0,0483 0,766 Pt trơn 0,024 0,721 0,068 0,85 0,288 1,28 0,676 1,49 Cu 0,479 0,422 0,584 0,580 0,801 0,660 1,254 0,793 Ag 0,4751 0,580 0,7618 0,729 0,8749 0,984 1,0890 1,131 Au 0,241 0,673 0,390 0,963 0,588 1,244 0,798 1,63 Graphit 0,5995 0,7788 0,9774 1,2200 Pb 0,52 1,090 1,179 1,262 Zn 0,716 0,746 1,064 1,229 Hg 0,9 1,0 1,1 1,1
Sự hình thành sóng cực phổ của một ion kim loại:
Ta nghiên cứu quá trình điện phân trên catot là điện cực thủy ngân, còn anot là điện cực có
diện tích lớn ví dụ điện cực calomen. Vì điện cực calomen có diện tích bề mặt lớn hơn diện
tích điện cực giọt Hg rất nhiều nên quá trình điện cực chủ yếu xảy ra trên điện cực giọt Hg.
Vì điện cực Hg là catot nên người ta gọi đây là phân cực catot. Nếu trong dung dịch không có
các chất có khả năng bị khử dưới tác dụng của dòng điện, cường độ dòng điện I sẽ tỉ lệ với
điện thế đặt vào hai cực (định luật Ohm). I = (7-1) 4
I là cường độ dòng điện chạy qua bình điện phân;
E là điện thế giáng vào hai cực;
R là điện trở của bình điện phân;
Từ (7-1) cho thấy cường độ I phụ thuộc tuyến tính với điện thế đặt vào hai cực bình điện phân.
Khi có các chất tham gia phản ứng khử trên catot Hg trong miền điện thế nghiên cứu, dạng
đường cong I-E sẽ thay đổi. Khi điện thế giáng vào hai cực của bình điện phân đạt đến giá trị
điện thế khử của ion nghiên cứu, trên điện cực giọt thủy ngân có thể tạo thành hỗn hống: – Mn+ + ne + Hg ⇋ M(Hg) (7-2)
Điện thế của điện cực giọt Hg khi xảy ra quá trình thuận nghịch 7-2 tính theo phương trình Nernst: E = E° + ln (7-3)
Ca (Camalgam) là nồng độ của hỗn hống (M);
là hệ số hoạt độ của hỗn hống;
CM là nồng độ của ion kim loại bị khử tại lớp dung dịch ở sát bề mặt của điện cực, M;
là hệ số hoạt độ của ion kim loại M trong dung dịch;
aHg là hoạt độ của thủy ngân trong hỗn hống
E° là thế điện cực tiêu chuẩn của điện cực, V
Do kết quả của phản ứng (7-2), khi cường độ dòng điện bắt đầu tăng thì nồng độ ion kim loại
ở lớp dung dịch sát bề mặt điện cực giảm. Tuy nhiên, do hiện tượng khuếch tán, các ion kim
loại ở sâu bên trong dung dịch sẽ tiến đến lớp dung dịch ở sát bề mặt điện cực. Vì vậy cường
độ dòng điện sẽ phụ thuộc tốc độ khuếch tán, mà tốc độ khuếch tán ion lại phụ thuộc hiệu số nồng độ
ở sâu bên trong dung dịch và nồng độ CM ở sát bề mặt điện cực. I = K – M( CM) (7-4)
Trong thành phần dòng điện chạy qua bình điện phân, ngoài dòng điện sinh ra do sự khuếch
tán ion kim loại đến sát bề mặt điện cực và gây ra phản ứng điện cực, người ta gọi đó là dòng
khuếch tán, còn có thành phần dòng điện sinh ra do sự dịch chuyển các ion đến các điện cực
do tác dụng của điện trường dù các ion này không tham gia phản ứng điện cực. Người ta gọi 5
dòng điện sinh ra đơn thuần do sự dịch chuyển các ion không tham gia quá trình điện cực là
dòng dịch chuyển. Dòng dịch chuyển cản trở việc đo thành phần dòng khuếch tán (đặc trưng
cho ion nghiên cứu) nên người ta phải loại bỏ dòng khuếch tán khi phân tích theo phương
pháp vôn-ampe. Để giảm và đi đến loại bỏ dòng dịch chuyển, người ta có thể đưa thêm vào
dung dịch phân tích một chất điện ly trơ (không tham gia phản ứng điện cực) có nồng độ lớn
hơn nồng độ ion nghiên cứu nhiều lần. Người ta gọi đây là chất điện ly nền. Cation của chất
điện ly nền sẽ chắn tác dụng của điện trường và làm dòng dịch chuyển thực tế bằng không.
Điện thế bắt đầu xảy ra quá trình điện phân trước hết phụ thuộc vào bản chất ion bị khử cũng
như thành phân dung dịch chất nghiên cứu như: nồng độ các ion có mặt trong dung dịch,
nồng độ ion H+, sự có mặt của các chất tạo phức...
Điện thế phân hủy của chất điện ly thực tế bằng hiệu đại số của điện thế anot và catot: E = Ea – Ek (7-5)
Khi dùng điện cực calomen làm anot thì thế anot Ea thực tế không thay đổi khi có dòng điện
nhỏ chạy qua bình điện phân. Thực vậy, quá trình anot trên calomen chính là sự oxy hóa thủy
ngân kim loại thành ion Hg+ và chuyển Hg+ vào dung dịch: – 2Hg ⇋ 2Hg+ + 2e (7-6) Nhưng dung dị –
ch của điện cực calomen lại có ion Cl với nồng độ không thay đổi (thường là
dung dịch KCl bão hòa hoặc dung dịch KCl 3M) nên lập tức sẽ xuất hiện kết tủa calomen. – 2Hg+ + 2Cl ⇋ Hg2Cl2↓ (7-7) –
Nồng độ ion Cl luôn luôn không thay đổi và do đó nồng độ Hg+ không đổi và thế điện cực
Ea trong suốt quá trình điện phân không đổi, Ea = const. Nếu trong trường hợp này ta chấp
nhận Ea = 0 V vì diện tích bề mặt của anot quá lớn so với diện tích của catot nên phân cực
catot không đáng kể) thì thế bắt đầu điện phân là: E = –Ek hay Ek = –E
Điện thế này gọi là điện thế thoát kim loại (hay thế khử) của ion kim loại trong điều kiện
đang xét. Điện thế thoát kim loại phụ thuộc vào nồng độ ion kim loại bị khử. Nồng độ ion
kim loại càng bé càng khó bị khử, thì điện áp đặt vào bình điện phân có thể bắt đầu quá trình
điện phân phải càng lớn. 6
Khi tăng điện thế đặt vào catot (điện thế đặt vào bình điện phân) thì nồng độ CM ở phương
trình 7-4 sẽ giảm dần, dù rằng trong quá trình điện phân luôn có các kim loại mới ở lớp sâu
bên trong dung dịch bổ sung đến sát bề mặt điện cực do hiện tượng khuếch tán. Nhưng sẽ đến
lúc ứng với điện thế E nào đó, vận tốc khử kim loại sẽ bằng vận tốc khuếch tán và nồng độ
CM ở lớp dung dịch sát bề mặt điện cực bằng không, CM = 0. Quá trình điện phân ở đây
thường xảy ra với cường độ dòng bé (thường bé hơn 10–5A) nên nồng độ dung dịch ở sâu bên
trong của khối dung dịch thực tế không đổi và bằng
. Cường độ dòng chạy qua bình điện
phân lúc bấy giờ đạt giá trị không đổi Id dù cho có tiếp tục tăng điện thế đặt vào bình điện
phân. Ứng dụng phương trình 7-4 với CM = 0 ta có: I d = KM× (7-8)
Dòng Id theo (7-8) được gọi là dòng giới hạn. Thay Id vào 7-4 ta có: I = Id – KM CM và C M = (7-9)
Tương tự, nồng độ kim loại hỗn hống được tạo thành theo quá trình (7-2) cũng tỉ lệ với cường độ dòng: ’ Ca = Ka ×I = (7-10)
Thay 7-9, 7-10 vào 7-3 ta có: E = E° + ln (7-11)
Trong quá trình điện phân xảy ra trong bình phân tích cực phổ, ngoài thành phần Id (dòng
khuếch tán) liên quan đến quá trình khử ion kim loại, còn có các thành phần khác không liên
quan đến quá trình điện cực gọi là dòng không Faraday.
Việc tạo thành dòng không Faraday có thể do mấy nguyên nhân:
Khi nhúng điện cực vào dung dịch, trên bề mặt sẽ xuất hiện lớp điện kép. Lớp điện kép có thể
xem như một tụ điện, khi tụ này phóng điện sẽ tiêu thụ một lượng điện nào đó. Khi tăng điện
thế đặt vào hai điện cực, điện dung của tụ này sẽ tăng lên. Dòng phóng điện của tụ lại tạo nên 7
một thành phần của dòng không Faraday gọi là dòng tụ điện. Ngoài dòng tụ điện, dòng dịch
chuyển như đã nêu ở trên cũng là thành phần dòng không Faraday.
Trong thực tế phân tích, dòng dịch chuyển có thể được loại bỏ nhờ tác dụng của nền cực phổ
là dung dịch các chất điện ly mạnh, trơ có nồng độ lớn.
Tất cả các vấn đề vừa mô tả trên đây giải thích dạng đặc biệt của đường cong I-E.
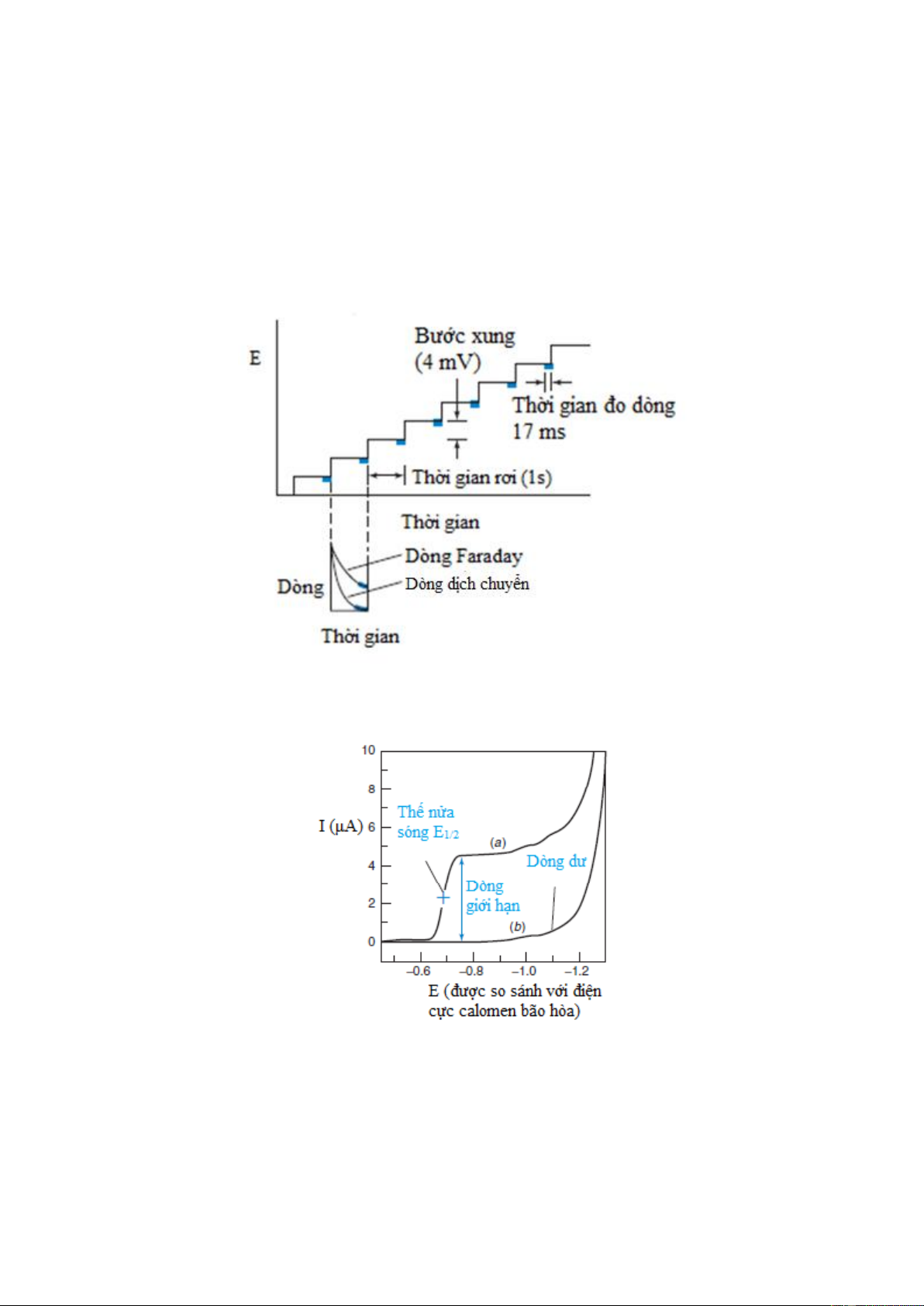
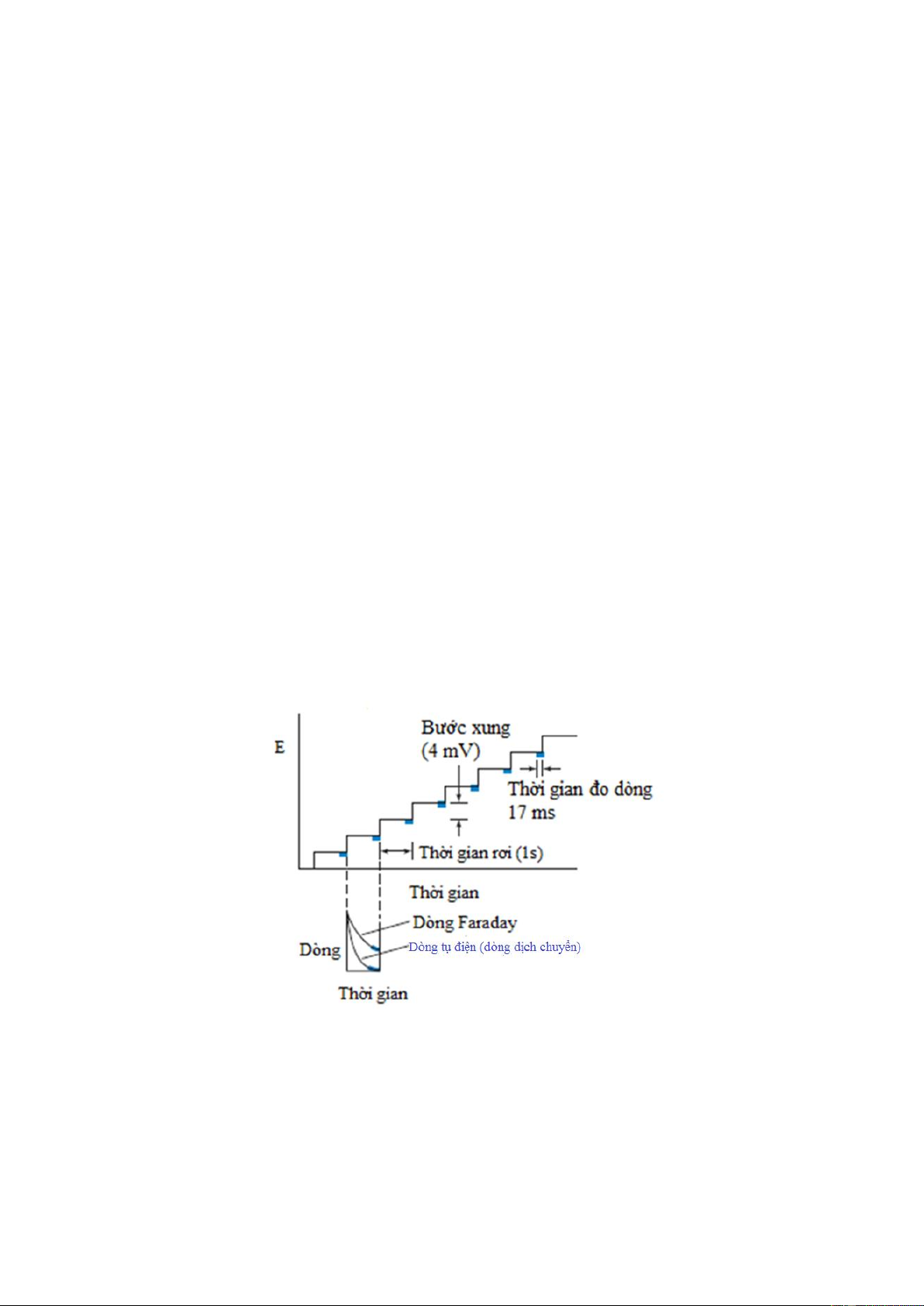
Hình 7-4. Quét thế dạng bậc thang. Dòng được đo ở miền được tô đậm màu xanh.
Hình 7-5. Cực phổ đồ (a) Cd2+ 5mM trong HCl 1M, (b) HCl 1M
Để thực hiện được việc đo dòng bằng phương pháp cực phổ với việc thay đổi thế dạng
bậc thang (stair voltage ramp) trên hình 7-4. Sau khi giọt Hg hình thành từ mao quản,
thế được tạo ra âm hơn 4 mV. Sau khi đợi khoảng 1s, dòng được đo trong khoảng 17 ms 8
cuối trước khi giọt Hg rơi. Dạng sóng cực phổ được mô tả trên hình 7-5 là kết quả của
quá trình khử Cd2+ tạo thành hỗn hống:
Cd2+ + 2e– → Cd(hỗn hống)
Trên hình 7-5, phần đầu của đường cong, cường độ dòng ứng với phần này tuy không
bằng không nhưng cũng rất bé. Đó là do tác dụng của dòng không Faraday. Người ta gọi
đó là dòng dư. Thông thường dòng dư cỡ vào khoảng 10–7A. Dòng dư được gây ra do
dung dịch phân tích không đủ sạch tạo nên quá trình khử các tạp chất. Tuy nhiên trong
thực tế phân tích người ta phải tìm mọi cách giảm bớt ảnh hưởng của tạp chất bằng quá
trình làm sạch thích hợp, bằng các biện pháp che với các chất tạo phức. Phân tiếp theo
của đường cong nâng lên đột ngột ứng với quá trình xảy ra trên điện cực (khử ion kim
loại trên catot) và cường độ dòng sẽ tăng nhanh. Phần cuối của đường cong gần như
nằm ngang ứng với lục đạt dòng giới hạn Id. Đường cong I-E có dạng sóng nên người ta
gọi đó là sóng cực phổ.
7.1.3. Điện thế nửa sóng và phương trình sóng cực phổ Từ phương trình 7-11: E = E° + ln
Ta thấy có một số đại lượng không phụ thuộc các điều kiện thí nghiệm trừ nhiệt độ. Bởi
vì hỗn hống tạo thành khi điện phân trên điện cực giọt Hg có nồng độ bé nên hoạt độ của
thủy ngân trong hỗn hống aHg thực tế bằng hoạt độ của Hg tinh khiết và là một giá trị
không đổi. Khi phân tích sử dụng dung dịch nền có nồng độ lớn để pha loãng nên hệ số
hoạt độ được coi là không thay đổi. Các hệ số hoạt độ , hệ số KM, Ka cũng không
thay đổi với lý do tương tự. Vậy (7-11) có thể viết dưới dạng: E = E° + ln + ln (7-12) Hay E = E 1/2 + ln (7-13) Với E1/2 = E° + ln (7-14) 9
Đại lượng E1/2 được gọi là thế nửa sóng vì đó chính là điện thế ứng với cường độ dòng
đo được bằng một nửa dòng giới hạn vì khi I=Id/2 thì theo phương trình (7-13) sẽ cho ta
E = E1/2. Thế này đặc trưng cho chất phân tích ở một dung dịch nền xác định và là cơ sở
cho phân tích định tính. Với các phản ứng điện cực mà chất phản ứng và sản phẩm phản
ứng đều ở dạng dụng dịch, chẳng hạn như Fe3+ + 1e– ⇋ Fe2+ thì E1/2 gần như bằng thế khử tiêu chuẩn E°.
7.1.4. Các cực đại trên sóng cực phổ
Đôi khi dạng đường cong cực phổ bị biến dạng khác với dạng lý tưởng ở hình 7-1, 7-5. Đó là
việc xuất hiện các cực đại. Người ta phân biệt hai loại cực đại: cực đại loại một và cực đại
loại hai. Việc xuất hiện các cực đại liên quan đến các hiện tượng động lực học khi tạo giọt
thủy ngân, do hiện tượng hấp phụ của các ion trên bề mặt điện cực. Để giảm các cực đại trên
sóng cực phổ, người ta thường đưa vào dung dịch phân tích các chất hoạt dộng bề mặt như gielantin, aga-aga.
Oxy phải được loại bỏ khỏi dung dịch phân tích bởi vì nó gây ra hai sóng do sự khử tới H2O2
và tới H2O (hình (7-6). Thường thì N2 (hay Ar) được thổi vào dung dịch phân tích khoảng 10
phút để đuổi oxy. Sau đó N2 được thổi để giữ cho không có O2 trong dung dịch.
Hình 7-6. Cực phổ của dung dịch KCl 0,1M bão hòa không khí và sau khi thổi N2 để đuổi O2
7.1.5. Phương trình Inkovich
Phương pháp phân tích cực phổ định lượng đặt trên cơ sở mối quan hệ giữa dòng giới hạn với
nồng độ ion kim loại CM và các đại lượng khác qua phương trình Inkovich: Id = 607zD1/2m2/3t1/6CM (7-15) Trong đó
z là điện tích ion kim loại 10
D là hệ số khuếch tán, cm2/s
CM là nồng độ chất phân tích mM/lit
m là khối lượng thủy ngân chảy ra từ mao quản mg/s
t là thời gian tạo giọt Hg, s
Trong các đại lượng trong biểu thức (7-15), hệ số khuếch tán D khó xác định bằng thực
nghiệm và cũng ít khi tìm thấy trong các sổ tay.
Trong phân tích cực phổ, m và t đặc trưng cho mao quản, có thể xác định bằng thực nghiệm.
Trong thực tế, vì D, n, và t có thể được duy trì không thay đổi trong điều kiện thực nghiệm
nên phương trình (7-5) có thể viết dưới dạng: Id = KCM (7-16)
Từ phương trình (7-16) cho thấy cường độ dòng giới hạn Id phụ thuộc tuyến tính với nồng độ
chất nghiên cứu và (7-16) là cơ sở cho phân tích cực phổ định lượng.
7.2. Các phương pháp vôn-ampe trực tiếp
7.2.1. Điện thế nửa sóng E1/2 và phân tích cực phổ định tính
Điện thế nửa sóng E1/2 là đặc trưng định tính của chất nghiên cứu. Nếu để phân tích định tính
người ta cần xác định điện thế nửa sóng E . Ngườ 1/2
i ta có thể xác định điện thế nửa sóng bằng phương pháp đồ thị. Theo phương trình 7
-13, ta thấy log phụ thuộc tuyến tính với E. Do đó dựa vào số liệu
thực nghiệm thiết lập log phụ thuộc điện thế E, ta sẽ có đường thẳng cắt trục hoành tại điể m E = E , nghĩa là khi 1/2 log = 0 (hình 7-7)
Dựa vào thế nửa sóng tìm được, người ta có thể dựa vào sổ tay thế nửa sóng (hoặc theo cực
phổ đồ chuẩn), phán đoán nguyên tố hoặc hợp chất nghiên cứu. Thường thì người ta dùng kết
quả này để chọn nền cực phổ cho việc tiến hành phân tích định lượng, tránh được các nguyên
tố hợp chất cản trở. log 0 E 11 E1/2
Hình 7-7. Xác định điện thế nửa sóng bằng đồ thị
Trong các máy cực phổ hiện đại, có phần mềm dánh cho việc tính toán thế nửa sóng E1/2 theo
các số liệu thực nghiệm của cực phổ đồ ghi được, nhờ đó người phân tích tránh được các thao
tác tính toán như vừa trình bày ở trên.
7.2.2. Phương pháp cực phổ dòng một chiều
Phương pháp cực phổ dòng một chiều hay cực phổ cổ điển được ứng dụng khá rộng rãi trong
thực tế phân tích định lượng. Cơ sở của phương pháp này là phương trình 7-16.
Phương pháp đường chuẩn:
Xây dựng đường chuẩn mối quan hệ giữa I và C . Đườ ch
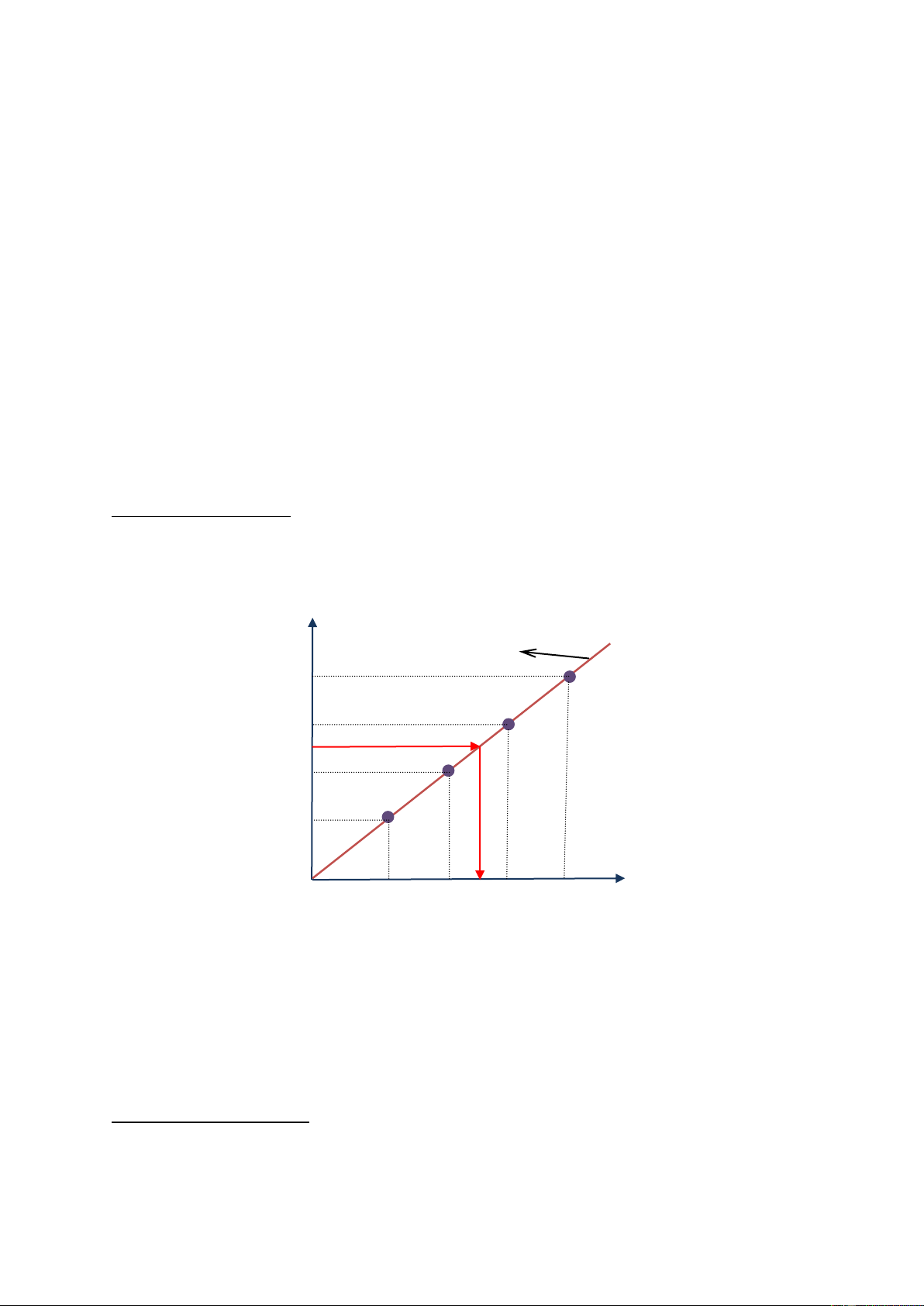
ng chuẩn là một hàm bậc nhất có dạng như hình 7-8. Id I = KC Id4 Id3 Idx Id2 Id1 0 C Cch1 Cch2 Cx Cch3 Cch4
Hình 7-8. Phương pháp đường chuẩn trong phân tích định lượng bằng phương pháp cực phổ
Với dung dịch nghiên cứu chưa biết nồng độ, chúng ta tiến hành ghi phổ của mẫu nghiên cứu
với điều kiện như khi tiến hành xây dựng đường chuẩn. Với giá trị Ix nhận được từ dung dịch
phân tích ta có thể tính được nồng độ chất nghiên cứu.
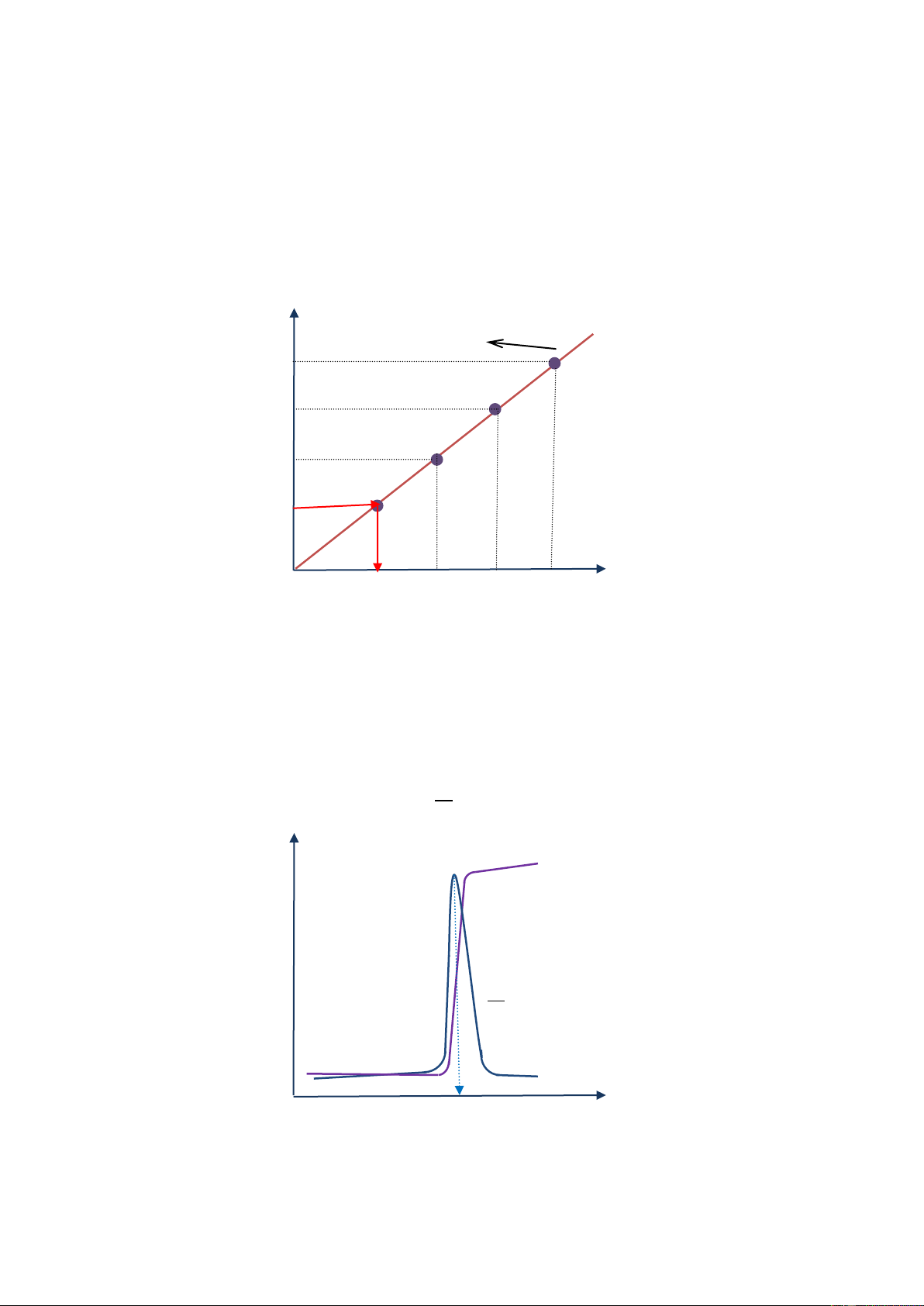
Phương pháp thêm tiêu chuẩn: 12
Đầu tiên ghi phổ của chất nghiên cứu ta được giá trị Ix. Thêm vào dung dịch nghiên cứu dung
dịch chuẩn có nồng độ Cch, ta ghi cực phổ cùng với điều kiện đã ghi với dung dịch phân tích,
được giá trị cường độ dòng giới hạn Ix+ch. Sau đó lại thêm một lượng dung dịch chuẩn vào dung dịch trên với C , đo được cường độ x+2ch
dòng giới hạn Ix+2ch... Xây dựng đồ thị thêm
chuẩn. Từ đó suy ra được Cx từ Ix. Id I = KC Idx+3ch Idx+2ch Idx+ch Idx 0 C Cx Cx+ch Cx+2ch Cx+3ch
Hình 7-9. Phương pháp thêm chuẩn trong phân tích định lượng bằng phương pháp cực phổ
7.2.3. Phương pháp đo vi phân
Đây là một cải tiến trong phương pháp đo trong cực phổ dòng một chiều nhằm tăng độ chọn
lọc của phương pháp phân tích cực phổ. Trong phương pháp này, thay cho việc đo theo đườ
ng cong I-E người ta dùng đường cong - E. I 0 E E1/2
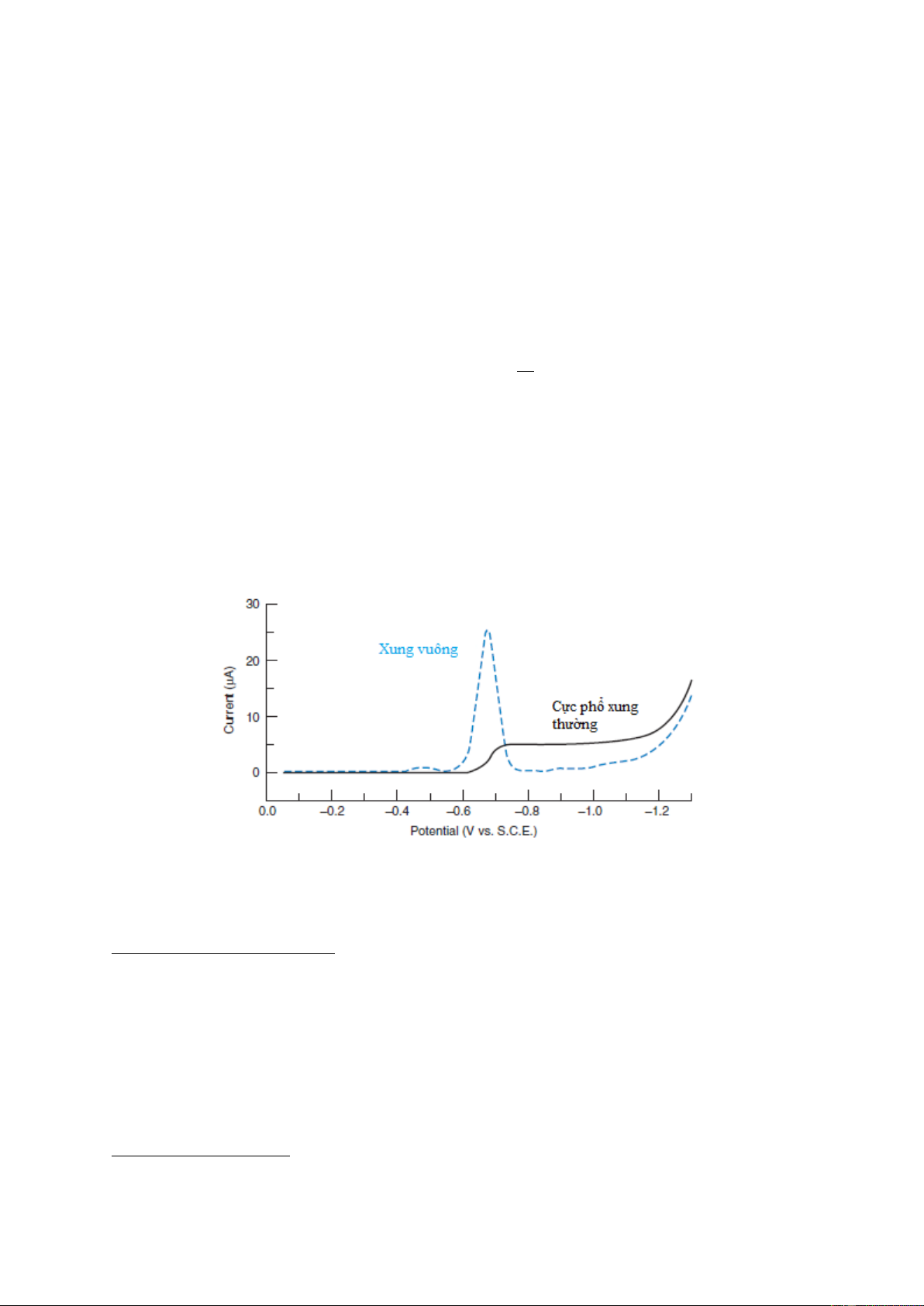
Hình 7-10. Cực phổ đồ của phương pháp cực phổ vi phân và cực phổ thường 13
Với phương pháp cực phổ vi phân, ta có thể xác định các hợp chất có thế nửa sóng khá gần
nhau trong cùng một dung dịch mà không cần tách chúng ra khỏi nhau. Điều này thực hiện
được vì phương pháp cực phổ vi phân có năng suất phân giải cao hơn hẳn phương pháp cực
phổ thường. Ví dụ, hai ion Pb2+ và Tl+ trong nền KNO3 2N có các thế nửa sóng khác nhau
0,06V. Trên cực phổ thường hai sóng cực phổ chập nhau trên cùng một cực phổ đồ. Tuy
nhiên, trên đường cong vi phân, ta thấy hai sóng cực phổ nhờ có hai cực trị phân biệt rõ rệt.
Phương pháp cực phổ vi phân cũng cho kết quả chính xác hơn cực phổ thường vì trong
phương pháp này ta có thể xác định chính xác các cực trị, cũng như đo chiều cao các cực đại
chính xác hơn đo giá trị Id trong cực phổ thường.
7.2.4. Cực phổ xung
Trong cực phổ dòng một chiều, chính thành phần dòng tụ đã che lấp dòng Faraday khi giá trị
dòng Faraday bé, vì thế chính dòng tụ điện đã hạn chế độ nhạy của phương pháp cực phổ
dòng một chiều. Việc tách dòng Faraday khỏi dòng điện chung chạy qua bình điện phân là
biện pháp tăng độ nhạy của phương pháp vôn-ampe. Cực phổ xung là biện pháp nhằm tách
dòng Faraday khỏi dòng tụ điện. Đặc điểm của phương pháp này là sẽ phân cực hóa điện
cực chỉ thị (cực giọt thủy ngân) bằng các xung điện trong thời gian thích hợp.
Hình 7-11. Cực phổ xung. Dòng được đo ở miền được tô đậm màu xanh khi dòng Faraday còn đủ lớn còn dòng
tụ điện thực tế bằng 0.
Thực nghiệm chứng minh dòng điện nạp và dòng phóng điện của tụ điện bất kỳ (kể cả điện
dung tạo ra do các lớp điện kép) tăng giảm dần theo hàm lũy thừa với thời gian, trong khí đó 14
sự tăng giảm của dòng Faraday khi giáng điện thế vào các điện cực đủ để gây phản ứng điện
cực lại theo hàm bậc hai theo thời gian. Nói cách khác dòng tụ tắt nhanh hơn dòng Faraday.
Điều đó cho phép tách dòng tụ điện do lớp điện kép tạo ra khỏi dòng Faraday nếu chọn thời
điểm ghi cường độ dòng thích hợp, lúc cường độ dòng Faraday còn đủ lớn còn dòng tụ điện
thực tế bằng 0. Dĩ nhiên, các quá trình này xảy ra với cường độ dòng rất bé, nhưng với các sơ
đồ điện tử hiện đại, cho phép khuếch đại các dòng điện bé đến giá trị cần thiết có thể điều
khiển được các máy ghi mà không gây méo tín hiệu, đặc biệt là khi đã có các máy tính với
tốc độ tính toán đủ lớn.
Cường độ dòng điện chạy qua bình điện phân tỉ lệ với bề mặt điện cực, mà điện tích bề mặt
điện cực thay đổi từng lúc trong quá trình lớn lên của giọt thủy ngân. Vì vậy phải giáng xung
điện chỉ một lần vào lúc xác định thời gian sống của giọt thủy ngân. Thuận lợi nhất là giáng
xung điện vào giọt thủy ngân ở cuối giai đoạn tăng trưởng của giọt Hg, lúc giọt Hg sắp rơi.
Tại chính thời điểm này diện tích bề mặt của giọt Hg thay đổi không đáng kể. Thời gian đo
cường độ dòng ở cuối xung điện.
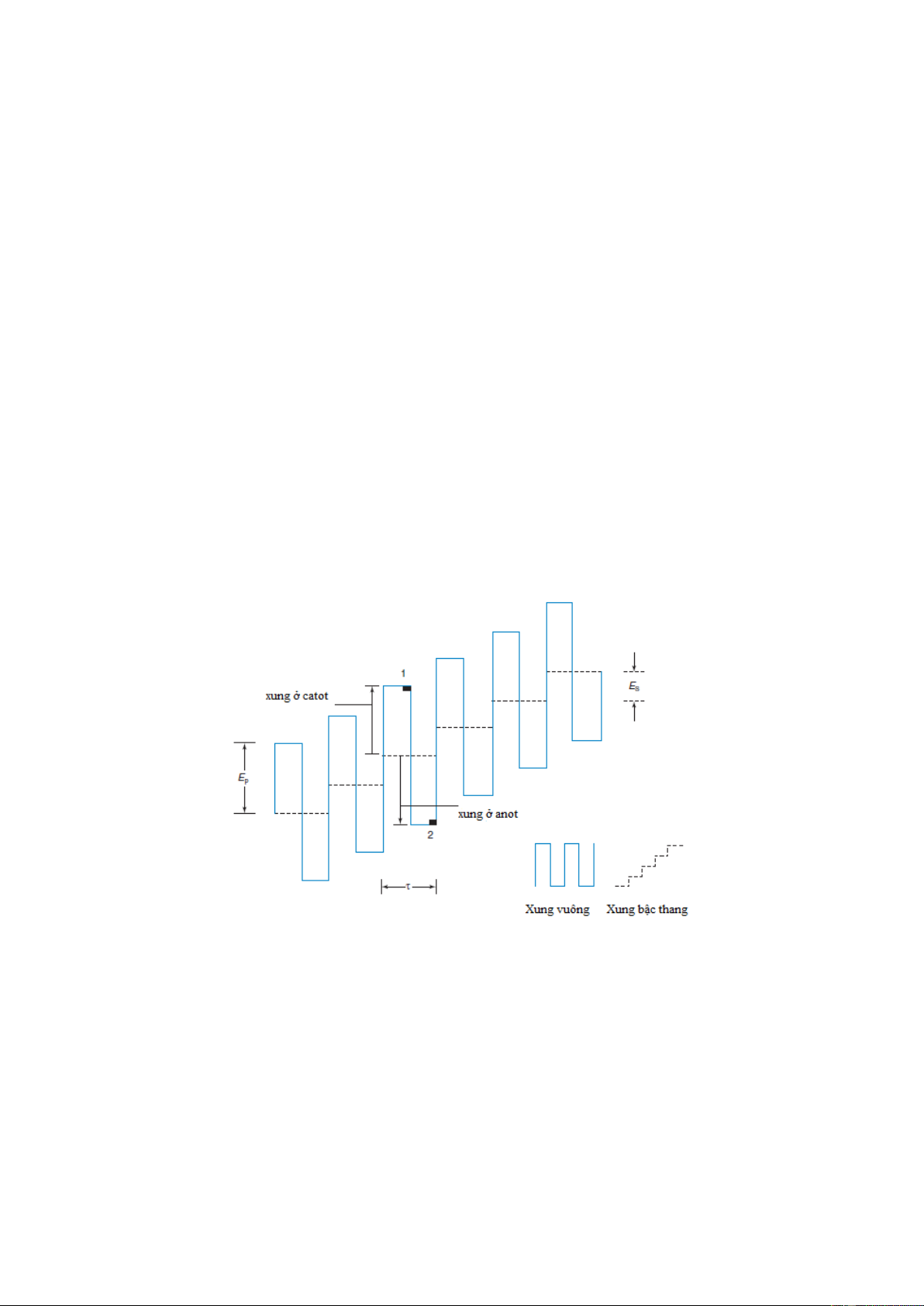
Hình 7-12. Dạng sóng cho cực phổ xung vuông. Các thông số đặc trưng là chiều cao xung Ep = 25mV, bước
chiều cao Es = 10 mV, thời gian xung là 5 ms. Dòng được đo giữa vùng 1 và vùng 2. Giá trị tối ưu là Ep = 50/n
(ms), Es = 10/n (mV) trong đó n là số e- trong nửa phản ứng.
Có hai phương pháp cực phổ xung: phương pháp thường và phương pháp xung vi phân.
Trong phương pháp đầu, ở cuối giai đoạn tồn tại của một giọt, người ta cực hóa giọt thủy
ngân bằng xung điện hình chữ nhật, kéo dài từ 40-60 ms. Vậy trong phương pháp này xung 15
điện giáng vào cực được dồn vào và cường độ dòng được đo ở giai đoạn cuối của mỗi xung.
Trường hợp này cực phổ đồ không khác cực phổ của cực phổ thường.
Trong trường hợp sau, điện cực bị phân cực như ở cực phổ thường bằng điện áp thay đổi
chậm. Nhưng ở cuối thời gian tồn tại của giọt Hg, người ta giáng một xung điện bổ sung có
biên độ không lớn lắm ~50 mV và thời gian ~100 ms. Việc đo hiệu số cường độ dòng điện
chạy qua bình điện phân trước và sau khi giáng xung điện, tức là đo gia số của cường độ
dòng với gia thế điện thế giáng xung điện có biên độ xác định. Vì vậy, đường cong sẽ có
dạng pic với cực đại ứng với E = E1/2 và đồ thị của
và E (theo nguyên tắc của phương pháp cực phổ vi phân).
Cường độ dòng ở đây ít phụ thuộc vào động học của quá trình điện cực, vì vậy phương pháp
có độ nhạy không chỉ với quá trình thuận nghịch mà còn cả với quá trình không thuận nghịch.
Đó là ưu điểm nổi bật của phương pháp cực phổ xung so với các phương pháp cực phổ khác.
Trong thực tế phân tích người ta hay dùng cực phổ xung vi phân.
Hình 7-12. So sánh giữa cực phổ xung thường và xung vi phân. Xung thường: thời gian của giọt Hg là 1s, chiều
cao xung là 4ms và thời gian đo là 17 ms. Xung vuông vi phân: thời gian của giọt Hg là 1s, chiều cao xung Ep =
25mV, bước xung là Es = 4 mV, thời gian xung là 67 ms và thời gian đo là 17 ms.
Ưu điểm của cực phổ xung vi phân:
- độ nhạy tín hiệu tăng
- có độ phân giải tốt, có thể tách nhiễu - phép đo nhanh
7.2.5. Phương pháp vôn-ampe ngược (vôn-ampe hòa tan- stripping analysis)
Đặc điểm của phương pháp:
- chất phân tích được làm giàu vào màng Hg bằng phản ứng khử 16
- chất phân tích bị oxy hóa trở lại bằng giáng thế dương hơn (quá trình hòa tan)
- đo tín hiệu trong quá trình oxy hóa
Ta biết rằng quá trình ion kim loại bị khử trên catot Hg theo phản ứng: Men+ + ne- ⇋ Me(Hg)
Kim loại được hòa tan vào catot Hg tạo thành hỗn hống. Sự khử được xảy ra ở trên điện cực
giọt Hg treo (không phải giọt Hg rơi) khi hiệu điện cực tương ứng với dòng giới hạn. Khi đó
nồng độ của kim loại trong hỗn hống nhanh chóng lớn hơn nồng độ ion kim loại trong dung
dịch ở chung quanh điện cực. Bấy giờ nếu cho phân cực tuyến tính anot trên cực giọt Hg treo
ở điện thế điện cực ứng với sự xuất hiện dòng oxy hóa hòa tan kim loại trong hỗn hống thủy ngân.
Nếu khi tiến hành điện phân, ta chọn điều kiện để lượng kim loại bị khử tỉ lệ với nồng độ ion
kim loại có trong dung dịch thì dòng (dạng pic) sẽ phụ thuộc vào nồng độ ion nghiên cứu ,
còn về trị số cường độ của pic sẽ lớn hơn dòng giới hạn khi khử ion loại.
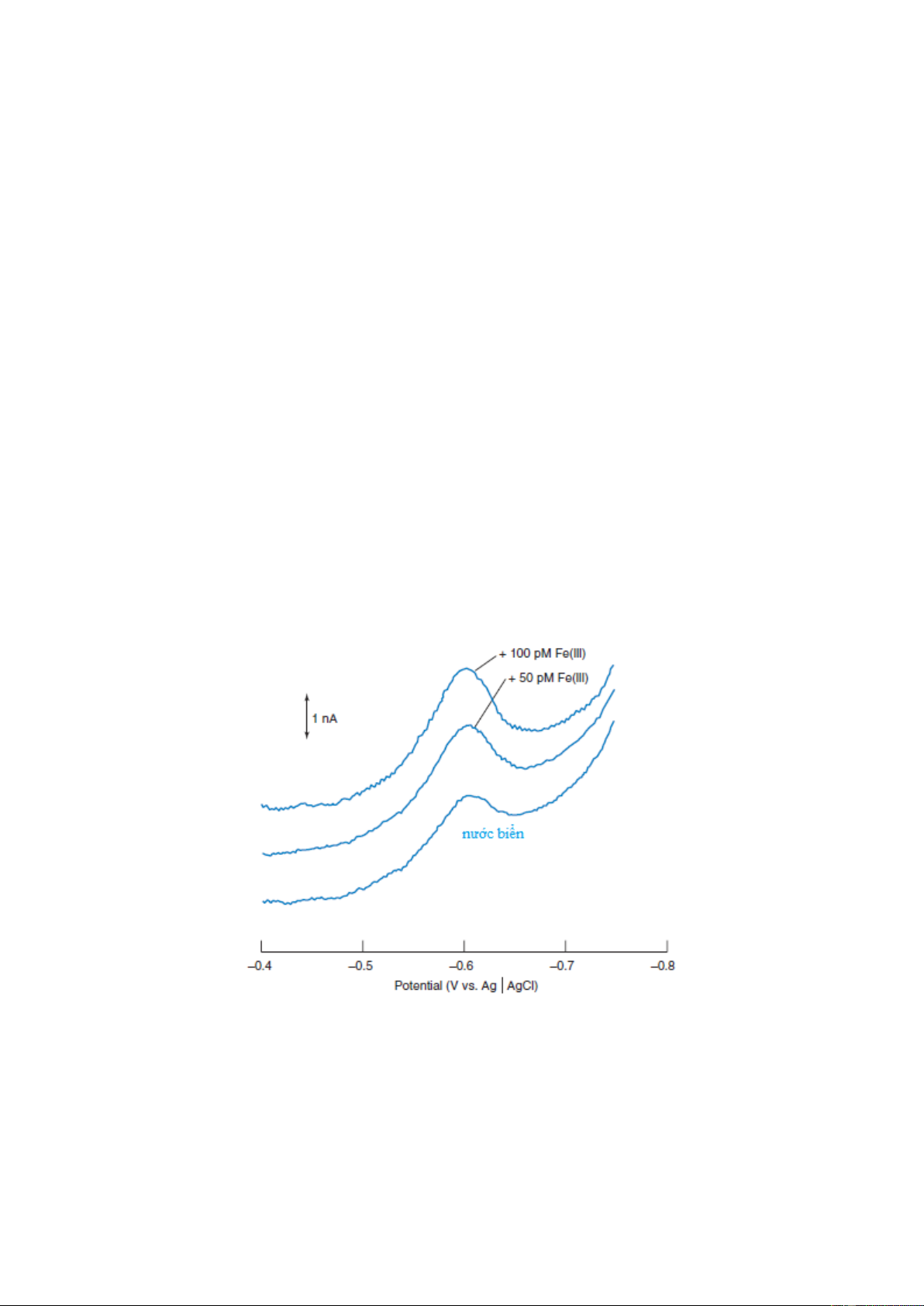
Hình 7-13. Phương pháp vôn-ampe hòa tan xác định Fe(III) trong mẫu nước biển với việc thêm tiêu chuẩn mỗi lần 50 pM Fe(III).
Sự tăng hữu ích của tín hiệu phân tích mở ra khả năng lớn trong việc xác định vi lượng và
siêu vi lượng các ion kim loại trong dung dịch. 17
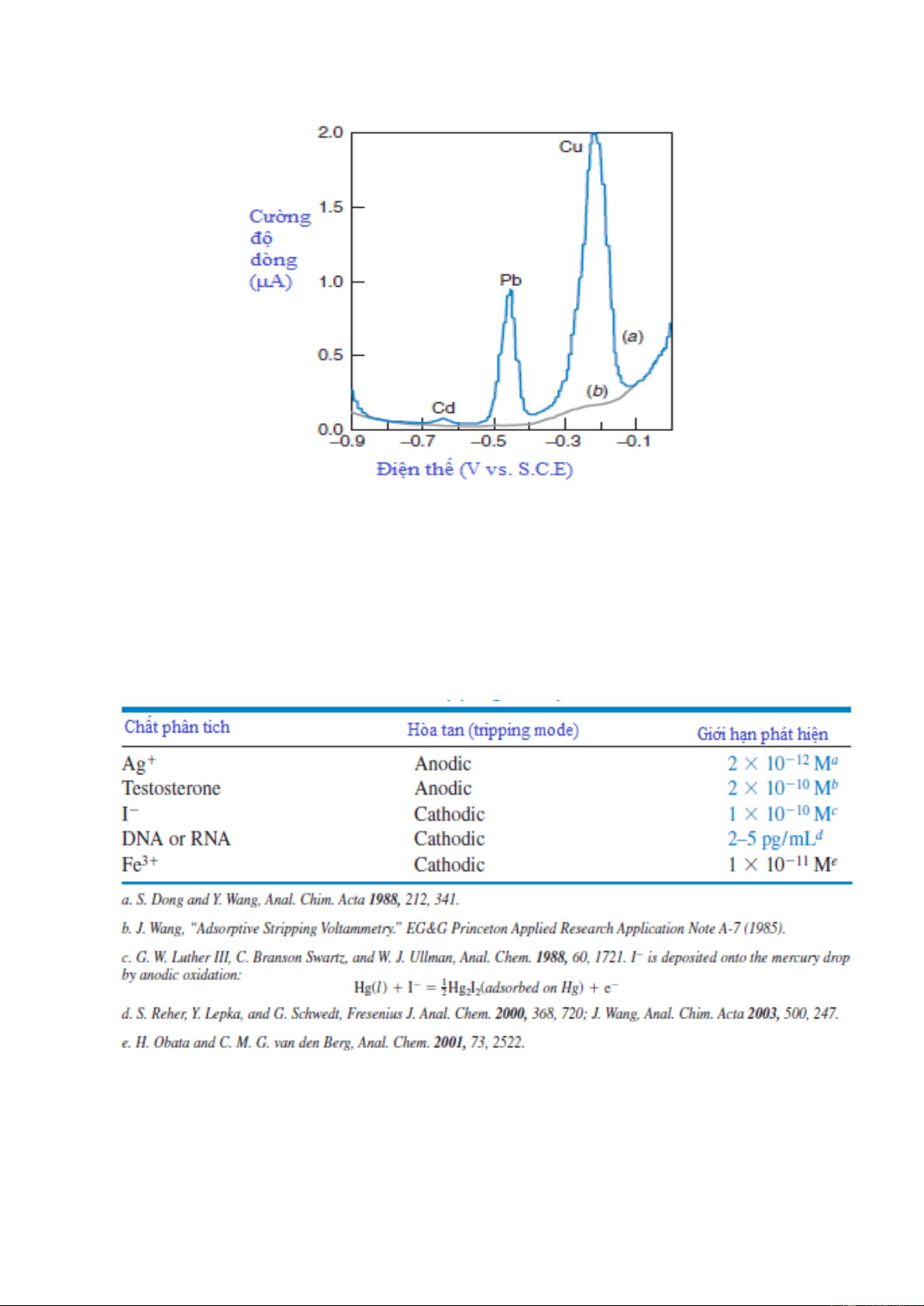
Hình 7-14. (a) Cực phổ hòa tan anot của mẫu mật ong (mật ong được hòa tan trong nước và axit hóa tới pH =
1,2 bằng HCl. Cd, Pb, và Cu bị khử từ dung dịch lên màng Hg trong 5 phút ở điện áp –1,4V (vs. S.C.E.) (b) Cực
phổ đồ nhận được khi không qua giai đoạn khử 5 phút.Nồng độ của Cd và Pb trong mật ong tương ứng là 7 và
27 ng/g (ppb). Độ chính xác nằm trong khoảng 2–4%.
Bảng 7-1. Giới hạn phát hiện đối với phương pháp von-ampe hòa tan
7.3. Câu hỏi ôn tập
1. Trình bày sự hình thành sóng cực phổ của một ion kim loại trên điện cực giọt Hg 18
2. Trình bày phương trình Inkovich biểu diễn sự phụ thuộc cường độ dòng khuếch tán vào
nồng độ chất phân tích.
3. Tại sao phải đuổi oxy khi phân tích bằng phương pháp cực phổ?
4. Chất nền cực phổ là gì? Nêu vai trò của chất nền cực phổ.
5. Trình bày cơ sở phân tích định tính và định lượng bằng phương pháp cực phổ. Trình bày
thủ tục đường chuẩn và thêm tiêu chuẩn trong phân tích định lượng bằng phương pháp cực phổ.
6. Trình bày nguyên tắc hai phương pháp tăng độ nhạy của cực phổ xung thường và cực phổ
xung vi phân. So sánh hai phương pháp.
7. Trình bày nguyên tắc của phương pháp vôn-ampe hòa tan. Tính ưu việt của phương pháp
này so với phương pháp cực phổ thường. 19




