













Preview text:
CHƯƠNG 7
PHƯƠNG PHÁP PHÂN TÍCH VÔN-AMPE (Voltammetry) History
❑ The beginning of voltammetry was facilitated by the
discovery of polarographyin 1922 by the Nobel Prize–winning
chemist Jaroslav Heyrovský.
❑ Early voltammetric techniques had many problems, limiting
their viability for everyday use in analytical chemistry.
❑ In 1942 Hickling built the first three electrodes potentiostat.
❑ The 1960s and 1970s saw many advances in the theory,
instrumentation, and the introduction of computer added and
controlled systems. These advancements improved sensitivity
and created new analytical methods. Industry responded with
the production of cheaper potentiostat, electrodes, and cells
that could be effectively used in routine analytical work. 2
Chất oxy hóa- chất khử 2H+ + 2e = H2
Cặp oxy hóa khử liên hợp 2H+/H2 H+ là chất oxy hóa
Sự khử H+, quá trình khử H+ Pb2+ + 2e = Pb
Cặp oxy hóa khử liên hợp Pb2+/Pb Pb2+ là chất oxy hóa
Sự khử Pb2+, quá trình khử Pb2+
Thế oxy hóa khử tiêu chuẩn Eo , thế oxy hóa khử càng lớn khả năng
oxy hóa càng mạnh, khả năng khử càng yếu. K+ + e– → K(rắn) E° = –2,936 K+ + e– + Hg → K(hỗn hống E° = –1,975 V Hg)
Catot (K): Điện cực âm, xảy ra quá trình khử
Anot (A): Điện cực dương, xả ra quá trinh oxy hóa 3
7.1. Cơ sở của phương pháp Đặc điểm chung
Phương pháp phân tích vôn-ampe là nhóm các phương pháp phân tích
điện hóa dựa vào đường cong vôn-ampe (đường cong phân cực) là
đường cong biểu diễn mối quan hệ giữa cường độ dòng điện với điện thế
khi tiến hành điện phân dung dịch phân tích.
Quá trình điện phân được thực hiện trong một bình điện phân đặc biệt,
trong đó có một điện cực có diện tích bé hơn điện tích của điện cực kia
nhiều lần. Điện cực có diện tích bé được gọi là vi điện cực. Quá trình khử
(hay oxy hóa) chủ yếu xảy ra trên vi điện cực.
Phương pháp von-ampe người ta có thể xác định được nhiều ion vô cơ,
hữu cơ. Phép phân tích có độ nhạy, độ chọn lọc và độ chính xác cao (10-9
- 10-8M). Có thể xác định đồng thời một số nguyên tố mà không cần tách trước. 4
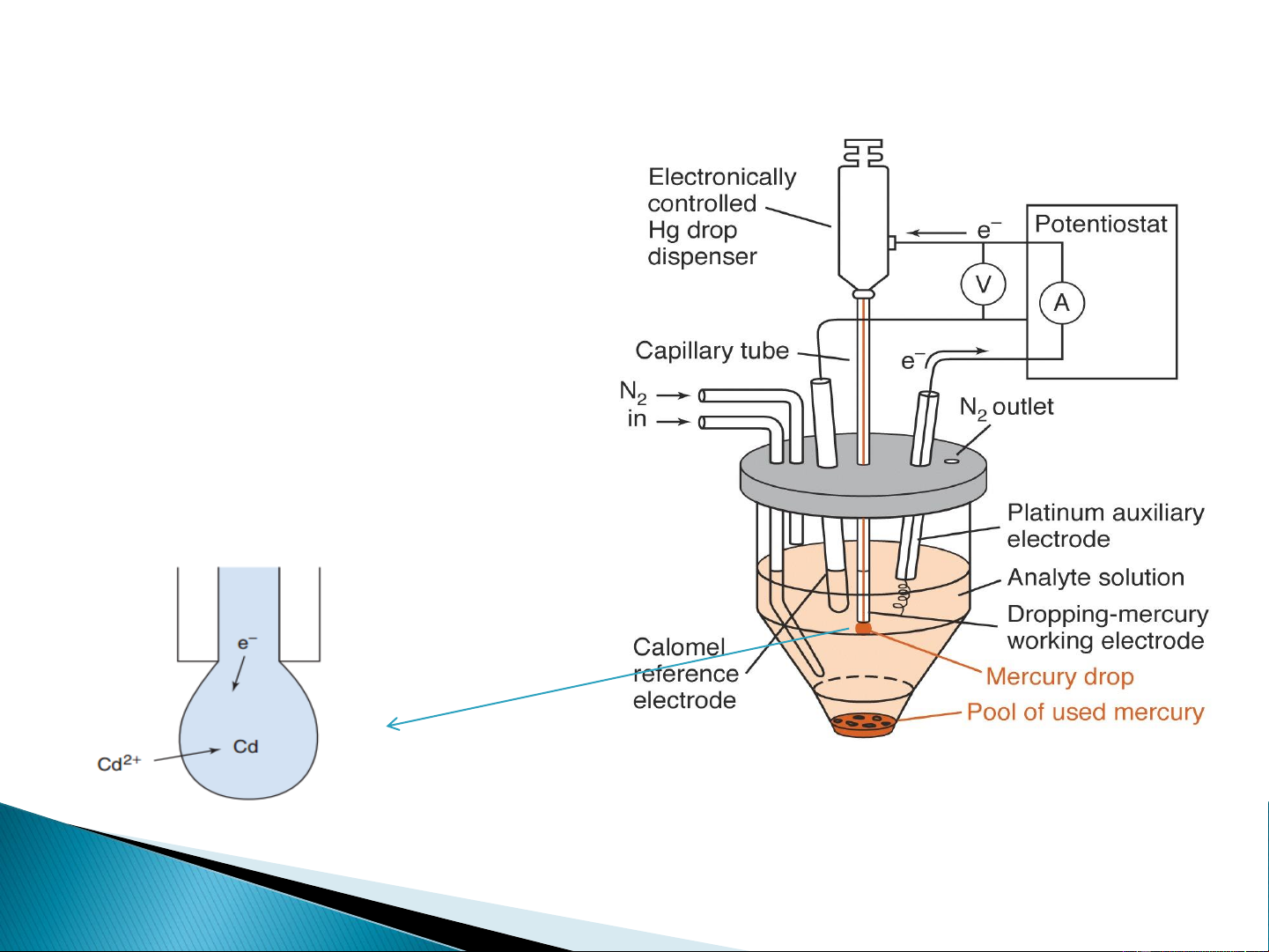
Quá trình xảy ra trên điện cực thủy ngân
Phương pháp vôn-ampe dựa trên
quá trình điện phân với điện cực
giọt thủy ngân được gọi là
phương pháp cực phổ
Applied potential : about 0.01 V ( 0 ~ 3.0 V)
Cell current : 0.01 ~ 100 A ( accuracy : 0.01 A)
Thiết bị vôn-ampe với điện cực làm việc Hg 5 1.
The working electrode, which makes contact with the analyte,
must apply the desired potential in a controlled way and
facilitate the transfer of charge to and from the analytes. 2.
The reference electrode is a half cell with a known reduction
potential. Its only role is to act as reference in measuring and
controlling the working electrode's potential and at no point
does it pass any current. 3.
The auxiliary electrode passes all the current needed to
balance the current observed at the working electrode. To
achieve this current, the auxiliary will often swing to extreme
potentials at the edges of the solvent window, where it
oxidizes or reduces the solvent or supporting electrolyte 6 •
A mercury electrode is not very useful for performing oxidations, because
Hg is too easily oxidized. In a noncomplexing medium, Hg is oxidized near + 0.25 V (versus S.C.E.). •
For most oxidations, some other working electrode must be employed. •
Pt electrode Vs SCE; works for a range of +1.2 to –0.2 in acidic solution
+0.7 V to –1 V in basic solution. Carbon paste electrode is also used in voltammetry. •
Mercury is toxic and slightly volatile, and spills are almost inevitable. a good vacuum cleaner. •
To remove residual mercury, sprinkle elemental zinc powder on the surface
and dampen the powder with 5% aqueous H S0 . 2 4 •
Mercury dissolves in the zinc. After working the paste into contaminated
areas with a sponge or brush, allow the paste to dry and then sweep it up.
Discard the powder appropriately as contaminated mercury waste. 7
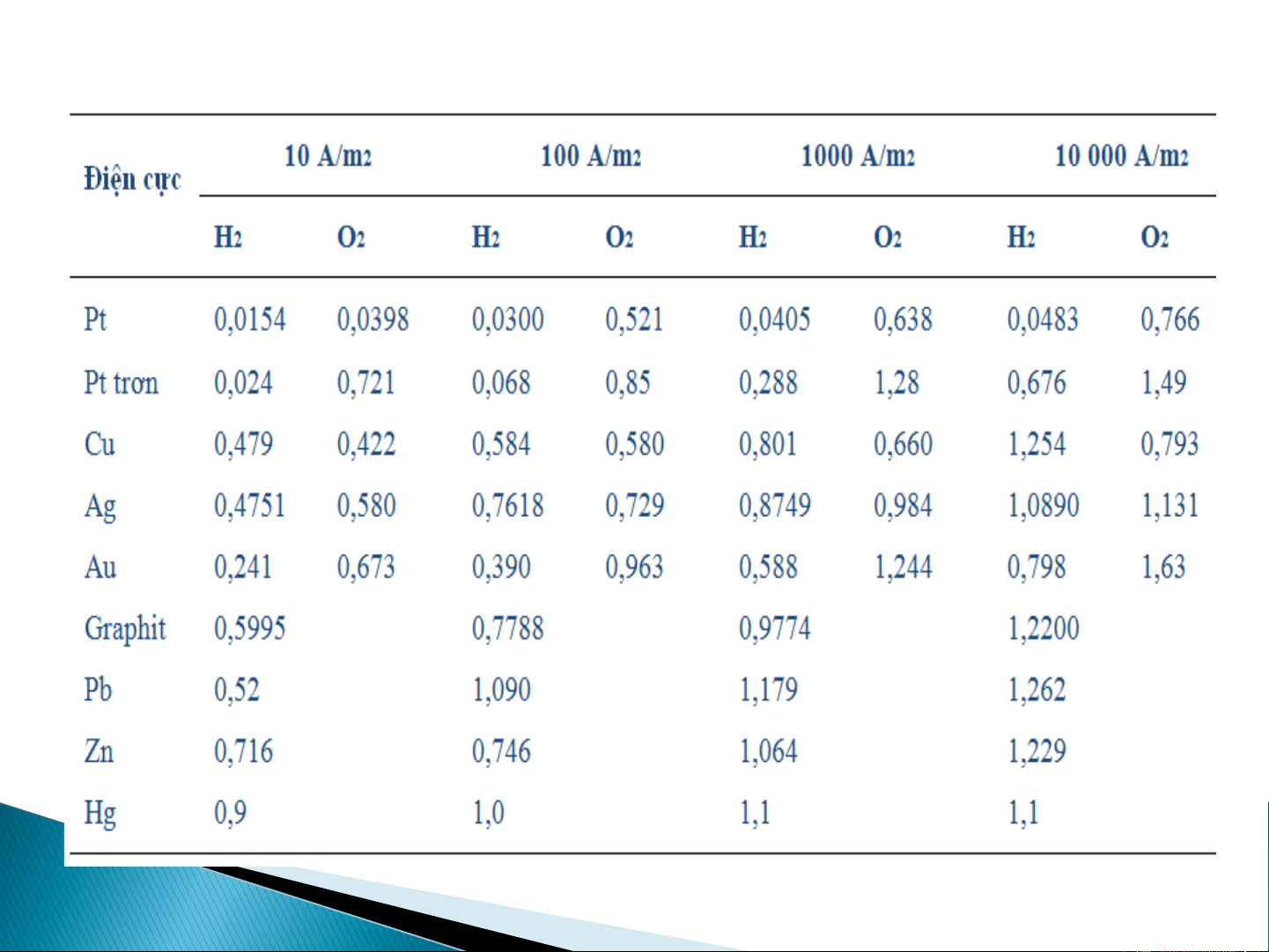
Một số lượng lớn các phản ứng được nghiên cứu với điện cực thủy ngân là các
phản ứng khử. Ở bề mặt điện cực Pt, sự khử H+ xảy ra với nhiều chất phân tích.
2H+ + 2e– → H (khí) E° = 0,000V 2
Bảng 7-1 chỉ ra rằng quá thế cho sự thoát H trên bề mặt điện cực Hg là rất lớn. 2
Trong môi trường trung tính hay kiềm, thậm chí các cation kim loại kiềm (nhóm I) bị
khử dễ dàng hơn H+. Hơn nữa, sự khử của một ion kim loại trên điện cực Hg ở
dạng hỗn hống là dễ dàng hơn sự khử trên bề mặt điện cực rắn. K+ + e– → K(rắn) E° = –2,936 K+ + e– + Hg → K(hỗn hống E° = –1,975 V Hg)
Điện cực thủy ngân không thuận lợi cho việc nghiên cứu phản ứng oxy hóa bởi vì
Hg dễ bị oxy hóa trong môi trường không tạo phức ở thế gần 0,25V (được so sánh
với điện cực calomen bão hòa). Nếu nồng độ Cl– là 1M, Hg bị oxy hóa gần giá trị 0V
bởi vì Hg(II) được ổn định bởi Cl– do tạo phức: Hg 2-
lỏng + 4Cl– ⇋ HgCl + 2e– 4
Để nghiên cứu các phản ứng oxy hóa bằng phương pháp vôn-ampe, các điện cực
làm việc như Pt, Au, C hay kim cương trong dung dịch nền thích hợp được sử dụng. 8
Bảng 7-1. Quá thế của quá trình thoát khí ở các mật độ dòng khác nhau ở 25°C 9
7.2. Sự hình thành sóng cực phổ của một ion kim loại
Ta nghiên cứu quá trình điện phân trên catot là điện cực thủy ngân, còn
anot là điện cực có diện tích lớn ví dụ điện cực pt. Vì điện cực pt có diện
tích bề mặt lớn hơn diện tích điện cực giọt Hg rất nhiều nên mật độ dòng
điện trên catot lớn hơn rất nhiều lần so với anot. Quá trình điện cực chủ
yếu xảy ra trên điện cực giọt Hg và gọi đây là phân cực catot. E = E – E – IR (7-1) applied k a
I: Cường độ dòng điện chạy qua bình điện phân
E: Điện thế giáng vào hai cực
R: Điện trở của bình điện phân
I thường rất nhỏ (10-7 - 10-5 A) nên bỏ qua IR E = E – E applied k a 10
Khi dùng điện cực calomen làm anot thì thế anot E thực tế không thay a
đổi khi có dòng điện nhỏ chạy qua bình điện phân (E = const). Nếu trong a
trường hợp này ta chấp nhận E = 0,0 V thì thế bắt đầu điện phân là: a E = E = f(I) k
Điện thế này gọi là điện thế thoát kim loại.
Điện thế thoát kim loại phụ thuộc vào nồng độ ion kim loại bị khử. Nồng
độ ion kim loại càng bé thì điện áp đặt vào bình điện phân phải càng lớn. 11
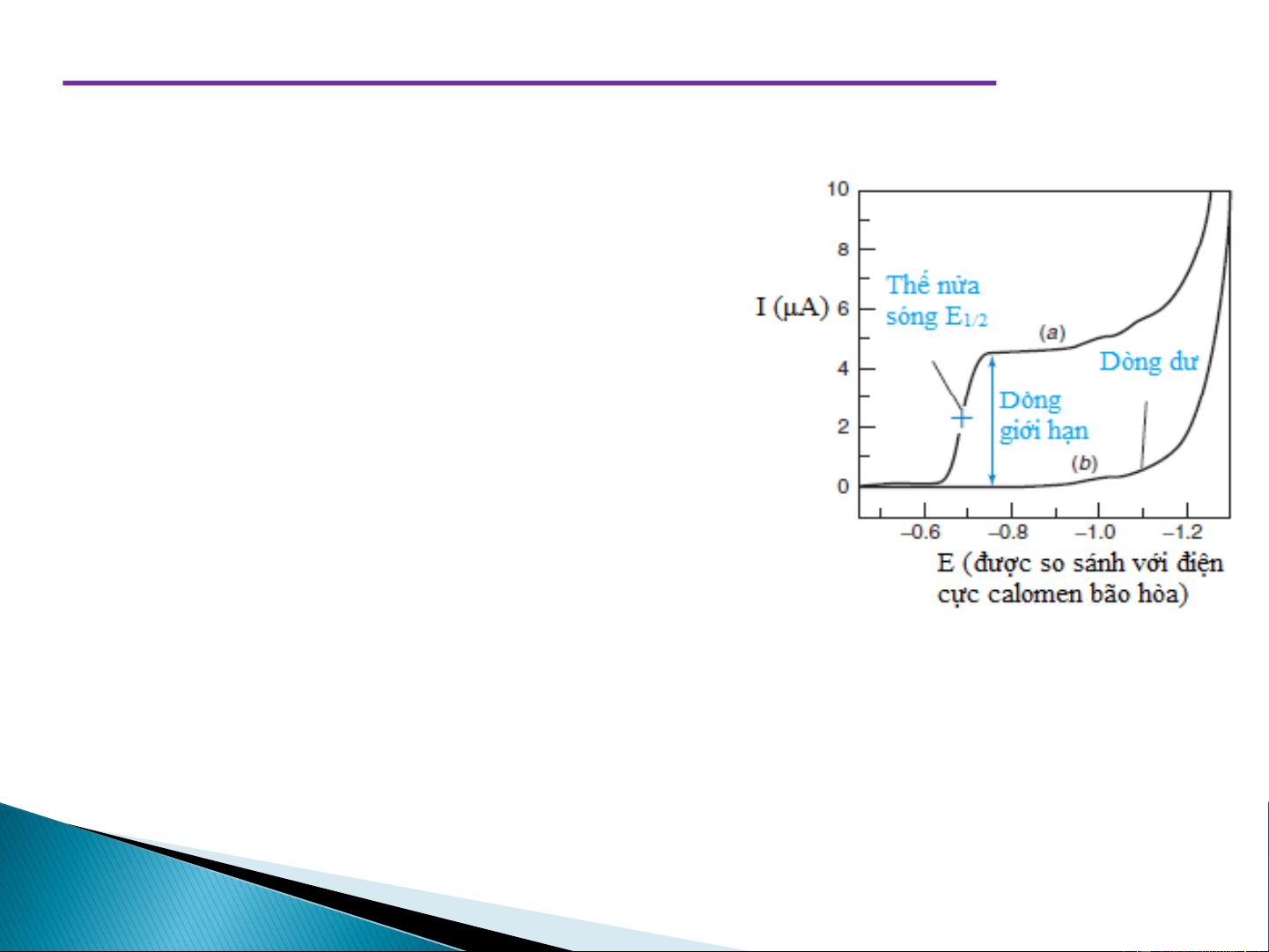
Dòng dư và dòng tụ điện C I (μA) B
Xét đoạn OA: E tăng nhiều nhưng I tăng rất
ít. Lúc này E nhỏ hơn thế phân hủybcủa
chất phân tích (E ), chưa xảy ra quá trình h điện phân.
Dòng dư hình thành do nhiều nguyên A nhân: O E (V) 1. Dòng tụ điện:
Khi nhúng điện cực vào dung dịch, trên bề mặt sẽ xuất hiện lớp điện kép.
Lớp điện kép có thể xem như một tụ điện, khi tụ này phóng điện sẽ tiêu thụ
một lượng điện nào đó. Dòng phóng điện của tụ lại tạo nên một thành phần
của dòng không Faraday gọi là dòng tụ điện (Ic). Khi tăng điện áp đặt vào
hai điện cực, dòng tụ tăng lên. 12
2. Do sự khử tạp chất có trong dung dịch sinh ra một dòng gọi là It Vậy dòng dư I = I + I r c t
Nếu trong dung dịch không có tạp chất I = I r c
Giá trị dòng dư thường là rất nhỏ (~10-7 A). Tuy nhiên khi phân tích
các dung dịch có nồng độ rất nhỏ thì I trở nên đáng kể do đó phải r
tìm cách giảm đến mức tối thiểu dòng dư.
Trong thực tế phân tích, dòng tụ điện có thể được loại bỏ nhờ tác
dụng của chất nền cực phổ (là dung dịch các chất điện ly mạnh,
trơ có nồng độ lớn). 13 Dòng giới hạn (I ) d
Xét đoạn AB: Thế tăng ít nhưng cường độ dòng tăng đột ngột
Khi tiếp tục tăng điện thế đến lúc E > E xảy ra phản ứng điện phân, ví h dụ:
Zn2+ + 2e = Zn(Hg) hỗn hợp hống (7-2)
Nồng độ ion kim loại ở lớp dung dịch sát bề mặt điện cực giảm do sự
điện phân. Tuy nhiên, do hiện tượng khuếch tán, các ion kim loại ở sâu
bên trong dung dịch sẽ tiến đến lớp dung dịch ở sát bề mặt điện cực.
Khi E tăng quá trình khử tăng, ∆C= C o–C
tăng, vận tốc khuyêch tán M M tăng, I tăng.
Vì vậy cường độ dòng điện sẽ phụ thuộc tốc độ khuếch tán, mà tốc độ
khuếch tán ion lại phụ thuộc vào hiệu số nồng độ ở sâu bên trong dung
dịch và nồng độ C ở sát bề mặt điện cực. M I = K (C o –C ) (7-3) M M M 14 Xét đoạn BC:
Khi tăng điện thế đặt vào catot thì nồng độ C ở phương trình sẽ giảm dần, I tăng M
dần. Nhưng sẽ đến lúc ứng với điện thế E nào đó, vận tốc khử kim loại sẽ bằng
vận tốc khuếch tán và nồng độ ở lớp dung dịch sát bề mặt điện cực bằng không (C = 0). M
Quá trình điện phân ở đây thường xảy ra với cường độ dòng bé (thường bé hơn
10–2 mA) nên nồng độ dung dịch sâu bên trong của dung dịch thực tế không đổi
và bằng C °. Cường độ dòng chạy qua bình điện phân lúc bấy giờ đạt giá trị M
không đổi I dù cho có tiếp tục tăng điện thế đặt vào bình điện phân. d
Ứng dụng phương (7-3) trình với C = 0 ta có: M I = K ×C ° (7-4) d M M I = I – K ×C (7-5) d M M
Nếu tiếp tục tăng E nhưng I không tăng nữa (đoạn BC).
Nhận xét: I phụ thuộc vào hệ số khuyêch tán và nồng độ dung dịch d phân tích. 15
Cực phổ đồ Cd2+ 5mM trong HCl 1M và HCl 1M (a) Dòng
khuếch tán giới hạn Id
(diffusion current) là tỉ lệ thuận với nồng
độ chất phân tích. Dòng khuếch tán giới
hạn được đo từ đường cơ sở khi không có chất phân tích.
(b) Dòng dư (residual current) khi vắng
mặt của chất phân tích là do sự khử các
tạp chất trong dung dịch và trên bề mặt
của các điện cực.
Cực phổ đồ (a) Cd2+ 5mM trong
Ở giá trị gần –1,2V, dòng tăng nhanh HCl 1M, (b) HCl 1M
chóng do sự khử của H+ về H . 2 16
Dòng Faraday và dòng dịch chuyển
Dòng dịch chuyển (charging current): do lực
Faradaic current: Do phản
hút tĩnh điện hay lực đẩy của các ion trong
ứng oxy hóa khử ở điện cực
dung dịch và điện tử trong các điện cực
Dòng Faraday là tín hiệu mà chúng ta quan tâm, còn dòng dịch
chuyển lại che khuất tín hiệu của dòng Faraday, nên chúng ta
tìm cách giảm thiểu tín hiệu này. 17
Trong phân tích định lượng, dòng dòng khuếch tán giới hạn phải được
điều khiển bởi tốc độ tại đó chất phân tích có thể khuếch tán tới bề mặt
điện cực. Chúng ta có thể giảm thiểu sự đối lưu bằng cách không
khuấy dung dịch. Chúng ta có thể giảm thiểu sự dịch chuyển (lực hút
tĩnh điện của chất phân tích) bằng cách sử dụng chất trợ điện cực có
nồng độ lớn, chẳng hạn như HCl 1M.
Như vậy, để giảm và đi đến loại bỏ dòng dịch chuyển, người ta có thể
đưa thêm vào dung dịch phân tích một chất điện ly trơ (không tham gia
phản ứng điện cực) có nồng độ lớn hơn nồng độ ion nghiên cứu nhiều
lần. Người ta gọi đây là chất điện ly nền. Cation của chất điện ly nền sẽ
chắn tác dụng của điện trường và làm dòng dịch chuyển thực tế bằng không. 18
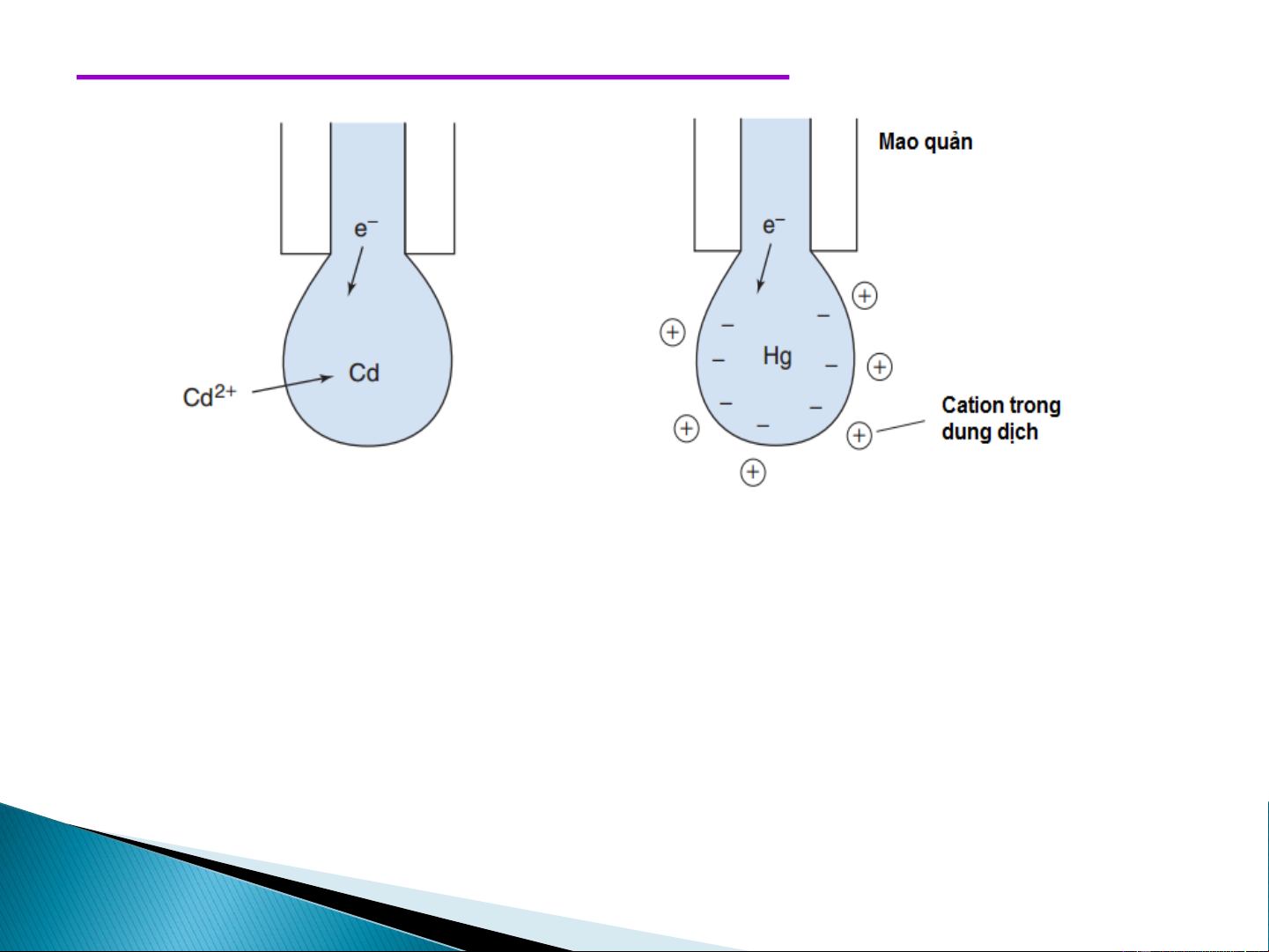
Vai trò của chất nền cực phổ
Sự dịch chuyển các ion kim loại từ sâu trong dung dịch đến sát điện cực do hai tác dụng.
1.tác dụng của lực khuyếch tán (phụ thuộc vào sự chênh lệch về nồng độ) gây ra Ikt
2. do tác dụng của điện trường (điện tích âm của catot hút các ion
dương gây ra dòng dịch chuyển). I = I + I (7-6) d kt dc Mà I
~ nồng độ chất phân tích kt
Dòng dịch chuyển cản trở việc đo thành phần dòng khuếch tán nên người ta
phải loại bỏ dòng dịch chuyển khi phân tích theo phương pháp vôn-ampe.
Để giảm và đi đến loại bỏ dòng dịch chuyển, người ta có thể đưa thêm vào dung
dịch phân tích một chất điện ly trơ (không tham gia phản ứng điện cực: KCl,
NH Cl, Na SO ….) có nồng độ lớn hơn nồng độ ion nghiên cứu nhiều lần ~100 4 2 4
lần. Người ta gọi đây là chất điện ly nền. Cation của chất điện ly nền sẽ chắn tác
dụng của điện trường và làm dòng dịch chuyển thực tế bằng không. Dòng giơi
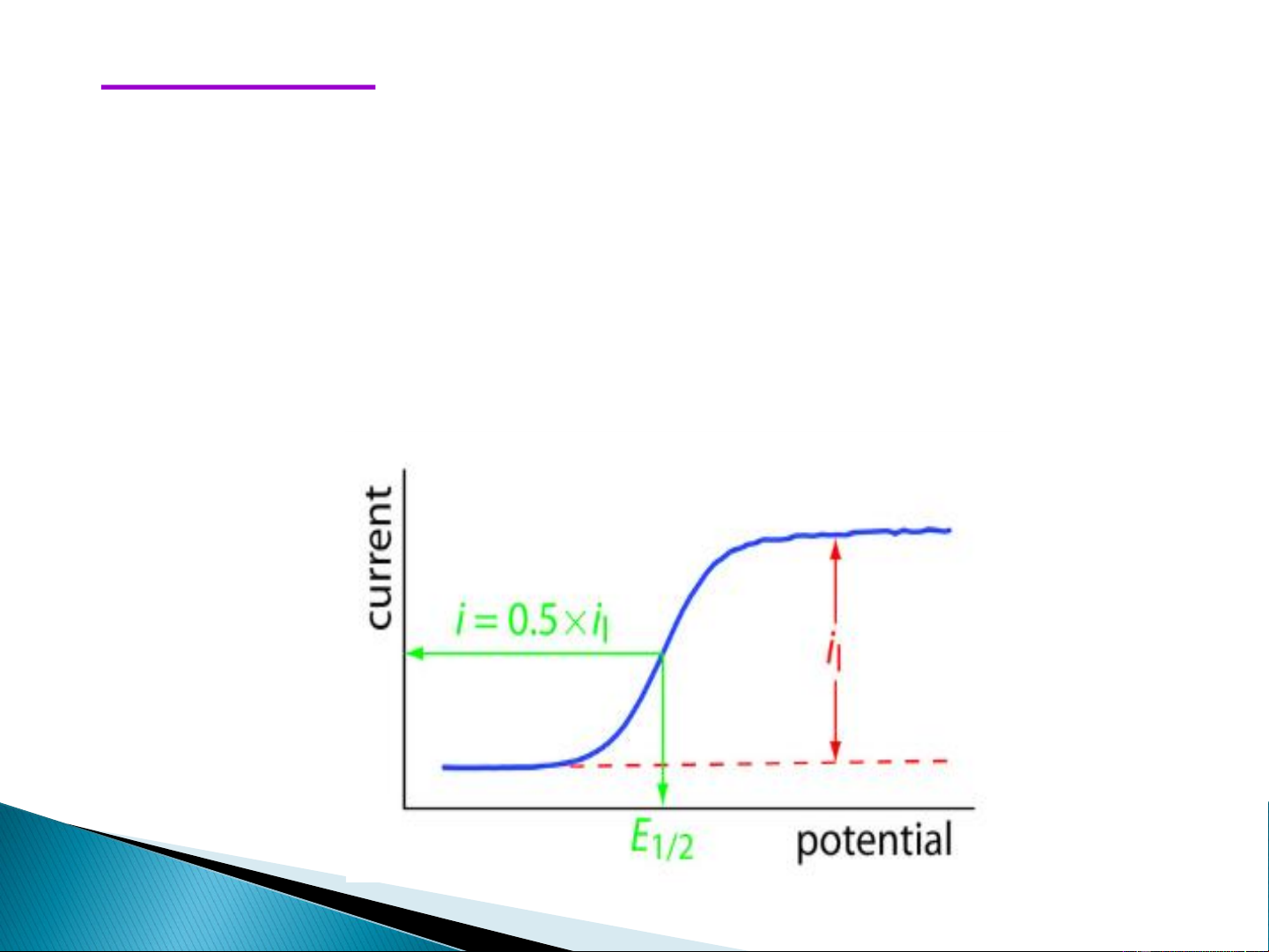
hạn lúc này gọi là dòng khuyêch tán giới hạn. 19 Thế bán sóng ➢ E
là thế ứng với ½ chiều cao của sóng cực phổ 1/2 ➢ E
không phụ thuộc vào nồng độ mà phụ thuộc vào bản chất 1/2
của ion nghiên cứu và chất nền cực phổ. Đây là đại lượng đặc
trưng cho các ion kim loại dùng để phân tích định đính. ➢ E
được tra trong sổ tay hóa học hoặc sổ tay hóa phân tích 1/2 20




