

















Preview text:
Chương 8 Phương pháp chiết (Extraction) 02/11/2020 1 Analytical Chemistry Steps in Chemical Analysis 1. Formulating the Question
2. Selecting the Analytical Procedure 3. Sampling 4. Sample Preparation 5. Analysis
6. Interpretation and Reporting 7. Drawing Conclusions
- Sample Storage (e.g. moisture, temperature)
- Grinding, Extracting Analyte, etc.
- Dissolving Sample/Dispersing Analyte - Concentrating Analyte
- Eliminate Interfering/”Mask” Species
(e.g. drying, ignition, isolation) 02/11/2020 2
CHƯƠNG 8: PHƯƠNG PHÁP CHIẾT
8.1. Đặc điểm phương pháp chiết lỏng-Lỏng (Liquid- Liquid Extraction; LLE) Khái niệm:
Chiết là quá trình tách và phân li các chất dựa vào quá trình chuyển
một chất hòa tan trong một pha lỏng (nước) vào một pha lỏng khác
không hòa tan lẫn với nó (dung môi hữu cơ không tan lẫn với nước) Ưu điểm:
➢ Tiến hành nhanh và thuận lợi.
➢ Có thể tách được các hỗn hợp phức tạp và các nguyên tố gần như nhau.
➢ Có thể tách triệt để. 02/11/2020 3 Phân loại:
Theo bản chất của hợp chất chiết (Morison và Freizer)
➢Chiết các hợp chất nội phức: ion kim loại kết hợp với các phối tử hữu
cơ có nhiều nhóm chức khác nhau tạo thành các vong kín.
➢Chiết các tập hợp ion: là các tập hợp không tích điện do sự trung hòa
điện tích của các ion đối nhau. Sự tạo thành tập hợp ion chủ yếu do lực tĩnh điện. Ứng dụng:
➢Tách các chất (Hóa phân tích, phân tích môi trường, phân tích thực phẩm,..) ➢Làm giàu ➢Làm sạch 02/11/2020 4
8.2. Một số đại lượng cơ bản của quá trình chiết
Hằng số phân bố (Coefficient constant):
Định luật phân bố (Nernst): K = pb
Kpb là hằng số phân bố.
ax,hc là hoạt độ của chất X trong dung môi hưũ cơ.
ax,n là hoạt độ của chất X trong dung môi nước.
Kpb phụ thuộc vào bản chất của chất tan, dung môi, nhiệt độ, và áp suất. 02/11/2020 5
Với nồng độ chất hoà tan bé có thể coi hoạt độ bằng nồng độ. [X] K = hc pb [X]n
[X ], [X ] nồng độ chất X trong hai pha hữu cơ và hc n nước. 02/11/2020 6
Hệ số phân bố (Partition coefficient):
Ví dụ: với chất hoà tan là HgCl2 thì ở pha hữu cơ chỉ là HgCl2 nhưng trong
pha nước thì có thể tồn tại cả ba dạng HgCl2, HgCl+, Hg2+ D = X D = hc X n
Hệ số phân bố phải được xác định bằng thực nghiệm 02/11/2020 7
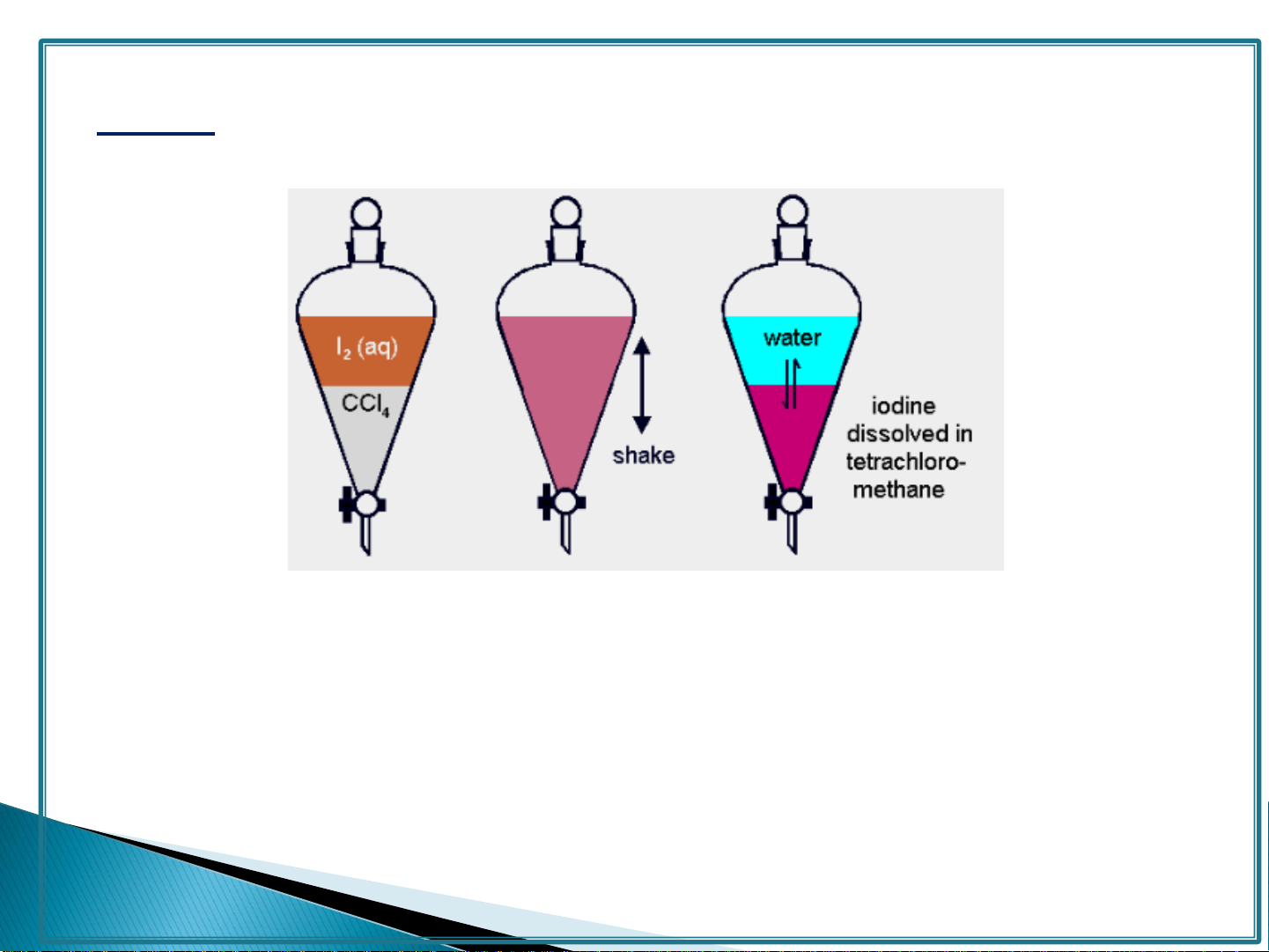
Ví dụ: Chiết iot ra khỏi nước bằng cloroform
0.034 g iodine dissolves in 100 g water at 25 oC - approx 0.003 mol L−1
2.587 g iodine dissolves in 100 g CCl4 at 25 oC - approx 0.361 mol L−1 02/11/2020 8 02/11/2020 8
Độ chiết và phần trăm chiết:
➢ Phần trăm chiết R (%) là số phần trăm chất tan được tách ra
khỏi pha nước sau một lần chiết.
➢ Gọi X là phần chất tan được chiết ra khỏi pha nước sau một lần tách
➢ 1-X là phần còn lại trong pha nước sau một lần chiết
➢ V , V là thể tích pha hữu cơ và pha nước. hc n R = 100X 02/11/2020 9 02/11/2020 10
Tính toán lượng chất được chiết 02/11/2020 11
Ví dụ 1: lượng chất cần chiết là 1 gam, hệ số phân bố là D=5, V = V = 20 ml. n hc
➢Hỏi sau lần chiết thứ nhất chất còn lại là bao nhiêu?
➢Muốn chiết được 99,5% cần phải chiết mấy lần? 02/11/2020 12
Ví dụ 2: Hệ số phân bố của một hợp chất hoá học là 20.
Bằng tính toán để kết luận trong hai trường hợp chiết sau, trường hợp nào chiết tốt hơn.
1. Chiết 10ml dung dịch nước bằng một lần chiết với 20 ml dung môi hữu cơ.
2. Chiết 10 ml nước bằng 2 lần chiết mỗi lần 10 ml dung môi hữu cơ. 02/11/2020 13
8.3. Cân bằng trong quá trình chiết
Một quá trình chiết bao gồm nhiều cân bằng, khi tính toán cần phải
tính đến tất cả những cân bằng đó, bởi vậy việc tính toán chính
xác là rất phức tạp.
Ví dụ 1: Chiết một ion kim loại Me+ bằng thuốc thử HR (axit hữu
cơ). Quá trình chiết bao gồm các quá trình sau:
1. Cân bằng phân bố thuốc thử (HR) giữa hai pha: HRhc ⇌ HRn (1) HR
(pha hữu cơ) (pha nước) HR 1 n K = K = = Me+ 1 cb HR K hc pb( HR ) 02/11/2020 14
2. Cân bằng thuốc thử trong nước
HRnc ⇌ H+nc + R-nc (2) + − H . R n n K K 2 = HR a (HR) n =
3. Cân bằng hợp chất nội phức trong pha nước
Me+nc + R-nc ⇌ MeRnc (3)
4. Cân bằng hợp chất nội phức giữa hai pha MeRnc ⇌ MeRhc (4)
Tổng hợp cả quá trình: (1)+(2) +(3) +(4) HR + Me+ ⇌ MeR + H+ (5) hc n hc n K .β .K
Hằng số phương trình chiết: K a(HR) MeR pb(MeR) C = K1×K2×K3×K4 = Kpb(HR) 02/11/2020 15 + + K [MeR ].[H n ] D.[H n ] hc c = + = [Me n ].[HR ] [HR ] hc hc [HR ] K .β .K .[HR ] ⇒ D = K a(HR) MeR pb(MeR) hc + hc C = [H + n ] K .[H n ] pb(HR)
D càng lớn khả năng chiết càng tốt, D phụ thuộc vào:
✓Ka(HR) (Ka(HR) càng lớn D càng lớn)
✓β(MeR) càng lớn phức càng bền D càng tăng)
✓Kpb(MeR) chọn dung môi hữu cơ để MeR tan nhiều
✓[HR]hc: dùng dư thuốc thử
✓Kpb(HR): HR tan mạnh trong nước càng tốt
✓[H+]n: Thích hợp để ngăn chặn sự tạo phức hydroxo của Me và
không làm giảm sự phân ly của HR 02/11/2020 16
Ví dụ 2: Khi chiết axit axetic vào dung môi benzen, hiệu quả chiết cao
hơn khi điều chỉnh pH ở pha nước ở pH = 3 hay 8? Giải thích Bài giải
The distribution of acetic acid between benzene and water 02/11/2020 17
Hằng số phân bố KD của axit yếu HA giữa pha nước và pha hữu cơ là 100.
Hằng số phân ly axit Ka =2,010-4. Tính nồng độ axit HA còn lại trong pha
nước nếu ta chiết 50,0 ml axit HA 0,050M bằng 25,0ml dung môi hữu cơ ở
pH=4,0. Lặp lại phép tính với pH = 1,0; từ đó rút ra kết luận gì? pH = 4 D = K
/ (1+Ka/[H+]) = 100/ (1+2.10-4/10-4) = 33,3 D,HA
R= D/(D+Vnc/Vhc) 100 = 33,3 / (33,3 + 50/25) = 94,33 %
[HA] còn lại = 0,05 (100 – 94,33)% = 2,83510-3 M pH = 1 D = K
/ (1+Ka/[H+]) = 100/ (1+2.10-4/10-1) = 99,8 D,HA
R= [D/(D+Vnc/Vhc)] 100 = [99,8 / (99,8 + 50/25)] 100 = 98,04 %
[HA] còn lại = 0,05 (100 – 98,04)% = 9,8010-4 M
Example: Give at 20 oC only 0.24 g of an organic acid “A” dissolves
in 100 mL of water, but 2.70 g of the same acid dissolves in 100 mL of ether.
a. calculate the value of partition coefficient.
b. calculate the percentage of extraction if 0.12 g of acid extracted
in 100 ml of aqueous solution.
c. calculate the volume of ether required to extract 85% of a 3.00 g
of acid “A” in 100 mL solution.
d. calculate the total amount of acid extracted by a double
extraction of 50 mL ether in each extraction in part (c). 02/11/2020 19
Example: Isobutyric acid has a solubility in water (at 25 oC)
about one-third of its solubility in diethyl ether; thus D = 3.0.
Imagine 4.0 g of isobutyric acid dissolved in a mixture of 35.0
ml of diethyl ether and 100.0 ml of water.
a) What weight of acid is in each layer at equilibrium after first
extraction and second extraction?
b) Calculate the percentage extraction after second extraction.
Solubility of butyric acid in water = X g/ml
Solubility of butyric acid in diethyl ether = 3X g/ml 02/11/2020 20




