













Preview text:
Phần III: Các phương pháp tách
Chương 8. Phương pháp chiết Tran Thi Thuy
Department of Analytical Chemistry
School of Chemical Engineering – Hanoi University of Science and Technology (HUST) Outline
8.1. Đặc điểm chung của phương pháp
8.2. Phân loại quá trình chiết
8.3. Các đặc trưng định lượng của quá trình chiết
8.4 Cân bằng trong hệ thống chiết
8.5 Một số vấn đề trong kỹ thuật chiết 8.6 Bài tập 9/22/2020 2 HUST SCE
Trong một số lớn các vấn đề phân tích thực tế, chúng ta
phải xác định và định lượng một hay một vài cấu tử từ
một hỗn hợp phức tạp. Việc tách chất cần xác định ra khỏi
hỗn hợp là nhiệm vụ đầu tiên. Trong chương này chúng ta
sẽ thảo luận các nguyên lý tách trong phân tích. 3 HUST SCE
8. 1. Đặc điểm chung của phương pháp
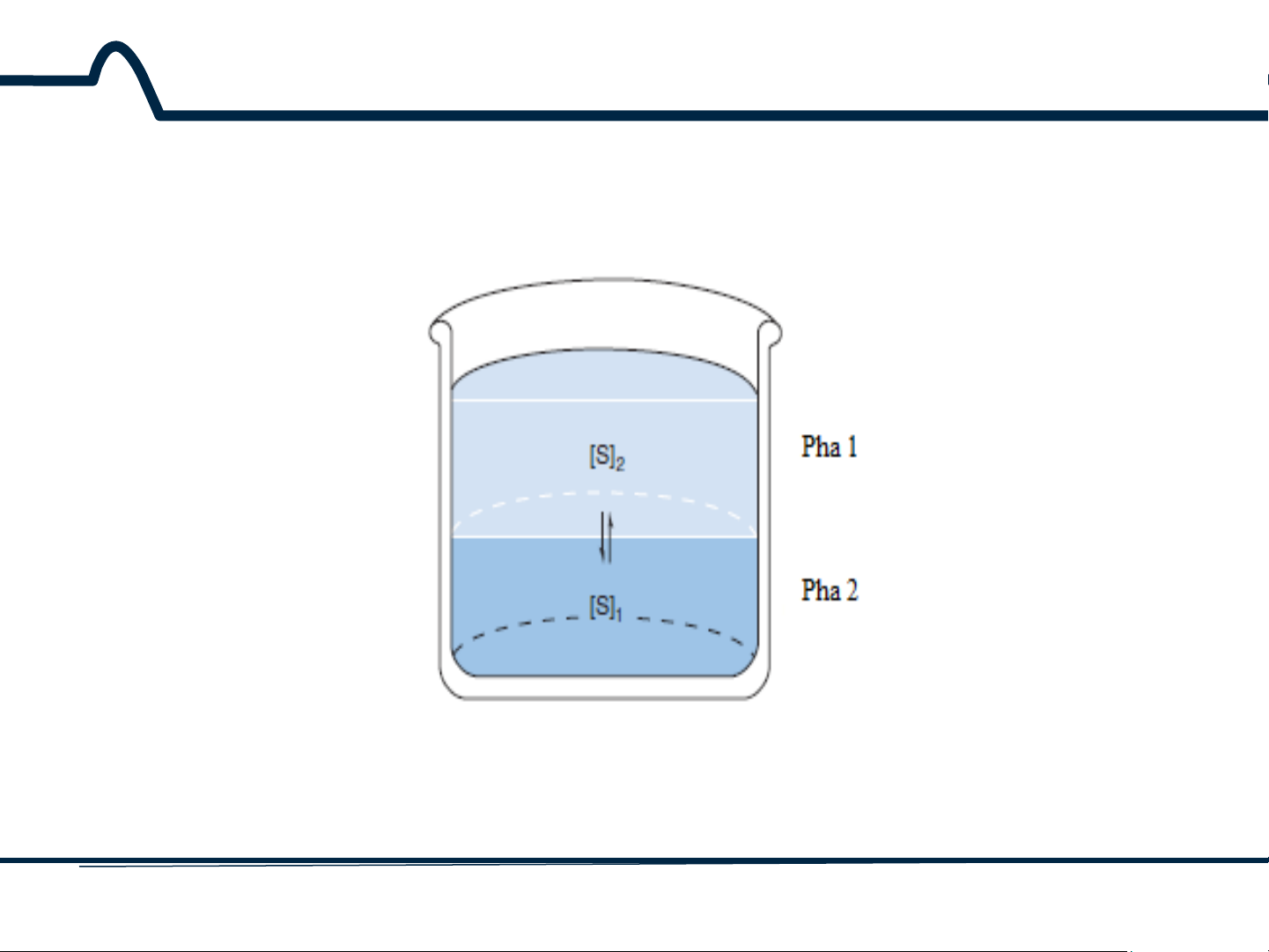
Chiết là quá trình chuyển chất tan từ một pha này sang pha khác dựa
trên tính tan khác nhau của chất tan trong hai pha (hình 8-1).
Hình 8-1. Sự phân bố của một chất tan giữa hai pha lỏng 4 HUST SCE
8. 1. Đặc điểm chung của phương pháp
Các dung môi hữu cơ là những hợp chất ít phân cực nên
thường không tan trong nước, chất có độ phân cực rất lớn.
Dietyl ete, toluen, hexan là các dung môi có tỉ trọng nhỏ
hơn nước, chúng nổi ở trên pha nước. Clorofoc CHCl3,
CH2Cl2, CCl4 là các dung môi phổ biến có tỉ trọng lớn hơn
nước. Trong hỗn hợp hai pha, một pha nước chiếm ưu thế,
pha kia dung môi chiếm ưu thế. 5 HUST SCE
8.2. Phân loại quá trình chiết
Dựa vào bản chất hợp chất chiết, Morison và Freizer đã chia hợp chất
chiết thành hai nhóm lớn là:
+ Chiết các hợp chất nội phức (hay còn gọi là các chelat) + Chiết tập hợp ion
Chelat là hợp chất phức, trong hợp chất này, ion kim loại (axit Lewis)
bị một ligan (bazơ Lewis) tấn công nhiều hơn một nguyên tử.
Tập hợp ion là các tập hợp không tích điện do sự trung hòa điện tích
của các ion đối nhau. Sự tạo thành tập hợp ion chủ yếu do lực tĩnh
điện. Các tác giả đã chia tập hợp ion thành ba nhóm có thể chiết được theo các kiểu sau: 6 HUST SCE
8.2. Phân loại quá trình chiết
Quá trình chiết xảy ra do các ion kim loại tham gia tạo ion
có kích thước lớn có chứa các nhóm hữu cơ phức tạp,
hoặc đôi khi ion kim loại liên kết với một ion có kích thước lớn
Quá trình chiết ion kim loại do tạo các solvat: tham gia tạo
các solvat là các anion ( ví dụ như các halogenua..) và các
phân tử dung môi chứa oxy như rượu, ete thay vào các vị
trí của phân tử nước trong ion kim loại
Quá trình chiết bằng amin và axit cacboxylic: ở đây các
ion kim loại được chiết dưới dạng muối có khối lượng phân
tử lớn. Chính nhờ khối lượng phân tử lớn mà các muối này
dễ tan vào dung môi hữu cơ 7 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết
8.3.1 Định luật phân bố Nernst
Giả sử chất tan S được phân bố giữa pha 1 và pha 2.
Hằng số phân bố (partition coefficient), K, là hằng số cân bằng của phản ứng:
S(trong pha 1)⇋ S(trong pha 2)
Giả sử pha 2 là hữu cơ, pha 1 là pha nước
[S]i: nồng độ của S trong pha i (i=1,2)
Với một hợp chất chiết xác định thì Ks chỉ phụ thuộc vào
nhiệt độ và bản chất dung môi. Giá trị Ks càng lớn thì khả
năng hợp chất S từ pha nước vào pha hữu cơ càng lớn khi
thực hiện quá trình chiết. 8 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết
8.3.2 Hệ số phân bố
Trong thực tế rất khó xác định dạng xác định của hợp chất hòa tan trong cả hai pha.
Ví dụ 1: 1 amin B, axit liên hợp BH+, khi thay đổi pH thì nồng độ hai dạng thay đổi
Ví dụ 2: HgCl2 tan ở trong pha hữu cơ dưới dạng HgCl2, nhưng tan ở
pha nước dưới dạng HgCl2, HgCl+, .. Xác định riêng nồng độ HgCl2 thì
rất khó khăn. Để có thể ước lượng khả năng chiết của một hợp chất
nào đó bằng dung môi hữu cơ người ta dùng hệ số phân bố D
Chữu cơ: tổng nồng độ các dạng của hợp chất nghiên cứu trong pha hữu cơ
Cnước: tổng nồng độ các dạng của hợp chất nghiên cứu trong pha nước 9 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Định nghĩa: Độ chiết R (%) là phần trăm lượng chất chiết đã đi vào
pha hữu cơ với lượng chất trong pha nước ban đầu tại thời điểm cân bằng. R = Qhữu cơ × 100 (8-3) Q ban đầu
Giả sử rằng chất tan S có thể tích V1 (dung môi 1: nước) được chiết
với V2 ml dung môi hữu cơ (ví dụ toluen). Gọi m là số mol của S trong
hệ thống và gọi q là phần S vẫn còn trong pha nước ở thời điểm cân
bằng. Nồng độ mol trong pha nước bởi vậy là 𝑞 𝑚. Phần chất tan S 𝑉1
chuyển sang pha 2 là (1-q) và nồng độ trong pha hữu cơ 2 là (1-q) 𝑚. 𝑉2 Do vậy, (1−𝑞) 𝑚 (1−𝑞) 𝐷 = Chữu cơ = 𝑉2 = 𝑉2 = (1−𝑞)𝑉1 (8-4) C 𝑞𝑚 𝑞 nước 𝑞𝑉 𝑉 2 1 𝑉1 10 HU ST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Giải phương trình (8-4) đối với q suy ra phần chất tan S còn lại trong
pha nước sau lần chiết thứ nhất. 𝑞 = 𝑉1 = 𝑉1 (8-5) 𝑉1+𝐾𝑉2 𝑉1+𝐷𝑉2
Từ (8-5) cho phép ta nói rằng phần chất tan trong pha nước phụ
thuộc vào hệ số phân bố và thể tích. Nếu các pha được tách ra và
dung môi hữu cơ mới được thêm vào, phần chất tan còn lại trong nước sẽ là: 2 q.q = 𝑉1 (8-6) 𝑉1+𝐷𝑉2
Sau n lần chiết với thể tích dung môi V2 hữu cơ, phần chất tan còn lại trong nước sẽ là: 𝑛 qn = 𝑉1 (8-7) 𝑉 1+𝐷𝑉2 11 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Ví dụ: Một hợp chất A có hệ số phân bố giữa pha hữu cơ
và pha nước là D = 60. Trong 500 ml dung dịch có 10 mg chất A.
a. Sau 1 lần chiết với 50 ml dung môi hữu cơ, có bao
nhiêu phần trăm chất A được tách vào pha hữu cơ 𝑞 = 𝑉1 = 500 = 1 𝑉1+𝑫𝑉2 500+60.50 7
Sau lần chiết 1, phần trăm chất A được tách vào pha hữu cơ là: R(%) = 1−𝑞 100 = 85,7% 1 12 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Ví dụ: Một hợp chất A có hệ số phân bố giữa pha hữu cơ và pha nước
là D = 60. Trong 500 ml dung dịch có 10 mg chất A.
b. Sau bao nhiêu lần chiết như trên thì độ chiết đạt được 99%
Phần chất tan A còn lại trong pha nước là 1% = 0,01 Có phương trình: 𝑛 𝑛 𝑛 qn = 𝑉1 = 0,01 = 500 = 1 𝑉1+𝐷𝑉2 500+60.50 7 lấy logarit hai vế: 𝑛 log0,01 = log 1 ↔ n = 2,37 7 do nϵN → n = 3
Như vậy, sau 3 lần chiết thì độ chiết đạt được 99% 13 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Ví dụ: Một hợp chất A có hệ số phân bố giữa pha hữu cơ
và pha nước là D = 60. Trong 500 ml dung dịch có 10 mg chất A.
c. Mỗi lần chiết chỉ sử dụng 10,0 ml dung môi hữu cơ thì
sau 5 lần chiết phần trăm A được tách vào pha hữu cơ bằng bao nhiêu? 5 q5 = 500 = 0,019 500+60×10
R(%) = 1−𝑞5 100 = 1−0,019 100 = 98,1% 1 1 14 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết 8.3.3 Độ chiết R
Bài tập: Chất tan A có hệ số phân bố giữa toluen và nước
là 3 (D = 3). Tính phần chất tan A còn ở trong pha nước
khi thực hiện chiết 100 ml dung dịch chứa chất tan A 0,010M với
(a) Một lần với 500 ml toluen
(b) Năm lần với mỗi lần là 100 ml toluen ĐS. (a) 6%; (b) 0.1% 15 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết
8.3.4. Hệ số tách và hệ số làm giàu
Để ước lượng khả năng tách hai chất A, B ra khỏi nhau
bằng quá trình chiết, người ta dùng hệ số tách χ
χ = 𝐷𝐴 = [𝐴]ℎ𝑐 : [𝐵]ℎ𝑐 (8-8) 𝐷𝐵 [𝐴]𝑛 [𝐵]𝑛
Nếu χ = 1, ta không thể thực hiện tách hai chất ra khỏi
nhau bằng quá trình chiết. Giá trị χ càng khác 1 bao nhiêu
thì việc tách càng thực hiện dễ dàng. 16 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết
8.3.4. Hệ số tách và hệ số làm giàu
Một tham số đặc trưng toàn diện hơn cho khả năng tách là hệ số làm giàu S.
Giả sử ta cần tách các chất A và B trong hỗn hợp ra khỏi nhau bằng
một quá trình nào đó. Người ta gọi hệ số làm giàu SB/A là tỉ số nồng
độ của chất A so với chất B trong pha hữu cơ lớn hơn tỉ số nồng độ
của chất A so với chất B trong dung dịch nước ban đầu. Giả sử 𝐶° ° 𝐴, 𝐶𝐵
là nồng độ các chất A và B trong nước ban đầu và [A]hc, [B]hc là nồng
độ các chất A và B trong pha hữu cơ sau khi quá trình chiết đạt trạng thái cân bằng. 𝐶°𝐴 ° ° ° S 𝐶𝐵 [𝐵]ℎ𝑐 [𝐵]ℎ𝑐 B/A = = 𝐶𝐴 = 𝐶𝐴 = 𝑅𝐵 (8-9) [𝐴]ℎ𝑐 𝐶° [𝐴] [𝐴] 𝐶° 𝑅 [ 𝐵] 𝐵 ℎ𝑐 ℎ𝑐 𝐵 𝐴 ℎ𝑐
Vì ta biết rằng RA = [𝐴]ℎ𝑐; R ; thay vào (8-9) 𝐶° B = [𝐵]ℎ𝑐 ° 𝐴 𝐶𝐵 SB/A = 𝐷𝐵(𝐷𝐴+1) (8-10) 𝐷𝐴(𝐷𝐵+1) 17 HUST SCE
8.3 Các đặc trưng định lượng của quá trình chiết
8.3.4. Hệ số tách và hệ số làm giàu
Tuy nhiên, quá trình chiết này không hoàn toàn thành công vì khi dùng quá
trình chiết này để tách A khỏi B thì dù rằng ta tách được 99,99% . A ra khỏi
nước, nhưng trong sản phẩm chiết vẫn còn một lượng khá lớn chất B (gần
10%) và theo (8-10) thì hệ số làm giàu của quá trình là:
Cũng với hệ số tách χ = 105, nhưng nếu DA = 102, DB = 10–3 thì:
Nghĩa là SB/A sẽ nhỏ hơn hai bậc. Trong trường hợp này chất A sẽ chuyển vào
pha hữu cơ 99%, còn chất B chỉ chuyển vào pha hữu cơ 0,1%. Vậy hệ số làm
giàu S phản ánh khả năng tách hai chất ra khỏi nhau thực chất hơn hệ số tách χ. 18 HUST SCE
8.4 Cân bằng trong hệ thống chiết
8.4.1 Cân bằng trong hệ thống chiết 1 bazơ hữu cơ
Giả sử 1 amin (1 bazơ hữu cơ) B, axit liên hợp với nó là BH+ B + H2O ⇋ BH+ + OH– Kb B [𝐵]ℎ𝑐 nước ⇋ Bhữu cơ Kphân bố = [𝐵]𝑛ướ𝑐
Giả sử BH+ chỉ nằm trong pha nước tức chỉ có B đi vào pha hữu cơ. D = [𝐵]ℎ𝑐
[𝐵]𝑛ướ𝑐+[𝐵𝐻+]𝑛ướ𝑐
Có [BH+]= 𝐻+ [𝐵] → D = 𝐾𝑝ℎâ𝑛 𝑏ố𝐾𝑎 = K 𝐾 phân bốαB (8-11) 𝑎 𝐾𝑎+ 𝐻+ 19 HUST SCE
8.4 Cân bằng trong hệ thống chiết
8.4.1 Cân bằng trong hệ thống chiết 1 bazơ hữu cơ
Ví dụ: giả sử rằng hệ số phân bố của một amin Kphân bố = 3,0
Nếu 50 ml dung dịch amin 0,010 M được chiết với 100 ml dung môi,
nồng độ của amin còn lại trong pha nước bằng bao nhiêu? Ở pH = 10,00 Ở pH = 8,00 20 HUST SCE




