














Preview text:
CHƯƠNG 8 CÁC PHƯƠNG PHÁP PHÂN TÍCH QUANG HỌC
8.1 PHƯƠNG PHÁP QUANG PHỔ HẤP THỤ PHÂN TỬ UV-VIS
8.1.1 Định luật BOUGHE - LAMBERT – BEER (Định luật Beer)
8.1.1.1 Biểu thức của định luật
Chiếu một chùm sáng có bước sóng xác định đi qua b lớp dung dịch. Do hấp thụ, sau
mỗi lớp dung dịch, ánh sáng giảm đi n lần. Gọi cường độ ánh sáng ban đầu là Io, sau I
khi đi qua lớp thứ nhất là I o 2 1 ta có: .
I Khi đi qua lớp thứ hai, ánh sáng giảm đi n 1 = n I I I
lần, ta có I = , toiếp tục với b lớp ta có I =hay o I o b = n 2 2 n n = n b I
Hình 8.1 Thí nghiệm đo quang
a)Sự hấp thụ ánh sáng khi đi qua dung dịch
b) Hai cuvet cùng chứa một lượng chất
màu được quan sát từ trên xuống
Lấy logarit hai vế, ta có: log = b.Il I
o og n = k b. Đại lượng log
ta gọi là độ hoấp thụ I I
quang A, k là hệ số, ta có: A= k.b (8.1)
Mặt khác, làm thí nghiệm với hai ống hình trụ có đường kính như nhau, có thể
quan sát dung dịch từ trên xuống (hình 8.1b). Trong mỗi ống nghiệm chứa lượng chất
màu như nhau, cùng loại, tuy nhiên thể tích dung dịch khác nhau: dung dịch một có
chiều cao h1, dung dịch 2 có chiều cao h2; h1>h2. Như vậy, nồng độ dung dịch 1 nhỏ hơn dung dịch 2, ta có: K C1b1 = K C2 b2
C1, C2 là nồng độ của dung dịch 1 và 2; b1, b2 là số lớp dung dịch 1 và 2. Do cùng một
chất màu nên hệ số phụ thuộc bản chất chất màu K của hai dung dịch như nhau.
Tiến hành với nồng độ dung dịch C1 nhỏ hơn C2 n lần, tuy nhiên số lớp chất màu
lại tăng n lần nên tích số K.C.b không đổi.
Khi thay dung dịch thứ hai bằng chất màu khác, sao cho hai dung dịch 1 và 2 có
cùng nồng độ, và số lớp chất màu, C1= C2 và b1= b2. Tuy nhiên, lúc này K1 khác K2 cho
nên độ hấp thụ quang khác nhau, ta có phương trình: K1C b ¹ K2 C b (8.2)
Như vậy độ hấp thụ quang của một chất màu phụ thuộc vào:
• Bản chất của chất màu với hệ số K tương ứng
• Nồng độ chất màu, C
• Chiều dày lớp hấp thụ, b
Kết hợp cả (8.1) và (8.2), hệ số k trong 8.1 là hằng số phụ thuộc cả hai yếu tố là nồng
độ và bản chất của chất, ta có biểu thức: A=ε bC (8.3)
Đây là biểu thức của định luật Boughe Lambe Beer, thường gọi tắt là định luật
Beer. Hệ số k hay e là đại lượng phụ thuộc bản chất của chất hấp thụ quang, còn gọi là
hệ số hấp thụ phân tử. C là nồng độ dung dịch chất hấp thụ quang, b là chiều dày lớp
hấp thụ; có thể phát biểu: “Độ hấp thụ quang (A) của một chất trong dung dịch phụ
thuộc vào hệ số hấp thụ phân tử e của chất đó, phụ thuộc nồng độ chất và chiều dày lớp hấp thụ dung dịch”
Một khái niệm khác là độ truyền qua, T: I T = Io -logT = I 1 0 log -εCb = ε. h C.aby T =10 ; A = l og I T
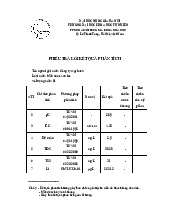
Thí dụ 8.1 Một mẫu dung dịch chứa trong cuvet 1cm đo độ truyền qua đạt 80% ánh
sáng ở một bước sóng nhất định. Nếu độ hấp thụ quang của chất này cũng ở bước sóng
đó là 2,0 thì nồng độ chất là bao nhiêu.
Giải: Độ truyền qua là 0,8 hay phần trăm truyền qua đạt 80% nên T = 0,8. Theo định
nghĩa: log T = - ε.b.C hay log 1/T = ε.b.C, vậy theo đầu bài ta có
Log 1/T = 2,0 cm-1mol-1 .l .1 cm.C hay Log 1/0,8 = log 1,25 = 2 mol-1 l.C C = 0,10/2,0 = 0,05M/l
Thí dụ 8.2 Một dung dịch chứa 1,00mg ion (SCN-) trong 100 ml có độ truyền qua 70%
của tia tới so với mẫu trắng.
a) Độ hấp thụ quang (A) của dung dịch ở bước sóng này là bao nhiêu
b) Độ truyền qua là bao nhiêu nếu nồng độ dung dịch tăng 4 lần Giải: T = 0,70 a)
A = log 1/T = log 1/0,70= log 1,43 = 0,155 b) 0,155 = εb (0,010g/l) εb = 15,5l/g; vì vậy
A = 15,5 l/g (4 x 0,010g/l) = 0,620 Log 1/T = 0,620 Þ T = 0,240
8.1.1.2 Tính chất của hệ số hấp thụ phân tử, e
Trong biểu thức A = ebC, nếu C được biểu diễn bằng mol/l và b tính bằng cm
thì e là hệ số hấp thụ phân tử gam. Biểu thức trên cho thấy e có giá trị bằng A khi dung
dịch có nồng độ bằng 1M đo với cuvét có bề dày b = 1cm.
• Hệ số hấp thụ phân tử gam e đặc trưng cho bản chất hấp thụ ánh sáng và không
phụ thuộc vào thể tích dung dịch, bề dày lớp dung dịch và chỉ phụ thuộc vào l của
dòng sáng tới (I0). Do đó đại lượng e thường được coi là tiêu chuẩn khách quan quan
trọng nhất để đánh giá độ nhạy của phép định lượng trắc quang, e = f(l). • Thứ nguyên của e: Ta có: A e = (8.4) bC A e = = l /cm-1M-1 b(cm).C( l M/ )
8.1.1.3 Tính chất của độ hấp thụ quang A và áp dụng
a) Phổ hấp thụ quang A phụ thuộc bước sóng của ánh sáng tới.
Nếu chiếu những chùm sáng có bước sóng khác nhau đi qua dung dịch hấp thụ,
độ hấp thụ của dung dịch phụ thuộc nhiều vào bước sóng (hệ số hấp thụ phân tử e phụ
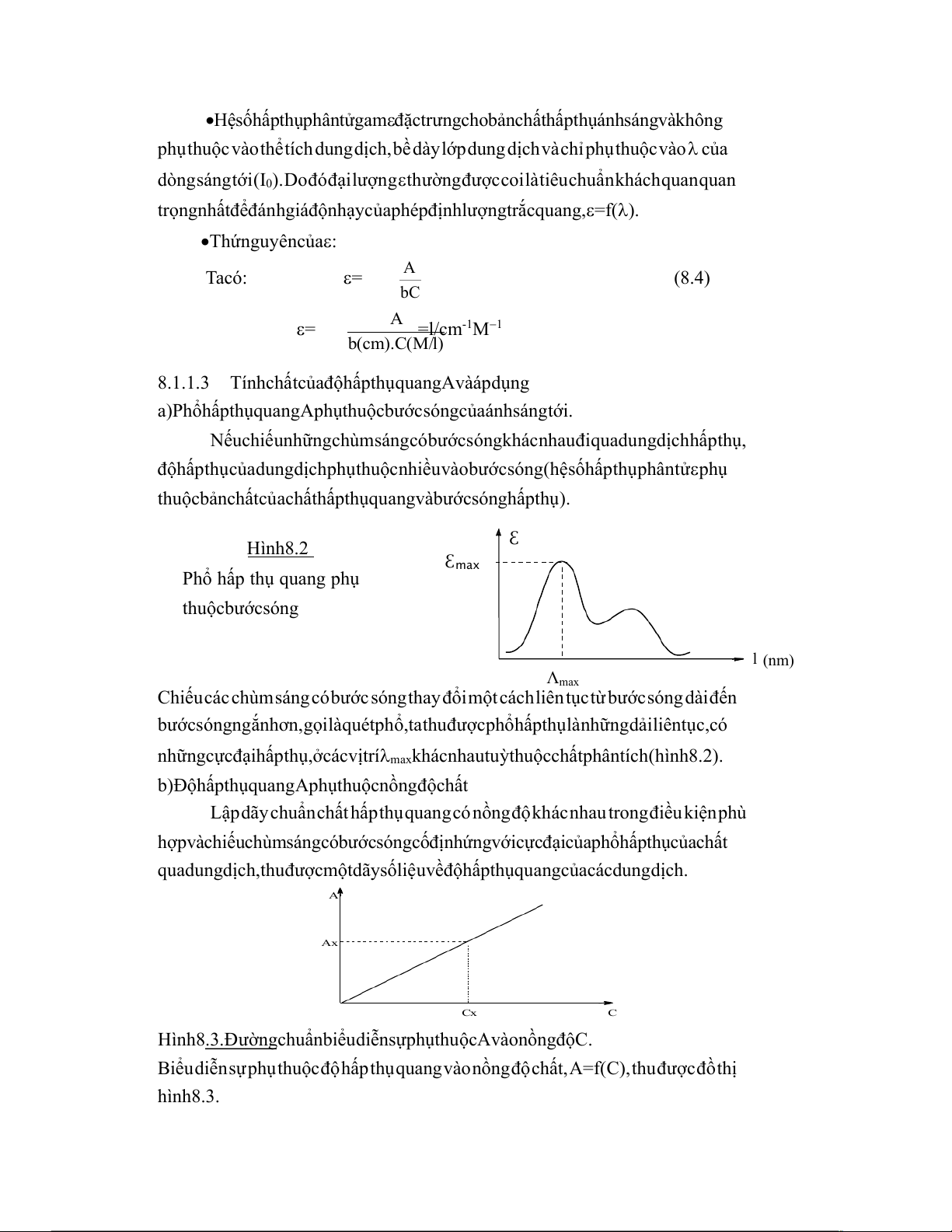
thuộc bản chất của chất hấp thụ quang và bước sóng hấp thụ). ℇ Hình 8.2 ℇmax
Phổ hấp thụ quang phụ
thuộc bước sóng l (nm) Λmax
Chiếu các chùm sáng có bước sóng thay đổi một cách liên tục từ bước sóng dài đến
bước sóng ngắn hơn, gọi là quét phổ, ta thu được phổ hấp thụ là những dải liên tục, có
những cực đại hấp thụ, ở các vị trí lmax khác nhau tuỳ thuộc chất phân tích (hình 8.2).
b) Độ hấp thụ quang A phụ thuộc nồng độ chất
Lập dãy chuẩn chất hấp thụ quang có nồng độ khác nhau trong điều kiện phù
hợp và chiếu chùm sáng có bước sóng cố định ứng với cực đại của phổ hấp thụ của chất
qua dung dịch, thu được một dãy số liệu về độ hấp thụ quang của các dung dịch. A Ax Cx C
Hình 8.3. Đường chuẩn biểu diễn sự phụ thuộc A vào nồng độ C.
Biểu diễn sự phụ thuộc độ hấp thụ quang vào nồng độ chất, A=f(C), thu được đồ thị hình 8.3.
c) Độ hấp thụ quang A có tính chất cộng tính
Nếu dung dịch có nhiều chất hấp thụ, mỗi chất có hệ số hấp thụ phân tử riêng,
có nồng độ riêng, được trộn trong một dung dịch chiều dày lớp hấp thụ b thì độ hấp thụ
quang của dung dịch ở một bước sóng nhất định là tổng các độ hấp thụ quang thành phần (hình 8.4):
A= e1C1b + e2 C2 b +…+ enCnb
d). Áp dụng định luật Beer xác định đồng thời các chất trong dung dịch
Hai chất P và Q có hai cực đại hấp thụ tại hai bước sóng l1max và l2max
Đo độ hấp thụ quang tại hai bước sóng trên, thu được hai đại lượng hấp thụ A1 và A2,
trong đó A1 và A2 đều là tổng của các đại lượng hấp thụ thành phần tại mỗi bước sóng.
Hình 8.4 Phổ hấp thụ của P và Q trong một dung dịch
Từ biểu thức định luật Beer, ta có: A1 = (eP, l1.CP + eQ, l1.CQ ) ℓ
A2 = (eP, l2.CP + eQ, l2.CQ ) ℓ
Do chiều dài lớp hấp thụ ℓ giống nhau, các giá trị eP, l1 ; eP, l2 ; eQ, l1 ; eQ, l2 đều
được xác định khi nghiên cứu chất chuẩn nên đã biết. Hai phương trình còn lại có hai
ẩn số (CP và CQ) nên dễ dàng tìm ra.
Thí dụ 8.3: P và Q tạo phức với thuốc thử X, tạo thành PX và QX có hai cực đại hấp
thụ ở 400nm và 500 nm, e tương ứng với mỗi nguyên tố như sau: 400 nm 500 nm e của phức PX
1.104 l /cm-1M-1 1.103 l /cm-1M-1 e của phức QX
1.103 l /cm-1M-1 1.104 l /cm-1M-1
Hoà tan hoàn toàn 0,10g mẫu, thêm chất che và thuốc thử rồi định mức đến 100
ml. Đo độ hấp thụ quang (A) ở hai bước sóng 400 nm và 500 nm, được các số liệu sau: A 4 3
400 = 1.10 CP + 1.10 CQ = 0,500 (8.5) A 3 4
500 = 1.10 CP + 1.10 CQ = 0,300 (8.6)
Tính hàm lượng P, Q trong mẫu biết MP = 65, MQ = 60.
Giải: Nhân hai vế của phương trình (8.6) với 10 ta có 1.104 C 3 P + 1.10 CQ = 0,500 (8.7) 1.104 C 4 P + 10.10 CQ = 3,00 (8.8)
Lấy 8.8 trừ 8.7 ta có 9,9.104CQ = 2.50 5 , 2 2 . 5 10- .560 1 . 0 . 0 Tính được C 5 , 2 0 Q = =2,525.10-5M Þ %Q = = 0 , 0 01 5 % 2 4 1 . 9 , 9 0 1000x 1 , 0 7 , 4 5 1 . 0 5 - 6 . 5 1 . 0 . 0 C -5 P = 4,75.10 M/l Þ %P = = 0 , 0 030 % 8 1000x 1 , 0
8.1.2 Những sai lệch của định luật BEER
a) Những dấu hiệu sai lệch
Độ hấp thụ quang A là hàm bậc nhất của bước sóng, nồng độ C và chiều dày lớp
dung dịch đo b: A = f(l, C, b). Khi cố định điều kiện đo về bước sóng, và chiều dày lớp
dung dịch (thường đo với cuvet 1cm) thì A=f(C), đây là sự phụ thuộc tuyến tính (hình
8.2). Khi sự phụ thuộc này không tuyến tính điều đó có nghĩa là có sự sai lệch. Đây là
dấu hiệu thứ nhất về sự sai lệch khỏi định luật Beer.
Dấu hiệu thứ hai là phổ hấp thụ của dung dịch chất hấp thụ quang ở những nồng
độ khác nhau phải có cực đại ở cùng một bước sóng (các điều kiện khác như pH, thành
phần dung giống nhau). Các dung dịch có thành phần giống nhau trừ chất hấp thụ quang
có thành phần khác nhau nhưng cực đại hấp thụ lệch nhau thì đây cũng là dấu hiệu của
sự không tuân theo định luật Beer.
b) Nguyên nhân
• Do ánh sáng không đơn sắc
Khi ánh sáng không đơn sắc chiếu qua chất hấp thụ quang, có nghĩa dòng sáng
tới có nhiều tia sáng với các bước sóng khác nhau, chất phân tích chỉ hấp thụ một số tia
sáng nhất định, tỷ lệ hấp thụ không đồng đều. Khi tăng nồng độ chất phân tích, một số
tia sáng đó có thể bị hấp thụ hoàn toàn trong khi một số tia sáng vẫn bị hấp thụ ít, thậm
chí không hấp thụ. Kết quả là thu được đường biểu diễn không tăng tuyến tính về độ
hấp thụ quang theo nồng độ (do các tia sáng không bị hấp thụ có cường độ đi ra (I)
không giảm khi tăng nồng độ).
• Chất hấp thụ quang có thành phần thay đổi
1. Chất hấp thụ quang không bền, thành phần thay đổi khi pha loãng dung dịch
Giả sử phức giữa kim loại M và thuốc thử X tạo thành phức hấp thụ quang MX,
có nồng độ C. Khi pha loãng dung dịch n lần, MX có nồng độ C/n.
Đo hấp thụ quang A của dung dịch ban đầu trong ống nghiệm theo chiều từ trên
xuống, được A1, sau khi pha loãng, đo A trong ống nghiệm có đường kính đúng bằng
ống nghiệm ban đầu và cũng quan sát từ trên xuống, tất nhiên chiều cao của dung dịch
tăng lên và lúc này dung dịch đo có chiều dày gấp n lần ống nghiệm ban đầu, được An.
Nếu chất màu bền, độ hấp thụ quang A1= An, (do e.C1V1 = e.CnVn). Trường hợp A1 >
An chứng tỏ chất màu bị phân ly khi pha loãng. Gọi a là độ phân ly của phức màu
MX, phương trình phân ly như sau: MX M + X (1-a)C aC aC K = [M][ = X] 1 K a2C ® K = a2C ® a = . (8.9) [MX] 1 - a C
Vậy khi chưa pha loãng độ phân li là K a1 = . C nK
Khi pha loãng n lần, độ phân li là K an = = (8.10) C / n C
Do độ sai lệch S là hiệu số của độ phân ly lần thứ n và ban đầu: S = K an - a1 = .( n - 1) (8.11) C
Biểu thức trên cho thấy độ sai lệch S tỷ lệ thuận với và , tỷ K lệ nghị nch với
C . Do đó muốn bị sai lệch ít thì phức phải bền hằng số phân ly K =0.
Để tránh sự phân ly của phức MX, biện pháp hiệu quả cao là giữ nồng độ thuốc thử X
không đổi trước và sau khi pha loãng dung dịch. Thông thường, nồng độ thuốc thử lớn
hơn nồng độ kim loại M nhiều lần và giữ không đổi, an = a1, S =0.
2. Ảnh hưởng của ion H+ (pH) tới sự hình thành phức màu.
Đa số các thuốc thử dùng trong phân tích phổ hấp thụ phân tử là những muối của axit hay bazơ: M + HX MX + H+
Khi tăng hoặc giảm nồng độ H+, đều làm cân bằng tạo MX thay đổi.
Trường hợp pH cao, kim loại M có thể bị thuỷ phân và kết tủa, mặt khác X ở trạng thái
X-, như vậy, phức có thể ở trang thái đa phối tử (thí dụ phức Fe(III)- salixilic ở pH 1-3
hình thành phức 1:1 FeSal+ có màu tím, khi tăng pH lên 4, một nửa phức có 2 phối tử,
FeSal -2 có màu đỏ; Đến pH 9, phức chuyển sang dạng 3 phối tử, FeSal3 có màu vàng).
Trường hợp nồng độ H+ cao, pH thấp, HX tồn tại nhiều, phức màu MX cũng hình
thành ít. Người phân tích cần chọn ra pH phù hợp cho việc hình thành phức màu vừa
đảm bảo phức MX hình thành tốt, độ chính xác và độ lặp lại cao.
3 Ảnh hưởng của các cấu tử lạ
Các cấu tử lạ là cation
Kí hiệu cấu tử lạ là ion kim loại M’, nó cũng tác dụng với thuốc thử X tạo hợp
chất màu M’X tương tự MX. Như vậy, hợp chất này cũng hấp thụ quang, làm sai lệch
kết quả đo. Để tránh hiện tượng này, phải chọn thuốc thử X có hằng số bền với M cao
hơn với M’ (hằng số bền lớn hơn 104 lần thì không ảnh hưởng). Trường hợp thuốc thử
là anion của axit yếu, cần sử dụng nồng độ H+ làm phương tiện để che. Cấu tử lạ là anion
Khi có các anion (A) phản ứng với kim loại M cần phân tích, nó làm cho phức
màu MX hình thành không hoàn toàn, đôi khi nếu nồng độ anion lạ lớn, bền thì phức
MX không hình thành. Để loại trừ ảnh hưởng của các anion có 3 khả năng chính:
+ Chọn thuốc thử X tạo phức tốt với M (có thể áp dụng cả kỹ thuật che, pH…)
để phức MA không hình thành.
+ Thêm vào dung dịch chất chuẩn một lượng anion lạ tương đương. Trường hợp
này ảnh hưởng của cấu tử lạ đến chất phân tích và chất chuẩn là như nhau, kết quả đo
được so sánh với nồng độ chất có trong mẫu chuẩn, từ đó tính ra nồng độ của nó.
+ Tách loại các anion trước khi cho thuốc thử X vào mẫu.
8.1.2.1 Phân tích định lượng bằng phương pháp UV-VIS
a) Phương pháp đường chuẩn
Để phân tích định lượng chất, trước hết người phân tích phải chuẩn bị chất chuẩn,
thí dụ để phân tích Ni trong một mẫu nước, phải chuẩn bị dung dịch Ni có nồng độ
chính xác được pha chế từ muối Ni tinh khiết.
Thực hiện phương pháp đường chuẩn bằng cách lập một dãy dung dịch chuẩn của
chất phân tích (Ni) có nồng độ phù hợp cùng với điều kiện cần thiết như pH, chất tạo
phức v.v. Đo độ hấp thụ quang của dãy dung dịch này và dựng đường chuẩn. Tiếp theo,
đưa mẫu phân tích về cùng điều kiện như với dãy chuẩn đã thiết lập và đo độ hấp thụ
quang của nó. Từ số liệu độ hấp thụ quang của mẫu, áp vào đường chuẩn để tìm ra nồng
độ chất phân tích. Phương pháp đường chuẩn có ưu điểm là tiện lợi, dễ sử dụng, kinh
tế, có thể áp dụng cho hàng loạt mẫu. Tuy nhiên phương pháp cũng gặp khó khăn khi
thiết lập dãy chuẩn có điều kiện hoàn toàn giống mẫu thực tế. A, S
Hình 8.5 Đường chuẩn xác định mẫu phân tích Ax A = C .tgα x x A x Þ C a x = tgα Cx C
b) Phương pháp thêm chuẩn
Phương pháp thêm chuẩn là phương pháp thêm một lượng chính xác chất chuẩn
vào mẫu phân tích. Để thực hiện phương pháp này, ngay từ đầu sau khi lấy mẫu, chia
mẫu làm hai phần, một phần được thêm một lượng chất chuẩn nhất định còn phần còn
lại không thêm chuẩn. Tiến hành các bước xử lý mẫu và đo hai mẫu song song, sau đó
so sánh với kết quả hai phép đo để tính nồng độ chất phân tích. S,h
Hình 8.6 Phương pháp thêm chuẩn Ax+Ast. Δ A A A x x Þ = C = .Δ x C A Δ C Δ x DA C x A D D C
A là hiệu độ hấp thụ quang mẫu thêm chuẩn
và không thêm, DC là nồng độ chất chuẩn Cx Cx+Cst. C thêm vào.
Do mẫu thêm chuẩn và không thêm chuẩn được xử lý và đo trong cùng điều kiện,
hơn nữa có thành phần nền đồng nhất nên tránh sai số. Để tính kết quả theo phương
pháp này, biểu diễn các kết quả đo bằng đồ thị ở hình 8.7. Nếu thêm những lượng khác
nhau vào một dãy chất phân tích sau đó dựng đường chuẩn và tính ra nồng độ chất phân
tích theo phương pháp ngoại suy.
8.1.3 Máy quang phổ hấp thụ phân tử UV-VIS
8.1.3.1 Các loai cấu hình máy đo UV-VIS
Phương pháp quang phổ hấp thụ phân tử UV-VIS có ưu điểm rõ nét so với các
phương pháp phân tích công cụ khác ở chỗ thiết bị gọn, dễ trang bị cho các phòng thí
nghiệm. Tuy nhiên hạn chế của phýõng pháp là giới hạn phát hiện ðạt khoảng 10-6M
đối với các chất có hệ số hấp thụ phân tử cỡ 104. Phương pháp cũng gặp khó khăn khi
xác định đồng thời nhiều chất, đặc biệt là trong trường hợp mẫu có nhiều tạp chất không kiểm soát được.
Nếu phân loại theo khả năng phân tích của máy, có chia các máy đo quang phổ
hấp thụ phân tử UV-VIS thành hai loại theo thứ tự đặt cuvet trong máy. Loại thứ nhất
đã được sử dụng từ nửa đầu thế kỷ 20 có bộ đơn sắc đặt trước cuvet trên đường đi của
chùm sáng tới; loại thứ hai mới được sử dụng ở cuối thế kỷ 20, loại này có bộ đơn sắc
mà ngày nay chủ yếu là cách tử đặt ở sau cuvet. Điểm khác biệt cơ bản của 2 loại máy
này là khả năng phân tích của nó. Loại thứ nhất là phân tích đơn chất, nếu có đa chất
thì rất hạn chế, trong khi loại thứ 2 có khả năng phân tích cùng một lúc nhiều chất.
Hình 8.7 Sơ đồ chức năng máy UV-VIS
Loại máy thứ hai có năng lực làm việc rất lớn do sử dụng hàng ngàn diode ở sau
cách tử nên có thể theo dõi cùng một lúc được nhiều chất ở nhiều bước sóng khác nhau.
Để thuận tiện cho việc sử dụng, người ta còn chế tạo máy có 2 chùm tia, một chùm hoàn
toàn giống trong sơ đồ trên, chùm thứ hai được tách ra từ chùm chính để đi tới cuvet so sánh.
Năng lực của máy UV-VIS còn được thể hiện ở khả năng phân giải phổ, các máy
càng phân giải phổ tốt, năng lực phân tích càng cao. Bởi lẽ những tia sáng càng đơn sắc,
khả năng phân biệt chất càng tốt hay tính chọn lọc càng cao, đồng thời độ nhạy cũng cao hơn.
Chúng ta còn trở lại vấn đề máy đo UV-VIS trong phần detector của máy sắc ký lỏng hiệu năng cao.
8.1.3.2 Máy đo UV-VIS hai chùm tia Nguồn sáng
Để phép đo có độ nhạy và độ chọn lọc cao, nguồn sáng cần được chon phù hợp về cường
độ và vùng phổ. Đối với phép đo UV-VIS, sử dụng nguồn liên tục, trong đó phép đo
UV được sử dụng đèn Dơteri, đèn khí Ar, Xe hay đèn Hg (180-320nm) còn phép đo
VIS sử dụng đèn sợi đốt W (320-1000nm).
Hình 8.8 Sơ đồ chức năng máy đo UV-VIS hai chùm tia
1- Nguồn sáng
; 2- Bộ phận đơn sắc; 3- Bán gương; 4 Gương; 5- Cuvet
mẫu; 6- Dung dịch so sánh; 7,8 - Nhân Quang- Điện; 9 Xử lý tín hiệu
Khe sáng thường được đặt ở đầu vào và đầu ra của đường quang học, có tác dụng tăng
cường tính chọn lọc và độ nhạy của phép đo. Trong một phép phân tích căn cứ vào vùng
phổ (λ) chất phân tích mà chọn đèn và khe sáng. Do tiêu cự của thấu kính cố định n ĝên
độ rộng khe đo tỷ lệ thuận với bước sóng, λ của chùm sáng hấp thụ; w = k λ.
Cách đo phổ
Mỗi loại máy đo UV-VIS, có phần cấu tạo và chức năng riêng từ đó các vận hành
của mỗi loại máy khác nhau, điều đó được thể hiên trong phần điều khiển máy (phần
mềm) do hãng chế tạo đặt ra. Với máy hai chùm tia, dung dịch mẫu đo (5) là dung dịch
chứa chất phân tích và tất các các hóa chất khác cần thiết cho phép đo như dung dịch
đệm, thuốc thử, dung môi...; dung dịch so sánh cũng chứa tất cả các hóa chất cần thiết
như dung dịch mẫu đo, tuy nhiên không có chất phân tích. Như vậy căn cứ vào độ lệch
của hai tín hiệu đo, từ đó máy cho ta trị số tín hiệu của chất phân tích.
Hai phương pháp thông thường để xác định thành phần phức (kim loại và thuốc
thử) là đồng phân tử gam và biến thiên một thành phần. Tuy nhiên khi đã biết thành
phần phức, người phân tích luôn pha chế dung dịch đo có nồng độ thuốc thử cao hơn so
với yêu cầu của phản ứng để hạn chế sự phân ly của phức, giảm sai số.
8.2 PHƯƠNG PHÁP QUANG PHỔ PHÁT XẠ NGUYÊN TỬ
8.2.1 Sự xuất hiện phổ phát xạ nguyên tử
Chúng ta biết rằng nguyên tử bao gồm hạt nhân mang điện tích dương và lớp vỏ
electron mang điện tích âm bao quanh và chuyển động trong các orbital khác nhau. Hạt
nhân nguyên tử có thể tích nhỏ (khoảng một phần vạn thể tích nguyên tử) nhưng chiếm
hầu như toàn bộ khối lượng của nguyên tử. Electron là hạt vi mô, sự có mặt của nó trong
nguyên tử để trung hòa điện tích hạt nhân, nó chịu sức hút của hạt nhân. Tuy nhiên vai
trò của electron còn là tham gia lai hóa, tạo liên kết giữa các nguyên tử. Sự chuyển động
của electron quanh hạt nhân cũng như khi lai hóa tuân theo quy luật của các hạt vi mô.
Nguyên tố hóa học bao gồm nhiều nguyên tử cùng loại và chính hạt nhân nguyên tử và
hệ electron làm nên sự khác biệt giữa các nguyên tố hóa học cũng như hợp chất của chúng.
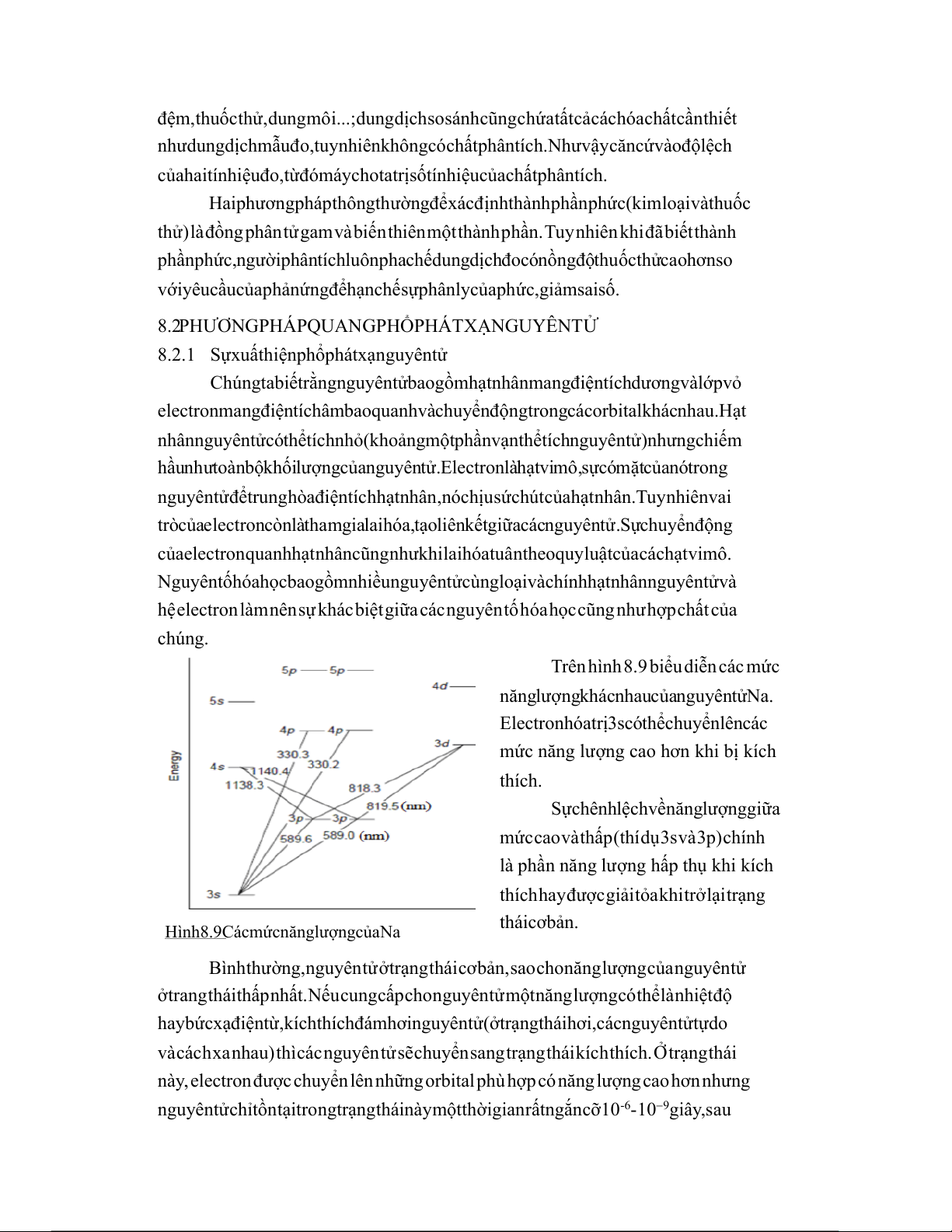
Trên hình 8.9 biểu diễn các mức
năng lượng khác nhau của nguyên tử Na.
Electron hóa trị 3s có thể chuyển lên các
mức năng lượng cao hơn khi bị kích thích.
Sự chênh lệch về năng lượng giữa
mức cao và thấp (thí dụ 3s và 3p) chính
là phần năng lượng hấp thụ khi kích
thích hay được giải tỏa khi trở lại trạng Hình
thái cơ bản.
8.9 Các mức năng lượng của Na
Bình thường, nguyên tử ở trạng thái cơ bản, sao cho năng lượng của nguyên tử
ở trang thái thấp nhất. Nếu cung cấp cho nguyên tử một năng lượng có thể là nhiệt độ
hay bức xạ điện từ, kích thích đám hơi nguyên tử (ở trạng thái hơi, các nguyên tử tự do
và cách xa nhau) thì các nguyên tử sẽ chuyển sang trạng thái kích thích. Ở trạng thái
này, electron được chuyển lên những orbital phù hợp có năng lượng cao hơn nhưng
nguyên tử chỉ tồn tại trong trạng thái này một thời gian rất ngắn cỡ 10-6- 10-9 giây, sau
đó nó trở về trạng thái ban đầu bền vững. Từ trạng thái kích thích trở về trạng thái ban
đầu, đồng thời với việc giải toả ra năng lượng mà nó đã hấp thụ.
Năng lượng giải tỏa khi nguyên tử chuyển từ trạng thái kích thích về trạng thái
cơ bản được phát ra dưới dạng bức xạ. Phương pháp sử dụng kỹ thuật đo bức xạ giải
tỏa của nguyên tử khi chuyển trạng thái này gọi là phương pháp quang phổ phát xạ nguyên tử.
Mỗi nguyên tử của nguyên tố hóa học có cấu tạo riêng, năng lượng hấp thụ và
giải tỏa của mỗi loại nguyên tử sẽ khác nhau, thể hiện ở bước sóng phát xạ nhất định và
gián đoạn, là cơ sở để phân biệt các nguyên tố hóa học. Điều này thể hiện bằng các số
sóng phát xạ khác nhau, thí dụ chênh lệch gữa hai mức 3s và 3p của Na khi phát xạ sóng
có bước sóng khoảng 589nm (màu vàng) trong khi chênh lệch giữa hai mức 3s và 4p
cho bức xạ có bước sóng khoảng 330nm.
Phổ phát xạ của mẫu phân tích thường có 3 thành phần:
- Phổ vạch là phổ của nguyên tử và ion chuyển từ trạng thái kích thích về trạng thái cơ
bản, có bước sóng trong vùng UV-VIS (190-1000nm).
- Phổ đám là phổ phát xạ của phân tử và nhóm phân tử, thí dụ MeO, CO và CN, chúng
thường có hai phần đậm mầu ở phía sóng dài và nhạt màu ở phía sóng ngắn. Phố dám
thường có nhiều ở vùng khả kiến.
- Phổ liên tục gây ra do vật rắn bị đốt nóng, phổ của ánh sáng trắng và phổ do bức xạ
riêng của điện tử. Phổ liên tục cũng mờ ở vùng sóng ngắn và đậm ở vùng sóng dài.
8.2.2 Định luật cơ bản của phổ phát xạ nguyên tử
Cường độ vạch phổ, I liên hệ với số nguyên tử N đã bị kích thích phổ trong
plasma bằng phương trình Schaibe Lomakin: I = KN
Mặt khác, không phải có bao nhiêu nguyên tử chất phân tích thì có bấy nhiêu
nguyên tử bị kích thích, số nguyên tử N trong plasma liên hệ với nồng độ C của chất
phân tích bằng biểu thức sau: N = KaCb
trong đó, Ka là hằng số thực nghiệm, phụ thuộc vào các điều kiện hoá hơi và nguyên tử
hoá mẫu; còn b được gọi là hằng số bản chất, phụ thuộc vào từng vạch phổ của từng
nguyên tố. Giá trị của b £ 1; ứng với mỗi vạch phổ đều có một giá trị ngưỡng C = C0,
với nồng độ C > C0 thì b luôn nhỏ hơn 1 và C < Co thì b =1. Kết hợp cả hai phương
trình trên ta có phương trình Schaibe Lomakin biểu diễn theo nồng độ như sau: I = aCb
trong đó: a - hằng số thực nghiệm, phụ thuộc vào các điều kiện nguyên tử hoá mẫu, C
là nồng độ chất phân tích, b là hằng số thực nghiệm. Khi C < C0 thì b = 1 và khi C ³ C0
thì b < 1 (C0 gọi là ngưỡng nồng độ của vùng tuyến tính).
Vì vậy, để có sự phụ thuộc tuyến tính giữa I và C người ta thường dùng phương
pháp phổ phát xạ để phân tích những chất có hàm lượng nhỏ.
Phương trình trên là phương trình cơ bản dùng trong phân tích định lượng bằng
phổ phát xạ nguyên tử.
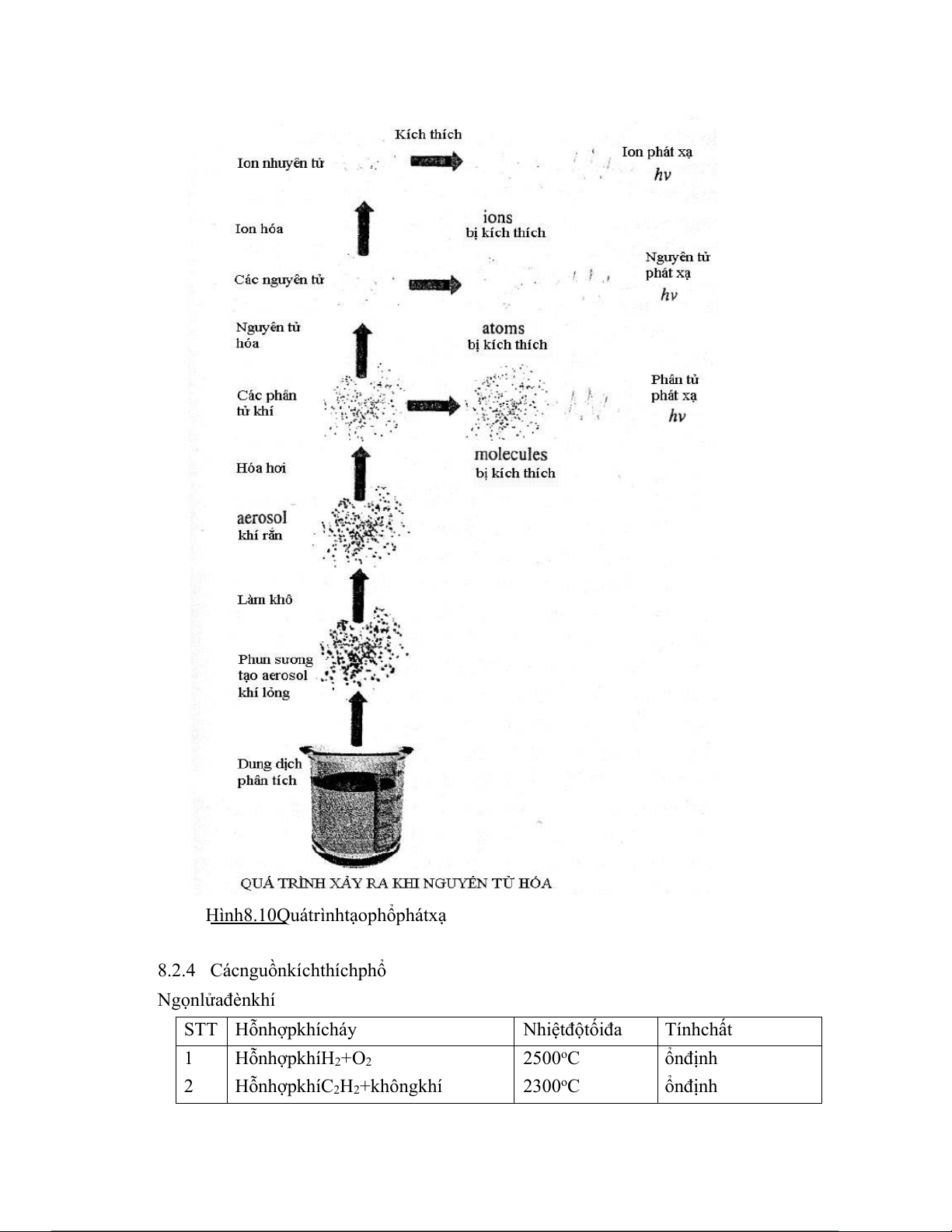
8.2.3 Quá trình quang phổ phát xạ nguyên tử
Hình 8.10 Quá trình tạo phổ phát xạ
8.2.4 Các nguồn kích thích phổ
Ngọn lửa đèn khí STT Hỗn hợp khí cháy Nhiệt độ tối đa Tính chất 1 Hỗn hợp khí H2 + O2 2500oC ổn định 2
Hỗn hợp khí C2H2 + không khí 2300oC ổn định 3 Hỗn hợp khí C2H2 + O2 2900oC ổn định 4
Hỗn hợp khí dixianogen + O2 3000oC ổn định
Dùng nguồn kích thích là ngọn lửa đèn khí có ưu điểm là cho phép ta chọn được
nhiệt độ kích thích tuỳ ý và nhiệt độ khá ổn định; song có nhược điểm là cường độ vạch
phổ thay đổi rất nhiều khi thay đổi thành phần hỗn hợp mẫu phân tích và ảnh hưởng của nền (matrix).
Hình 8.11 Nguồn kích thích phổ phát xạ F-AES ngọn lửa đèn khí
Hồ quang điện
Đặt một điện áp cao khoảng 220V vào hai cực than đối diện nhau, cách nhau một
khoảng 4 mm thì xuất hiện sự phóng điện giữa hai cực, với dòng điện 1-30 ampe. Đây
là hiện tượng hồ quang điện, đồng thời với việc tăng nhiệt độ tại vùng hồ quang lên rất
cao (4000-6000oC). Tại đây, mẫu phân tích thường chứa trong một phía điện cực, sẽ
chuyển thành hơi rồi bị kích thích quang phổ. Vùng này người ta gọi là plasma gồm các
nguyên tử, các ion, các electron và cả phân tử, đây là môi trường phát xạ.
Có hai loại hồ quang điện thường dùng là: Hồ quang điện một chiều và Hồ quang điện
xoay chiều. Về bản chất hai loại này đều như nhau, tuy nhiên điều khác biệt là một bên
dùng điện áp phân cực, một chiều còn bên kia là điện áp xoay chiều. Hồ quang điện một
chiều đảm bảo độ nhạy tốt; nhưng do nhiệt độ cao nên cực làm bằng than sẽ bị ăn mòn
nhanh. Hồ quang điện xoay chiều có vạch phổ tạo ra chủ yếu là các vạch phổ nguyên
tử độ lặp lại tốt, luôn được dùng trong phân tích định lượng.
Tia lửa điện
Tia lửa điện là sự phóng điện giữa hai điện cực có thế hiệu rất cao (10000-50000V)
nhưng có dòng rất nhỏ (<1A). Sự phóng điện giữa hai điện cực là gián đoạn (50-300
chu kỳ trong một giây), do đó điện cực không bị đốt nóng đỏ.
Tia lửa điện là nguồn kích thích phổ có năng lượng tương đối cao (nhiệt độ ở tâm
plasma lên đến 4000 - 7000oC) nên phổ phát xạ của ion là chủ yếu. Tia lửa điện là nguồn
kích thích tương đối ổn định và có độ lặp lại cao, song có độ nhạy kém hồ quang điện,
cho nên thời gian ghi phổ phải dài hơn hồ quang. Phổ phát xạ trong plasma tia lửa điện
cũng giống như trong hồ quang điện nhưng do nhiệt độ của plasma cao nên sự tạo thành
các hợp chất kém bền nhiệt ít gặp hơn trong hồ quang điện.
Plasma cao tần cảm ứng (ICP- Inductively Coupled Plasma)
Nguồn năng lượng cao tần là nguồn năng lượng đặc biệt, sinh ra từ phát cao tần
cung cấp năng lượng cho cuộn cảm cao tần ở đầu miệng đèn nguyên tử hoá mẫu, tạo ra
plasma có nhiệt độ rất cao để hoá hơi mẫu, nguyên tử hoá và kích thích phổ. Nhiệt độ
ở tâm plasma khi dùng nguồn cao tần tới 5000-10000oC (hình 8.13). Nhờ nhiệt độ cao
này, hầu hết các mẫu phân tích được hoá hơi và nguyên tử hoá được với hiệu suất cao,
tạo phổ phát xạ ion là chủ yếu. Dùng nguồn kích thích ICP thì phép phân tích có độ
nhạy rất cao (10-4- 10-6 %) và độ ổn định tốt, nên sai số của phép phân tích nhỏ.
Cấu tạo nguồn ICP gồm:
- Máy phát cao tần HF, thường làm việc ở tần số
27,12 MHz dùng để cung cấp năng lượng cho cuộc
cảm cao tần ở đầu miệng đèn nguyên tử hóa mẫu.
- Mộ phận nguyên tử hóa mẫu gồm bộ phận tạo sol
khí mẫu và đèn nguyên tử hóa mẫu.(tourch
burner). Đèn nguyên tử hóa mẫu có cấu tạo là 3
ống thạch anh lồng vào nhau. Ống trong cùng có
nhiệm vụ dẫn khí mang cùng mẫu vào plasma, ống
thứ hai tạo khí plasma, ống ngoài cùng có nhiệm
vụ làm lạnh. Phía bên ngoài ống thứ ba là cuộn
cảm cao tần bằng đồng, được nối với máy phát cao
tần. Cuộn cảm này cũng được làm lạnh bằng nước.
Dòng khí trong 3 ống thạch anh, có thể toàn bộ Ar
Hình 8.12 Nguồn plasma cao tần
tổng lưu lượng là 13-18 lit/phút.
cảm ứng (tourch burner) Trong đó: - Khí mang 0,7-1 l/phút - Khí plasma 6-8 l/phút
- Khí làm lạnh 5-9 l/phút
8.2.5 Thiết bị quang phổ phát xạ nguyên tử
Ngày nay nhờ tiến bộ của khoa học kỹ thuật, máy quang phổ phát xạ nguyên tử
(AES) được cải thiện nhiều về năng lực làm việc của máy cũng như thiết kế. Nếu trước
đây vào giữa thế kỷ 20, máy AES chủ yếu dùng cho định tính, còn định lượng rất hạn
chế - bán định lượng, thì ngày nay các máy AES có thể định lượng với độ chính xác
cao, có thể đạt 10-4- 10-6%.
Hầu như tất cả các phần của máy đều được cải tiến, tuy nhiên góp phần nâng cao
năng lực của máy chủ yếu gồm:
- Nâng cao độ phân giải phổ, các máy hiện nay có thể phân biệt các bức xạ khác
nhau tới 1-2nm. Đây là cải tiến cơ bản để định tính cũng như định lượng chính xác chất phân tích.
- Nguồn kích thích phổ, với nguồn kích thích tốt, hiệu suất nguyên tử hóa cao là
tiền đề để nâng cao độ nhạy của phương pháp.
- Hệ điện tử và các công cụ toán học để xử lý số liệu Nguồn kích Nguyên tử hoá và Phân giải Khuếch đại thích quang phổ kích thích quang phổ phổ và ghi phổ Hoá hơi mẫu
Hình 8.13 Sơ đồ máy quang phổ phát xạ nguyên tử
1 Ngọn lửa kích thích phổ 2- Thấu kính 3- Khe đo
4- Cách tử tạo tia đơn sắc 5- Xử lý tín hiệu
Chất phân tích được đưa vào vùng nhiệt độ cao bằng dòng khí mang. Tại đây, nhờ
nhiệt độ cao, chúng hóa hơi, nguyên tử hóa, kích thích và phát xạ. Bức xạ phát đi từ đèn
ngọn lửa 1 (hình 8.14) khi nguyên tử từ trạng thái kích thích trở về trạng thái cơ bản
được chuyển tới bộ phận chuẩn trực 2 và khe đo 3 sau đó tới bộ phận phân giải phổ 4.
Tại đây bức xạ có bước sóng xác định của chất phân tích được chọn và đưa tới bộ phận
xử lý tín hiệu 5 để định tính và định lượng chất phân tích.
8.2.6 Ứng dụng của phương pháp.
• Phục vụ sản xuất công nghiệp và nông nghiệp (phân tích nguyên liệu, sản phẩm và
phân tích trong dây chuyền)
• Phục vụ điều tra khai thác mỏ trong địa chất
• Phục vụ nghiên cứu thiên văn học, vũ trụ
• Phân tích môi trường
• Phục vụ các ngành khác như hình sự, bảo tàng, thể thao...
Phân tích định tính
Định tính dựa vào vạch phổ đặc trưng: vạch đặc trưng của 1 nguyên tố là vạch
phổ chỉ xuất hiện đối với nguyên tố đó, nó mất đi sau cùng khi nồng độ của nguyên tố
giảm dần tới 0. Mỗi nguyên tử hoặc ion sẽ có những vạch phổ đặc trưng riêng, dựa vào
những vạch phổ đặc trưng đó, ta có thể phát hiện được các nguyên tố có trong mẫu phân tích.
Trong thực tế, đôi khi các nguyên tố có vạch trùng nhau, xen lấn nhau. Điều này
còn tùy số lượng vạch phổ của một phép đo. Nhìn chung số lượng vạch phổ tỷ lệ thuận
với năng lượng kích thích. Để phân tích lượng vết và siêu vết, phải dùng năng lượng
kích thích lớn; điều này cũng đồng nghĩa tăng số lượng vạch phổ, việc chọn vạch đặc
trưng càng khó khăn. Sau đây là một vài biện pháp loại trừ hoặc hạn chế vạch trùng:
- Chọn năng lượng kích thích phù hợp (nếu nồng độ nguyên tố đủ lớn, chọn
năng lượng kích thích thấp để hạn chế các vạch phổ xen lấn của tạp chất)
- Chọn môi trường kích thích phổ phù hợp, ngày nay một phương pháp rất có
hiệu quả là sử dụng môi trường khí trơ (Ar)
- Chọn thời điểm ghi phổ phù hợp, có thể có các chất dễ bay hơi là tạp chất,
như vậy ghi phổ muộn là biện pháp hữu hiệu.
- Thêm vào mẫu các chất che, chất tạo hợp chất khó bay hơi với tạp chất.
- Sử dụng máy quang phổ có độ phân giải cao. Thực tế cho thấy độ phân giải
của máy càng cao, vạch trùng càng it.
- Chọn hai vạch đặc trưng thay cho một vạch.
Phương pháp chọn vạch đặc trưng để định danh nguyên tố ngày nay được áp
dụng cho hầu hết các máy quang phổ. Thí dụ Li có vạch đặc trưng ở 670,8 nm (đỏ) và
610,3 nm (da cam), Na có vạch đặc trưng ở 589,3 nm (vàng), K có 2 vạch đặc trưng ở
768,2 nm (đỏ) và 704,4 nm (tím) …
Phân tích định lượng
Hai phương pháp áp dụng phân tích định lượng là đường chuẩn và thêm chuẩn.
a) Phương pháp đường chuẩn
Điều kiện sử dụng phương pháp đường chuẩn:
• Các mẫu đầu phải có trạng thái vật lí và thành
phần hoá học như mẫu phân tích.
• Mẫu đầu và mẫu phân tích phải được xử lí trong cùng một điều kiện.
• Các mẫu đầu phải bền vững theo thời gian.
• Nồng độ của mẫu phân tích phải nằm trong
Hình 8.14. Đồ thị chuẩn xác
khoảng tuyến tính nồng độ của dãy chuẩn trong
định bằng phương pháp thêm cùng điều kiện.
b) Phương pháp thêm chuẩn
Nguyên tắc định lượng chất phân tích bằng phương pháp thêm chuẩn hoàn toàn
tương tự phương pháp quang phổ hấp thụ phân tử. Chuẩn bị 2 dung dịch đo trong đó
một dung dịch có chứa chất phân tích đã thêm một lượng chất phân tích chuẩn vào với
nồng độ đã biết còn một dung dịch không thêm. Ghi phổ của 2 mẫu, có độ hấp thụ quang
A1 ứng với mẫu không thêm là nồng độ Cx, A2 tương ứng nồng độ Cx+s từ đó tính ra
nồng độ chất phân tích.
Hình 8.15. Đồ thị chuẩn xác định bằng
phương pháp thêm Δ Δ Δ .A C A = hay C C = 1 C A x Δ x 1 A 8.3
PHƯƠNG PHÁP QUANG PHỔ HẤP THỤ NGUYÊN TỬ
(Atomic Absorption Spectrometry- AAS)
8.3.1 Sự xuất hiện phổ hấp thụ nguyên tử
Bình thường, nguyên tử ở trạng thái cơ bản, bền vững sao cho mức năng lượng
thấp nhất có thể, tuy nhiên khi nhận năng lượng từ ngoài từ các nguồn khác nhau, nó
trở thành trạng thái kích thích. Khi ở trạng thái kích thích, nguyên tử dễ dàng giải phóng
năng lượng dưới dạng bức xạ chỉ sau thời gian rất ngắn (khoảng 10-6-10-9 giây) để trở
về trạng thái cơ bản. Vấn đề này đã được đề cập trong phần quang phổ phát xạ nguyên
tử. Tuy nhiên trong phần này, ta quan tâm đến khía cạnh hấp thụ năng lượng của nguyên
tử. Khi các nguyên tử ở trạng thái tự do trong một đám hơi, nếu ta chiếu chùm bức xạ
có bước sóng xác định đúng với bước sóng mà chúng có thể phát ra khi ở trạng thái
kích thích vào đám hơi nguyên tử tự do, thì chúng hấp thụ bức xạ đó. Quá trình này gọi
là quá trình hấp thụ năng lượng của nguyên tử tự do ở trạng thái hơi để tạo ra phổ hấp
thụ nguyên tử của nguyên tố.
Như vậy trong phân tích quang phổ hấp thụ nguyên tử, công việc trước tiên là
chuyển các nguyên tố phân tích thành đám hơi nguyên tử tự do. Ở trạng thái này, các
nguyên tử là các hạt vi mô không nhận những năng lượng bất kỳ, phần năng lượng nhận
được phải phù hợp về cả về độ lớn, đó là những lượng tử để rồi trở thành trạng thái kích
thích. Trong phương pháp quang phổ hấp thụ nguyên tử, người ta sử dụng một nguồn
năng lượng là các bức xạ có bước sóng xác định, được phát ra từ nguồn đèn catot rỗng
và quan tâm tới phần bị nguyên tử tự do hấp thụ. So sánh phần còn lại của chùm sáng
đơn sắc ban đầu, là cơ sở để định lượng nguyên tố có trong mẫu.
Nghiên cứu sự phụ thuộc cường độ dòng ánh sáng bị hấp thụ của một nguyên tố
vào nồng độ C của nguyên tố đó trong mẫu phân tích, người ta thấy rằng trong phổ hấp
thụ nguyên tử vùng nồng độ C nhỏ, mối quan hệ giữa cường độ của tia sáng bị hấp thụ
và nồng độ của nguyên tố đó trong đám hơi cũng tuân theo định luật Lambert-Beer.
8.3.2 Định luật quang phổ hấp thụ nguyên tử
Độ hấp thụ quang A phụ thuộc vào nồng độ nguyên tử biểu thị qua số nguyên tử
N trong môi trường hấp thụ và vào bề dày của lớp hấp thụ. Trong máy đo phổ hấp thụ
nguyên tử, chiều dày của đèn nguyên tử hóa hay cuvet grafit là không đổi, nên gía trị
độ hấp thụ quang A chỉ còn phụ thuộc vào số nguyên tử N trong môi trường hấp thụ,
tức là: A = k.N, trong đó k là hệ số thực nghiệm, phụ thuộc vào bản chất nguyên tử,
nhiệt độ của môi trường hấp thụ và bề dày của lớp hấp thụ.
Giữa số nguyên tử N trong môi trường hấp thụ với nồng độ C của nguyên tố
trong mẫu phân tích có mối quan hệ với nhau. Mối quan hệ này rất phức tạp, nó phụ
thuộc vào các điều kiện nguyên tử hóa mẫu, thành phần vật lý, hóa học của mẫu phân
tích. Nhiều kết quả thực nghiệm chỉ ra rằng, trong một giới hạn nhất định của nồng độ
C, mối quan hệ giữa N và C được biểu thị bằng biểu thức: N = kiCb
trong đó ki, là hằng số thực nghiệm. Hằng số này phụ thuộc vào tất cả các điều kiện hóa
hơi và nguyên tử hoá mẫu. b được gọi là hằng số bản chất, nó phụ thuộc vào nguyên tố
và bước sóng của dòng sáng, b có gía trị £ 1; b = 1 khi nồng độ C nhỏ. Ứng với mỗi
bước sóng, mỗi nguyên tố có một gía trị C = C0 là giới hạn, bắt đầu từ C ³ C0 thì b <
1. Kết hợp các biểu thức trên ta có: A = aCb trong đó a là hằng số thực nghiệm, phụ
thuộc vào tất cả các điều kiện thực nghiệm để nguyên tử hoá mẫu như đã nói ở trên.
Chính do thực tế này mà trong phép đo định lượng một nguyên tố bằng phương pháp
hấp thụ nguyên tử phải luôn luôn giữ các điều kiện nguyên tử hóa mẫu ổn định và không
đổi trong mọi thí nghiệm. Phương trình trên khi nồng độ C nhỏ hơn nồng độ ngưỡng C0 thì b = 1 nên ta có A = aC
Phương trình này được gọi là phương trình biểu diễn luật cơ bản của phép đo
hấp thụ nguyên tử và phép đo này chỉ dùng để xác định nồng độ nhỏ thì b mới bằng 1
và trong điều kiện đó A mới phụ thuộc tuyến tính vào C.
8.3.3 Quá trình quang phổ hấp thụ nguyên tử
Hình 8.16 Quá trình tạo phổ hấp thụ nguyên tử
8.3.4 Các phương pháp nguyên tử hóa mẫu
Nguyên tử hóa mẫu theo phương pháp ngọn lửa
Theo kỹ thuật này, dùng năng lượng nhiệt của ngọn lửa đèn khí để hóa hơi và
nguyên tử hóa mẫu phân tích. Ngọn lửa cần có 5 yêu cầu cơ bản sau:
1. Ngọn lửa làm khô mẫu phân tích, hóa hơi và nguyên tử hóa mẫu với hiệu suất cao.
2. Năng lượng nhiệt của ngọn lửa phải lớn và điều chỉnh được theo yêu cầu riêng của từng nguyên tố.
3. Ngọn lửa phải tinh khiết, không có ra các áng sáng phụ để ảnh hưởng tới phép đo.
4. Bề dày ngọn lửa lớn để tạo ra môi trường hấp thụ có tiết diện lớn (thường 2-10cm)
5. Tiêu tốn it mẫu phân tích. Bảng sau đưa ra một vài loại ngọn lửa đèn khí.