










Preview text:
Phần III: Các phương pháp tách
Chương 9. Giới thiệu về phương pháp
tách trong Hóa phân tích Tran Thi Thuy
Department of Analytical Chemistry
School of Chemical Engineering – Hanoi University of Science and Technology (HUST)
Năm 1903, M. Tswett đầu tiên áp dụng sắc ký hấp phụ để
tách các sắc tố thực vật, bằng cách sử dụng một dung môi
hydrocarbon và bột inulin (carbohydrate) làm pha tĩnh. Sự
tách của các đám màu dẫn đến tên “sắc ký”, từ chromatos
từ tiếng Hy Lạp, có nghĩa là "màu sắc". Tswett sau đó thấy
rằng CaCO3 hoặc sucrose cũng có thể được sử dụng làm pha tĩnh. 2 HUST SCE Outline 9.1. Định nghĩa
9.2. Phân loại sắc ký
9.3. Các đại lượng đặc trưng của sắc ký 9.4. Hiệu quả tách
9.5. Ứng dụng phương pháp sắc ký 8.6 Câu hỏi ôn tập 9/22/2020 2 HUST SCE 9.1. Định nghĩa
Nguyên lý hoạt động của sắc ký như quá trình chiết nhưng
một pha được giữ cố định và một pha động di chuyển qua pha cố định này.
Chất lỏng đi vào cột gọi là dung môi rửa giải. Chất lỏng đi
ra khỏi cột gọi là dung môi giải hấp. Quá trình mà chất
khí hay chất lỏng đi qua cột sắc ký gọi là quá trình rửa
giải. Cột sắc ký được nhồi với các hạt có kích thước nhỏ
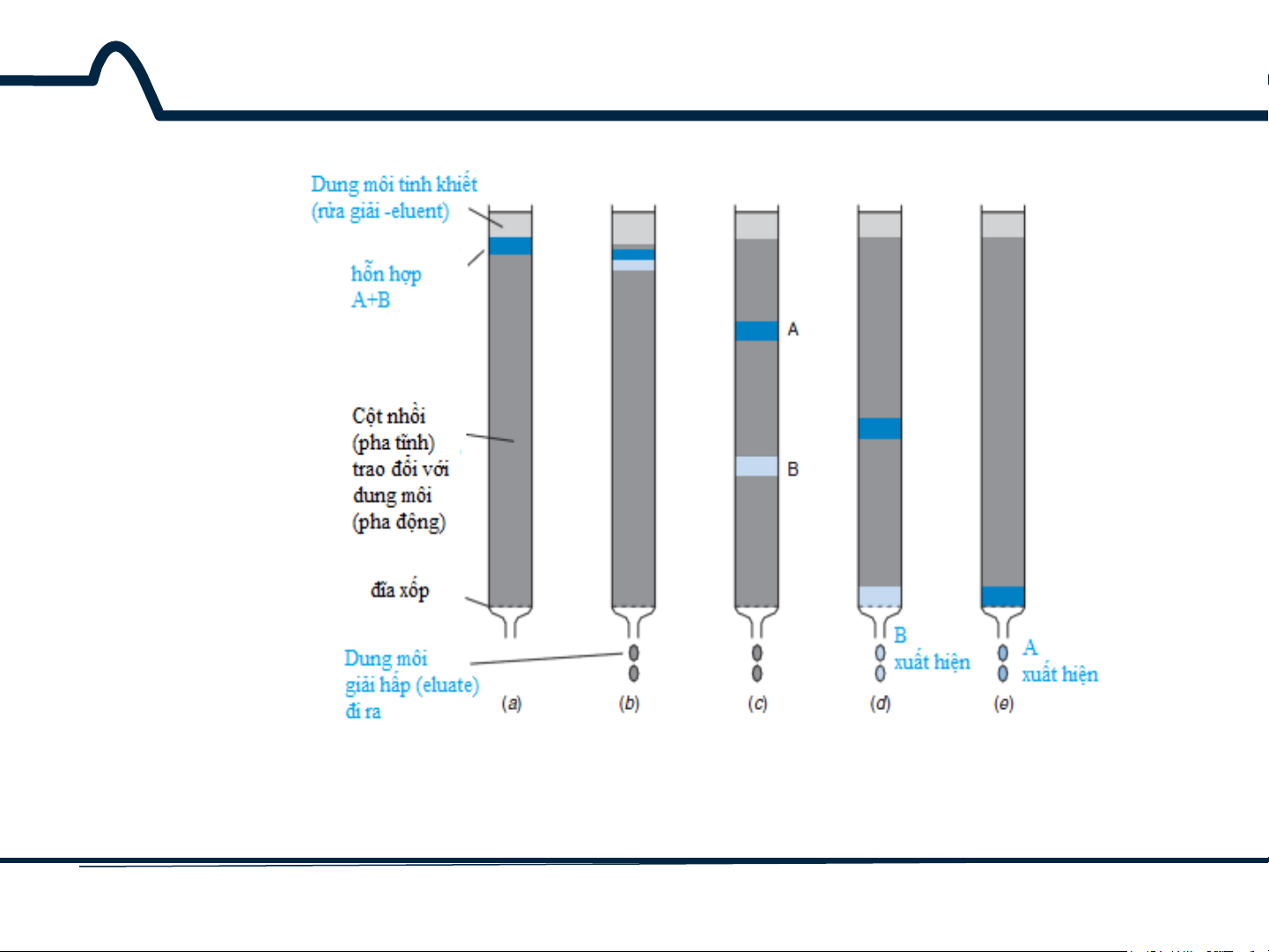
như được chỉ ra ở hình vẽ 9-1. 4 HU ST SCE 9.1. Định nghĩa
Hình 9-1. Ý tưởng đằng sau sắc ký: chất tan A có độ hấp phụ lớn
hơn đối với pha tĩnh so với chất tan B, lưu lại trên cột lâu hơn. 5 HUST SCE
9.2. Phân loại sắc ký
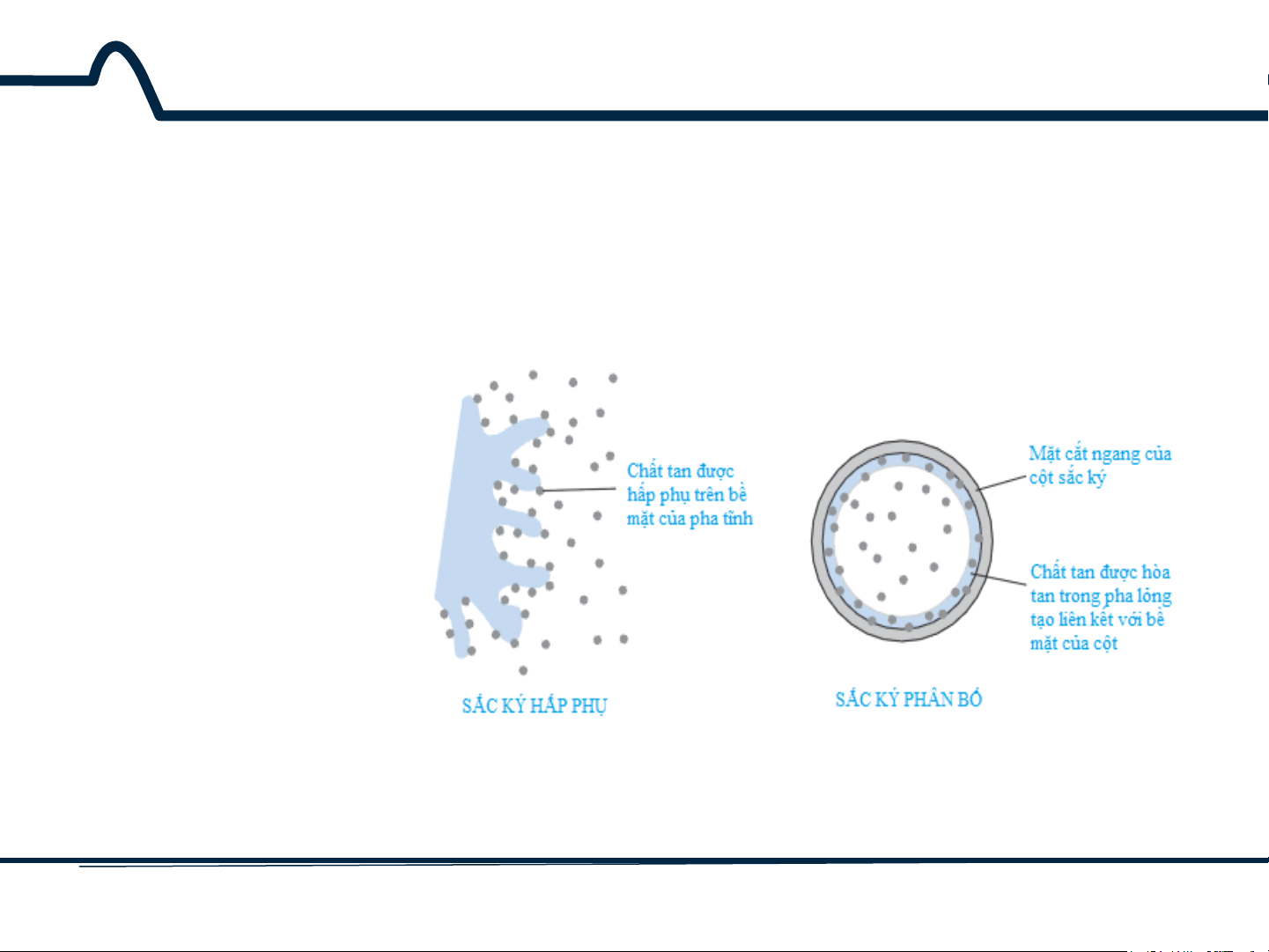
- Sắc ký hấp phụ: Pha tĩnh là chất rắn, pha động là chất lỏng hay khí.
Chất tan được hấp phụ trên bề mặt của các hạt rắn. Các chất tan được
hấp phụ càng mạnh thì nó càng di chuyển chậm ở trong cột (hình 9-2). - Sắc ký phân bố: Pha tĩnh là chất lỏng
được liên kết với bề mặt rắn, thường là SiO2. Pha động thường là chất khí. Cân bằng của chất tan giữa với pha tĩnh và pha động được thiết lập trong sắc ký khí (hình 9-2).
Hình 9-2. Sắc ký hấp phụ và sắc ký phân bố 6 HUST SCE
9.2. Phân loại sắc ký
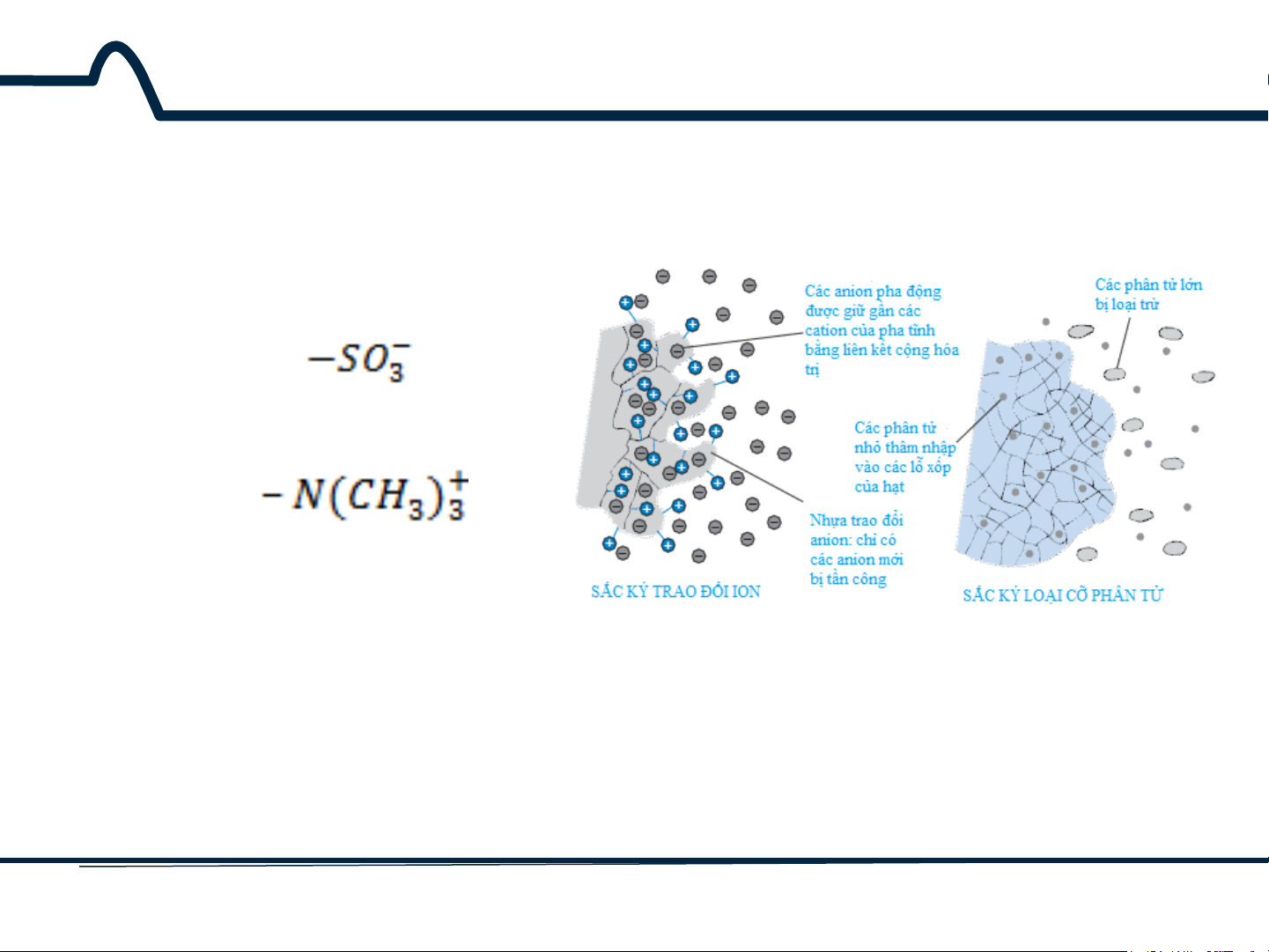
-Sắc ký trao đổi ion: Các loại
nhựa trao đổi ion, ví dụ nhựa trao đổi anion hay nhựa trao đổi cation
được liên kết với pha tĩnh bằng
liên kết cộng hóa trị. Pha động
là các chất lỏng chứa các ion
chất tan có điện tích trái dấu
Hình 9-3. Sắc ký trao đổi ion và sắc
được liên kết với pha tĩnh bởi ký loại cỡ phân tử
lực tĩnh điện (hình 9-3). 7 HUST SCE
9.2. Phân loại sắc ký
- Sắc ký loại cỡ phân tử: còn
được gọi là sắc ký lọc gel hay
sắc ký thẩm thấu gel. Kỹ thuật
sắc ký này cho phép tách các
phân tử dựa trên kích thước
của nó. Các chất tan có kích
thước lớn hơn sẽ đi qua cột
nhanh chóng. Trong trường hợp
lý tưởng của sắc ký loại cỡ phân
tử, sẽ không có tương tác giữa
pha động và chất tan. Pha động
là chất khí hay lỏng sẽ đi qua
gel xốp. Các lỗ xốp là đủ nhỏ
để loại các phân tử chất tan có
Hình 9-3. Sắc ký trao đổi ion và sắc
kích thước lớn. Các phân tử lớn ký loại cỡ phân tử
không cần thâm nhập vào các
lỗ xốp. Do vậy, các phân tử nhỏ
sẽ cần nhiều thời gian hơn để đi qua cột (hình 9-3). 8 HUST SCE
9.2. Phân loại sắc ký
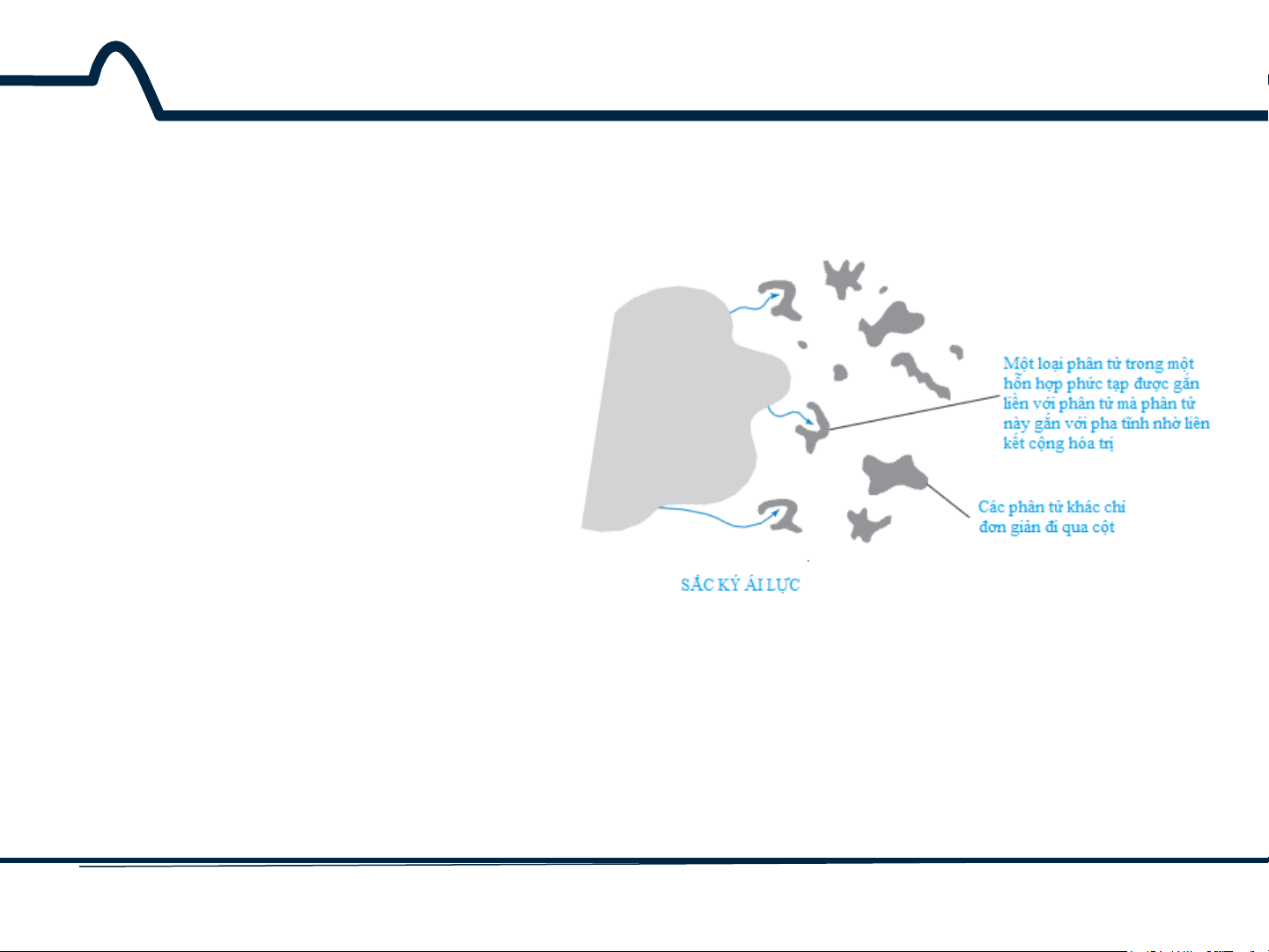
- Sắc ký ái lực: Đây là loại sắc
ký có độ chọn lọc cao nhất sử
dụng sự tương tác chọn lọc
giữa phân tử chất tan và một
phân tử thứ hai, phân tử gắn
với pha tĩnh nhờ liên kết cộng
hóa trị. Ví dụ, các phân tử bất
động có thể là một kháng thể
với một loại protein cụ thể. Khi
có một hỗn hợp chứa hàng
nghìn protein đi qua cột, chỉ có
một protein là phản ứng với
kháng thể liên kết của cột. Tất
cả các chất tan khác được rửa
Hình 9-4. Sắc ký ái lực
sạch từ cột, protein cần tách sẽ
được tách ra bằng cách thay
đổi độ pH hoặc cường độ ion (hình 9-4). 9 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
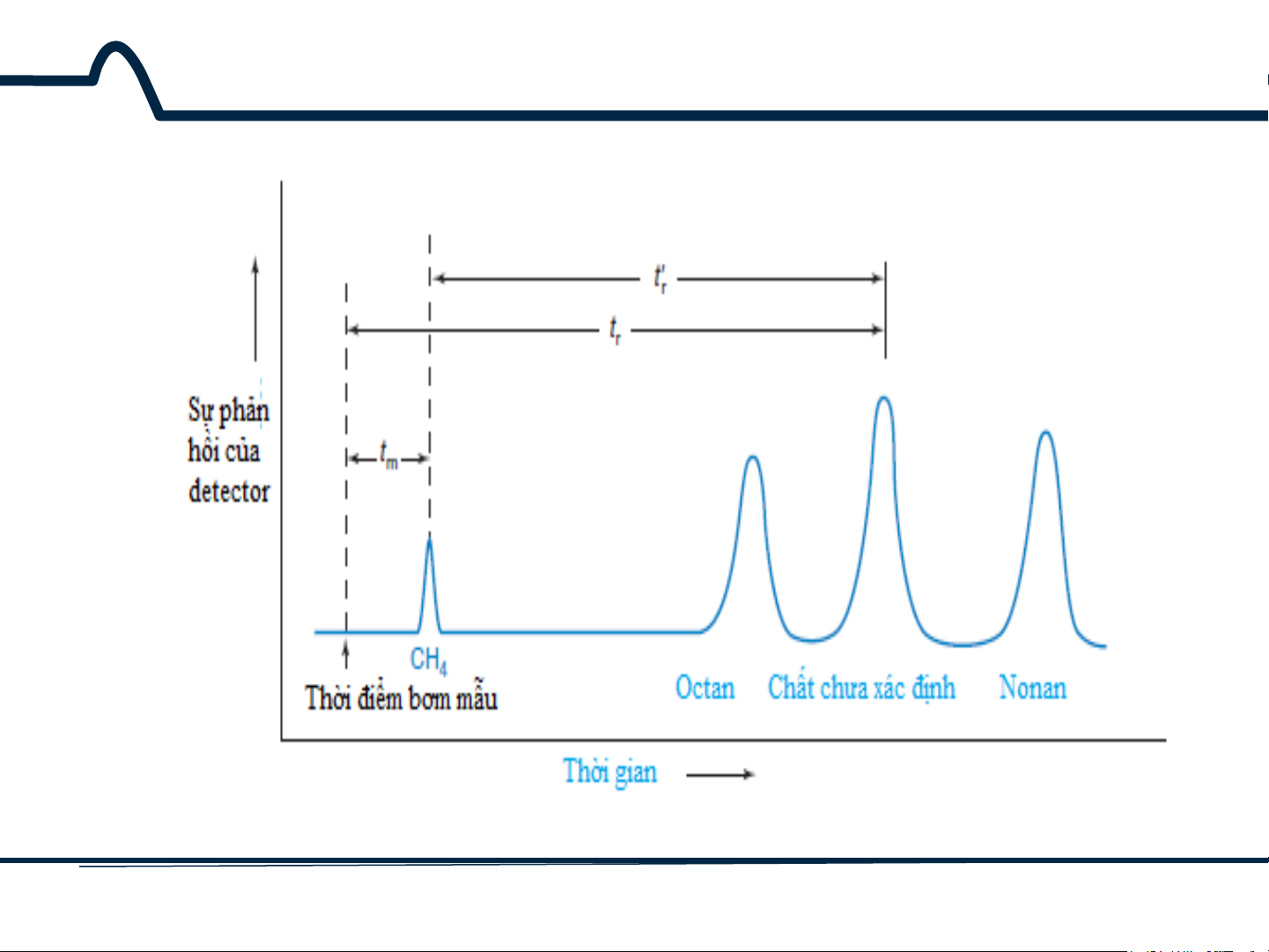
Hình 9-5. Sơ đồ sắc ký khí ái lực theo thời gian lưu. 10 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
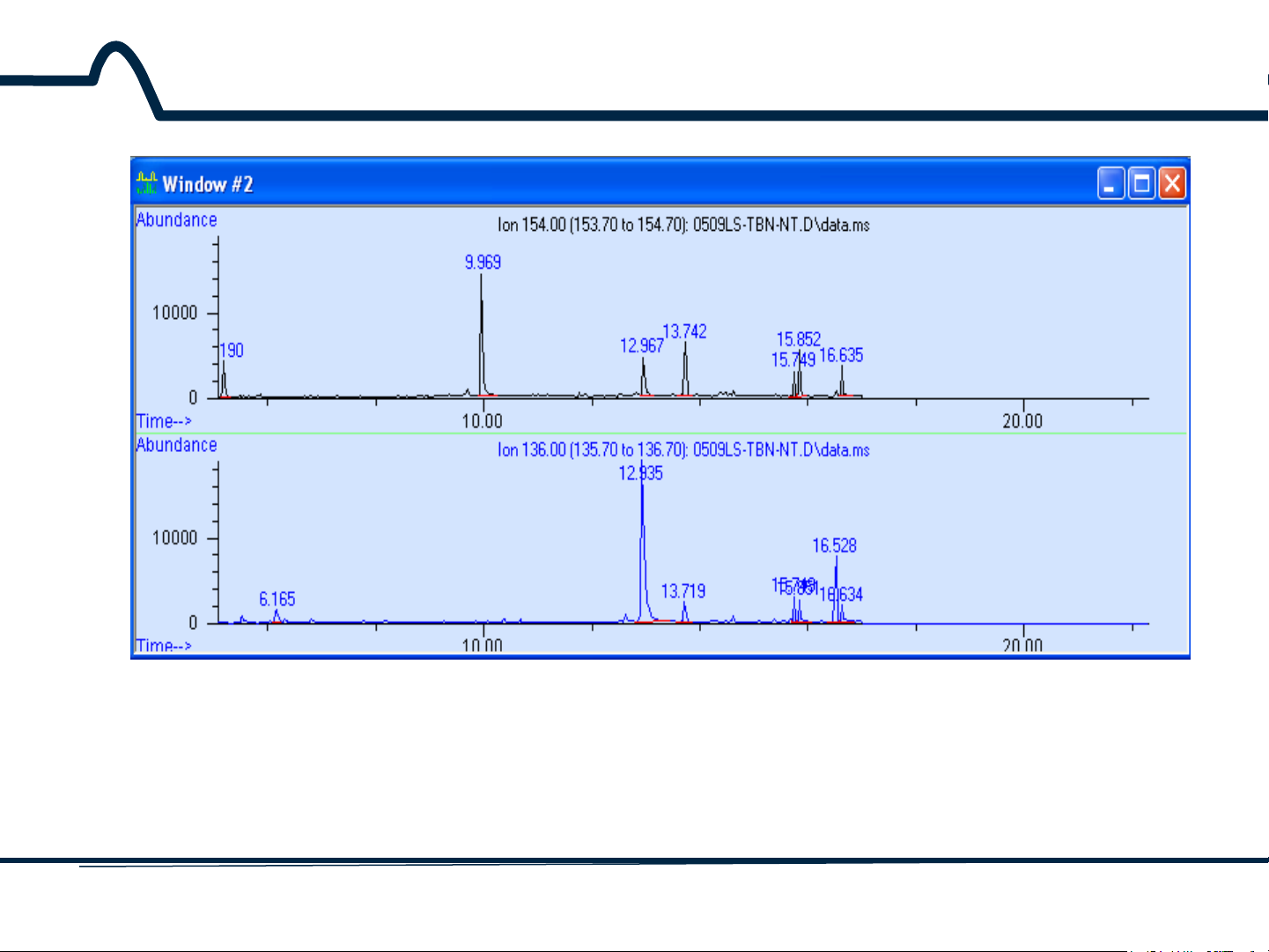
Hình 9-6. Sắc ký đồ phân tích mẫu nước tiểu của một
người có methamphetamin (MA) ở tr = 9,96 phút 11 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
Thời gian lưu, tr , của mỗi cấu tử là thời gian cần thiết để cấu tử tiếp
cận được với detector kể từ lúc nó được bơm vào cột.
Thể tích lưu, Vr , là thể tích của pha động cần thiết để rửa giải một chất tan ra khỏi cột.
Thời gian lưu hiệu chỉnh, tr‘ của một chất tan là thời gian cần thiết để
chất tan di chuyển theo chiều dài cột trừ đi thời gian cần thiết để dung môi đi qua cột. (9-1)
Pha động chuyển động dọc theo cột khi không có chất tan với thời
gian tm. Trong sắc ký khí, tm thường được lấy là thời gian cần thiết để
CH4 chuyển động qua cột. 12 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
Với hai cấu tử bất kỳ 1 và 2, sự lưu tương đối, là tỉ số giữa thời gian
lưu hiệu chỉnh của chúng (9-2)
Sự lưu tương đối càng lớn, khả năng tách giữa hai cấu tử ra khỏi
nhau càng lớn. Sự lưu tương đối không phụ thuộc vào tốc độ chảy và
vì vậy có thể được sử dụng để xác định pic khi tốc độ chảy thay đổi. 13 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
Đối với mỗi pic trên sắc ký đồ, thừa số dung tích, k’, được định nghĩa: (9-3)
Các cấu tử được lưu lại trong cột lâu hơn nếu thừa số
dung tích càng lớn. Để theo dõi hiệu suất của cột sắc ký,
tốt nhất là kiểm tra và đo thừa số dung tích, số đĩa và tính
đối xứng của pic. Việc thay đổi các tham số này chỉ ra sự
giảm hiệu suất của cột. 14 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký 9.3.1. Sắc ký đồ
Ví dụ về các tham số lưu:
Một hỗn hợp gồm benzen, toluen và metan được bơm vào cột sắc ký khí. Metan cho tín
hiệu ở 42s, benzen ở 251s và toluen bị rửa giải ở 333s. Hãy xác định thời gian lưu hiệu
chỉnh và thừa số dung tích cho mỗi chất tan và sự lưu tương đối. Giải
Thời gian lưu hiệu chỉnh:
Sự lưu tương đối được diễn tả dưới dạng tỉ số giữa thời gian lưu hiệu chỉnh của toluen và benzen: 15 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký
9.3.2. Mối quan hệ giữa thời gian lưu và hệ số phân bố
Thừa số dung tích ở phương trình 9-3 là tương đương với: (9-4)
ở đây Cs là nồng độ chất tan trong pha tĩnh, Vs là thể tích của pha
tĩnh, Cm là nồng độ của chất tan trong pha động và Vm là thể tích của pha động.
Tỉ số Cs/Cm là tỉ số nồng độ của chất tan trong pha tĩnh và pha động.
Nếu cột được chuyển động đủ chậm để đạt cân bằng, tỉ số Cs/Cm là
hệ số phân bố, K, được giới thiệu trong chương chiết. Do đó, chúng ta
có thể biểu diễn phương trình 9-4 dưới dạng: (9-5) 16 HUST SCE
9.3. Các đại lượng đặc trưng của sắc ký
9.3.2. Mối quan hệ giữa thời gian lưu và hệ số phân bố
Do , sự lưu tương đối có thể diễn đạt: (9-6)
Điều này có nghĩa là sự lưu tương đối của hai chất tan tỉ lệ với tỉ số
của hệ số phân bố của chúng. Mối liên hệ này là cơ sở vật lý của phương pháp sắc ký.
Thể tích lưu,Vr , là thể tích của pha động cần thiết để rửa giải một
chất tan cụ thể ra khỏi cột: Thể tích lưu: Vr = tr×uv (9-7)
ở đây uv là tốc độ chảy của pha động (thể tích trên đơn vị thời gian).
Thể tích lưu của một chất tan cụ thể là không đổi trong một phạm vi của tốc độ chảy. 17 HUST SCE
9.4. Hiệu quả tách
9.4.1. Độ phân giải
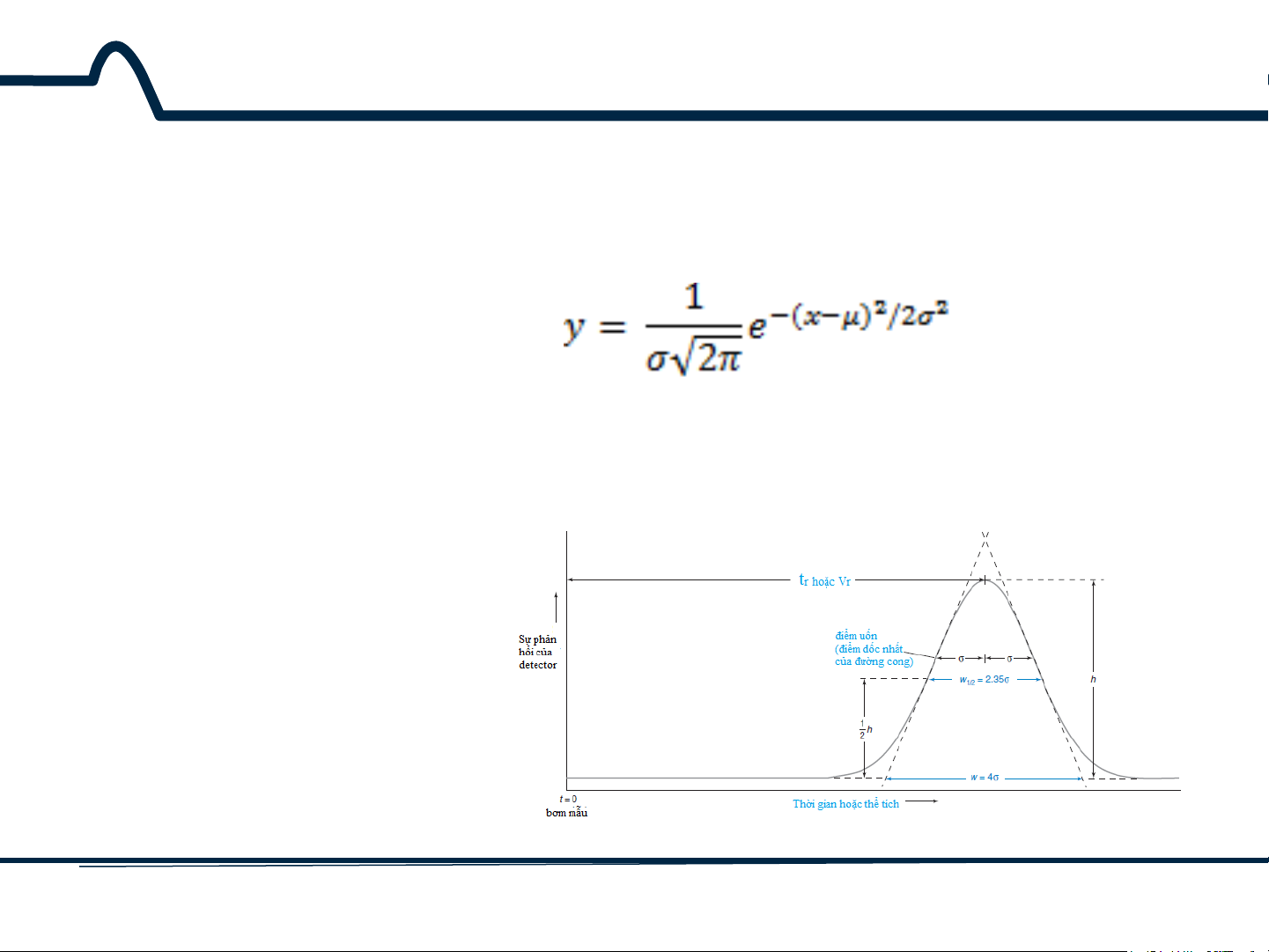
Các chất tan chuyển động qua cột sắc ký có xu hướng phân bố như đường cong Gauxơ
với độ lệch chuẩn σ (hình 9-6). Thời gian sử dụng để di qua cột càng dài, thì pic sắc ký
càng tù. Thông thường người ta đo độ rộng ở độ cao bằng một nửa chiều cao pic w1/2.
Từ phương trình đường cong Gauxơ
có thể thấy là w1/2 = 2.35σ và w = 4σ.
Hình 9-6. Đường cong Gauxơ lý tư ởng để đo w và w1/2. Các
giá trị của w là thu được
bằng cách ngoại suy các tiếp
tuyến với các điểm uốn xuống đường cơ sở. 18 HUST SCE
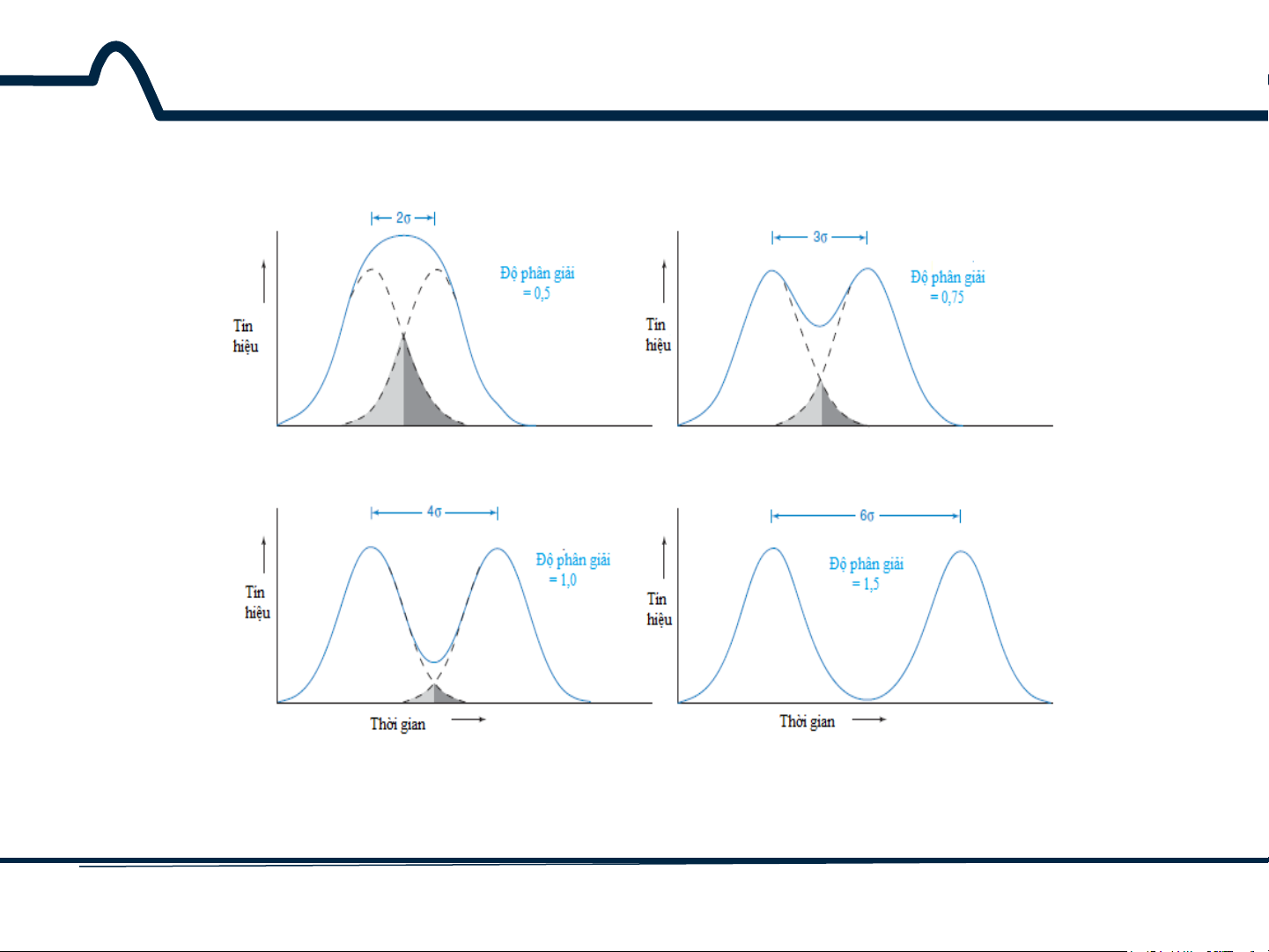
9.4. Hiệu quả tách
9.4.1. Độ phân giải
Trong sắc ký, độ phân giải của hai pic với nhau được định nghĩa là:
ở đây, Δtr hay ΔVr là sự tách giữa hai pics (đơn vị thời gian hay thể
tích) và wav là độ rộng trung bình của hai pic. Ngoài ra, độ phân giải
có thể biểu diễn qua việc sử dụng w1/2av chiều rộng tại nửa chiều cao
của đỉnh đường cong Gauxơ. Hình 9-7 cho thấy sự chồng chéo của
hai đỉnh với mức độ khác nhau của độ phân giải. Đối với phân tích
định lượng, độ phân giải là > 1,5 là điều trong đợi. 19 HUST SCE
9.4. Hiệu quả tách
9.4.1. Độ phân giải
Hình 9-7. Độ phân giải của các pic Gauxơ có diện tích và biên độ bằng nhau. Đường
nét đứt cho thấy các pic riêng biệt và các dòng liền là tổng của hai đỉnh pic. Phần
chồng sắc ký đồ là phần bóng mờ. 20 HUST SCE




