






























Preview text:
Chuyên đề
2 NHÓM NI TƠ – PHOTPHO
VẤN ĐỀ 1: LÝ THUYẾT I. NITƠ
1. Vị trí - cấu hình electron nguyên tử
- Vị tí: Nitơ ở ô thứ 7, chu kỳ 2, nhóm VA của bảng tuần hoàn.
- Cấu hình electron: 1s22s22p3.
- Công thức cấu tạo của phân tử: N≡N.
2. Tính chất hóa học
- Ở nhiệt độ thường, nitơ trơ về mặt hóa học, nhưng ở nhiệt độ cao nitơ trở nên hoạt động.
- Trong các phản ứng hóa học nitơ vừa thể hiện tính oxi hóa vừa thể hiện tính khử. Tuy
nhiên tính oxi hóa vẫn là chủ yếu.
a. Tính oxi hóa (tác dụng với kim loại, H2,…) 0 -3 0 t 3Mg+ N Mg N (magie nitrua) 2 3 2 0 0 -3 t ,p N + 3H 2N H 2 2 3 xt b. Tính khử 0 0 +2 t N + O 2NO 2 2
Khí NO sinh ra kết hợp ngay với O2 không khí tạo ra NO2 +2 +4 2N O + O 2NO 2 2
2. Điều chế a. Trong công nghiệp
- Nitơ được điều chế bằng cách chưng cất phân đoạn không khí lỏng. b. Trong phòng thí nghiệm
- Đun nóng nhẹ dung dịch bảo hòa muối amoni nitrit 0 NH t 4NO3 N2↑ + 2H2O 0 - Hoặc NH t 4Cl + NaNO2 N2↑ + NaCl + 2H2O
II. AMONIAC - MUỐI AMONI 1. Amoniac
a. Cấu tạo phân tử - Tính chất vật lý - Cấu tạo phân tử
- Tính chất vật lý: NH3 là một chất khí, tan nhiều trong nước cho môi trường kiềm yếu. b. Tính chất hóa học * Tính bazơ yếu - Tác dụng với nước + - NH + H O NH + OH 3 2 4
Trong dung dịch amoniac là bazơ yếu. Có thể làm quỳ tím hóa xanh. Dùng để nhận biết NH3.
- Tác dụng với dung dịch muối
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl - Tác dụng với axit
NH3 + HCl → NH4Cl (khói trắng) * Tính khử -3 0 0 t 4N H + 3O 2N +6H O 3 2 2 2 -3 0 0 t 2N H + 3Cl N + 6HCl 3 2 2
Đồng thời NH3 kết hợp ngay với HCl tạo thành khói trắng. c. Điều chế * Trong phòng thí nghiệm 0 2NH t 4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O * Trong công nghiệp 0 t ,xt,p N (k) + 3H (k) 2NH (k) ∆H<0 2 2 3
- Các điều kiện áp dụng để sản xuất amoniac trong công nghiệp là + Nhiệt độ: 450 - 5000C
+ Áp suất cao: 200 - 300atm
+ Chất xúc tác: sắt kim loại trộn thêm Al2O3, K2O… 2. Muối amoni
a. Định nghĩa - Tính chất vật lý
- Là chất tinh thể ion, gồm cation amoni + NH và anion gốc axit 4
- Tất cả đều tan trong nước và điện li hoàn toàn thành ion. b. Tính chất hóa học
* Tác dụng với dung dịch kiềm 0 (NH t 4)2SO4 + 2NaOH 2NH3↑ + 2H2O + Na2SO4 NH + 4 + OH - → NH3↑ + H2O
- Phản ứng này để nhận biết ion amoni và điều chế amoniac. * Phản ứng nhiệt phân 0 NH t 4Cl NH3 (k) + HCl (k) 0 (NH t 4)2CO3 NH3 (k) + NH4HCO3 (r) 0 t NH4HCO3
NH3 (k) + CO2 (k) + H2O (k) 0 NH t 4NO2 N2 + 2H2O 0 NH t 4NO3 N2O + 2H2O III. AXIT NITRIC
1. Cấu tạo phân tử - Tính chất vật lý a. Cấu tạo phân tử
- Trong hợp chất HNO3, nguyên tố nitơ có số oxi hoá cao nhất là +5. b. Tính chất vật lý
- Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. Axit
nitric không bền lắm: khi đun nóng bị phân huỷ một phần theo phương trình: 4HNO3 4NO2 + O2 + 2H2O
- Axit nitric tan trong nước theo bất kì tỉ lệ nào. Trên thực tế thường dùng loại axit đặc có
nồng độ 68%, D = 1,40 g/cm3.
2. Tính chất hóa học a. Tính axit
- Axit nitric là một axit mạnh. Có đầy đủ tính chất của một axit. CuO + 2HNO 3 Cu(NO3)2 + H2O Ca(OH) 2 + 2HNO3 Ca(NO3)2 + 2H2O CaCO 3 + 2HNO3 Ca(NO3)2 + CO2 + H2O b. Tính oxi hoá
- Axit nitric là một trong những axit có tính oxi hoá mạnh. Tuỳ thuộc vào nồng độ của
axit và bản chất của chất khử mà HNO3 có thể bị khử đến một số sản phẩm khác nhau của nitơ. * Với kim loại
- Khi tác dụng với kim loại có tính khử yếu như Cu, Pb, Ag,... HNO3 đặc bị khử đến NO2,
còn HNO3 loãng bị khử đến NO. Thí dụ: 0 +5 +2 +4 Cu+ 4H N O (®Æ c) Cu(NO ) +2NO +2H O 3 3 2 2 2 0 +5 +2 +2 3Cu+8H N O (lo·ng) 3Cu(NO ) +2NO+ 4H O 3 3 2 2
- Khi tác dụng với những kim loại có tính khử mạnh như Mg, Zn, Al,... HNO3 loãng có +1 o -3
thể bị khử đến N O , N hoặc NH NO . 2 2 4 3
- Fe, Al bị thụ động hoá trong dung dịch HNO3 đặc, nguội. * Với phi kim 0 5 6 4 S 6HNO (®Æ c) H SO 6NO 2H O 3 2 4 2 2 * Với hợp chất 2 5 6 4 H S + 6H N O (®Æ c) H SO + 6 N O + 3H O 2 3 2 4 2 2
3. Điều chế a. Trong phòng thí nghiệm
NaNO3(r) + H2SO4(đặc) HNO3 + NaHSO4 b. Trong công nghiệp
- HNO3 được sản xuất từ amoniac. Quá trình sản xuất gồm ba giai đoạn :
+ Giai đoạn 1: Oxi hóa NH3 bằng oxi không khí tạo thành NO 4NH 3 + 5O2 4NO + 6H2O
+ Giai đoạn 2: Oxi hoá NO thành NO2. 2NO + O2 2NO2
+ Giai đoạn 3: Chuyển hoá NO2 thành HNO3. 4NO2 + 2H2O + O2 4HNO3.
IV. MUỐI NITRAT
- Muối nitrat là muối của axit nitric. Thí dụ, natri nitrat (NaNO3), đồng (II) nitrat (Cu(NO3)2),...
1. Tính chất vật lí
- Tất cả các muối nitrat đều tan nhiều trong nước và là chất điện li mạnh. + - NaNO Na + NO 3 3
2. Tính chất hoá học
- Muối nitrat của các kim loại hoạt động mạnh (kali, natri, canxi, ...) bị phân huỷ thành muối nitrit và oxi: o t Thí dụ : 2KNO 3 2KNO2 + O2
- Muối nitrat của kẽm, sắt, chì, đồng,... bị phân huỷ thành oxit kim loại tương ứng, NO2 và O2: o t Thí dụ : 2Cu(NO 3)2 2CuO + 4NO2 + O2
- Muối nitrat của bạc, vàng, thuỷ ngân,... bị phân huỷ thành kim loại tương ứng, khí NO2 và O2. o t Thí dụ : 2AgNO 3 2Ag + 2NO2 + O2
3. Nhận biết ion nitrat - Để nhận ra ion
NO , người ta đun nóng nhẹ dung dịch chứa NO với Cu và H 3 3 2SO4 loãng: 3Cu + 8H+ + 2NO 3Cu2+ + 2NO + 4H 3 2O (xanh) (không màu) 2NO + O 2 NO (nâu đỏ) 2
Phản ứng tạo dung dịch màu xanh và khí màu nâu đỏ thoát ra. V. PHOTPHO
1. Vị trí - Cấu hình electron nguyên tử
a. Vị trí: Ô thứ 15, nhóm VA, chu kỳ 3 trong bảng tuần hoàn.
b. Cấu hình electron: 1s22s22p63s23p3.
2. Tính chất vật lý
- Photpho có hai dạng thù hình: Photpho trắng và photpho đỏ. Tùy vào điều kiện mà P(t)
có thể chuyển thành P (đ) và ngược lại.
- P (t) kém bền hơn photpho đỏ. Do vậy để bảo quản P (t) người ta ngâm vào nước.
3. Tính chất hóa học
- Trong các hợp chất, photpho có các số oxi hóa -3, +3, +5.
- Trong các phản ứng hóa học photpho thể hiện tính oxi hóa hoặc tính khử. a. Tính oxi hóa 0 -3 0 t 2P + 3Ca Ca P (canxi photphua) 3 2 b. Tính khử * Tác dụng với oxi 0 +3 0 - Thiếu oxi: t 4 P + 3O 2P O 2 2 3 0 +5 0 - Dư oxi: t 4P+ 5O 2P O 2 2 5 * Tác dụng với Clo 0 +3 0 - Thiếu clo: t 2P+ 3Cl 2PCl 2 3 0 +5 0 - Dư clo: t 2P+ 5Cl 2PCl 2 5
4. Trạng thái tự nhiên
- Trong tự nhiên photpho không tồn tại dưới dạng tự do. Hai khoáng vật quan trọng của
photpho là: photphorit Ca3(PO4)2 và apatit 3Ca3(PO4)2.CaF2.
VI. AXIT PHOTPHORIC - MUỐI PHOTPHAT
1. Axit photphoric a. Tính chất hóa học
- Là một axit ba nấc, có độ mạnh trung bình. Có đầy đủ tính chất hóa học của một axit. + - H PO H + H PO 3 4 2 4 - + 2- H PO H + HPO 2 4 4 2- + 3- HPO H + PO 4 4
- Khi tác dụng với dung dịch kiềm, tùy theo lượng chất mà tạo ra các muối khác nhau.
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O b. Điều chế * Trong phòng thí nghiệm
P + 5HNO3 → H3PO4 + 5NO2 + H2O * Trong công nghiệp
- Cho axit sunfuric đặc tác dụng với quặng apatit hoặc photphoric 0 Ca t
3(PO4)2 + 3H2SO4 (đặc) 2H3PO4 + 3CaSO4↓
- Để sản xuất axit photphoric với độ tinh khiết và nồng độ cao hơn người ta điều chế từ P 0 4P + 5O t 2 2P2O5 P2O5 + 3H2O 2H3PO4
2. Muối photphat a. Định nghĩa
- Muối photphat là muối của axit photphoric.
- Muối photphat được chia thành 3 loại Muối đihiđrophotphat
: NaH2PO4, NH4H2PO4, Ca(H2PO4)2… Muối hiđrophotphat
: Na2HPO4, (NH4)2HPO4, CaHPO4… Muối photphat
: Na3PO4, (NH4)3PO4, Ca3(PO4)2… b. Nhận biết ion photphat
- Thuốc thử: dung dịch AgNO3
- Hiện tượng: Xuất hiện kết tủa màu vàng + 3- 3Ag + PO Ag PO (màu vàng) 4 3 4
VII. PHÂN BÓN HÓA HỌC
- Phân bón hóa học là những hóa chất có chứa các nguyên tố dinh dưỡng, được bón cho
cây nhằm nâng cao năng suất mùa màng. 1. Phân đạm
- Phân đạm cung cấp nitơ hóa hợp cho cây dưới dạng ion nitrat NO và ion amoni NH . 3 4
- Độ dinh dưỡng của phân đạm được đánh giá theo tỉ lệ % về khối lượng nguyên tố nitơ. a. Phân đạm amoni
- Đó là các muối amoni: NH4Cl, NH4NO3, (NH4)2SO4…
- Được điều chế bằng cách cho NH3 tác dụng với axit tương ứng. 2NH3 + H2SO4 → (NH4)2SO4 b. Phân đạm nitrat
- Đó là các muối nitrat: NaNO3, Ca(NO3)2…
- Được điều chế bằng phản ứng giữa axit HNO3 và muối cacbonat tương ứng.
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + 2H2O c. Phân đạm urê
- (NH2)2CO (chứa khoảng 46%N) là loại phân đạm tốt nhất hiện nay.
- Được điều chế bằng cách cho NH3 tác dụng với CO ở nhiệt độ và áp suất cao. 0 2NH t , p 3 + CO (NH2)2CO + H2O
- Trong đất urê dần chuyển thành muối cacbonat
(NH2)2CO + 2H2O → (NH4)2CO3. 2. Phân lân
- Phân lân cung cấp nguyên tố P cho cây dưới dạng ion photphat ( 3- PO ). 4
- Độ dinh dưỡng của phân lân được đánh giá theo tỉ lệ % khối lượng P2O5 tương ứng với
lượng P có trong thành phần của nó. a. Supephotphat
- Có hai loại: supephotphat đơn và supephotphat kép.
* Supephotphat đơn: Gồm hai muối: Ca(H2PO4)2 và CaSO4. Được điều chế bằng cách
cho quặng photphorit hoặc apatit tác dụng với axit H2SO4 đặc.
Ca3(PO4)2 + 2H2SO4 (đặc) → Ca(H2PO4)2 + CaSO4↓
* Supephotphat kép: Đó là muối Ca(H2PO4)2. Được điều chế qua hai giai đoạn
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4↓
Ca3(PO4)2 + H3PO4 → 3Ca(H2PO4)2 3. Phân kali
- Phân kali cung cấp nguyên tố K dưới dạng ion K+.
- Độ dinh dưỡng của phân K được đánh gái theo tỉ lệ % khối lượng K2O tương ứng với
lượng K có trong thành phần của nó.
4. Phân hỗn hợp - Phân phức hợp
a. Phân hỗn hợp: chứa N, P, K được gọi chung là phân NPK.
- Thí dụ: (NH4)2HPO4 và KNO3.
b. Phân phức hợp: Thí dụ: Phân amophot là hỗn hợp các muối NH4H2PO4 và (NH4)2HPO4. 5. Phân vi lượng:
- Phân vi lượng cung cấp cho cây các nguyên tố như bo, kẽm, mangan, đồng… ở dạng hợp chất.
VẤN ĐỀ 2: CÁC DẠNG BÀI TẬP
DẠNG 1: HOÀN THÀNH SƠ ĐỒ PHẢN ỨNG
Phương pháp giải:
Cần nắm chắc kiến thức về tính chất hoá học, phương pháp điều chế các chất, đặc
biệt về các chất thuộc nhóm nitơ như N2, NO, NO2, HNO3, NH3, muối nitrat,
muối amoni, H3PO4, muối photphat…
Cần nhớ: Mỗi mũi tên trong sơ đồ nhất thiết chỉ biểu diễn bằng một phản ứng. Ví dụ:
Ví dụ 1: Sơ đồ phản ứng sau đây cho thấy rõ vai trò của thiên nhiên và con người trong
việc chuyển nitơ từ khí quyển vào trong đất, cung cấp nguồn phân đạm cho cây cối: Hãy
viết các phản ứng trong sơ đồ chuyển hoá trên. Hướng dẫn giải X: O2 Y: HNO3 Z: Ca(OH)2 M : NH3
Ví dụ 2: Viết các phương trình phản ứng thực hiện dãy chuyển hoá sau : Hướng dẫn giải B: NH3 A: N2 C: NO
D: NO2 E: HNO3 G: NaNO3 H: NaNO2
Ví dụ 3: Hoàn thành sơ đồ chuyển hoá sau: Hướng dẫn giải
DẠNG 2: NHẬN BIẾT
Phương pháp giải:
Lựa chọn những phản ứng có dấu hiệu đặc trưng (sự biến đổi màu, mùi, kết tủa, sủi bọt khí…) để nhận biết. Chất cần STT Thuốc thử
Hiện tượng xảy ra và phản ứng nhận biết NH3 Quỳ tím 1. Quỳ tím ẩm hoá xanh (khí) ẩm Dung dịch 2. NH + + 4 kiềm
Giải phóng khí có mùi khai: NH4 + OH- → NH3 + H2O (có hơ nhẹ)
Dung dịch hoá xanh, giải phóng khí không màu và hoá nâu trong không khí: 3. HNO3 Cu
3Cu + 8HNO3 → Cu(NO3)2 + 2NO + 4H2O và 2NO + O2 → 2NO2
Dung dịch hoá xanh, giải phóng khí không màu và hoá 4. NO - 3 H2SO4, Cu nâu trong không khí: 3Cu + 8H+ + 2NO - 3 →3Cu2+ + 2NO + 4H2O và 2NO + O2 → 2NO2 Dung dịch Tạo kết tủa màu vàng 5. PO 3- 4 AgNO3 3Ag+ + PO 3- 4 → Ag3PO4↓ Ví dụ:
Ví dụ 1: Chỉ được dùng một kim loại, làm thế nào phân biệt những dung dịch sau đây:
NaOH, NaNO3, HgCl2, HNO3, HCl. Hướng dẫn giải
Dùng kim loại Al, cho Al tác dụng lần lượt với các mẫu thử
Nếu có khí màu nâu bay ra là HNO3:
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O 2NO + O2 → 2NO2 (màu nâu)
Nếu có kim loại trắng sinh ra là HgCl2 2Al + 3HgCl2 → 3Hg + 2AlCl3
Có bọt khí bay ra và có kết tủa, kết tủa tan ra là NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑ Có bọt khí bay ra là HCl
2Al + 6HCl → 2AlCl3 + 3H2↑ Còn lại là NaNO3
Ví dụ 2: Chỉ dùng một chất khác để nhận biết từng dung dịch sau : NH4NO3, NaHCO3,
(NH4)2SO4, FeCl2 và FeCl3. Viết phương trình các phản ứng xảy ra. Hướng dẫn giải
Dùng Ba(OH)2 để nhận biết. Tóm tắt theo bảng sau : NH4NO3 NaHCO3 (NH4)2SO4 FeCl2 FeCl3 Ba(OH) NH ↓trắng, 2 3↑ mùi NH3↑ ↓trắng ↓nâu khai, hơi mùi khai BaCO3 ↓trắng xanh Fe(OH)3 BaSO4 Fe(OH)2
(1) 2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3 + H2O
(2) 2NaHCO3 + Ba(OH)2 → BaCO3 + Na2CO3 + H2O
(3) (NH4)2SO4 + Ba(OH)2 → BaSO4 + NH3 + H2O
(4) FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2
(5) FeCl3 + Ba(OH)2 → BaCl2 + Fe(OH)3
Ví dụ 3: Mỗi cốc chứa một trong các chất sau: Pb(NO3)2, Na2S2O3, MnCl2 NH4Cl,
(NH4)2CO3, ZnSO4. Ca3(PO4) và MgSO4. Dùng nước, dung dịch NaOH, dung dịch HCl
để nhận biết mỗi chất trên. Hướng dẫn giải
Cho nước vào các mẫu thử, tất cả đều tan, chỉ có mẫu thử chứa Ca3(PO4)2 không tan.
Cho từ từ dung dịch NaOH vào các mẫu thử chứa các hoá chất trên có những hiện tượng xảy ra như sau:
Chỉ có hai mẫu thử cho khí NH3 mùi khai là NH4Cl và (NH4)2CO3.
NH4Cl + NaOH → NH3↑+ H2O + NaCl
(NH4)2CO3 + NaOH → 2NH3↑ + 2H2O + Na2CO3
Để nhận biết hai muối này ta cho tác dụng với dung dịch HCl, mẫu thử nào cho khí bay
lên là (NH4)2CO3, còn mẫu thử không có hiện tượng gì xảy ra là NH4Cl.
Có bốn mẫu thử cho kết tủa trắng Zn(OH)2, Mg(OH)2, Pb(OH)2 và Mn(OH)2, nếu tiếp tục
cho NaOH và Zn(OH)2 và Pb(OH)2 tan còn Mg(OH)2 không tan, như vậy ta biết được cốc chứa MgSO4:
ZnSO4 + 2NaOH → Zn(OH)2 + Na2SO4
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
Pb(NO3)2 + 2NaOH → Pb(OH)2 + 2NaNO3
Pb(OH)2 + 2NaOH → Na2PbO2 + 2H2O
MnCl2 + 2NaOH → Mn(OH)2 + 2NaCl
Để nhận biết Pb(NO3)2 với ZnSO4 ta cho dung dịch HCl vào hai mẫu thử, mẫu thử nào
cho kết tủa màu trắng là Pb(NO3)2, còn mẫu thử không tác dụng là ZnSO4.
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Mn(OH)2 không bền, dễ bị oxi hoá thành Mn(OH)4 màu nâu còn Mg(OH)2 không bị oxi hoá.
2Mn(OH)2 + O2(kk) + 2H2O → 2Mn(OH)4
Mẫu cuối cùng còn lại là Na2S2O3
Có thể cho dung dịch HCl vào mẫu thử còn lại này, có kết tủa màu vàng và có khí mùi hắc (SO2):
Na2S2O3 + 2HCl → 2NaCl + SO2↑ + S↓+ H2O
DẠNG 3: CÂN BẰNG PHẢN ỨNG OXI HÓA – KHỬ
CỦA NHỮNG PHẢN ỨNG CÓ HNO - 3 HOẶC NO3
THEO PHƯƠNG PHÁP THĂNG BẰNG ELECTRON
Phương pháp giải:
Cân bằng phản ứng oix hoá - khử theo phương pháp thăng bằng ion – electron
cũng phải đảm bảo nguyên tắc: tổng electron mà chất khử cho bằng tổng electron
mà chất oxi hoá nhận (như ở phương pháp thăng bằng electron).Chỉ khác là chất
oxi hoá, chất khử viết dưới dạng ion.
Cần nhớ: Chất kết tủa (không tan), chất khí (chất dễ bay hơi), chất ít điện li
(H2O) phải để dạng phân tử.
Tuỳ theo môi trường phản ứng là axit, bazơ hoặc trung tính mà sau khi xác định
nhường, nhận electron ta phải cân bằng thêm điện tích hai vế.
Nếu phản ứng xảy ra trong môi trường axit, ta thêm H+ vào vế nào dư oxi, vế còn lại thêm H2O.
Nếu phản ứng xảy ra trong môi trường bazơ, ta thêm OH- vào vế nào thiếu
oxi, vế còn lại thêm H2O.
Nếu phản ứng xảy ra trong môi trường nước thì nếu tạo axit ta cân bằng
như môi trường axit, nếu tạo bazơ ta cân bằng như môi trường bazơ.
Nhân hệ số cho hai quá trình nhường và nhận electron sao cho: số electron nhường
ra của chất khử bằng số electron nhận vào của chất oxi hoá. Ví dụ:
Ví dụ 1: Cân bằng phản ứng sau đây theo phương pháp thăng bằng ion electron:
Cu + HNO3 → Cu(NO3)2 + NO + H2O Hướng dẫn giải Dạng ion: Quá trình oxi hoá: Quá trình khử:
(Vì môi trường axit nên thêm H+ vào vế trái (dư oxi) và thêm nước vào vế phải: Ta có:
→ 3Cu + 2NO -3 + 8H+ → 3Cu2+ + 2NO↑ + 4H2O Dạng phân tử:
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Ví dụ 2: Cân bằng phản ứng sau theo phương pháp thăng bằng ion electron
Cu + NaNO3 + H2SO4 → Cu(NO3)2 + NO + Na2SO4 + H2O Hướng dẫn giải
Phương trình dạng ion rút gọn: 3Cu + 2NO -
3 + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
Phương trình dạng phân tử:
3Cu + 8NaNO3 + 4H2SO4 → 3Cu(NO3)2 + 2NO + 4Na2SO4 + 4H2O
DẠNG 4: XÁC ĐỊNH NGUYÊN TỐ THUỘC NHÓM NITO
DỰA VÀO VIỆC XÁC ĐỊNH SỐ HIỆU NGUYÊN TỬ (Z)
HOẶC NGUYÊN TỬ KHỐI (M)
Phương pháp giải:
Đối với bài toán về số hạt proton, nơton, electron phải thiết lập phương trình toán học để tìm được Z.
Đối với bài toán khối lượng, phải tìm cách xây dựng phương trình để tìm ra NTK
(M), từ đó suy ra nguyên tố cần tìm. Ví dụ:
Ví dụ 1: Có hai nguyên tử A, B thuộc phân nhóm chính trong hệ thống tuần hoàn.
Tổng số điện tích hạt nhân của A và B bằng số khối nguyên tử Na.
Hiệu số điện tích hạt nhân của chúng bằng số điện tích hạt nhân của nguyên tử nitơ.
a) Xác định vị trí của A, B trong hệ thống tuần hoàn.
b) Viết công thức cấu tạo của hợp chất tạo thành từ A, B và nguyên tử có cấu hình electron là 1s1. Hướng dẫn giải → ZA = 15; ZB = 8
Cấu hình electron của A: 1s22s22p63s23p3
A thuộc chu kì 3, phân nhóm chính nhóm V, A là Photpho (P)
Cấu hình electron của B: 1s22s22p4
B thuộc chu kì 2, phân nhóm chính nhóm VI, B là Oxi (O).
b) Nguyên tử có cấu hình e là 1s1 là Hiđro (H). Hợp chất được cấu tạo từ
H, P, O là: H3PO4, HPO4, HPO4, H3PO4, H3PO3, H4P2O7
Ví dụ 2: Nguyên tố R thuộc phân nhóm chính, có công thức oxit cao nhất dạng R2O5.
Hợp chất của R với hiđro chứa 17,65% hiđro theo khối lượng. Xác định nguyên tố R. Hướng dẫn giải
Từ công thức oxit cao nhất là R2O5 suy ra hợp chất với hiđro của R có công thức RH3.
Theo đề: RH3 có 17,65% H suy ra %mR = 100 – 17,65 = 82,35%. Ta có: Vậy R là Nitơ (N).
DẠNG 5: LẬP CÔNG THỨC PHÂN TỬ CỦA OXIT NITO
Phương pháp giải:
Thường qua các bước sau :
Bước 1 : Đặt công thức oxit của nitơ NxOy.
(với 1 ≤ x ≤ 2 ; 1 ≤ y ≤ 5 đều nguyên).
Bước 2 : Từ dữ liệu bài cho lập hệ thức tính phân tử khối NXOY.
Bước 3 : Thiết lập phương trình toán học : MNxOy = 14x + 16y.
Sau đó lập bảng trị số, biện luận y theo x, rút ra cặp nghiệm hợp lí. Suy ra công
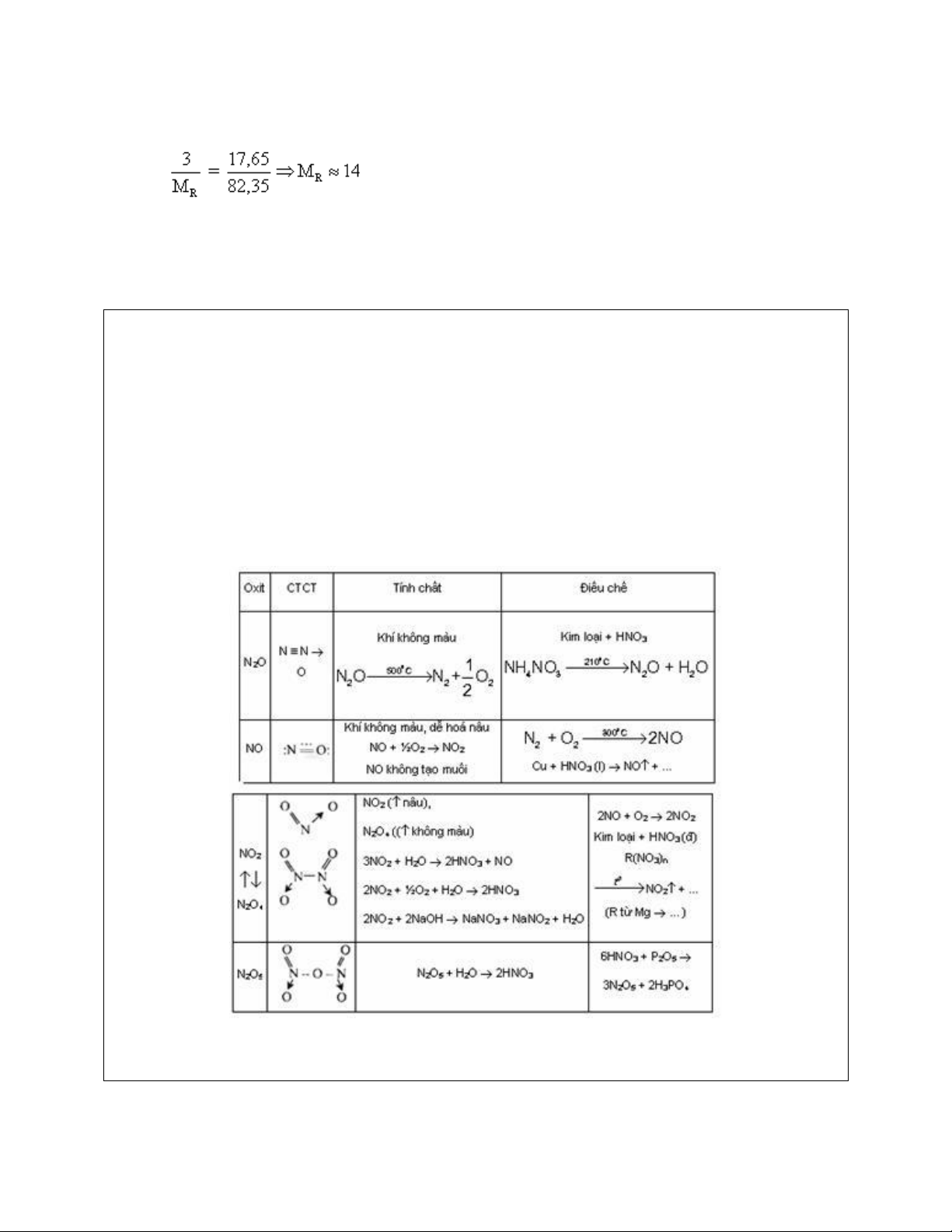
thức oxit cần tìm của nitơ. Một số oxit của Ví dụ:
Ví dụ 1: Một oxit A của nitơ có chứa 30,43% N về khối lượng. Tỉ khối hơi của A so với
không khí là 1,586. Xác định công thức phân tử, công thức cấu tạo và gọi tên A. Hướng dẫn giải
Đặt công thức oxit A của nitơ là OxOy
Phân tử khối A là: MA = 29.d = 29.1,586 = 46
Vì trong A, nitơ chiếm 30,43% về khối lượng nên:
Do MA = 14x + 16y = 46 → y = 2. Công thức phân tử của A là NO2
Công thức cấu tạo của A là : O = N → O : nitơ đioxit hay penxinitơ.
Ví dụ 2: Một hỗn hợp X gồm CO2 và một oxit của nitơ có tỉ khối đối với H2 là 18,5. Hãy
xác định công thức oxit của nitơ và % thể tích các khí trong hỗn hợp X. Hướng dẫn giải Vì nên MNxOy < 37.
Hay 14x + 16y < 37. x, y phải nguyên dương → chỉ hợp lí khí x = 1, y = 1. Vậy oxit của nitơ là NO.
Giả sử trong 1mol hỗn hợp X có a(mol) CO2 và (1-1)mol NO.
Ta có: 44a + 30(1 – a) = 37 → a = 0,5 Vậy %VCO2 = %VNO = 50%.
Ví dụ 3: Mỗt hỗn hợp khí X gồm 3 oxit của N là NO, NO2 và NxOy. Biết phần trăm thể
tích của các oxit trong X là: %VNO = 45%, %VNO2 = 15%, %VNxOy = 40%, còn phần trăm
theo khối lượng NO trong hỗn hợp là 23,6%. Xác định công thức NxOy. Hướng dẫn giải
Vì ở cùng điều kiện bên ngoài về nhiệt độ, áp suất, tỉ lệ thể tích giữa các chất khí cũng
chính là tỉ lệ số mol giữa chúng, nên nếu gọi số mol hỗn hợp khí X là a(mol) thì số mol
của các khí thành phần là: nNO = 0,45a mol; nNO2 = 0,15a mol; nNxOy = 0,4a mol.
Bài cho %mNO = 13,6% mà mNO = 30 0,45a = 13,5a (g) Suy ra:
MNxOy = mhhX – mNO – mNO2 = 57,2a – 13,5a – 6,9a = 35,8a sai đúng sai Vậy oxit NxOy là N2O4
DẠNG 6: BÀI TẬP HIỆU SUẤT Phương pháp giải:
Thực tế, do một số nguyên nhân, một số phản ứng hoá học xảy ra không hoàn
toàn, nghĩa là hiệu suất phản ứng (H%) dưới 100%. Có một cách tính hiệu suất phản ứng :
Cách 1 : Tính theo lượng chất ban đầu cần lấy
Cách 2 : Tính theo lượng sản phẩm phản ứng thu được :
Trừ trường hợp để yêu cầu cụ thể tính hiệu suất phản ứng theo chất nào thì ta phải
theo chất ấy. Còn khi ta biết lượng của nhiều chất tham gia phản ứng, để tính
hiệu suất chúng của phản ứng, ta phải :
So sánh tỉ lệ mol của các chất này theo đề cho và theo phản ứng.
Nếu tỉ lệ mol so sánh là như nhau: thì hiệu suất phản ứng tính theo chất nào cũng một kết quả.
Tỉ lệ mol so sánh là khác nhau, thì hiệu suất phản ứng phải không được tính
theo chất luôn luôn dư (ngay cả khi ta giả sử chất kia phản ứng hết). Ví dụ:
Ví dụ 1: Để điều chế 68g NH3 cần lấy bao nhiêu lít N2 và H2 ở đktc. Biết hiệu suất phản ứng là 20%. Hướng dẫn giải
Vì hiệu suất phản ứng (1) là 20% nên thực tế cần : Thể tích N2 (đktc) là : Thể tích H2(đktc) là :
Ví dụ 2: Cần lấy bao nhiêu gam N2 và H2 (đo ở đktc) để điều chế được 51g NH3, biết hiệu
suất của phản ứng là 25%. Hướng dẫn giải Theo bài ra
Khối lượng N2 và H2 cần lấy :
Ví dụ 3: Trong bình phản ứng có chứa hỗn hợp khí A gồm 10 mol N2 và 40 mol H2. Áp
dụng trung bình lúc đầu là 400 atm, nhiệt độ bình được giữ không đổi. Khi phản ứng xảy
ra và đạt đến trạng thái cân bằng thì hiệu suất của phản ứng tổng hợp là 25%.
a) Tính số mol các khí trong bình sau phản ứng.
b) Tính áp suất trong bình sau phản ứng Hướng dẫn giải
Phản ứng tổng hợp NH3 xảy ra theo tỉ lệ : nN2 : nH2 = 1 : 3
Bài cho : nN2 : nH2 = 10 : 40 = 1 : 4. Vậy H2 dư nhiều hơn.
Phải dựa vào số mol N2 phản ứng để tính số mol NH3 :
a) Phương trình phản ứng : Số mol ban đầu 10 40 0 mol Số mol phản ứng 2,5 7,5 5,0 mol Số mol sau phản ứng 7,5 32,5 5,0 mol
Vậy số mol các khi trong bình sau phản ứng là : 7,5 mol N2 ; 32,5 mol H2 ; 5,0 mol NH3. 7,5 + 32,5 + 5,0 = 45 mol
b) Tổng số mol khí trong bình ban đầu : 10 + 40 = 50 mol
Vì PV + nRT mà ở đây VB, TB không đổi, nên ta có
DẠNG 7: KIM LOẠI TÁC DỤNG VỚI HNO3 TẠO THÀNH HỖN HỢP KHÍ Phương pháp giải:
Kim loại tác dụng với dung dịch axit HNO3 giải phóng hỗn hợp nhiều sản phẩm khí. Biết
tỉ khối của hỗn hợp khí này:
Bước 1: Thiết lập biểu thức tính
từ đó rút ra tỉ lệ số mol
(hay tỉ lệ thể tích) giữa các khí sản phẩm.
Bước 2: Viết phương trình phản ứng của kim loại với axit HNO3 sinh ra từng khí
sản phẩm (có bao nhiêu sản phẩm khử trong gốc NO -
3 thì phải viết bấy nhiêu
phương trình phản ứng).
Bước 3: Dựa vào tỉ lệ số mol (hay thể tích) giữa các khí sản phẩm để viết phương
trình phản ứng tổng cộng chứa tất cả các sản phẩm khí đo.
Bước 4: Tính toán theo phương trình phản ứng tổng cộng. Ví dụ:
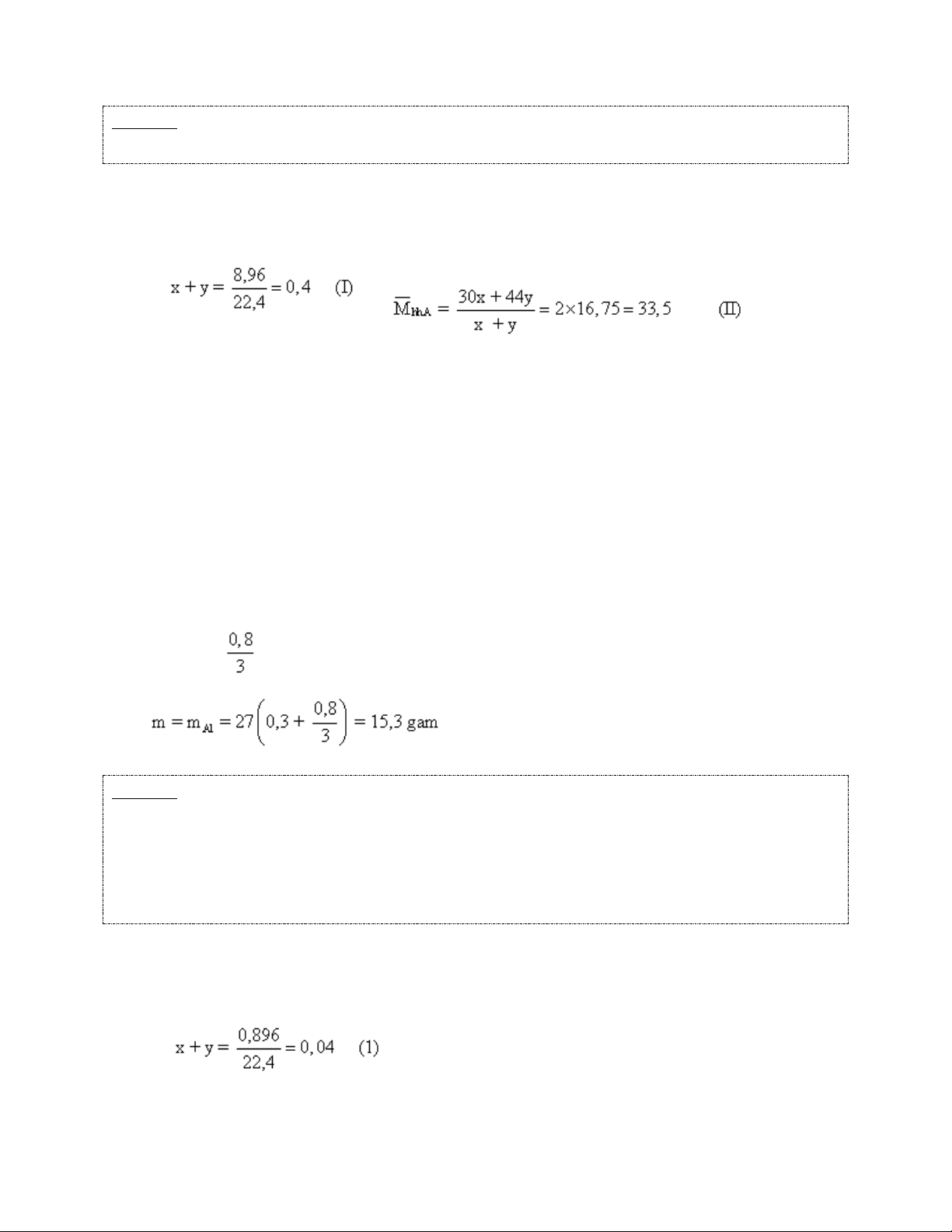
Ví dụ 1: Hoà tan hoàn toàn m gam Al trong dung dịch HNO3 thì thu được 8,96 lít (đktc)
hỗn hợp khí A (gồm NO và N2O) có tỉ khối dA/H2 = 16,75. Tính m? Hướng dẫn giải
Đặt số mol NO và N2O trong 8,96l hỗn hợp khí A lần lượt là x và y. Ta có:
Từ (I, II): x = 0,3 và y = 0,1
Các phương trình phản ứng:
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O (1) 0,3 mol 0,3 mol
8Al + 30HNO3 → 8Al(NO3)3 + 3N2O↑ + 15H2O (2) 0,1 mol Vậy
Ví dụ 2: Cho 13,5 gam Al tác dụng vừa đủ với 2,0 lít dung dịch HNO3 thì thu được hỗn
hợp khí A gồm NO và N2 có tỉ khối đối với hiđro là 14,75.
a) Tính thể tích mỗi khí sinh ra (đktc)?
b) Tính nồng độ mol của dung dịch HNO3 đem dùng? Hướng dẫn giải
Đặt số mol NO và N2 trong hỗn hợp khí A lần lượt là a và b. Ta có Từ (I):
a : b = 3 : 1 hay nNO : nH2 = 3 : 1
Các phương trình phản ứng: (19 27) g 72 mol → 9 mol 3 mol 13,5g x mol → y mol z mol nHNO3 = x = 1,895 mol ; nNO = y = 0,237 mol ; nN2 = z = 0,0789 mol ;
a) VNO = 0,237 22,4 = 5,3088 (l)
VN2 = 0,0789 22,4 = 1,76736 (l)
DẠNG 8: HỖN HỢP KIM LOẠI TÁC DỤNG VỚI HNO3
Phương pháp giải:
Khi cho nhiều kim loại tác dụng với cùng một dung dịch HNO3 cần nhớ: Kim loại
càng mạnh tác dụng với dung dịch HNO - 3 càng loãng thì trong gốc NO3 bị
khử xuống mức oxi hoá càng thấp
Nếu đề yêu cầu xác định thành phần hỗn hợp kim loại ban đầu có thể qua các bước giải:
Bước 1: Viết các phương trình phản ứng xảy ra (chú ý xác định sản phẩm
của nitơ cho đúng), nhớ cân bằng.
Bước 2: Đặt ẩn số, thường là số mol của các kim loại trong hỗn hợp
Bước 3: Lập hệ phương trình toán học để giải.
Trường hợp bài toán không cho dữ kiện để lập phương trình đại số theo số mol và
khối lượng các chất có trong phản ứng, để ngắn gọn ta nên áp dụng phương pháp bảo toàn electron.
Cơ sở của phương pháp này là: dù các phản ứng oxi hoá - khử có xảy ra như thế
nào nhưng vẫn có sự bảo toàn electron. Nghĩa là: Tổng số mol electron mà các chất oxi hoá thu vào.
Phương pháp này sử dụng khi phản ứng xảy ra là phản ứng oxi hoá - khử đặc biệt
đối với những trường hợp số các phản ứng xảy ra nhiều và phức tạp.
Trước hết, ta phải nắm được thế nào là phản ứng oxi hoá - khử?
Phản ứng oxi hoá - khử là những phản ứng oxi hoá trong đó có sự cho và nhận
electron, hay nói cách khác, trong phản ứng có sự thay đổi số oxi hoá của một số nguyên tố.
Quá trình ứng với sự cho electron gọi là quá trình oxi hoá
Quá trình ứng với sự nhận electron gọi là quá trình khử.
Trong phản ứng oxi hoá - khử: tổng số electron do chất khử nhường phải đúng
bằng tổng số electron mà chất oxi hoá nhận.
Từ đó suy ra: Tổng số mol electron do chất khử nhường bằng tổng số mol electron mà chất oxi hoá nhận.
Đó chính là nội dung của định luật bảo toàn electron.
Điều kiện để có phản ứng oxi hoá - khử: đó là chất oxi hoá mạnh phải tác dụng với
chất khử mạnh tạo thành chất oxi hoá yếu hơn và chất khử yếu hơn.
Khi giải toán mà phản ứng xảy ra là phản ứng oxi hoá - khử, nhất là khi số phản
ứng xảy ra nhiều và phức tạp, chúng ta nên viết các quá trinh oxi hoá, các quá
trình khử, sau đó vận dụng Định luật bảo toàn electron cho các quá trình này. Ví dụ:
Ví dụ 1: Hoà tan hoàn toàn m gam Al trong dung dịch HNO3 thì thu được 8,96 lít (đktc)
hỗn hợp khí A (gồm NO và N2O) có tỉ khối dA/H2 = 16,75. Tính m. Hướng dẫn giải
Đặt số mol NO và N2O trong 8,96 l hỗn hợp A lần lượt là x và y. Ta có:
Từ (I, II): x = 0,3 và y = 0,1
Các phương trình phản ứng:
Al + 4HNO3 → Al(NO3)3 + NO↑ + 2H2O (1) 0,03mol ← 0,3 mol
8 Al + 30HNO3 → 8Al(NO3)3 + 3N2O↑ + 15H2O (2) ← 0,1 mol Vậy
Ví dụ 2: Cho 0,54g bột Al hoà tan hết trong 250 ml dung dịch HNO3 1M. Sau khi phản
ứng xong, thu được dung dịch A và 0,896 lít hỗn hợp khí B gồm NO2 và NO (đo ở đktc).
a) Tính tỉ khối của hỗn hợp khí B đối với H2.
b) Tính nồng độ mol các chất trong dung dịch A thu được. Hướng dẫn giải
Đặt số mol NO2 và NO trong 0,896 l hỗn hợp khí B lần lượt là x và y. Ta có :
Các phương trình phản ứng:
Al + 6HNO3 → Al(NO3)3 + 3NO2↑ + 3H2O (a) x/ 3 2x x/3 ← xmol
Al + 4HNO3 → Al(NO3)3 + 3NO↑ + 3H2O (b) y 4y y ← ymol Vậy
DẠNG 9: PHẢN ỨNG CỦA MUỐI NO -3 TRONG MÔI TRƯỜNG AXIT VÀ BAZO
Phương pháp giải: Anion gốc nitrat NO - 3
Trong môi trường trung tính không có tính oxi hoá.
Trong môi trường bazơ có tính oxi hoá yếu. (chẳng hạn : ion) NO - 3 trong môi
trường kiềm có thể bị Zn, Al khử đến NH3. Ví dụ :
8Al + 5NaOH + 3NaNO3 + 2H2O → 8NaAlO2 + 3NH3↑
Phương trình ion : 8Al + 5OH- + 2H - - 2O + 3NO3 → 8AlO2 + 3NH↑ Anion gốc nitrat NO -
3 trong môi trường axit có khả năng oxi hoá như HNO3.
Chẳng hạn cho kim loại tác dụng với dung dịch hỗn hợp hai axit (H2SO4 loãng và
HNO3) hay dung dịch hỗn hợp axit HCl, H2SO4 loãng và muối nitrat. Lúc này
cần phải viết phương trình dưới dạng ion để thấy rõ vai trò chất oxi hoá của gốc NO - 3 . Ví dụ :
Cho Cu vào dung dịch hỗn hợp NaNO3 và H2SO4 loãng sẽ xảy ra phản ứng giải phóng khí sau : 3Cu2+ + 8H+ + 2NO - 3 → 3Cu2+ + 2NO↑ + 4H2O
Phương pháp chung để giải loại toán này là phải viết phương trình dạng ion có sự tham gia của ion NO -
3 . Sau đó so sánh số mol của kim loại M với tổng số mol H+ và tổng số mol NO _
3 để xem chất hay ion nào đã phản ứng hết, rồi mới tính toán
tiếp theo số mol của chất rắn phản ứng hết. Ví dụ:
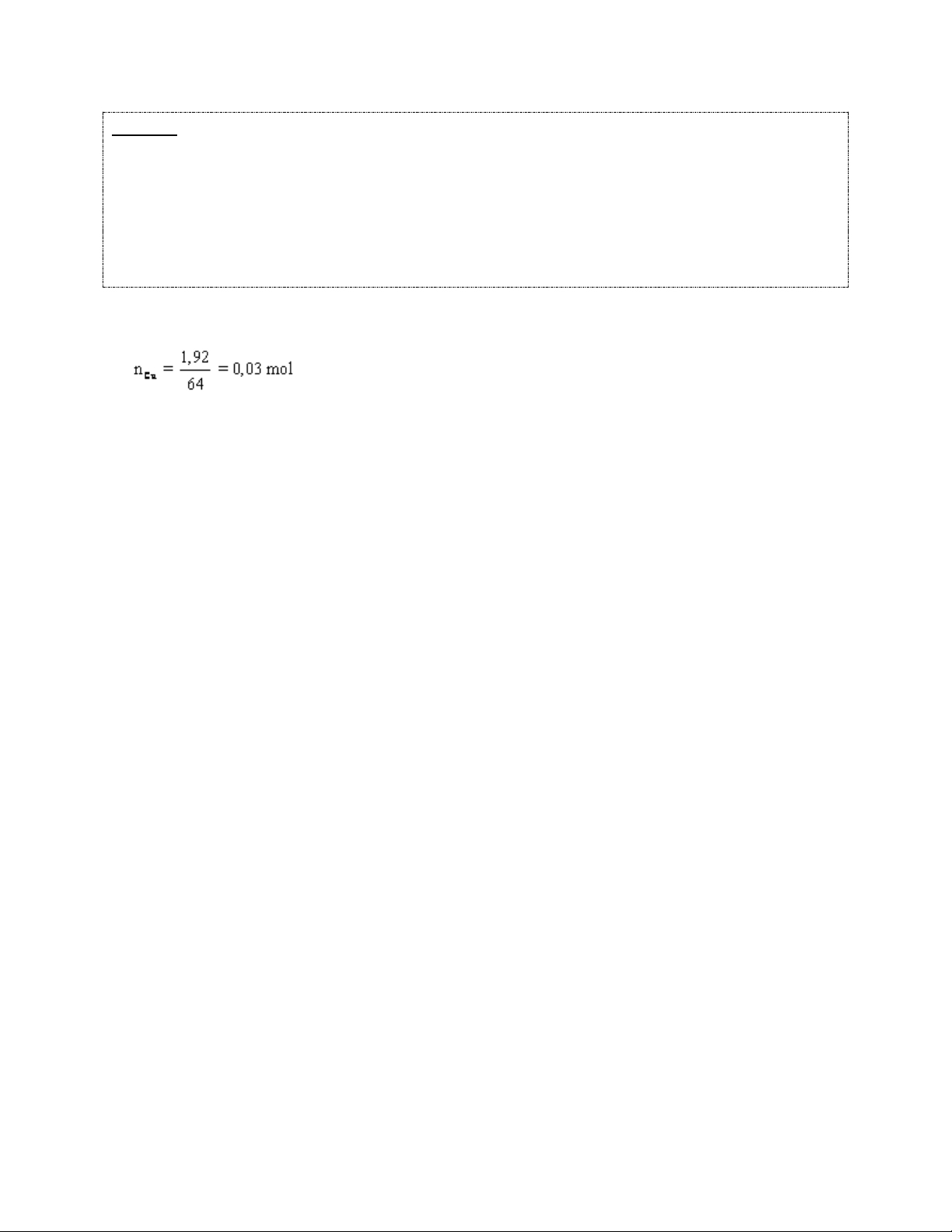
Ví dụ 1: Cho 1,92 gam đồng vào 100 ml dung dịch chứa đồng thời KNO3 0,16M và
H2SO4 0,4M thấy sinh ra một chất khí có tỉ khối hơi so với H2 là 15 và dung dịch A.
a) Viết phương trình ion thu gọn của phản ứng và tính thể tích khí sinh ra ở đktc.
b) Tính thể tích dung dịch NaOH 0,5M tối thiểu cần dùng để kết tủa toàn bộ ion Cu2+ trong dung dịch A. Hướng dẫn giải a)
nKNO3 = 0,16 × 0,1 = 0,16 mol nH2SO4 = 0,4 × 0,1 = 0,4 mol
Vậy trong 100 ml dung dịch trên có 0,016 mol NO3 và 0,08 mol H+
Khí sinh ra có M = 30 chỉ có thể là NO theo phương trình phản ứng sau:
3Cu + 8H+ + 2NO3 = 3Cu2+ + 2NO + 4H2O (1)
Số mol b đầu 0,03 0,080 0,016 0 0 mol
Số mol p.ư 0,024 0,064 0,016 0,024 0,016 mol
Số mol c.lại 0,006 0,016 0 0,0024 0,016 mol
Vậy VNO(đktc) = 0,016 22,4 = 0,3584 lít.
b) Dung dịch A thu được sau cùng có chứa: 0,016 mol H+ và 0,024 mol Cu2+. Khi cho
NaOH vào dung dịch A, trước hết xảy ra phản ứng: NaOH + H+ → Na+ + H2O (2) 0,016 mol 0,016 mol
Sau đó xảy ra phản ứng: Cu2+ + 2NaOH → Cu(OH)2 + 2Na+ (3) 0,024 mol 0,048 mol Vậy
(cần) = 0,016 + 0,048 = 0,064 mol
VddNaOH 0,5M (tối thiểu cần)
Ví dụ 2: Tiến hành hai thí nghiệm sau:
* Thí nghiệm 1: Hoà tan 6,4 g Cu và 120 ml dung dịch HNO3 1M.
* Thí nghiệm 2: Hoà tan 6,4 ga Cu và 120 mol dung dịch hỗn hợp HNO3 1M.
Hãy so sánh thể tích khí NO (duy nhất tạo thành) đo cùng điều kiện nhiệt độ và áp suất,
thoát ra ở hai thí nghiệm trên. Hướng dẫn giải * Thí nghiệm 1: Phương trình phản ứng: 3Cu + 8H+ + 2NO - 3 → 3Cu2+ + 2NO + 4H2O (1)
Số mol b.đầu (mol): 0,1 0,12 0,12 0 0
Số mol p.ư (mol): 0,045 0,12 0,03 0,045 0,03
Số mol còn lại (mol): 0,055 0 0,09 0,045 0,03 * Thí nghiệm 2: nCu = 0,1 mol nHNO3 = 0,12 mol
nH2SO4 = 0,12 5 = 0,06 mol mol Phương trình phản ứng: 3Cu + 8H+ + 2NO - 3 → 3Cu2+ + 2NO + 4H2O (1)
Số mol b.đầu (mol): 0,1 0,24 0,12
Số mol p.ư (mol): 0,09 0,24 0,06 0,06
Số mol còn lại (mol): 0,01 0 0,06 0,06
Vì tỉ lệ thể tích bằng tỉ lệ số mol giữa các khí đo cùng điều kiện nên: lần
DẠNG 10: HPO4 TÁC DỤNG VỚI DUNG DỊCH KIỀM (NaOH,KOH,...)
Phương pháp giải: nNaOH T nH3PO4
Nếu T 1 thì tạo muối: NaH2PO4
Nếu 1 < T < 2 thì tạo 2 muối: NaH2PO4 và Na2HPO4
Nếu T = 2 thì tạo muối: Na2HPO4
Nếu 2 < T < 3 thì tạo 2 muối: Na2HPO4 và Na3PO4
Nếu T 3 thì tạo muối Na3PO4 * PTTQ:
H PO NaOH
NaH PO H O 3 4 2 4 2
H PO 2NaOH
Na HPO 2H O 3 4 2 4 2
H PO 3NaOH
Na PO 3H O 3 4 3 4 2 Ví dụ:
Ví dụ 1: Cho 500ml dung dịch H3PO4 2M tác dụng với 200ml dung dịch NaOH 1M.
Tính nồng độ mol các chất au phản ứng Hướng dẫn giải n 5 , 0 . , 0 2 ( 1 , 0 mol) H3PO4 n , 0 2.1 , 0 2(mol) NaOH n , 0 2 NaOH 2 Na HPO 2 4 n 1 , 0 H3PO4
H PO 2NaOH
Na HPO 2H O 3 4 2 4 2 BD: 0,1 0,2 PƯ: 0,1 0,2 0,1 SPU: 0 0 0,1 1 , 0 1 C M Na2HP 4 O , 0 7 7
VẤN ĐỀ 3: TRẮC NGHIỆM
Câu 1: Điểm giống nhau giữa N2 và CO2: A. Đều tan trong nước
B. Đều có tính Oxi hóa và tính khử
C. Đều không duy trì sự cháy và sự sống D. Tất cả đều đúng
Câu 2*: Cho phản ứng N2 + 3H2 2NH3 H = -92KJ
Tìm phát biểu không phù hợp với phản ứng này A. N2 là chất Oxi hóa
B.Cần cung cấp 92KJ nhiệt lượng để 1 mol N2 kết hớp với 3 mol H2
C. Hiệu suất của phản ứng rất bé
D. Phản ứng chỉ xảy ra ở nhiệt độ cao, có xúc tác và áp suất cao
Câu 3: Cặp công thức của Litinitrua và nhôm nitrua là: A. LiN3 và Al3N B. Li3N và AlN C. Li2N3 và Al2N3 D. Li3N2 và Al3N2
Câu 4*: Muốn cho cân bằng của phản ứng nhiệt độ tổng hợp amoniac chuyển dịch sang
phải cần phải đồng thời.
A. Tăng áp suất và tăng nhiệt độ
C. Tăng áp suất và giảm nhiệt độ
B. Giảm áp suất và giảm nhiệt độ
D. Giảm áp suất và tăng nhiệt độ
Câu 5**: Phải dùng bao nhiêu lít khí nitơ và bao nhiêu lít khí Hidro để điều chế 17 gam
NH3? Biết rằng hiệu suất chuyển hóa thành amoniac là 25%. Các thể tích khí đo được ở đktc.
A. 44,8 lít N2 và 134,4 lít H2
C. 22,4 lít N2 và 67,2 lít H2
B. 22,4 lít N2 và 134,4 lít H2
D. 44,8 lít N2 và 67,2 lít H2
Câu 6**: Trong phương trình hóa học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu? A. 5 B. 7 C.9 D. 21
Câu 7**: Trong phương trình hóa học các phản ứng nhiệt phân thủy ngân (II) nitrat, tổng
các hệ số bằng bao nhiêu? A.5 B.7 C. 9 D. 21
Câu 8*: Phương trình điện li tồng cộng của H3PO4 trong dung dịch là: H 3- 3PO4 3H+ + PO4
Khi thêm HCl vào dung dịch
A. Cân băng trên chuyển dịch theo chiều thuận
B. Căn bằng trên chuyển dịch theo chiều nghịch
C. Cân bằng trên không bị chuyển dịch D. Nồng độ PO 3- 4 tăng lên
Câu 9: Trong các công thức sau đây, chọn công thức đúng của magie photphua A. Mg3(PO4)2 B. Mg(PO3)2 C. Mg3P2 D. Mg2P2O7
Câu 10*: Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch
A. Axit nitric và đồng (II) nitrat B. Đồng (II) nitrat và amoniac
C. Barihidroxit và axit photphoric D. Amoni hidrophotphat và kalihidroxit
Câu 11: Khí nitơ có thể được tạo thành phản ứng hóa học nào sau đây?
A. Đốt cháy NH3 trong Oxi có chất xúc tác platin B. Nhiệt phân NH4NO3 C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
Câu 12: Trong dãy nào sau đây tất cả các muối đều ít tan trong nước?
A. AgNO3, Na3PO4, CaHPO4, CaSO4 C. AgCl, PbS, Ba(H2PO4)2, Ca(NO3)2
B. AgI, CuS, BaHPO4, Ca3(PO4)2 D. AgF, CuSO4, BaCO3, Ca(H2PO4)2
Câu 13: Dung dịch axit photphoric có chứa các ion ( không kể H+ và OH- của nước) A. H+, PO 3- - 3- 4 B. H+, H2PO4 , PO4 C. H+, HPO 2- 3- - 2- 3- 4 , PO4
D. H+, H2PO4 , HPO4 , PO4
Câu 14: Khi đun nóng, phản ứng giữa cặp chất nào sau đây tạo ra ba oxit?
A. Axit nitric đặc và cacbon
C. Axit nitric đặc và đồng
B. Axit nitric đặc và lưu huỳnh
D. Axit nitric đặc và bạc
Câu 15: Trong những nhận xét dưới đây về muối nitrat của kim loại, nhận xét nào là không đúng?
A. Tất cả các muối nitrat đều dễ tan trong nước
B. Các muối nitrat đều là chất điện li mạnh, khi tan trong nước phân li ra cation kim loại và anion nitrat.
C. Các muối nitrat đều dễ bị phân hủy bởi nhiệt
D.Các muối nitrat chỉ được sử dụng làm phân bón hóa học trong nông nghiệp.
Câu 16: Trong những nhận xét dưới đây về muối amoni, nhận xét nào là đúng?
A. Muối amoni là tinh thể ion, phân tử gồm cation amoni và anion hidroxit
B.Tất cả các muối amoni đều dễ tan trong nước, khi tan điện li hòa toàn thành
cation amoni và anion gốc axit.
C.Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất
khí làm quỳ tím hóa đỏ
D.Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra
Câu 17: Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính
khử vừa thể hiện tính Oxi hóa khi tham gia phản ứng ? A. NH3, N2O5, N2, NO2 B. N2, NO, N2O, N2O5 C. NH3, NO, HNO3, N2O5 D. NO2, N2, NO, N2O3
Câu 18: Trong dung dịch amoniac là một bazơ yếu là do:
A. Amoniac tan nhiều trong nước
B. Phân tử amoniac là phân tử có cực
C. Khi tan trong nước, amoniac kết hợp với nước tạo ra các ion NH + 4 và OH-
D.Khi tan trong nước, chỉ một phần nhỏ các phân tử amoniac kết hợp với ion H+
của nước tạo ra các ion NH + 4 và OH-
Câu 19: Trong những nhận xét dưới đây nhận xét nào là không đúng?
A.Nguyên tử nitơ có 2 lớp electron và lớp ngoài cùng có 3 lớp electron
B.Số hiệu của nguyên tử nitơ bằng 7
C.3 electron ở phân lớp 2p của nguyên tử nitơ có thể tạo được 3 liên kết cộng hóa
trị với các nguyên tử khác
D.Cấu hình electron của nguyên tử nitơ là 1s22s22p3 và nitơ là nguyên tố p
Câu 20: Trong những nhận xét dưới đây nhận xét nào là đúng?
A.Nitơ không duy trì sự hô hấp và nitơ là một khí độc
B.Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitơ khá trơ về mặt hóa học
C.Khi tác dụng với kim loại hoạt động, nitơ thể hiện tính khử
D.Số Oxi hóa của nitơ trong các hợp chất và ion AlN, N + - - 2O4, NH4 , NO3 , NO2 , lần lượt là -3, +4, -3,+5,+3.
Câu 21**: Khi hòa tan 30 g hổn hợp đồng và đồng (II) oxit trong dung dịch HNO3 1M
lấy dư, thấy thoát ra 6,72 lít khí NO (đktc). Khối lượng của đồng (II) oxit trong hổn hợp ban đầu là A. 1,2 g B. 4,25g C. 1,88 g D. 2,52g
Câu 22**: Đốt cháy hoàn toàn 6,2 g photpho trong Oxi lấy dư. Cho sản phẩm tạo thành
tác dụng với 15 ml dung dịch NaOH 2M. Sau phản ứng, trong dung dịch thu được các muối A. NaH2PO4 và Na2HPO4 C. NaH2PO4 và Na3PO4 B. Na2HPO4 và Na3PO4 D. Na3PO4
Câu 23**: Phân đạm Urê thường chỉ chứa 46% N. Khối lượng (kg) urê đủ để cung cấp 70 kg N là: A. 152,2 B. 145,5 C. 160,9 D. 200
Câu 24**: Phân supephotphat kép thực tế sản xuất được thường chỉ ứng với 40% P2O5 .
Hàm lượng (%) của canxi đihidrophotphat trong phân bón này là: A. 69 B. 65,9 C. 71,3 D. 73,1
Câu 25**: Phân Kali clorua sản xuất
được từ quặng xinvinit
thường chỉ ứng với 50%K2O. Hàm lượng (%) của KCl trong phân bón đó là: A. 72,9 B. 76 C. 79,2 D. 75,5
Câu 26**: Hòa tan 12,8g kim loại hóa trị II trong 1 lượng vừa đủ dung dịch HNO3 60%
(D = 1,365g/ml), thu được 8,96 lít (đktc) một khí duy nhất màu nâu đỏ. Tên của kim loại
và thể tích dung dịch HNO3 đã phản ứng là: A. đồng; 61,5ml B. chì; 65,1 ml C. thủy ngân;125,6 ml D. sắt; 82,3 ml
Câu 27: Dung dịch amoniac có thể hòa tan được Zn(OH)2 là do:
A. Zn(OH)2 là hidroxit lưỡng tính
B. Zn(OH)2là một bazơ ít tan
C.Zn(OH)2 có khả năng tạo thành phức chất tan, tương tự như Cu(OH)2
D.NH3 là một hợp chất có cực và là một bazơ yếu.
Câu 28: Có thể phân biệt muối amoni với các muối khác bằng cách cho nó tác dùng với
dung dịch kiềm, vì khí đó:
A. Thoát ra một chất khí màu lục nhạc
B.Thoát ra một chất khí không màu, mùi khai, làm xanh giấy quỳ tím ẩm
C.Thoát ra một chất khí màu nâu đỏ, làm xanh giấy quỳ tím ẩm
D.Thoát ra chất khí không màu, không mùi
Câu 29: Hợp chất nào sau đây của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại ? A. NO B. NH4NO3 C. NO2 D. N2O5
Câu 30**: Phản ứng giữa HNO3 với FeO tạo ra khí NO. Tổng các hệ số trong phương
trình của phản ứng Oxi hóa khử này bằng: A. 22 B. 20 C. 16 D. 12
Câu 31**: Phản ứng giữa kim loại magiê với axit nitric đặc, giả thiết chỉ tạo ra đinitơ
oxit. Tổng các hệ số trong phương trình hóa học bằng: A. 10 B. 18 C. 24 D. 20
Câu 32**: Phản ứng giữa kim loại Cu với Axit nitrric loãng giả thiết chỉ tạo ra nitơ
monoxit. Tổng các hệ số trong phương trình hóa học bằng: A. 10 B. 18 C. 24 D. 20
Câu 33:Magiê photphua có công thức là: A. Mg2P2O7 B. Mg2P3 C. Mg3P2 D.Mg3(PO4)2
Câu 34**: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. sau phản ứng dung dịch có các muối: A.KH2PO4 và K2HPO4 B. K2HPO4 và K3PO4 C. KH2PO4 và K3PO4 D. KH2PO4, K2HPO4 và K3PO4
Câu 35: Chọn công thức đúng của apatit A. Ca3(PO4)2 B. Ca(PO3)2 C. 3Ca3(PO4)2CaF2 D. CaP2O7
Câu 36**: Cho 44g NaOH vào dung dịch chứa 39,2 g H3PO4. Sau khi phản ứng xảy ra
hoàn thành, đem cô cạn dung dịch thu được đến cạn khô. Hỏi những muối nào được tạo
nên và khối lượng muối khan thu được là bao nhiêu ? A. Na3PO4 và 50g C. NaH2PO4 và 42,9g; Na2HPO4 và 14,2 g B. Na2HPO4 và 15g D. Na2HPO4 và 14,2 g; Na3PO4 và 49,2 g
Câu 37: Trong những nhận xét sau đây, nhận xét nào là sai?
Trong nhóm nitơ, từ nitơ đến bimut
A. Nguyên tử của các nguyên tố đều có 5 electron ở lớp ngoài cùng
B.Nguyên tử của các nguyên tố đều có cùng số lớp electron
C.Bán kính nguyên tử của các nguyên tố tăng dần
D.Độ âm điện của các nguyên tố giảm dần
Câu 38: Trong những nhận xét sau đây, nhận xét nào là sai?
Trong nhóm nitơ, từ nitơ đến bimut
A. Khả năng Oxi hóa giảm dần do độ âm điện giảm dần
B.Tính phi kim tăng dần đồng thời tính kim loại giảm dần
C.Hợp chất khí với hidrô RH3 có đồ bền nhiệt giảm dần và dung dịch không có tính Axit
D.Tính Axit của các oxit giảm dần, đồng thời tính bazơ tăng dần
Câu 39: Chọn ra ý không đúng trong các ý sau:
a) Nitơ có độ âm điện lớn hơn photpho
b) Ở điều kiện thường nitơ hoạt động hóa học yếu hơn photpho
c) Photpho đỏ hoạt động hóa học mạnh hơn photpho trắng
d) Photpho có công thức hóa trị cao nhất là 5, số oxi hóa cao nhât là +5
e) Photpho chỉ có tính oxi hóa, không có tính khử A. b, e B. c,e C. c. d D. e
Câu 40: Khí nitơ tương đối trơ ở nhiệt độ thường là do:
A. Nitơ có bán kính nguyên tử nhỏ.
B. Nguyên tử nitơ có độ âm điện lớn nhất trong nhóm nitơ
C. Trong phân tử N2, mỗi nguyên tử nitơ còn một cặp electron chưa tham gia liên kết
D.Trong phân tử N2 có liên kết 3 rất bền
Câu 41*: Một nhóm học sinh chưa thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch NH3
cho đến dư vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng quan sát đầy đủ và đúng nhất là:
A. Có kết tủa màu xanh lam tạo thành
B. Có dung dịch màu xanh thẩm tạo thành
C.Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dung dịch màu xanh thẩm.
D.Có kết tủa màu xanh lam tạo thành, có khí màu nâu đỏ thoát ra
Giải thích các hiện tượng và viết phương trình hóa học
Câu 42: Amoniac phản ứng được với tất cả các chất trong nhóm nào sau đây ( các điều kiện coi như có đủ)
A. HCl, O2, Cl2, CuO, dung dịch AlCl3 B. H2SO4, PbO, FeO, NaOH C. HCl, KOH, FeCl3, Cl2 D. KOH, HNO3, CuO, CuCl2
Câu 43: Nhận xét nào sau đây là sai?
A. Tất cả muối amoni dều dễ tan trong nước
B.Trong nước, muối amoni điện li hoàn toàn cho ion NH + 4 không màu và chỉ tạo ra môi trường Axit
C.Muối amoni kém bền với nhiệt
D.Muối amoni phản ứng với dung dịch kiềm đặc, nóng giải phóng khí amoniac
Câu 44: Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây? A. (NH4)3PO4 B. NH4HCO3 C. CaCO3 D. NaCl
Câu 45: Một nhóm học sinh thực hiện thí nghiệm cho kim loại Cu tác dụng với dung
dịch HNO3 đặc. Hiện tượng quan sát nào sau đây là đúng?
A. Khí không màu thoát ra, dung dịch chuyển sang màu xanh
B. Khí màu nâu đỏ thoát ra, dung dịch không màu
C.Khí màu nâu đỏ thoát ra, dung dịch chuyển sang màu xanh
D.Khí không màu thoát ra, dung dịch không màu
Câu 46*: Axit nitric đặc , nóng phản ứng được với tất cả các chất trong nóm nào sau đây?
A. Mg(OH)2, CuO, NH3, Ag B. Mg(OH)2, CuO, NH3, Pt C. Mg(OH)2, NH3, CO2, Au D. CaO, NH3, Au, FeCl2
Câu 47**: Hòa tan 1,2 g kim loại X vào dung dịch HNO3 dư thu được 0,22 lít khí nitơ ở
đktc (giả thiết phản ứng chỉ tạo ra khí N2). Vậy X là: A. Zn B. Cu C. Mg D. Al
Câu 48*: Khi bị nhiệt phân, dãy muối nitrat nào sau đây dều cho sản phẩm là kim loại ,
khí nitơ đioxit và khí Oxi A. Zn(NO3)2, KNO3, Pb(NO3)2 B. Cu(NO3)2, LiNO3, KNO3 C. Ca(NO3)2, LiNO3, KNO3 D. Hg(NO3)2, AgNO3
Câu 49**: Đốt cháy hổn hợp gồm 6,72 lít khí Oxi và 7 lít khí amoniac ( đo ở cùng điều
kiện nhiệt độ và áp suất). Sau phản ứng thu được nhóm các chất là: A. Khí nitơ và nước
C. Khí Oxi, khí nitơ và nước
B. Khí amoniac, khí nitơ và nước
D. Khí nitơ oxit và nước
Câu 50: Ở điều kiện thường, photpho hoạt động hóa học mạnh hơn nitơ là do:
A. Nguyên tử photpho độ âm điện nhỏ hơn nguyên tử nitơ
B. Nguyên tử photpho có điện tích hạt nhân lớn hơn nguyên tử nitơ.
C. Nguyên tử photpho có obitan 3d còn trống còn nguyên tử nitơ không có
D.Liên kết giữa các nguyên tử trong phân tử photpho kém bền hơn liên kết giữa
các nguyên tử trong phân tử nitơ




