













Preview text:
CỘNG HƯỞNG - TÍNH THƠM VÀ TÍNH CHẤT
Câu 1. Trong số các chất sau đây, chất nào thuộc loại hợp chất thơm, không thơm, phản thơm, vì sao?
Chất nào tác dụng được với kali kim loại trong đietyl ete? Viết phương trình phản ứng và giải thích.
Câu 2: VNCho 2018
1) Cho các chất sau đây:
a) Giữa A1 và A2, chất nào dễ tham gia phản ứng với Br2 theo cơ chế cộng electrophin (vào liên kết đôi C=C)? Giải thích.
b) So sánh lực axit giữa A2 và A3. Giải thích.
c) Trong số các chất: A4, A5 và A6, chất nào có lực bazơ lớn nhất? Giải thích. Câu 3:
Hãy cho biết những chất nào a) có tính thơm? b) phản thơm? c) không thơm?
d) không thơm nhưng có cấu trúc cộng hưởng có tính thơm?
e) không thơm nhưng có base liên hợp có tính thơm?
f) không thơm, có pKa xấp xỉ -3.8. Câu 4:
1. Vẽ cấu trúc của 1,3-diazole (imidazole, C3H4N2), anion imidazol-1-yl, cation imidazolyl, 1,3-
oxazole (oxazole, C3H NO) and 1,3-thia 3
zole (thiazole, C3H NS). Cấu trúc nào thơm? 3
2. Sắp xếp imidazole, 1,3-oxazole and 1,3-thiazole theo chiều giảm dần nhiệt độ sôi, nhiệt độ nóng chảy, giải thích?
3. Sử dụng cấu trúc viết quá trình ion hóa imidazole, oxazole, và thiazole trong nước. Sắp xếp
theo chiều giảm dần tính bazơ và giải thích? Câu 5.
1. So sánh và giải thích ngắn gọn các tính chất sau đây:
a.So sánh tính axit của H trong các phân tử sau: Chuyên đề hữu cơ HSGQG Page 1
b. So sánh nhiệt độ sôi của các chất sau: 2.Cho các chất:
a. Giải thích tại sao mômen lưỡng cực của D C
(0,7 D), nhỏ hơn của (1,7D)
b. So sánh nhiệt độ sôi của A B , , C D
, , giải thích ngắn gọn.
c. Bằng phương pháp hóa học, hãy nhận biết 2 chất lỏng trong suốt riêng biệt: xiclopentan và THF (chất C). Câu 6:
Hằng số tốc độ phản ứng xà phòng hóa bằng NaOH trong đioxin và nước các dẫn xuất thế m- và p-
metylbenzoat được liệt kê dưới đây. Dựa trên cấu trúc (gồm cả các trạng thái cộng hưởng có thể có)
giải thích sự khác biệt vận tốc phản ứng của các phản ứng này. k(M-1.phút-1) k(M-1.phút-1) Metyl p-nitrobenzoat 102 Metyl benzoat 1,70 Metyl m-nitrobenzoat 63 Metyl p-metylbenzoat 0,98 Metyl m-clobenzoat 9,1 Metyl p-metoxybenzoat 0,42 Metyl m-brombenzoat 8,6 Metyl p-aminobenzoat 0,06 Câu 7:
a. Hãy giải thích vì sao μ của hợp chất sau có giá trị lớn (5,6 D):
b. Hãy giải thích vì sao (A) có hằng số axit K 7
a cao gấp khoảng 10 lần (B): Câu 8:
1. Cho các hợp chất và ion sau: + A B C D E F
Chỉ rõ những hợp chất và ion thơm? Giải thích.
2. Viết công thức cấu tạo và giải thích các hiện tượng sau:
a. Xiclopropenon có momen lưỡng cực rất lớn
b. X có momen lưỡng cực lớn hơn Y. Chuyên đề hữu cơ HSGQG Page 2
c. 3,4-Đibrôm-1,2,3,4-tetraphenylxiclobut-1-en tác dụng AgBF sinh ra hợp chất rắn màu đỏ. 4
d. Xicloocta-1,3,5,7-tetraen tác dụng với K tạo hợp chất rắn. 3. Cho các axitsau: F: axit fumaric S: axit squaric C: axit croconic M: axit maleic D: axit dentic a. Giải thích:
- Vì sao pKa của M < F nhưng pKa 1 M >F 2
- Vì sao pKa của S xấp xỉ M nhưng pKa 1 S nhỏ hơn nhiều M 2
b. So sánh pKa của D, S với pKa của C.
c. Viết phương trình phản ứng khi cho S và D tác dụng lượng dư NaHCO3
4. Bốn hợp chất có trong thiên nhiên đều không chứa nhóm cacboxyl xong đều có tính axit là: A: axit ascobic pKa=4,2 T: axit tereic B: axit bacbituric pKa 4 U: axit uric (pKa= 3,9)
Giải thích vì sao các chất trên có tính axit. Bài 9
1) Imidazole là một base, tạo thành acid liên hợp với pKa 7.05. Nguyên tử nitrogen nào bị proton hóa
trong phản ứng acid-base sau?
2) pKa của cyclopentane cao hơn nhiều pKa của imidazolidine, thể hiện rằng độ âm điện của nitrogen có
tác động đáng kể. Còn pKa của imidazole chỉ cao hơn một chút so với pKa của cyclopentadiene. Tại
sao cyclopentadiene lại có tính acid cao hơn nhiều so với dự kiến? Chuyên đề hữu cơ HSGQG Page 3
3) Thường thì phản ứng tạo thành enol ngay lập tức sẽ bị hỗ biến thành dạng keto, như trong chuyển
hóa giữa cyclohexenol thành cyclohexanone. Tuy nhiên, một phản ứng như vậy sẽ ưu tiên chuyển
thành dạng enol của pyridine-2-ol hơn là dạng keto của pyridine-2-one. Giải thích tại sao.
4) Ketone nào phân cực hơn: cyclopropanone hay cycloprop-2-enone? Giải thích.
5) Các DNA base đều có tính thơm. Hãy vẽ các cấu trúc cộng hưởng để chỉ rõ đặc tính thơm của chúng. Bài 10:
1) Giải thích tại sao squaric acid bị ion hóa hoàn toàn (phân li cả hai proton) trong nước.
2) Giải thích tại sao guanidine là một trong những base hữu cơ không mang điện mạnh nhất từng được biết tới.
3) Giải thích tại sao tính acid của cyclopentadiene mạnh hơn nhiều so với indene. Chuyên đề hữu cơ HSGQG Page 4
ĐÁP ÁN CỘNG HƯỞNG - TÍNH THƠM VÀ TÍNH CHẤT
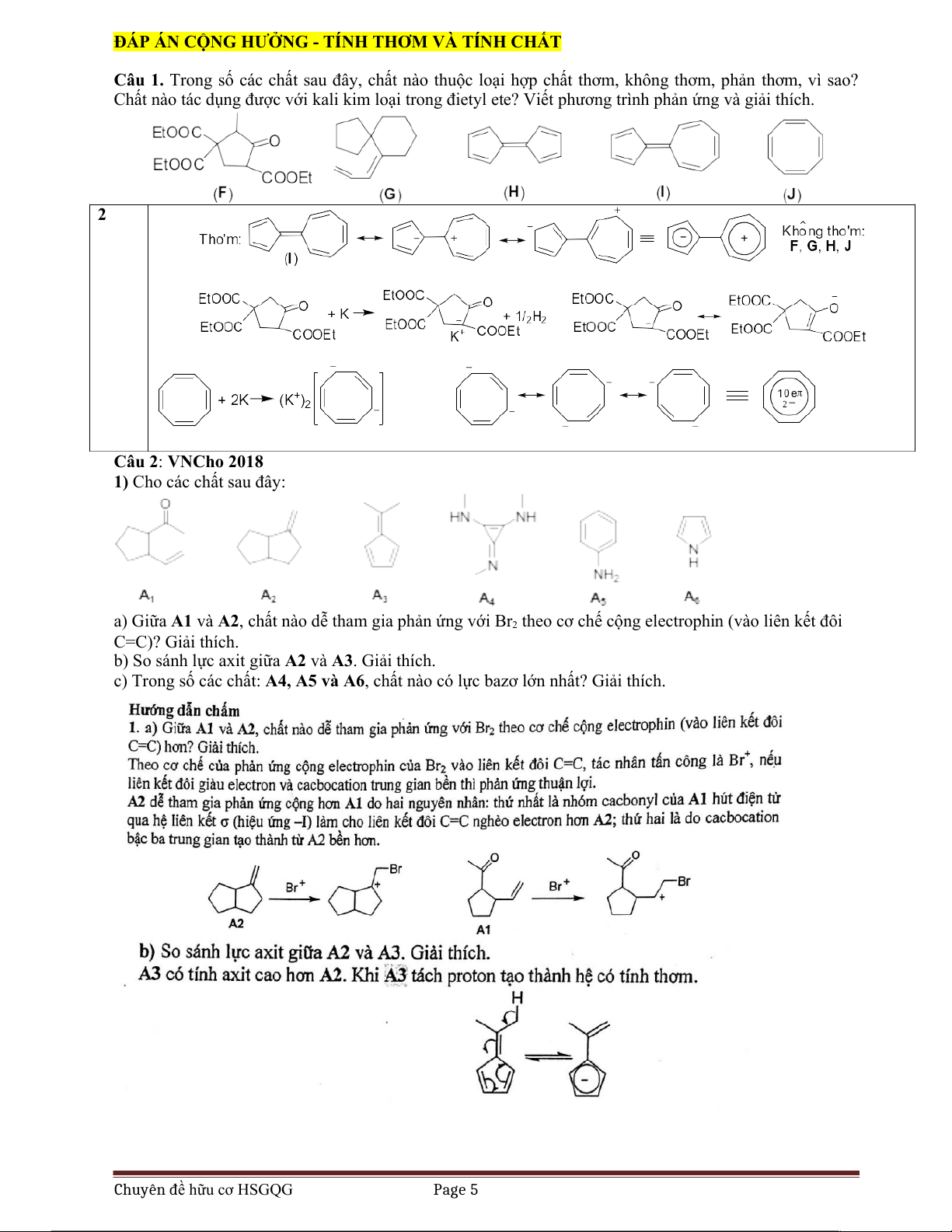
Câu 1. Trong số các chất sau đây, chất nào thuộc loại hợp chất thơm, không thơm, phản thơm, vì sao?
Chất nào tác dụng được với kali kim loại trong đietyl ete? Viết phương trình phản ứng và giải thích. 2 Câu 2: VNCho 2018
1) Cho các chất sau đây:
a) Giữa A1 và A2, chất nào dễ tham gia phản ứng với Br2 theo cơ chế cộng electrophin (vào liên kết đôi C=C)? Giải thích.
b) So sánh lực axit giữa A2 và A3. Giải thích.
c) Trong số các chất: A4, A5 và A6, chất nào có lực bazơ lớn nhất? Giải thích. Chuyên đề hữu cơ HSGQG Page 5 Câu 3:
Hãy cho biết những chất nào g) có tính thơm? h) phản thơm? i) không thơm?
j) không thơm nhưng có cấu trúc cộng hưởng có tính thơm?
k) không thơm nhưng có base liên hợp có tính thơm?
l) không thơm, có pKa xấp xỉ -3.8. Câu 4:
1. Vẽ cấu trúc của 1,3-diazole (imidazole, C3H4N2), anion imidazol-1-yl, cation imidazolyl, 1,3-
oxazole (oxazole, C3H NO) and 1,3-thia 3
zole (thiazole, C3H NS). Cấu trúc nào thơm? 3
2. Sắp xếp imidazole, 1,3-oxazole and 1,3-thiazole theo chiều giảm dần nhiệt độ sôi, nhiệt độ nóng chảy, giải thích?
3. Sử dụng cấu trúc viết quá trình ion hóa imidazole, oxazole, và thiazole trong nước. Sắp xếp
theo chiều giảm dần tính bazơ và giải thích?
1.(0,75 điểm) Cấu trúc Thơm hay không thơm Imidazole (C3H4N2) thơm Imidazol-1-yl anion thơm (C3H N 3 2) Imidazolyl cation (C Câu 4 3H5N2) thơm Oxazole (C3H3NO) thơm Thiazole (C3H3NS) thơm
2. (0,75 điểm) Tonc
Imidazole > Thiazole > Oxazole
Imidazole lớn nhất do liên kết H liên phân tử. Thiazole lớn Giải thích
hơn oxazole do khối lượng phân tử và độ phân cực lớn hơn. Chuyên đề hữu cơ HSGQG Page 6 Tos
Imidazole > Thiazole > Oxazole
Imidazole lớn nhất do liên kết H liên phân tử. Thiazole lớn Giải thích
hơn oxazole do khối lượng phân tử và độ phân cực lớn hơn. 3. (0,5 điểm) Phản ứng ion hóa Kb
Imidazole > Thiazole > Oxazole Lý do
Axit liên hợp của imidazole có sự giải tỏa đối xứng, tạo liên kết
H mạnh hơn với nước, do đó có lực bazo mạnh hơn oxadiazole
và thiazole. O có độ âm điện lớn hơn N và S, nên làm giảm mật
độ e trên N ở oxazole, làm giảm độ bền của axit liên hợp của
oxazole nên lực bazo yếu nhất. Câu 5.
1. So sánh và giải thích ngắn gọn các tính chất sau đây:
a.So sánh tính axit của H trong các phân tử sau:
b. So sánh nhiệt độ sôi của các chất sau: 2.Cho các chất:
a. Giải thích tại sao mômen lưỡng cực của D C
(0,7 D), nhỏ hơn của (1,7D)
b. So sánh nhiệt độ sôi của A B , , C D
, , giải thích ngắn gọn.
c. Bằng phương pháp hóa học, hãy nhận biết 2 chất lỏng trong suốt riêng biệt: xiclopentan và THF (chất C). Hướng dẫn chấm:
1. Làm đúng ý 1 được 1 điểm: Mỗi ý so sánh và giải thích được 0,25 điểm.
a.Tính axit của A>C>B. A tạo ra anion là hệ thơm, B tạo ra anion là hệ phản thơm, C tạo ra anion hệ không thơm.
b. Nhiệt đội sôi D>F>E. D tạo liên kết H liên phân tử, F có phân tử khối lớn hơn . E
2.Làm đúng ý 2 được 1,5 điểm: Mỗi ý nhỏ được 0,5 điểm. a.Giải thích:
C có hiệu +I của 2 nhóm CH2, do vậy vectơ momen lưỡng cực được biểu diễn như sau:
D có hiệu ứng liên hợp của O vào hệ electron nên electron dồn ngược lại vào hệ liên kết C-C: Chuyên đề hữu cơ HSGQG Page 7
Hiệu ứng –I của O trong phân tử D không lớn bằng C do nguyên tử Csp2 có độ âm điện lớn hơn Csp3.
b.So sánh nhiệt độ sôi:
A>C>B>D.
Phân tử Acó M lớn hơn, tương tác khuếch tán mạnh hơn do có 2 nguyên tử O.
B mạch hở, nên 2 nhóm thế có thể quay tự do, phân tử khó liên kết, hơn nữa làm momen lưỡng cực nhỏ hơn so với C.
Phân tử D có mômen lưỡng cực nhỏ hơn . B
c. Nhận biết: THF có nguyên tử oxi còn 2 cặp e không tham gia liên kết, do vậy THF có tính bazơ.
Thuốc thử nhận biết là dung dịch H2SO4 đặc. THF tan trong dung dịch H2SO 4đặc tạo thành dung dịch
đồng nhất. Xiclopentan khi cho vào dung dịch H2SO đặc không phản ứng và phân lớp. 4 Câu 6:
Hằng số tốc độ phản ứng xà phòng hóa bằng NaOH trong đioxin và nước các dẫn xuất thế m- và p-
metylbenzoat được liệt kê dưới đây. Dựa trên cấu trúc (gồm cả các trạng thái cộng hưởng có thể có)
giải thích sự khác biệt vận tốc phản ứng của các phản ứng này. k(M-1.phút-1) k(M-1.phút-1) Metyl p-nitrobenzoat 102 Metyl benzoat 1,70 Metyl m-nitrobenzoat 63 Metyl p-metylbenzoat 0,98 Metyl m-clobenzoat 9,1 Metyl p-metoxybenzoat 0,42 Metyl m-brombenzoat 8,6 Metyl p-aminobenzoat 0,06 Câu 7:
a. Hãy giải thích vì sao μ của hợp chất sau có giá trị lớn (5,6 D):
b. Hãy giải thích vì sao (A) có hằng số axit K 7
a cao gấp khoảng 10 lần (B): Câu Nội dung Điểm 7.1
Các nhóm thế hút electron hoạt nhóm cacbonyl, làm thuận lợi cho phản ứng thế SN2(CO). 1,0
Nhóm thế m-Cl gây gây –I mạnh hơn m-Br (do độ âm điện Cl lớn hơn), nên vận tốc của
dẫn xuất thế này lớn hơn. Nhóm thế O N gây cả 2
-I và –C nên vận tốc phản ứng nhanh hơn
nhóm thế halogen. Tuy nhiên, nhóm thế p-O N 2
đặt điện tích dương lên C cạnh nhóm
cacbonyl (cộng hưởng A) nên hoạt hóa nhóm này mạnh hơn nhóm thế m-O N 2 (xem cộng hưởng B).
Ngược lại, các nhóm đẩy electron phản hoạt hóa nhóm cacbonyl, làm giảm tốc độ
phản ứng. Nhóm p-CH 3gây +H phản hoạt hóa ít hơn các nhóm p-CH O 3 và p-H N 2
(gây +C). Vì N lại dễ nhường cặp electron hơn O (độ âm điện nhỏ hơn), nên p-H N 2
phản hoạt hóa nhóm cacbonyl nhiều hơn. Chuyên đề hữu cơ HSGQG Page 8 7.2.
Hợp chất này có thể tồn tại ở dạng có hai vòng thơm: một vòng mang điện dương, vòng 0,5 còn lại mang điện âm: 7.3.
Đietyl malonat (B) tồn tại ở dạng enol có liên kết H nội phân tử. Nhóm OH enol của (B) 0,5
gây ra tính axit của hợp chất này. Tuy nhiên, liên kết H nội phân tử làm giảm mạnh tính axit của nhóm OH enol:
(A) không tạo được liên kết H nội phân tử. Nhóm metilen chịu ảnh hưởng của hai nhóm
C=O este. Tính axit gây ra do H linh động của nhóm metilen này. Câu 8:
1. Cho các hợp chất và ion sau: + A B C D E F
Chỉ rõ những hợp chất và ion thơm? Giải thích.
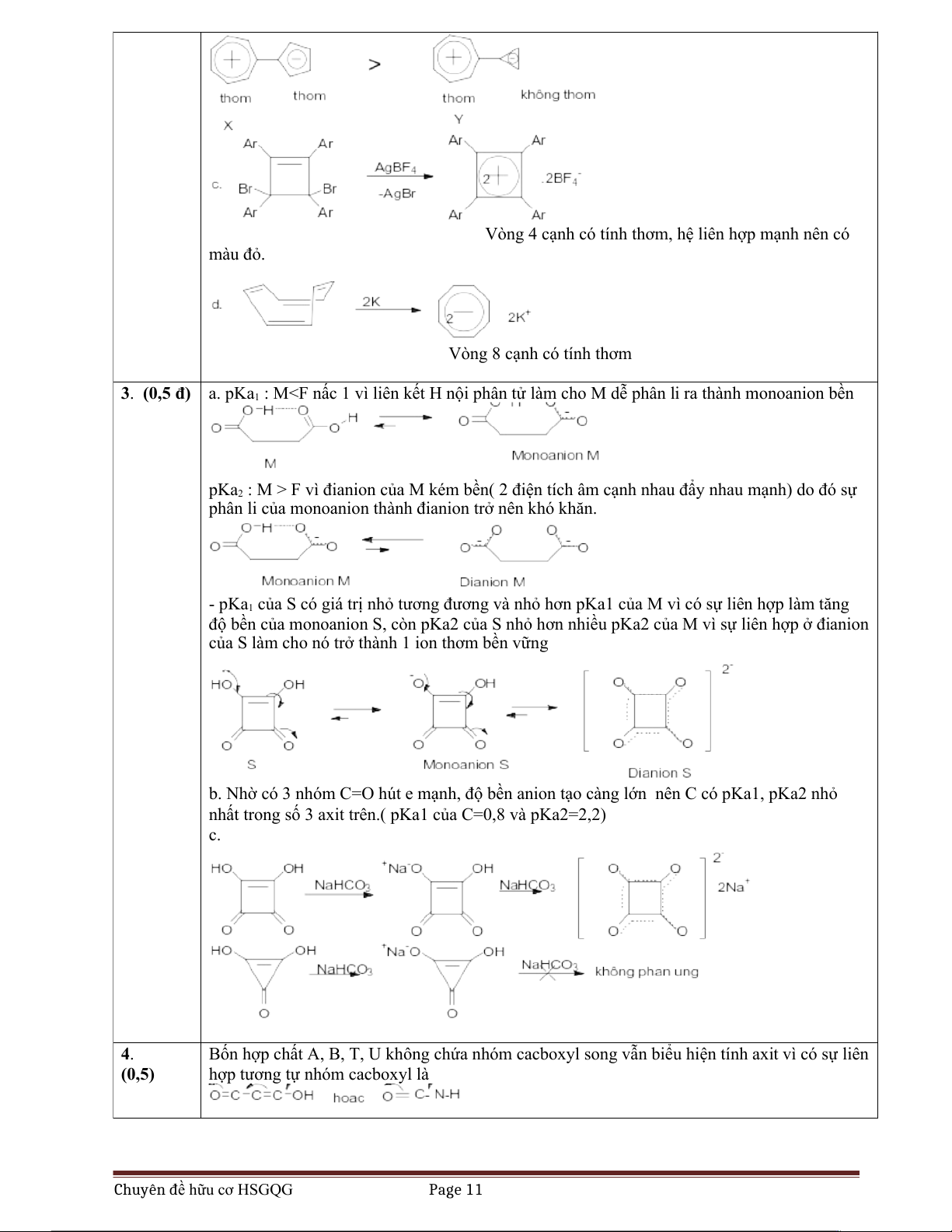
2. Viết công thức cấu tạo và giải thích các hiện tượng sau:
a. Xiclopropenon có momen lưỡng cực rất lớn
b. X có momen lưỡng cực lớn hơn Y.
c. 3,4-Đibrôm-1,2,3,4-tetraphenylxiclobut-1-en tác dụng AgBF sinh ra hợp chất rắn màu đỏ. 4
d. Xicloocta-1,3,5,7-tetraen tác dụng với K tạo hợp chất rắn. 3. Cho các axitsau: F: axit fumaric S: axit squaric C: axit croconic M: axit maleic D: axit dentic Chuyên đề hữu cơ HSGQG Page 9 a. Giải thích:
- Vì sao pKa của M < F nhưng pKa 1 M >F 2
- Vì sao pKa của S xấp xỉ M nhưng pKa 1 S nhỏ hơn nhiều M 2
b. So sánh pKa của D, S với pKa của C.
c. Viết phương trình phản ứng khi cho S và D tác dụng lượng dư NaHCO3
4. Bốn hợp chất có trong thiên nhiên đều không chứa nhóm cacboxyl xong đều có tính axit là: A: axit ascobic pKa=4,2 T: axit tereic B: axit bacbituric pKa 4 U: axit uric (pKa= 3,9)
Giải thích vì sao các chất trên có tính axit. Ý Nội dung 1
Theo Huckel, hợp chất thơm có cấu trúc vòng phẳng, liên hợp kín và số e,n tham gia liên (0,5đ) hợp là 4k+2.Vậy nên:
A: không thơm(ko có liên hợp kín) E: thơm(k=2)
B: không thơm(không có k thỏa mãn) F: không thơm(vòng không phẳng, 2H gần nhau nên đẩy nhau)
C: Không thơm (không liên hợp kín) D: thơm (k=0)
G, H, I là những hệ dung hợp nên mặc dù có 1 số đặc điểm không thõa mãn Huckel nhưng
tính thơm lại được xét do sự tồn tại dạng ion thơm dung hợp
G: thơm(k=2), dường như do 2 ion thơm dung hợp với nhau:
H, I không có những đặc điểm trên nên không thơm. 2.(0,5)
a. Xiclopropennon có momen lưỡng cực rất lớn do phân tử rât phân cực , ở dạng ion lưỡng
cực vòng 3 cạnh có tính thơm nên bền:
b. X có momen lưỡng cực lớn hơn vì dạng ion lưỡng cực là dạng bền do cả 2 ion tạo nên X có tính thơm (theo Huckel) Chuyên đề hữu cơ HSGQG Page 10
Vòng 4 cạnh có tính thơm, hệ liên hợp mạnh nên có màu đỏ. Vòng 8 cạnh có tính thơm
3. (0,5 đ) a. pKa : M1 i ra thành monoanion bền
pKa2 : M > F vì đianion của M kém bền( 2 điện tích âm cạnh nhau đẩy nhau mạnh) do đó sự
phân li của monoanion thành đianion trở nên khó khăn.
- pKa1 của S có giá trị nhỏ tương đương và nhỏ hơn pKa1 của M vì có sự liên hợp làm tăng
độ bền của monoanion S, còn pKa2 của S nhỏ hơn nhiều pKa2 của M vì sự liên hợp ở đianion
của S làm cho nó trở thành 1 ion thơm bền vững
b. Nhờ có 3 nhóm C=O hút e mạnh, độ bền anion tạo càng lớn nên C có pKa1, pKa2 nhỏ
nhất trong số 3 axit trên.( pKa1 của C=0,8 và pKa2=2,2) c. 4.
Bốn hợp chất A, B, T, U không chứa nhóm cacboxyl song vẫn biểu hiện tính axit vì có sự liên (0,5)
hợp tương tự nhóm cacboxyl là Chuyên đề hữu cơ HSGQG Page 11 Bài 9
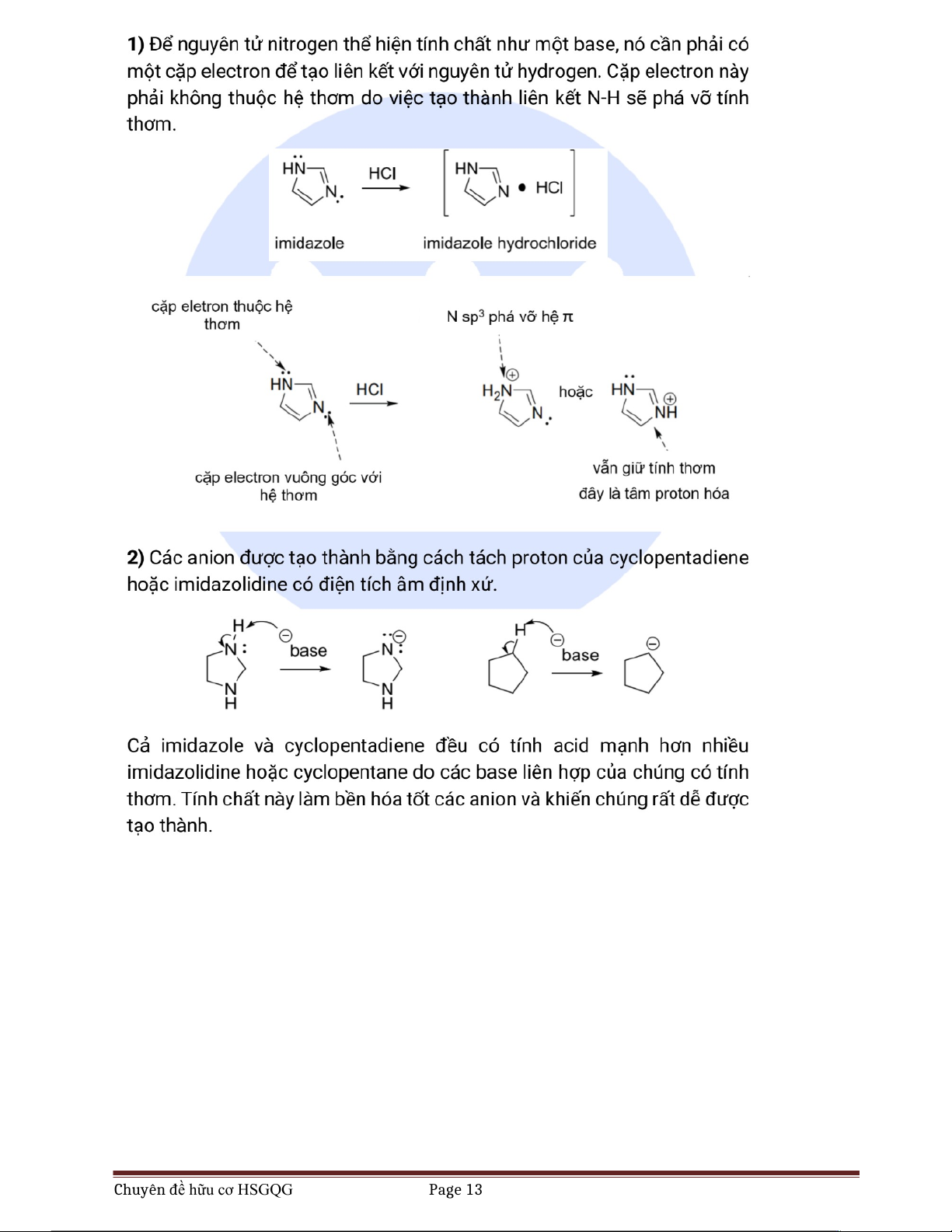
6) Imidazole là một base, tạo thành acid liên hợp với pKa 7.05. Nguyên tử nitrogen nào bị proton hóa
trong phản ứng acid-base sau?
7) pKa của cyclopentane cao hơn nhiều pKa của imidazolidine, thể hiện rằng độ âm điện của nitrogen có
tác động đáng kể. Còn pKa của imidazole chỉ cao hơn một chút so với pKa của cyclopentadiene. Tại
sao cyclopentadiene lại có tính acid cao hơn nhiều so với dự kiến?
8) Thường thì phản ứng tạo thành enol ngay lập tức sẽ bị hỗ biến thành dạng keto, như trong chuyển
hóa giữa cyclohexenol thành cyclohexanone. Tuy nhiên, một phản ứng như vậy sẽ ưu tiên chuyển
thành dạng enol của pyridine-2-ol hơn là dạng keto của pyridine-2-one. Giải thích tại sao.
9) Ketone nào phân cực hơn: cyclopropanone hay cycloprop-2-enone? Giải thích.
10) Các DNA base đều có tính thơm. Hãy vẽ các cấu trúc cộng hưởng để chỉ rõ đặc tính thơm của chúng. Chuyên đề hữu cơ HSGQG Page 12 Chuyên đề hữu cơ HSGQG Page 13 Chuyên đề hữu cơ HSGQG Page 14 Bài 10:
4) Giải thích tại sao squaric acid bị ion hóa hoàn toàn (phân li cả hai proton) trong nước.
5) Giải thích tại sao guanidine là một trong những base hữu cơ không mang điện mạnh nhất từng được biết tới. Chuyên đề hữu cơ HSGQG Page 15
6) Giải thích tại sao tính acid của cyclopentadiene mạnh hơn nhiều so với indene. Chuyên đề hữu cơ HSGQG Page 16 Chuyên đề hữu cơ HSGQG Page 17




