



Preview text:
Công thức, cách tính nồng độ mol của dung dịch cực hay
Bài viết dưới đây sẽ đem tới cho quý khách thông tin về Công thức, cách tính nồng độ mol
của dung dịch cực hay. Mong rằng thông tin chúng tôi đưa ra sẽ hữu ích cho quý khách
Mục lục bài viết
1. Hiểu thế nào về nồng độ mol?
2. Công thức, cách tính nồng độ mol của dung dịch
3. Bài tập vận dụng tính nồng độ mol
1. Hiểu thế nào về nồng độ mol?
Nồng độ mol (kí hiệu là CM) là một đại lượng trong lĩnh vực hóa học, được sử dụng để biểu thị số
mol của một chất hóa học cụ thể trong một thể tích dung dịch hoặc trong một không gian nhất
định. Nồng độ mol cho biết có bao nhiêu mol của chất đó trong một đơn vị thể tích hoặc không gian.
Công thức để tính nồng độ mol (CM) là:
CM = số mol chất (n) / thể tích dung dịch (V) Trong đó:
CM là nồng độ mol (đơn vị: mol/lít).
n là số mol của chất hóa học cụ thể.
V là thể tích dung dịch (đơn vị: lít).
Nồng độ mol giúp định lượng chất hóa học trong các phản ứng hóa học, cho phép các nhà hóa học
biết cần bao nhiêu chất để thực hiện một phản ứng cụ thể. Nó cũng được sử dụng để chuẩn bị các
dung dịch chuẩn và kiểm tra chất lượng trong phân tích hóa học.
Ví dụ: Nếu bạn có một dung dịch có nồng độ mol là 0.5 M (0.5 mol/lít) của một chất A, điều này
có nghĩa là trong mỗi lít dung dịch đó, có 0.5 mol của chất A.
2. Công thức, cách tính nồng độ mol của dung dịch
Để tính nồng độ mol (còn gọi là nồng độ molar) của một dung dịch, bạn cần biết số mol chất hóa
học có trong dung dịch và thể tích của dung dịch đó. Dưới đây là công thức và cách tính nồng độ mol của dung dịch: Công thức:
- Cách tính số mol qua thể tích: n = V/22.4 Trong đó:
n là số mol chất khí tại điều kiện tiêu chuẩn (đktc) với đơn vị tính: mol
V: thể tích của chất khí ở đktc (tính bằng lít)
- Tính số mol thông qua khối lượng: n = m/M Trong đó:
n là số mol, có đơn vị tính là mol
m là khối lượng được tính bằng gam
M là khối lượng mol chất, tính bằng g/mol Cách tính:
Tính số mol chất hóa học (n):
Số mol chất hóa học có thể được tính dựa trên khối lượng hoặc thể tích, tùy theo thông tin bạn có.
Nếu bạn có khối lượng chất hóa học (m) trong dung dịch và biết khối lượng mol của nó (M), bạn
có thể sử dụng công thức: n = m / M.
Nếu bạn có thông tin về thể tích khí (V) ở điều kiện tiêu chuẩn (22.4 lít/mol), bạn có thể tính số
mol bằng cách sử dụng công thức: n = V / 22.4 (đối với các chất khí).
Tính nồng độ mol (M):
Sau khi bạn đã tính được số mol (n), chỉ cần chia số mol đó cho thể tích dung dịch (V) để tính nồng độ mol.
Kết quả sẽ có đơn vị mol/lít (M).
Ví dụ: Nếu bạn có một dung dịch NaOH với khối lượng 40 gram và bạn biết khối lượng mol của
NaOH là 40 g/mol. Để tính nồng độ mol của dung dịch NaOH, bạn sẽ thực hiện các bước sau:
Tính số mol NaOH: n = m / M = 40 g / 40 g/mol = 1 mol
Tính nồng độ mol của dung dịch NaOH: M = n / V
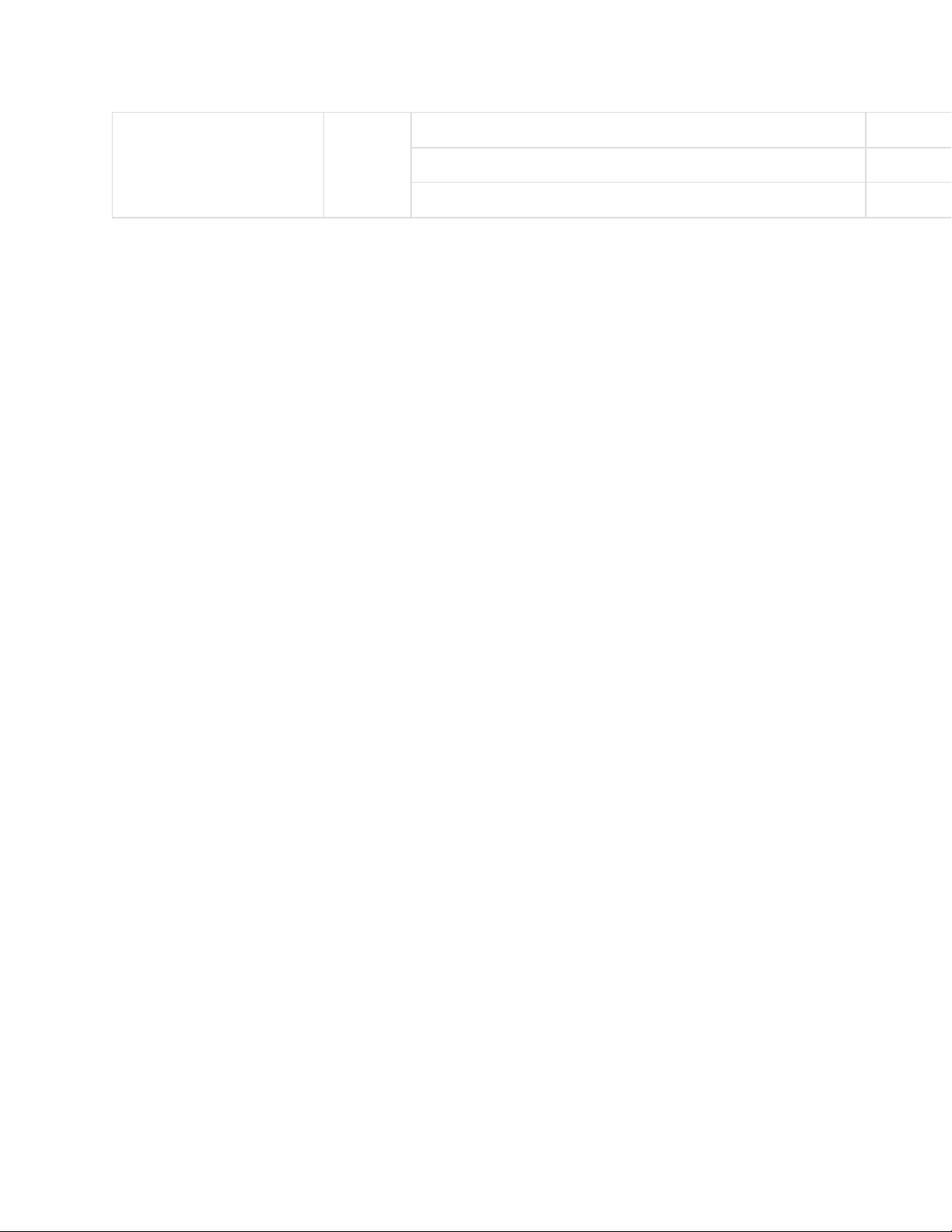
Một số cách tính khác Điều kiện Công thức Chú thích Đơn vị tính - n: số mol chất mol Khi có nồng độ mol/lít
n = CM.V - CM: nồng độ mol Mol/lit - V: thể tích dung dịch lit Nguyên tử hoặc
- A: số nguyên tử hay phân tử
Khi biết số nguyên tử hay phân tử n = A/N phân tử
- Số Avogadro (số đơn vị trong bất cứ một mol chất nào và có giá trị bằng 6.1023) - P: Áp suất 1 atm = 760mmHg - V: thể tích khí Lít
Tính số mol khí tại điều n = - R: hằng số 0,082 (hoặc 62400) kiện thường P.V/R.T
- T: nhiệt độ tính theo độ Kelvin (K) K = 273 + độ C
Phương pháp giải bài tập:
- Bước 1: Tính số mol chất tan theo đề bài cho
- Bước 2: Tính thể tích dung dịch (nếu bài cho dữ kiện trộn 2 dung dịch)
Chú ý đổi đơn vị đo (lít)
- Bước 3: Tính nồng độ mol dung dịch theo công thức: CM = n/V
3. Bài tập vận dụng tính nồng độ mol
Bài 1: Trong 500 ml dung dịch có hòa tan 24 gam chất K2SO4. Hãy tính nồng độ mol của dung dịch. Lời giải:
Đổi 500 ml = 0,5 lít nK2SO4 = 24 g / (174,26 g/mol + 32,07 g/mol * 4) = 0,1 mol
Theo công thức tính CM, ta có: Cdd = n/V = 0,1 mol / 0,5 l = 0,2 M
Bài 2: Tính nồng độ mol của 0,75 mol HNO3 trong 250 ml dung dịch. Lời giải:
CM = n/V = 0,75 mol / 0,25 l = 3 M
Bài 3: Tính nồng độ mol của một dung dịch chứa 0,25 mol K2CO3 trong 750 ml dung dịch. Lời giải:
CM = n/V = 0,25 mol / 0,75 l = 0,333 M
Bài 4: Hãy tính nồng độ mol của dung dịch khi tiến hành hòa tan 10,0 g Ba(OH)2 trong 200 ml dung dịch. Lời giải:
nBa(OH)2 = 10 g / (137,33 g/mol + 2 * 16,00 g/mol) = 0,05 mol CM = n/V = 0,05 mol / 0,2 l = 0,25 M
Bài 5: Tiến hành cho 8,0 gam natri phản ứng với 250 ml dung dịch axit sulfuric (H2SO4). Hãy tính:
a) Thể tích của H2 thu được ở điều kiện tiêu chuẩn b) Nồng độ mol của dung dịch H2SO4 đã sử dụng Lời giải:
a) nNa = 8 g / (23,00 g/mol) = 0,3478 mol Số mol H2 sản phẩm = 2 x nNa = 0,6956 mol Thể tích
H2 ở ĐKTC = 0,6956 x 22,4 = 15,62 lít
b) nH2SO4 = 0,6956 mol (vì 1 mol Na tạo ra 1 mol H2) CM = n/V = 0,6956 mol / 0,25 l = 2,7824 M
Bài 6: Trong 750 ml dung dịch có hòa tan 45 gam chất NH4Cl. Hãy tính nồng độ mol của dung dịch. Lời giải:
Đổi 750 ml = 0,75 lít nNH4Cl = 45 g / 53.5 g/mol (khối lượng mol của NH4Cl) = 0.84 mol
Theo công thức tính nồng độ mol, ta có: Cdd = n/V = 0.84 mol / 0.75 l = 1.12 (M)
Bài 7: Tính nồng độ mol của một dung dịch chứa 0.25 mol H2SO4 trong 2.5 lít dung dịch. Lời giải:
CM = 0.25 mol / 2.5 l = 0.1 (M)
Bài 8: Hãy tính nồng độ mol của dung dịch khi tiến hành hòa tan 10.6 g K2Cr2O7 trong 500 ml nước. Lời giải:
Số mol của chất K2Cr2O7 là: nK2Cr2O7 = 10.6 g / 294.19 g/mol = 0.036 mol
Vậy nồng độ mol của dung dịch là: Cdd = 0.036 mol / 0.5 l = 0.072 (M)
Bài 9: Trong phản ứng hóa học, 2 mol Al phản ứng với 3 mol CuSO4. Hãy tính nồng độ mol của
dung dịch CuSO4 khi tiến hành phản ứng hết 0.3 mol Al trong dung dịch. Lời giải:
Theo phản ứng, 2 mol Al phản ứng với 3 mol CuSO4. Vì vậy, khi 0.3 mol Al phản ứng hết, số mol
CuSO4 đã phản ứng cũng là 0.3 * (3/2) = 0.45 mol.
Nồng độ mol của dung dịch CuSO4 sẽ là: Cdd = 0.45 mol / thể tích dung dịch
Bài 10: Trong 1 lít dung dịch NaOH có nồng độ mol là 2 M, hãy tính số mol NaOH trong dung dịch. Lời giải:
Cdd = 2 M (mol/lít) Thể tích dung dịch (V) = 1 lít
Số mol NaOH = Cdd x V = 2 mol/lít x 1 lít = 2 mol
Bài 11: Trong 750 ml dung dịch có hòa tan 45 gam chất H2SO4. Hãy tính nồng độ mol của dung dịch. Lời giải: Đổi 750 ml = 0,75 lít
Khối lượng mol của H2SO4 là 98 g/mol.
Số mol H2SO4 trong dung dịch: nH2SO4 = 45 g / 98 g/mol = 0,459 mol
Nồng độ mol của dung dịch: Cdd = nH2SO4 / V = 0,459 mol / 0,75 l = 0,612 M
Bài 12: Tính nồng độ mol của 0,8 mol NaOH có trong 500 ml dung dịch. Lời giải:
Công thức tính nồng độ mol: Cdd = n / V
Trong trường hợp này, n = 0,8 mol và V = 0,5 lít (do chuyển 500 ml thành lít).
Nồng độ mol của dung dịch: Cdd = 0,8 mol / 0,5 l = 1,6 M
Bài 13: Tính nồng độ mol của một dung dịch chứa 1.2 mol NH3 trong 800 ml dung dịch. Lời giải:
Công thức tính nồng độ mol: Cdd = n / V
Trong trường hợp này, n = 1.2 mol và V = 0.8 lít (do chuyển 800 ml thành lít).
Nồng độ mol của dung dịch: Cdd = 1.2 mol / 0.8 l = 1.5 M
Bài 14: Hãy tính nồng độ mol của dung dịch khi tiến hành hòa tan 25,6 g Na2CO3 trong 1,5 lít nước. Lời giải:
Khối lượng mol của Na2CO3 là 106 g/mol.
Số mol của Na2CO3 là: nNa2CO3 = 25.6 g / 106 g/mol = 0.242 mol
Nồng độ mol của dung dịch: Cdd = nNa2CO3 / V = 0.242 mol / 1.5 l = 0.161 M
Bài 15: Cho 3,2 gam kẽm phản ứng vừa đủ với 200 ml dung dịch axit sulfuric (H2SO4). Hãy tính:
a) Tính thể tích của H2 thu được ở điều kiện tiêu chuẩn b) Nồng độ mol của dung dịch H2SO4 đã sử dụng Lời giải:
Theo phản ứng: Zn + H2SO4 → ZnSO4 + H2
Số mol của Zn là: nZn = 3.2 g / 65.38 g/mol (khối lượng mol của Zn) = 0.049 mol
Do Zn và H2SO4 phản ứng theo tỷ lệ 1:1, nên số mol của H2SO4 cũng là 0.049 mol.
a) Thể tích của H2 thu được ở ĐKTC: VH2 = nH2 x 22.4 lít/mol = 0.049 mol x 22.4 lít/mol = 1.0976 lít
b) Nồng độ mol của dung dịch H2SO4: CddH2SO4 = nH2SO4 / V = 0.049 mol / 0.2 l = 0.245 M




