



Preview text:
Công thức tính hiệu suất phản ứng hóa học chính xác, dễ hiểu nhất
Hiệu suất là gì? Công thức để tính hiệu suất như thế nào? Là câu hỏi chắc hẳn nhiều học sinh thắc mắc.
Vậy để trả lời cho câu hỏi đó thì hãy cùng tìm hiểu ngay trong bài viết dưới đây.
1. Hiệu suất là gì?
1.1. Khái niệm hiệu suất
Hiệu suất (hay còn được gọi là hiệu năng) là khả năng hoạt động hiệu quả và đạt được kết quả mong đợi
trong một hoạt động, quá trình hoặc hệ thống. Nó thường được đo lường bằng cách so sánh giữa kết quả
thực tế và kết quả mong đợi, hoặc so sánh giữa kết quả của các hệ thống khác nhau.
Trong ngữ cảnh khác nhau, hiệu suất có thể được áp dụng cho nhiều khía cạnh khác nhau. Ví dụ, trong lĩnh
vực kinh doanh, hiệu suất thường đề cập đến khả năng của một công ty hoặc tổ chức để đạt được mục tiêu
kinh doanh và tăng trưởng. Trong lĩnh vực công nghệ, hiệu suất có thể ám chỉ đến tốc độ, độ chính xác
hoặc hiệu quả của một hệ thống hoặc một thiết bị.
Để đạt được hiệu suất tốt, thường cần tối ưu hóa sử dụng tài nguyên có sẵn, giảm thiểu lãng phí và đạt đ
ược mục tiêu một cách nhanh chóng và chính xác. Điều này có thể bao gồm cải thiện quy trình làm việc,
tăng cường năng suất lao động, sử dụng công nghệ tiên tiến hoặc tối ưu hóa các thuật toán và phương
pháp trong các hệ thống máy tính.
1.2. Hiệu suất trong phản ứng hóa học được hiểu như thế nào?
Trong phản ứng hóa học, hiệu suất là một thước đo cho biết mức độ thành công của một phản ứng trong
việc chuyển đổi các chất khởi đầu thành các sản phẩm mong đợi. Hiệu suất phản ứng thường được tính
toán bằng cách so sánh lượng sản phẩm thực tế thu được với lượng sản phẩm lý thuyết được dự đoán.
Công thức tính hiệu suất phản ứng thường được biểu diễn theo công thức sau: Hiệu suất (%) = (Sản phẩm
thực tế / Sản phẩm lý thuyết) x 100% Trong đó:
- Sản phẩm thực tế là khối lượng hoặc số mol của sản phẩm được thu được thực tế trong phản ứng.
- Sản phẩm lý thuyết là khối lượng hoặc số mol của sản phẩm dự đoán được lý thuyết trong điều kiện lý tưởng.
Hiệu suất phản ứng thường được ước tính để đánh giá hiệu quả của quy trình hóa học. Một hiệu suất cao
cho thấy phản ứng diễn ra hiệu quả và đạt được số lượng sản phẩm mong đợi. Ngược lại, một hiệu suất
thấp có thể cho thấy sự mất mát trong quá trình phản ứng, gây ra lãng phí tài nguyên và chi phí cao.
Hiệu suất cũng có thể được ước tính dựa trên các yếu tố khác nhau như hiệu suất chuyển đổi, hiệu suất
sản phẩm, hiệu suất tổng hợp, hiệu suất bền vững, tùy thuộc vào mục tiêu cụ thể của phản ứng hoá học đang xem xét.
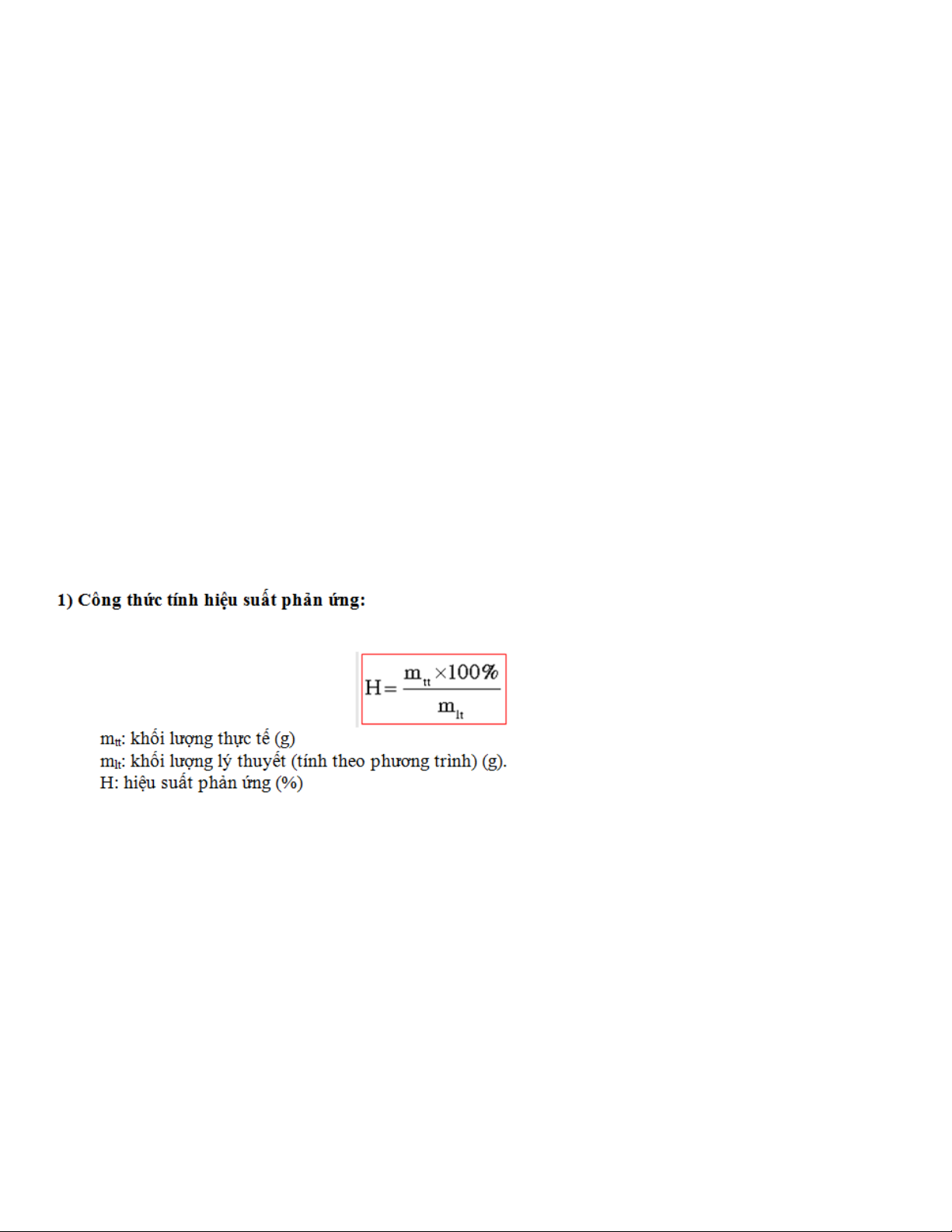
2. Công thức tính hiệu suất trong phản ứng hóa học
Hiệu suất phần trăm của phản ứng hóa học được tính theo công thức như sau: % hiệu suất = ( khối lượng
tt/ khối lượng lt) x 100 %.
Công thức tính hiệu suất như sau : H = m(tt)/m(lt) x 100% Trong đó
H là hiệu suất phản ứng (%) m(tt) là khối lượng thực tế tính bằng (g) m(lt) là khối lượng lý thuyết ( tính theo phương trình ) (g)
=> Còn độ hao phí của phản ứng thì cần phải dựa theo phần trăm được tính theo công thức:
% hao phí = 100% – % hiệu suất.
*Lưu ý: Tính hiệu suất theo số mol chất thiếu (theo số mol nhỏ)
Từ công thức cũng có thể tính được như sau:
nC = nA phản ứng = (nA ban đầu * H) / 100
nA ban đầu cần dùng: nA ban đầu = (nC * 100) / H
Lưu ý khi tính hiệu suất phản ứng
Khi tính toán hiệu suất phản ứng, có những điều cần lưu ý:
1. Xác định đúng đơn vị: Khi tính hiệu suất, cần xác định chính xác các đơn vị như gam, mol... để tránh sai sót trong phép tính.
2. Hiệu suất phản ứng không vượt quá 100%: Hiệu suất của phản ứng phải luôn nhỏ hơn 100%. Nếu kết
quả tính toán vượt quá 100%, điều đó có thể cho thấy sản phẩm chưa được tinh khiết hoặc có những yếu tố
khác gây ra hiệu suất cao hơn dự kiến.
3. Phân biệt hiệu suất và sai số, độ hao phí: Cần phân biệt rõ ràng giữa hiệu suất phản ứng, sai số và độ
hao phí của phản ứng. Điều này giúp xác định mức độ chính xác và hiệu quả của quá trình phản ứng.
4. Công thức tính hiệu suất phản ứng: Hiệu suất phản ứng được tính bằng công thức: % hiệu suất = (lượng
sản phẩm thực tế / lượng sản phẩm lý thuyết) * 100.
5. Độ hao phí của phản ứng: Độ hao phí của phản ứng được tính bằng công thức: % độ hao phí = 100% - % hiệu suất.
6. Sai số của phản ứng: Sai số của phản ứng được tính bằng công thức: Sai số phản ứng = lượng sản
phẩm lý thuyết - lượng sản phẩm thực tế. Lưu ý rằng, tính toán hiệu suất phản ứng là một cách đánh giá sơ
bộ về hiệu quả của quá trình hóa học, và còn có thể có các yếu tố khác như hiệu suất chuyển đổi, hiệu suất
tổng hợp và các yếu tố khác tùy thuộc vào mục tiêu và phạm vi của phản ứng cụ thể.
Công thức tính khối lượng chất tham gia khi có hiệu suất Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng
chất tham gia thực tế đem vào phản ứng phải hơn nhiều để bù vào sự hao hụt. Sau khi tính khối lượng chất
tham gia theo phương trình phản ứng, ta có khối lượng chất tham gia khi có hiệu suất như sau: m(lt) = m(tt).100/H
Công thức tính khối lượng sản phẩm khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng sản phẩm thực tế thu được phải nhỏ hơn nhiều sự hao
hụt. Sau khi khối lượng sản phẩm theo phương trình phản ứng, ta tính khối lượng sản phẩm khi có hiệu suất như sau:
3. Một số bài tập vận dụng
Bài 1. Nung 0,1 mol CaCO3 thu được 0,08 mol CaO. Tính hiệu suất phản ứng hóa học xảy ra.
Hướng dẫn giải chi tiết bài tập Cách 1: CaCO3 → CaO + CO2 0,1 mol → 0,1 mol
Theo phản ứng ta có 0,1 mol CaCO3 tạo 0,1 mol CaO.
Tuy nhiên theo thực tế đo được chỉ thu được 0,08 mol CaO.
Như vậy đối với CaO lượng tính toán theo phản ứng là 0,1 (gọi là khối lượng theo lý thuyết) và lượng chắc
chắn thu được là 0,08 (gọi là lượng thực tế).
Hiệu suất phản ứng H(%) = (thực tế/lý thuyết)*100 = (0,08/0,1)*100 = 80%, Cách 2: CaCO3 → CaO + CO2 0,08 mol ← 0,08 mol
Nhìn tỉ lệ mol trên phương trình nếu thu được 0,08 mol vôi sống CaO cần dùng 0,08 mol CaCO3.
Tuy nhiên đề bài cho là nung 0,1 mol CaCO3.
Tóm lại đối với CaCO3 lượng tính toán theo phản ứng là 0,08 (gọi là lựong lý thuyết) và lượng chắc chắn
cần phải có là 0,1 (gọi là lượng thực tế). Hiệu suất phản ứng
H = (lý thuyết/ thực tế).100 = (0,08/0,1).100 = 80%
Bài 2. Có một loại quặng pirit chứa 95% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn H2SO4 98% thì
lượng quặng pirit trên cần dùng là bao nhiêu? Biết hiệu suất điều chế H2SO4 là 90%.
Ta có sơ đồ phản ứng: FeS2 → H = 90% → 2H2SO4 Theo lý thuyết: 120 196 Phản ứng: 60 ← 98 tấn
Ta có vì hiệu suất điều chế H2SO4 là 90% => mFeS2 thực tế = 60/90% = 200/3 tấn
Vì quặng chứa 95% FeS2 => mquặng = 200/3.100/95 = 70,18 tấn
Bài 3. Cho hỗn hợp A gồm axit formic và axit axetic (tỉ lệ mol 1:1). Lấy 5,3 gam hỗn hợp A tác dụng với 5,75
gam C2H5OH (có xúc tác H2SO4đặc) thu được hỗn hợp este (hiệu suất của các phản ứng este hoá đều
bằng 85%). Tính khối lượng hỗn hợp este thu được.
Ta có theo đầu bài vì số mol ancol lớn hơn số mol 2 axit nên ancol dư.
n(ancol) phản ứng = 2.n(axit)= 0,1 mol.
Áp dụng định luật bảo toàn khối lượng có:
m(ancol) + m(axit) = m(este) + m(nước)
= 0,1.46 + 5,3 = meste + 0,1.18 => meste = 8,10 gam
Vì hiệu suất của các phản ứng este hoá đều bằng 80% Nên meste thu được = 8,10.85/100= 6,885 gam.
Trên đây, là bài viết về chủ đề công thức tính hiệu suất phản ứng hóa học chính xác, dễ hiểu.




