







Preview text:
lOMoAR cPSD| 58702377
Đáp án bài tập chương I:
Bài 1: Lực Van Der Waals giữa các phân tử được giải thích bằng những loại tương tác gì? Liên kết
Van der Waals cho tinh thể và chất lỏng những đặc tính lý học gì?
Bài 1: Lực Van der Waals giữa các phân tử gồm 3 loại tương tác:
1) Tương tác định hướng do Willem Hendrik Keesom tìm ra năm 1912. Tương tác này sinh ra
do sự hút lẫn nhau giữa các cực trái dấu của các phân tử có cực. Bản chất tương tác là liên kết
tĩnh điện. (tương tác lưỡng cực – lưỡng cực ) Tương tác càng lớn khi phân tử có moment lưỡng
cực càng lớn. Tương tác định hướng càng lớn khi phân tử càng có cực. Tương tác định hướng 4
được tính bằng công thức: 2 U dh 6 3r kT
Trong đó: r là khoảng cách từ tâm pân tử này đến tâm phân tử kia. k là hằng số Bolzman
T là nhiệt độ tuyệt đối
là moment lưỡng cực của phân tử.
2) Tương tác cảm ứng do Peter Joseph William Debye tìm ra năm 1920. Tương tác nảy sinh khi
có mặt phân tử có cực. Phân tử có cực tác động lên các phân tử xung quanh (phân tử có cực
hoặc không có cực) gây ra lưỡng cực cảm ứng trên các phân tử này. Tương tác cảm ứng là
tương tác giữa phân tử có lưỡng cực và phân tử có lưỡng cực cảm ứng. (tương tác lưỡng cực
– lưỡng cực cảm ứng). Độ lớn của tương tác cảm ứng phụ thuộc không những vào lưỡng cực
của phân tử mà còn phụ thuộc vào độ bị cực hóa của phân tử. Tương tác cảm ứng thường
rất nhỏ. Tương tác cảm ứng được tính bằng công thức: 2 2 U c .u 6 r Trong đó:
là độ bị cực hóa của phân tử.
3) Tương tác khuếch tán do Fritz London tìm ra năm 1930. Hai tương tác định hướng và cảm ứng
không đủ để giải thích vì sao các chất khí có phân tử không có cực (như H2, O2 …) có thể hóa
lỏng và hóa rắn. F. London cho rằng mọi tiểu phân (phân tử, nguyên tử) vẫn có năng lượng
khác không ở không độ tuyệt đối. Năng lượng này đảm bảo electron luôn luôn chuyển động
quanh hạt nhân. Năng lượng này càng lớn nếu tiểu phần có số electron càng lớn. Sự chuyển
động này làm có lúc tâm điện tích dương của hạt không trùng với tâm điện tích âm, do đó
lưỡng cực nhất thời được sinh ra. Tương tác khuếch tán là tương tác giữa các phân tử có lưỡng
cực nhất thời (tương tác lưỡng cực nhất thời – lưỡng cực nhất thời). Tương tác khuếc tán càng
lớn khi phân tử có khối lượng càng lớn. Tương tác khuếch tán được tính bằng công thức: lOMoAR cPSD| 58702377 2 3 h 0 U k .t 4r 6 Trong đó:
h 0 là năng lượng của tiểu phân ở không độ tuyệt đối. h là hằng số Plank.
0 là tần số giao động gây ra bởi chuyển động của electron.
Năng lượng của các loại tương tac trong lực Van de Waals (kJ/mol) Chất Khối
Moment Độ bị cực Tương Tương Tương tác Lực Van
lượng NT lưỡng cực hóa , 10- tác định
tác cảm khuếch tán de Waals hay PT , D 24 cm-1 hướng ứng He 4 0 0,20 0 0 0,21 0,21 Xe 131,3 0 4,00 0 0 18,41 18,41 HCl 36,5 1,07 2,36 3,31 1,00 16,82 21,13 HI 130,9 0,38 5,4 0,59 0,31 60,92 61,82 H2O 18 1,84 1,4 36,36 1,92 9,00 47,28 CO 28 0,12 1,99 0 0 8,74 8,74
(sinh viên không cần lập bảng và đưa ra các công thức tính các loại tương tác)
Đặc tính lý học của tinh thể và chất lỏng Van de Waals:
Do lực Van der Waals rất yếu nên tinh thể mạng phân tử có những tính chất đặc trưng: dễ nóng chảy, có
áp suất hơi bão hòa cao nên dễ bay hơi, mềm, dễ có khả năng thăng hoa ở áp suất thấp, không dẫn điện.
Chất lỏng hình thành nhờ liên kết Van de Waals có độ nhớt nhỏ, áp suất hơi bão hòa lớn, dễ bay
hơi, nhiệt độ sôi thấp, sức căng bề mặt nhỏ, không dẫn điện.
Bài 2: Hãy cho biết bản chất của liên kết ion. Độ mạnh của liên kết ion phụ thuộc vào các yếu tố
nào. Nêu các tính chất của liên kết ion. Liên kết ion cho tinh thể và chất lỏng những đặc tính lý học gì.
Bản chất của liên kết ion : là lực hút tĩnh điện giữa các ion mang điện tích trái dấu .
Độ mạnh của liên kết ion phụ thuộc vào những yêu tố sau :
-Điện tích ion: điện tích ion càng lớn thì liên kết ion càng mạnh.
- Kích thước ion: bán kính ion càng nhỏ thì liên kết ion càng mạnh.
- Độ chênh lệch độ âm điện
giữa các nguyên tử tham gia tạo liên kết:
càng lớn, liên kết ion càng bền + Không bảo hòa + Không định hướng lOMoAR cPSD| 58702377 + Phân cực rất mạnh
Liên kết ion cho tinh thể và chất lỏng những đặc tính lý học sau :
Do đặc điểm của liên kết ion: liên kết mạnh, không bão hòa , không định hướng, nên ở nhiệt độ thường
tất cả các hợp chất ion đều là tinh thể. Tinh thể ion có nhiệt độ nóng chảy tương đối cao, khá cứng, dòn,
áp suất hơi bão hòa rất nhỏ nên hầu như không bay hơi, không dẫn điện, dẫn nhiệt kém. Phần lớn các chất
tinh thể ion tan tốt trong nước, dung dịch dẫn điện. Hợp chất tinh thể ion rất khó có khả năng thăng hoa
ngay ở áp suất rất nhỏ.
Đối với chất lỏng ion: áp suất hơi nhỏ, hầu như không bay hơi, nhiệt độ sôi cao, độ nhớt cao, sức căng bề mặt cao, dẫn điện.
Bài 3: Hãy cho biết bản chất của liên kết cộng hóa trị. Độ mạnh của liên kết cộng hóa trị phụ thuộc
vào các yếu tố nào. Nêu các tính chất của liên kết cộng hóa trị. Liên kết cộng hóa trị cho tinh thể
những đặc tính lý học gì?
- Bản chất của liên kết cộng hóa trị là sự che phủ lẫn nhau giữa các orbital nguyên tử hóa trị của các nguyên
tử tương tác (có sự tham gia của electron hóa trị), tức là sự tổ hợp tuyến tính các hàm sóng nguyên tử.
Độ mạnh của liên kết cộng hóa trị phụ thuộc vào mật độ xen phủ của các AO: tức là phụ thuộc vào kích
thước và hình dạng, hướng xen phủ và sự chênh lệch năng lượng của các AO.
Tính chất của liên kết cộng hóa trị:
Tính định hướng: Muốn liên kết CHT bền vững thì mức độ che phủ của các obital nguyên tử phải
cực đại.Sự che phủ cực đại xảy ra theo những hứơng nhất định .Do đó liên kết CHT được tạo
thành theo những hướng nhất định trong không gian.
Tính bão hòa: khả năng tạo thành số liên kết công hóa trị hạn chế. Tính chất này làm cho các phân
tử có thành phần xác định và cấu trúc xác định.
Tính có cực: Liên kết có phân cực nếu 2 nguyên tử tương tác khác nhau, và không có phân cực nếu
2 nguyên tử tương tác giống nhau.
Liên kết cộng hóa trị là loại liên kết mạnh nên cho tinh thể một số tính chất đặc trưng:
Chất có mạng tinh thể nguyên tử (liên kết cộng hóa trị 3 chiều không gian): Cứng, khó nóng chảy, áp
suất hơi bão hòa rất nhỏ, rất khó bay hơi, không tan trong bất kỳ dung môi nào, cách nhiệt, cách điện hay bán dẫn.
Chất có cấu trúc dạng lớp (liên kết cộng hóa trị hai chiều không gian): Khó nóng chảy (hay bị phân hủy
nhiệt nếu chứa chất dễ bay hơi), áp suất hơi bão hòa nhỏ, khó bay hơi, tùy thuộc vào mức độ có cực của
liên kết cộng hóa trị: không tan, tan rất ít hay tan nhiều trong dung môi có cực, không tan trong dung
môi không có cực, cách điện hay có tính bán dẫn, một số chất có thể dẫn điện nhờ liên kết π không định
chỗ trong lớp. Trong trường hợp việc hình thành lớp nhờ liên kết cộng hóa trị cho - nhận nối các phân tử
hữu hạn với nhau thì nhiệt độ nóng chảy không cao và có thể thăng hoa khi đun nóng. Nếu chiều còn lại lOMoAR cPSD| 58702377
liên kết bằng lực Van de Waals: mềm, có tính dễ bóc tách lớp; nếu chiều còn lại có liên kết ion: độ cứng vừa phải, dòn.
Chất có cấu trúc dạng mạch (liên kết cộng hóa trị một chiều không gian): Khó nóng chảy (hay bị phân
hủy nhiệt nếu chứa chất dễ bay hơi), áp suất hơi bão hòa nhỏ, khó bay hơi, tùy thuộc vào mức độ có cực
của liên kết cộng hóa trị: không tan, tan rất ít hay tan nhiều trong dung môi có cực, không tan trong dung
môi không có cực, cách điện hay bán dẫn. Trong trường hợp việc hình thành lớp nhờ liên kết cộng hóa trị
cho - nhận nối các phân tử hữu hạn với nhau thì nhiệt độ nóng chảy không cao và có thể thăng hoa khi
đun nóng. Nếu chiều còn lại liên kết bằng lực Van de Waals: mềm, có tính dễ tách sợi; nếu chiều còn lại
có liên kết ion: độ cứng vừa phải, dòn.
Bài 4: Người ta cho rằng: “Liên kết kim loại là một loại liên kết đa tâm với một số lớn các electron hóa
trị không định chỗ”. Hãy giải thích điều này bằng thuyết miền năng lượng. Yếu tố nào quyết định
độ bền của liên kết kim loại. Liên kết kim loại cho tinh thể những đặc lính lý học gì.
Các kim loại có những tính chất khác biệt rõ rệt so với các chất khác: không trong suốt, có ánh kim, dẻo,
dẫn nhiệt và dẫn điện tốt, có nhiệt độ nóng chảy và độ cứng khác nhau rất nhiều, ở nhiệt độ phòng có kim
loại ở trạng thái lỏng (Hg , tnc =-38,80C), nhưng có kim loại rất khó nóng chảy (W , tnc = 33870C). Chỉ có
thể giải đáp thỏa đáng các tính chất này của kim loại khi quan niệm liên kết kim loại là một loại liên kết
đa tâm với một số lớn các electron không định chỗ.
Bản chất liên kết kim loại được giải thích bằng thuyết miền năng lượng. Thuyết miền năng lượng được
xây dựng trên cơ sở phương pháp LCAO-MO khi coi tổ hợp các AO hóa trị của một số lượng rất lớn các
nguyên tử kim loại (~1023). Sự tổ hợp của nAO thành nMO (n/2MOlk, n/2MOplk) . Do n rất lớn, các MO
lân cận nhau chỉ có sự chênh lệch năng lượng không đáng kể (~10-22eV). Tập hợp các MOlk và tập hợp
các MOplk tạo thành các miền năng lượng. Các electron có thể di chuyển tự do trong một miền năng lượng
nếu còn MO trống. Miền năng lượng MOlk chứa electron là miền hóa trị. Đối với kim loại, miền hóa trị
có thể bão hòa hay chưa bão hòa elctron. Miền năng lượng MOplk không chứa electron nằm ngay trên miền
hóa trị là miền dẫn. Đối với kim loại miền dẫn và miền hóa trị che phủ nhau.
Liên kết kim loại càng mạnh khi số lượng electron tự do càng lớn và do đó nút mạng tinh thể càng dương điện.
Bài 5: Liên kết hydro là gì? Nêu ví dụ. Điều kiện có liên kết hydro. Bản chất của liên kết hydro. Liên
kết hydro ảnh hưởng như thế nào đến tính chất các chất.
Liên kết hydro là loại liên kết giữa các phân tử hay trong nội phân tử trong đó nguyên tử hydro phân
cực dương liên kết với một nguyên tử phân cực âm của nguyên tố khác. Liên kết hydro có độ mạnh gấp
khoảng 10 lần độ mạnh của liên kết Van de Waals. Ví dụ:
1) Liên kết hydro giữa hai phân tử HF: H – F∙∙∙∙H – F
2) Liên kết hydro nội phân của orthonitropnenol (C6H4NO2OH) giữa nguyên tử hydro
trong nhóm chức -OH với một nguyên tử oxy trong nhóm chức -NO2.
Điều kiện có liên kết hydro:
Liên kết hydro chỉ được tạo thành khi có hai điều kiện: lOMoAR cPSD| 58702377 -
Nguyên tử hydro phân cực dương rất mạnh (do nó liên kết với nguyên tố có độ âm điện cao – F, O, N) -
Nguyên tử của nguyên tố liên kết với nó phải có mật độ điện tích âm lớn (các nguyên tố F, O và
N có độ âm điện cao thỏa điều kiện này) Bản chất liên kết hydro: -
Liên kết Hydro vừa có bản chất tĩnh điện, vừa có bản chất cho-nhận.
Ảnh hưởng của liên kết hydro đến tính chất vật lý của chất: -
Liên kết hydro liên phân tử làm tăng nhiệt độ sôi và nhiệt độ nóng chảy của chất. Do có liên kết
hydro, nước đá có tỷ trọng nhỏ hơn nước lỏng ở 00C. -
Liên kết hydro nội phân tử làm giảm nhiệt độ sôi và nhiệt độ nóng chảy của chất.
Bài 6: Thế nào là một khí lý tưởng? Thế nào là phương trình trạng thái khí lý tưởng. Cho biết ý
nghĩa hằng số khí lý tưởng. Nêu những đặc tính lý học của chất khí.
Khí lí tưởng: là chất khí trong đó mỗi phân tử (hoặc nguyên tử) được coi là một chất điểm (kích thước
phân tử không đáng kể so với thể tích bình chứa) và giữa chúng không có lực tương tác Van de Waals
mà chỉ có va chạm đàn hồi với nhau (va chạm không mất năng lượng). Các chất khí ở áp suất thấp, nhiệt
độ cao có thể được xem là khí lí tưởng.
Phương trình trạng thái khí lý tưởng là mối liên hệ giữa áp suất, thể tích, và nhiệt độ của một khối khí lý
tưởng nằm trong cân bằng nhiệt động lực học. Phương trình này có dạng: pV = nRT
Trong đó: p là áp suất khí V là thể tích bình
chứa khí n là số mol khí R
là hằng số khí T là nhiệt độ.
Ý nghĩa vật lý của hằng số lý tưởng:
R là độ lớn của công giãn nở của 1 mol khí lí tưởng khi tăng nhiệt độ lên 10C. Giải thích qua ví dụ:
Giả sử có một bình trụ, tiết diện S, với 1 piston có thể di chuyển không ma sát. Trong bình có 1
mol khí lý tưởng; áp suất khí trong bình là P, nhiệt độ là T. Đun nóng khí đến nhiệt độ T+1, trong điều
kiện áp suất không đổi P, thể tích khí tăng từ V1 lên V2. Ta có: P∆V = PV2 – PV1 = R(T+1) – RT = R.
Mặc khác: P∆V = P.S. ∆h = F. ∆h với ∆h là độ chuyển dịch của piston. Từ đó: R = P∆V = F. ∆h
Vậy R chính là độ lớn của công giãn nở của 1 mol khí lí tưởng khi tăng nhiệt độ lên 10C. Đặc
tính lý học của chất khí:
+ Chất khí chiếm toàn bộ thể tích bình chứa. lOMoAR cPSD| 58702377
+ Áp suất của chất khí là tác dụng của các phân tử khí lên thành bình chứa.
+ Va chạm giữa các phân tử khí với thành bình có tính đàn hồi. + Có thể nén chất khí.
+ Nhiệt độ hóa lỏng của chất khí phụ thuộc nhiều vào áp suất.
Bài 7: Phương trình trạng thái khí thực khác phương trình trạng thái khí lý tưởng ở điểm nào?
đã bỏ qua thể tích riêng của các phân tử khí và lực tương tác giữa chúng. Phương trình này chỉ đúng trong
điều kiện khí loãng, nhiệt độ cao, áp suất nhỏ .
Phương trình khí thực: a (PnRT )( V b ) V 2 a
có tính đến lực tương tác Van der
Waals ( ) giữa các phân tử khí và tính đến thể tích 2 riêng (b) của V các phân tử khí.
Bài 8: Cấu trúc chất lỏng ở nhiệt độ thường và ở nhiệt độ cao có khác nhau không? Giải thích. Vì
sao chất lỏng và chất khí ở nhiệt độ và áp suất tới hạn có cùng tỷ khối. Nêu những đặc tính lý học của chất lỏng.
Cấu trúc chất lỏng ở nhiệt độ thường và ở nhiệt độ cao: khác nhau vì ở nhiệt độ thường chất lỏng có
cấu trúc gần giống chất rắn tinh thể còn ở nhiệt độ cao có cấu trúc giống chất khí.
Ở điều kiện tới hạn chất khí và chất lỏng có cùng cấu trúc, có thể tích bằng nhau nên chúng có cùng tỉ khối.
Chất lỏng có những đặc tính lý học sau:
+ Có tính chảy, linh động.
+ Có hình dạng theo vật chứa.
+ Có tính đẳng hướng về các tính chất vậy lý (độ dẫn điện, độ dẫn nhiệt, tính chất quang...) +
Cho tính trong suốt cho ánh sáng truyền qua. + Có tính nhớt. + Không chịu nén.
+ Có sức căng bề mặt trên vùng tiếp xúc pha khác, do đó có hiện tượng mao dẫn khi nằm trong ống có kích thước đủ nhỏ.
Bài 9: Trạng thái chậm hóa hơi của chất lỏng là gì? Nguyên nhân gây ra trạng thái này? Cách khắc
phục trạng thái này trong phòng thí nghiệm như thế nào?
Trạng thái chậm hóa hơi của chất lỏng là hiện tượng chất lỏng không sôi ở nhiệt độ cao hơn nhiệt độ
sôi của chất lỏng đó. lOMoAR cPSD| 58702377
- Nguyên nhân : việc sinh ra lúc ban đầu những bóng hơi ở trong một chất lỏng không có khí hòa tan là
rất khó khăn vì những phần tử có động năng lớn hơn động năng cần cho sự hóa hơi phải tập trung lại với
nhau. Do vậy khi đun nóng chất lỏng đến nhiệt độ hóa hơi, chất lỏng vẫn chưa hóa hơi. - Khắc phục :
trong phòng thí nghiệm khi cần chưng cất 1 chất lỏng nào người ta cho vào chất lỏng những mảnh sứ nhỏ
vì bọt không khí nằm trong lỗ xốp của sứ thoát ra tạo điều kiện sinh ra những bọt hơi chất lỏng và chất sôi.
Bài 10: Trạng thái chậm đông của chất lỏng là gì? Nguyên nhân của hiện tượng này là gì? Cách
khắc phục trạng thái này.
Trạng thái chậm đông của chất lỏng: là hiện tượng chất lỏng chưa hóa rắn nhiệt độ thấp hơn nhiệt độ kết tinh của nó.
Nguyên nhân: khi làm lạnh chất lỏng đến nhiệt độ đông đặc, đa số các chất có cách sắp xếp các
hạt biến đổi không nhiều nên không ảnh hưởng nhiều đến sự đông đặc của chất lỏng. Tuy nhiên
trong 1 số chất cách sắp xếp này lại biến đổi đáng kể gây nên sự sai khác trong cấu trúc chất lỏng,
dẫn đến hiện tượng chậm đông của chất lỏng.
Cách khắc phục: Cho vào vài hạt tinh thể chất rắn cùng loại, khuấy lên, hay dung đua thủy tinh cọ vào thành bình đựng.
Bài 11: Plasma là gì? Thế nào là plasma nguội? Nguyên nhân gây ra plasma nguội. Thế nào là plasma
nóng? Nguyên nhân gây ra plasma nóng.
Plasma là khí được ion hóa một phần hay ion hóa hoàn toàn ở nhiệt độ cao. Đây là một môi trường trung
hòa điện trong đó có phân tử ở trạng thái cơ bản hay trạng thái kích động, nghĩa là có năng lượng cao,
nguyên tử, ion và electron.
Plasma nguội là plasma được tạo nên ở áp suất dưới 0.15 atm. Trong plasma áp suất thấp, độ chuyển
động của electron rất lớn nên năng lượng và nhiệt độ của electron cao hơn so với các hạt nặng. Trong
plasma nguội thì các hạt nặng có nhiệt độ từ 500 đến 1000oC còn electron thì lên đến nhiệt độ rất cao ( hàng nghìn độ )
Nguyên nhân gây nên plasma nguội: Sự ion hóa được xảy ra bởi sự nhận năng lượng từ các dòng vật
chất bên ngoài như các bức xạ điện từ …
Plasma nóng là plasma được tạo nên ở suất suất từ 0,15 atm đến 10 atm . Trong plasma này , áp suất
cao hơn các hạt trong plasma và va chạm với nhau nhiều hơn nên nhiệt độ của electron và của các hạt
nặng ít chênh lệch nhau hơn . Nhiệt độ của plasma nóng có thể lên đến khoảng 50000oC .
Nguyên nhân gây nên plasma nóng: Sự ion hóa xảy ra do sự va chạm nhiệt giữa các phân tử hay nguyên
tử ở nhiệt độ cao …
Bài 12: Hãy cho biết sự giống nhau và khác nhau giữa các trạng thái vô định hình, trạng thái tinh
thể và trạng thái lỏng. Trạng thái tinh hể
Trạng thái vô định hình Trạng thái lỏng lOMoAR cPSD| 58702377 Hình dáng xác định
Hình dáng theo vật đựng - Trật tự xa -Trật tự gần -có tính dị hướng - có tính đẳng hướng - cấu trúc xác định
- cấu trúc không xác định
Nhiệt độ nóng chảy xác Nhiệt độ nóng chảy
Nhiệt độ kết tinh xác định Bài 13: định không xác định Căn cứ vào đâu - Không chịu nén người ta phân các
- nhiệt độ nóng chảy, kết tinh không thay đổi bởi sự thay đổi áp suất. tinh thể
thành 7 hệ? Thế nào là mạng lưới Bravais?
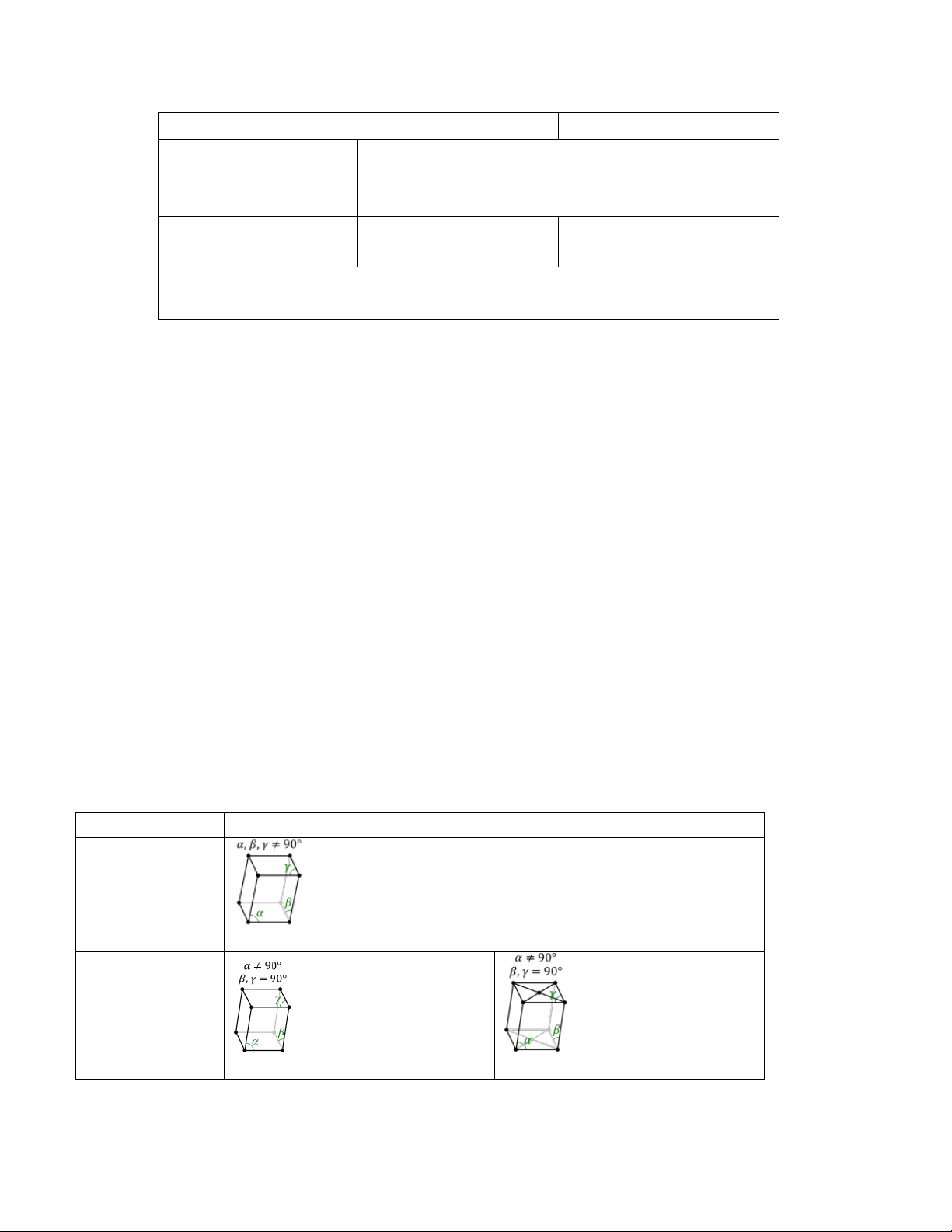
Căn cứ vào các yếu tố đối xứng (mặt đối xứng. trục đối xứng) người ta chia ra các tinh thể thành 7 hệ.
(tất cả các hệ tinh thể đều có tâm đối xứng).
Hệ tam tà: không có yếu tố mặt đối xứng và trục đối xứng.
Hệ đơn tà: Có 1 mặt đối xứng và một trục đối xứng hoặc có một trong hai yếu tố đối xứng này. Hệ trực
giao: Có vài trục đối xứng bậc hai và vài mặt phẳng đối xứng hoặc có một trong hai yếu tố đối xứng này.
Hệ tam phương: Có ít nhất một trục đối xứng bậc 3.
Hệ tứ phương: Có một trục đối xứng bậc bốn.
Hệ lục phương: Có một trục đối xứng bậc sáu.
Hệ lập phương: có ba trục đối xứng bậc bốn.
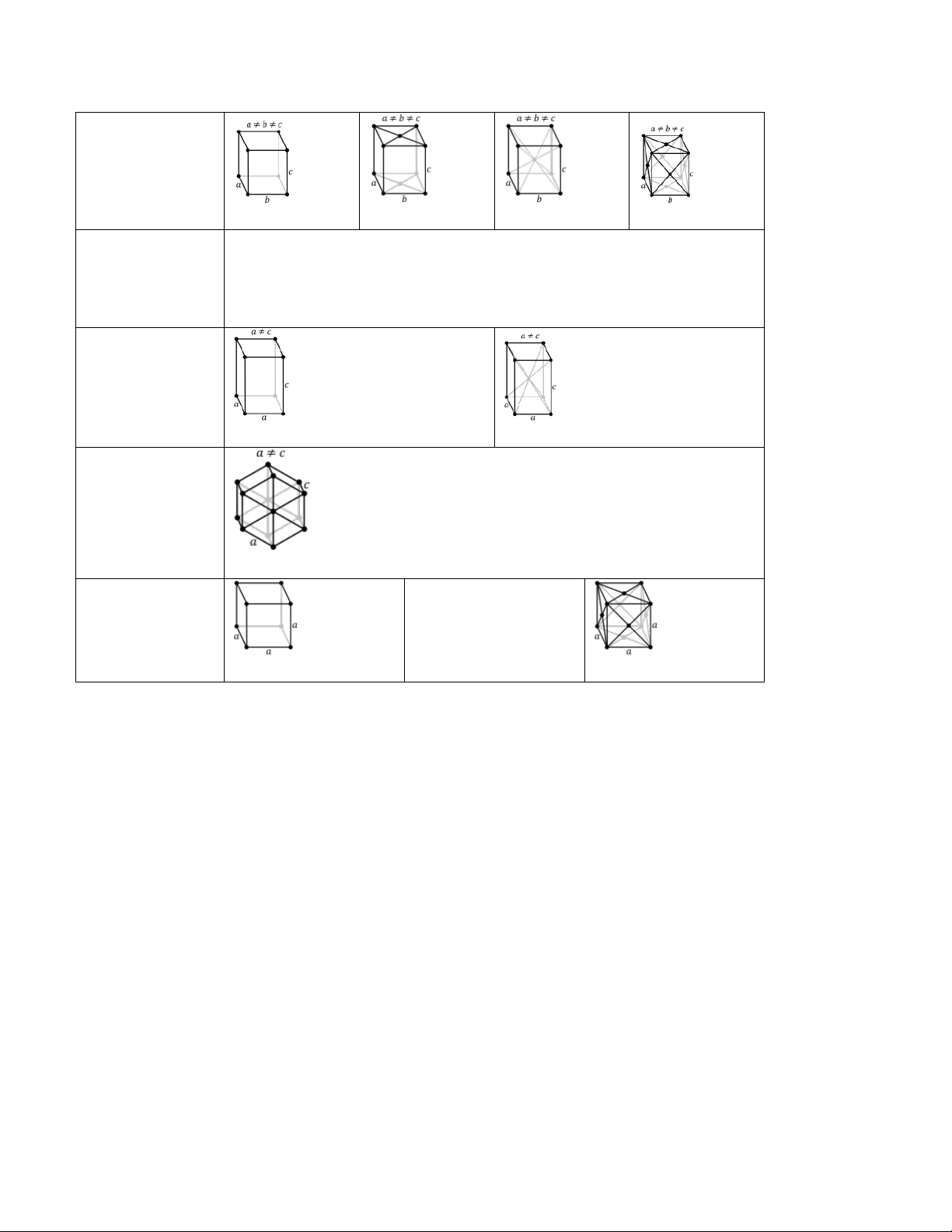
Mạng lưới Bravais: là một tập hợp các điểm tạo thành từ một điểm duy nhất theo các bước rời rạc xác
định bởi các véc tơ cơ sở.
Năm 1885 , O . Bravais chứng minh rằng tất cả các tinh thể đều thuộc về 1 trong 14 kiểu mạng tinh thể.
Chúng được gọi là mạng lưới Bravais, gồm:
+ 7 ô mạng cơ sở của 7 hệ tinh thể (mạng lưới Bravais nguyên thủy)
+ 2 ô mạng cơ sở tâm đáy của các hệ tinh thể đơn tà và trực giao.
+ 3 ô mạng cơ sở tâm khối của các hệ tinh thể trực giao, tứ phương và lập phương.
+ 2 ô mạng cơ sở tâm diện của các hệ tinh thể trực giao và lập phương. Các hệ tinh thể Các mạng lưới Bravais Tam tà Nguyên thủy Đơn tà Đơn giản Tâm đáy lOMoAR cPSD| 58702377 Trực giao Nguyên thủy Tâm đáy Tâm khối Tâm diện Tam phương Nguyên thủy Tứ phương Nguyên thủy Tâm khối Lục phương Nguyên thủy Lập phương Tâm khối Đơn giản Tâm diện
Bài 14: Dựa vào bản chất liên kết giữa các nút mạng tinh thể người ta phân các tinh thể thành bao
nhiêu kiểu mạng tinh thể. Cho biết đặc tinh lý học của từng loại mạng tinh thể.
Dựa vào bản chất liên kết giữa các nút mạng tinh thể ta phân mạng tinh thể thành 4 mạng tinh thể khác
nhau : mạng phân tử, mạng nguyên tử, mạng ion và mạng kim loại.
- Đặc tính lý học của từng mạng tinh thể :
+ Mạng phân tử được tạo thành nhờ liên kết Van de Waals giữa các phân tử ở nút mạng. Liên kết Van de
Waals có tính không định hướng, không bão hòa. Sự sắp xếp trong mạng phân tử theo xu hướng đặc khít
nhất (có chịu ảnh hưởng của tính đối xứng của phân tử). Liên kết Van de Waals rất yếu. Các đặc điểm nêu
trên cho mạng phân tử các đặc tính lý học sau: Có độ cứng thấp, nhiệt độ nóng chảy thấp, áp suất hơi
bão hòa cao, dễ thăng hoa, không dẫn điện, tỷ trọng nhỏ, các tinh thể của chất có khối lượng phân tử nhỏ
dễ tan trong dung môi không phân cực. Nhiều tinh thể có tính trong suốt (cho ánh sáng đi qua).
+ Mạng nguyên tử được tạo thành nhờ liên kết cộng hóa trị giữa các nguyên tử ở nút mạng. Liên kết cộng
hóa trị có tính định hướng, bão hòa, có cực hoặc không có cực. Sự sắp xếp trong mạng nguyên tử phụ
thuộc vào trạng thái lai hóa của nguyên tử và cấu tạo lớp vỏ electron hóa trị của nguyên tử. Liên kết cộng
hóa trị là loại liên kết mạnh. Các đặc điểm nêu trên cho mạng nguyên tử các đặc tính vật lý sau: rất bền,
độ cứng cao, nhiệt đô nóng chảy cao, áp suất hơi bão hòa rất nhỏ, không bay hơi, rất khó thăng hoa, tỷ lOMoAR cPSD| 58702377
trọng không lớn, hầu như không tan trong bất cứ loại dung môi nào, chất cách điện hay chất bán dẫn, cách
nhiệt, nhiều tinh thể có tính trong suốt (cho ánh sáng đi qua).
+ Mạng ion được tạo thành nhờ tương tác tĩnh điện của các ion. Liên kết ion có tính không bão hòa và
không định hướng. Có hiện tượng phân cực giữa các ion trái dấu. Sự sắp xếp trong mạng ion liên quan
đến tương quan kích thước và tỷ lệ giữa cation và anion. Liên kết ion là loại liên kết mạnh. Các đặc điểm
nên trên cho mạng ion các đặc tính vật lý sau: nhiệt độ nóng chảy khá cao, áp suất hơi bão hòa rất nhỏ,
không bay hơi, rất khó thăng hoa, khá cứng, dòn, không dẫn điện, cách nhiệt, tỷ trọng không lớn, một số
lớn dễ tan trong dung môi phân cực, nhiều tinh thể có tính trong suốt (cho ánh sáng đi qua). + Mạng kim
loại được tạo thành nhờ tương tác giữa “đám mây electron” và các ion dương ở nút mạng. Sự sắp xếp các
nguyên tử trong mạng kim loại đặc khít nhất. Độ mạnh liên kết kim loại phụ thuộc và mật độ “đám mây”
electron. Các đặc điểm trên cho mạng kim loại các đặc tính vật lý sau: không trong suốt, có ánh kim, có
tính dẻo (dễ dát mỏng, kéo dài), dẫn điện và nhiệt tốt, nhiệt độ nóng chảy, độ cứng và tỷ trọng, khả năng
thăng hoa thay đổi trong một khoảng rộng.
Bài 15: Dựa vào yếu tố nào để phân chia các tinh thể thành 4 kiểu cấu trúc. Yếu tố cấu trúc ảnh
hưởng như thế nào đến đặc tính lý học của tinh thể?
Việc phân chia tinh thể thành 4 kiểu cấu trúc căn cứ vào khoảng cách giữa các nút mạng với
nhau và khoảng cách giữa các nút mạng so với khoảng cách các nguyên tử trong một nút mạng.
Sự xuất hiện khác biệt khoảng cách giữa các tiểu phân trong mạng tinh thể là sự phản ảnh việc
trong mạng tinh thể đồng thời có nhiều loại liên kết. Yếu tố cấu trúc cho tinh thể them những tính chất sau:
+ Cấu trúc đảo: sự phá vỡ liên kết giữa các nút mạng là dễ dàng hơn rất nhiều sự phá vỡ liên kết trong một nút mạng,
+ Cấu trúc mạch: Nếu liên kết giữa các mạch là lực Van de Waals thì tinh thể có cấu trúc mạch có
tính dễ tước sợi. Nếu có liên kết pi không định chỗ trong một mạch thì tinh thể có tính dẫn điện
tốt theo chiều của mạch. Tinh thể cấu trúc mạch có tính không trong suốt, độ cứng không cao, tỷ trọng không cao.
+ Cấu trúc lớp: Nếu liên kết giữa các lớp là lực Van de Waals thì tinh thể cấu trúc lớp có tính dễ
bóc tách, mềm. Nếu có liên kết pi không định chỗ trong lớp thì tinh thể có tính dẫn điện tốt. Tinh
thể cấu trúc trúc có tính không trong suốt, độ cứng không cao, tỷ trọng không cao.
Bài 16: Bản chất liên kết ảnh hưởng như thế nào đến nhiệt độ nóng chảy và nhiệt độ sôi của các
chất. Nêu ví dụ minh họa (khác ví dụ trong bài giảng).
Nguyên tắc chung: Liên kết càng mạnh, chất càng khó nóng chảy, khó bay hơi.Lực Van de Waals rất yếu
nên các hợp chất có mạng phân tử đều có nhiệt độ nóng chảy và nhiệt độ sôi thấp. Ở điều kiện thường
nhiều chất ở trạng thái lỏng hay ở trạng thái khí. Trường hợp sự tồn tại của trạng thái tập hợp nhờ liên kết
Van de Waals, khối lượng phân tử càng lớn và độ có cực của phân tử càng lớn nhiệt độ nóng chảy và nhiệt
độ sôi càng cao. Sự chênh lệch của nhiệt độ nóng chảy và nhiệt độ sôi nhỏ. lOMoAR cPSD| 58702377
Lực liên kết hydro khá yếu nhưng mạnh hơn nhiều so với lực Van de Waals nên các chất có liên kết hydro
liên phân tử có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn hẳn các chất không có loại liên kết này. Chất Liên kết Phân tử (nguyên tử) Nhiệt độ nóng chảy Nhiệt độ sôi (0C) lượng (đ.v.C) (0C) He Van de Waals 4,0 -271,4 -268,9 Xe Van de Waals 131,3 -111,85 -108,12 H2S Van de Waals 34 -85,6 -60,4 H2Te Van de Waals 129,6 -51 -2 H2O Van de Waals + hydro 18 0 100
Do bản chất liên kết ion là lực hút tĩnh điện giữa các ion cùng dấu và là loại liên kết mạnh, ở điều kiện
thường các hợp chất ion đều là chất rắn. Tuy nhiên do hiện tượng phân cực giữa các ion trái dấu, các hợp
chất ion có nhiệt độ nóng chảy không quá cao (thường dưới 10000C). Có sự chênh lệch rõ rệt giữa nhiệt
độ nóng chảy và nhiệt độ sôi.
Chất Nhiệt độ nóng Nhiệt độ sôi Chất Nhiệt độ nóng Nhiệt độ sôi chảy (0C) (0C) (ở 1 atm) chảy (0C) (0C) LiCl 610 1380 NaCl 801 1490 BaF2 1368 2260 776 1430
Do hiện tượng phân cực ion, nhiệt độ nóng chảy và nhiệt độ sôi của các chất có cation điện tích cao và
anion kích thước lớn có thể nhỏ bất thường, loại hợp chất này có thể thăng hoa khi đun nóng (khí là phân tử)
Chất Nhiệt độ nóng chảy (0C) Nhiệt độ sôi (0C) (ở 1 atm) Nhiệt độ thăng hoa (0C) Liên kết BeI2 490 530 cộng hóa trị AlCl3 192,6 180 là loại liên FeCl3 307,5 315 kết mạnh.
Giữa hai nguyên tử có thể nối với nhau bằng một hay nhiều liên kết cộng hóa trị (1 liên kết sigma, 2 liên
kết pi và 1 liên kết delta). Liên kết cộng hóa trị có thể có cực và không có cực. Liên kết cộng hóa trị cho
nhận dễ bị đứt dưới tác động nhiệt độ. Các đặc điểm này cho các chất cộng hóa trị có nhiệt độ nóng chảy
từ khá cao đến rất cao. Chất Kiểu cấu trúc tinh Liên kết Nhiệt độ nóng Nhiệt độ sôi (0C) thể chảy (0C) BN Phối trí Cộng hóa trị có cực 3000 C (kim cương) Phối trí Cộng hóa trị không 1800 chuyển thành grafit cực SiO2 Phối trí Cộng hóa trị có cực 1610 2950 P (đen) Phối trí Cộng hóa trị không 453 (thăng hoa dạng P4) cực
Liên kết kim loại là loại liên kết mạnh nhưng phụ thuộc rất nhiều vào mật độ “đám mây” electron. Mật độ
đám mây electron lại phụ thuộc vào số electron hóa trị của kim loại. Số electron hóa trị càng nhiều thì kim lOMoAR cPSD| 58702377
loại có mật độ “đám mây” electron càng lớn. Vì vậy, các kim loại có nhiệt độ nóng chảy và nhiệt độ sôi
khác biệt nhiều, sự chênh lệch của giữa nhiệt độ nóng chảy và nhiệt độ sôi lớn.
Chất Cấu hình electron hóa trị Nhiệt độ nóng chảy (0C) Nhiệt độ sôi (0C) Hg 6s2 -38,89 356,66 W 5d46s2 3420 5680 Pb 6s26p2 327,4 1745 K 4s1 63,55 761 Tl 6s26p1 304 1475
Bài 17: Cho biết loại chất vô cơ nào tinh thể của chúng có cấu trúc đảo. Cho một ví dụ (ngoài các ví
dụ trong bài giảng) về chất mà tinh thể của nó có cấu trúc đảo. Cho biết số phối trí của Iod trong tinh thể đơn chất.
Cấu trúc đảo: các chất vô cơ thuộc loại cấu trúc này có mạng phân tử và các ion phức tạp
. Trong cấu trúc này , tại các nút mạng là các nhóm nguyên tử ( phân tử hay ion phức tạp)
liên kết với tiểu phân xung quanh bằng lực tàn dư ( lực Van der waals ) , lực liên kết hidro hay lực hút tĩnh điện.
- Ví dụ: CO2, NH3, Na3[Fe(CN)6], Xe…
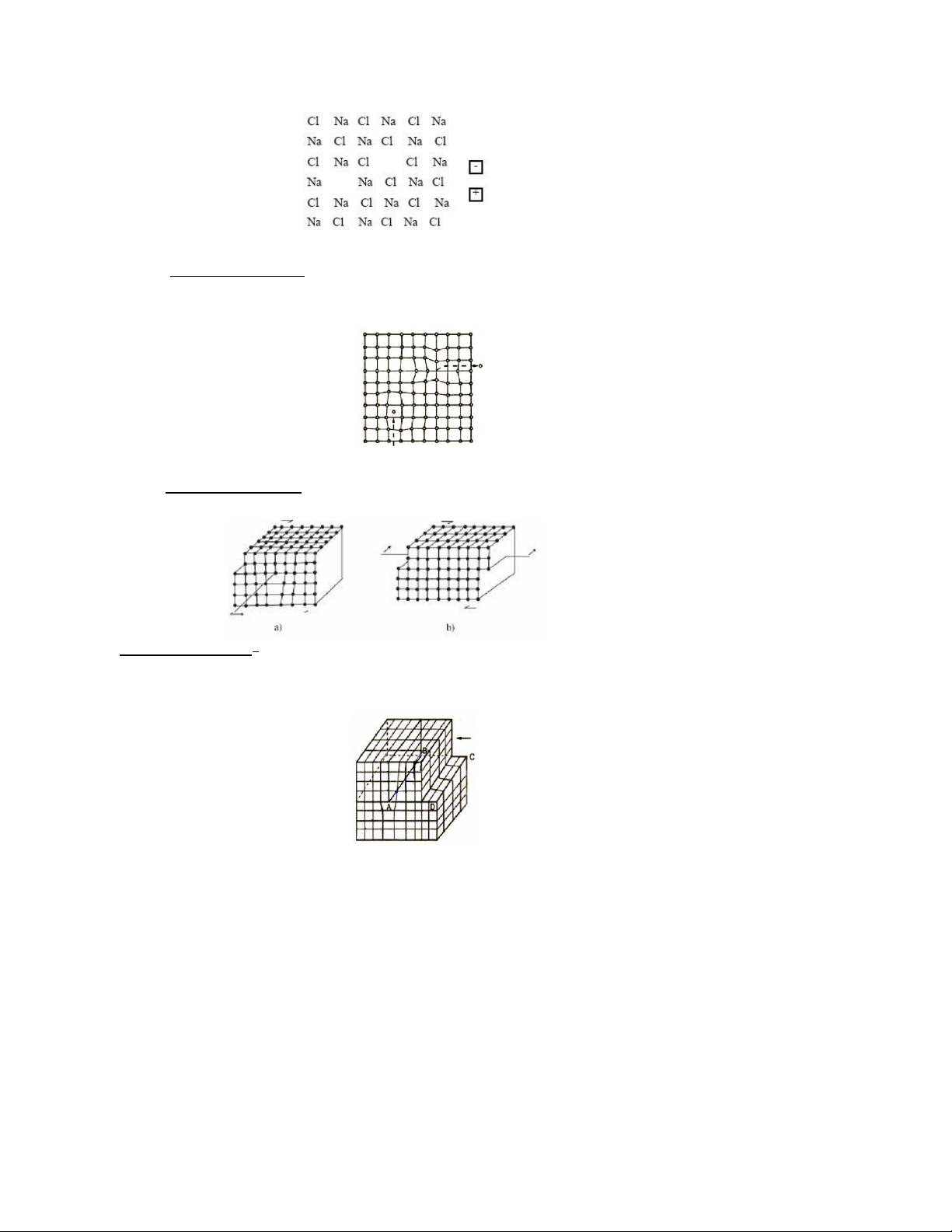
Số phối trí của Iod trong tinh thể đơn chất:
Ta thấy mỗi tiể u phân I 2 trung t âm ược bao bọc xung quanh số phân tử I 2 gần nhất: xung
quanh 4, phía trên 4 và phía dưới 4, vậy số phối trí của I là 12. 2
Bài 18: Có mấy loại khuyết tật cấu trúc? Trình bày các loại khuyết tật này.
Có 3 loại khuyết tật cấu trúc: khuyết tật điểm , khuyết tật đường và khuyết tật bề mặt 1)
Khuyết tật điểm:
a) Khuyết tật lỗ trống: trong mạng có những vị trí bỏ trống tại các nút mạng . Ví dụ : lOMoAR cPSD| 58702377
b) Khuyết tật xen kẽ: các tiểu phân tạp chất xâm nhập vào mạng tinh thể thay thế cho các
tiểu phân cấu trúc tại nút mạng hay xen kẽ vào giữa mạng .
2) Khuyết tật đường: đầu biên của một mặt mạng bị đứt cụt trong tinh thể.
3) Khuyết tật bề mặt : là tập hợp của khuy ết tật điểm và khuyết tật đường . Xuất hiện trên bề mặt
tinh thể và bề mặt biên giới giữa các tinh thể .
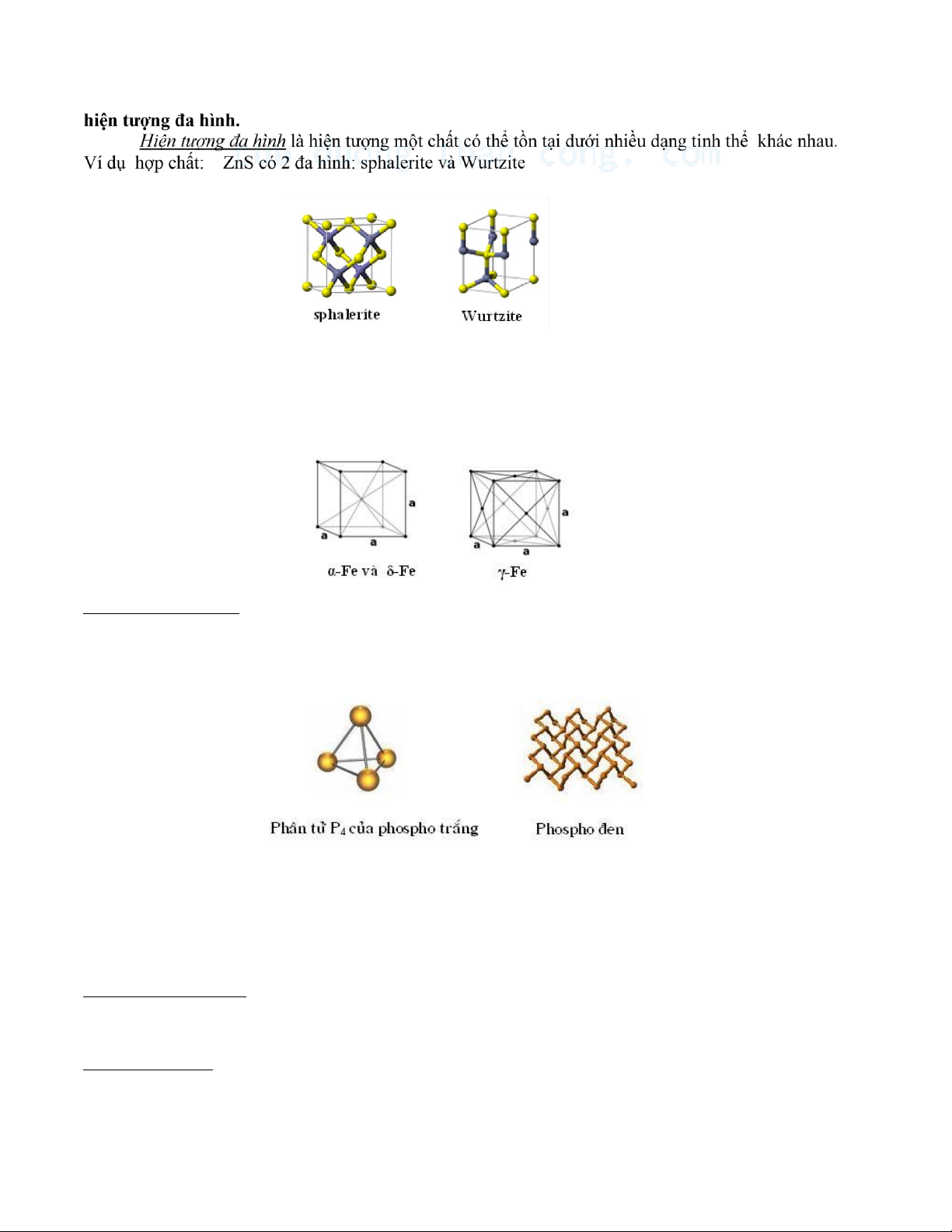
Bài 19: Hiện tượng đa hình (thù hình) là gì? Nêu 1 ví dụ về hiện tượng thù hình và một ví dụ về lOMoAR cPSD| 58702377
Ví dụ đơn chất: Sắt có 3 đa hình (thù hình): α-Fe và δ – Fe cùng có mạng lập phương tâm khối (BCC) và
chỉ có sự khác biệt về giá trị cạnh hộp lập phương, γ-Fe có mạng lập phương tâm diện (FCC).
Hiện tượng thù hình: là hiện tượng một đơn chất có nhiều dạng có cấu trúc phân tử khác nhau hay có cấu trúc tinh thể khác nhau.
Ví dụ: Phospho có hai thù hình: phosphor trắng: Ở trạng thái khí là phân tử P4, ở trạng thái rắn có kiểu cấu
trúc phân tử với nút mạng là P4. Phosphor đen có cấu trúc phối trí (hệ tinh thể trực giao hay tam phương)
Đối với đơn chất ở trạng thái rắn, có thể sử dụng kh ái niệm thù hình (allotropic) hoặc khái niệm đa hình ( polymorphic )
Bài 20: Hiện tượng đồng hình là gì? Điều kiện xảy ra hiện tượng đồng hình? Nêu 1 ví dụ về hiện
tượng đồng hình.
Hiện tượng đồng hình là các chất khác nhau có cùng loại tinh thể có thể đồng thời kết tinh tạo thành 1 loại
tinh thể trong đó các tiểu phân của chúng thay thế lẫn cho nhau. Sản phẩm thu được là 1 dung dịch rắn thay thế.
Điều kiện xảy ra:
- Các chất có cùng cấu trúc tinh thể. lOMoAR cPSD| 58702377
- Bán kính nguyên tử của các ion thay thế nhau xấp xỉ nhau. - cùng số oxy hóa
Ví dụ: α- FeOOH (Goetite) và β-AlOOH (boemite) có cùng kiểu mạng tinh thể tam phương. Sự thay thế
một phần Fe bằng Al tạo dung dịch rắn thay thế Fe1-xAlxOOH (alumogoetite) là một khoáng vật có nhiều
trong quặng bauxite Tây Nguyên. (bán kính ion Al = 0,57Å ; Fe = 0,67Å).
Phân nhóm bài tập nộp:
Nhóm 1: Bài 1, bài 6, bài 11 , bài 16 // Nhóm 2: Bài 2, bài 7, bài 12, bài 17 // Nhóm 3: Bài 3, bài 8,
bài 13, bài 18 // Nhóm 4: Bài 4, bài 9, bài 14, bài 19 // Nhóm 5: Bài 5, bài 10, bài 15, bài 20.