

Preview text:
ĐỀ THI ÔN TẬP CUỐI KỲ HÓA VÔ CƠ 1
Học kỳ 1 – Năm học 2024-2025
Tên học phần: Hóa Vô Cơ Mã HP:
Thời gian làm bài: Ngày thi:
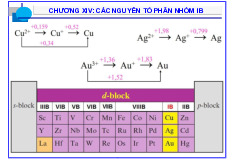
BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
VÒNG TRÒN BƯỚC SÓNG CỦA MÀU SẮC
Phần I: Phản ứng oxid hóa khử
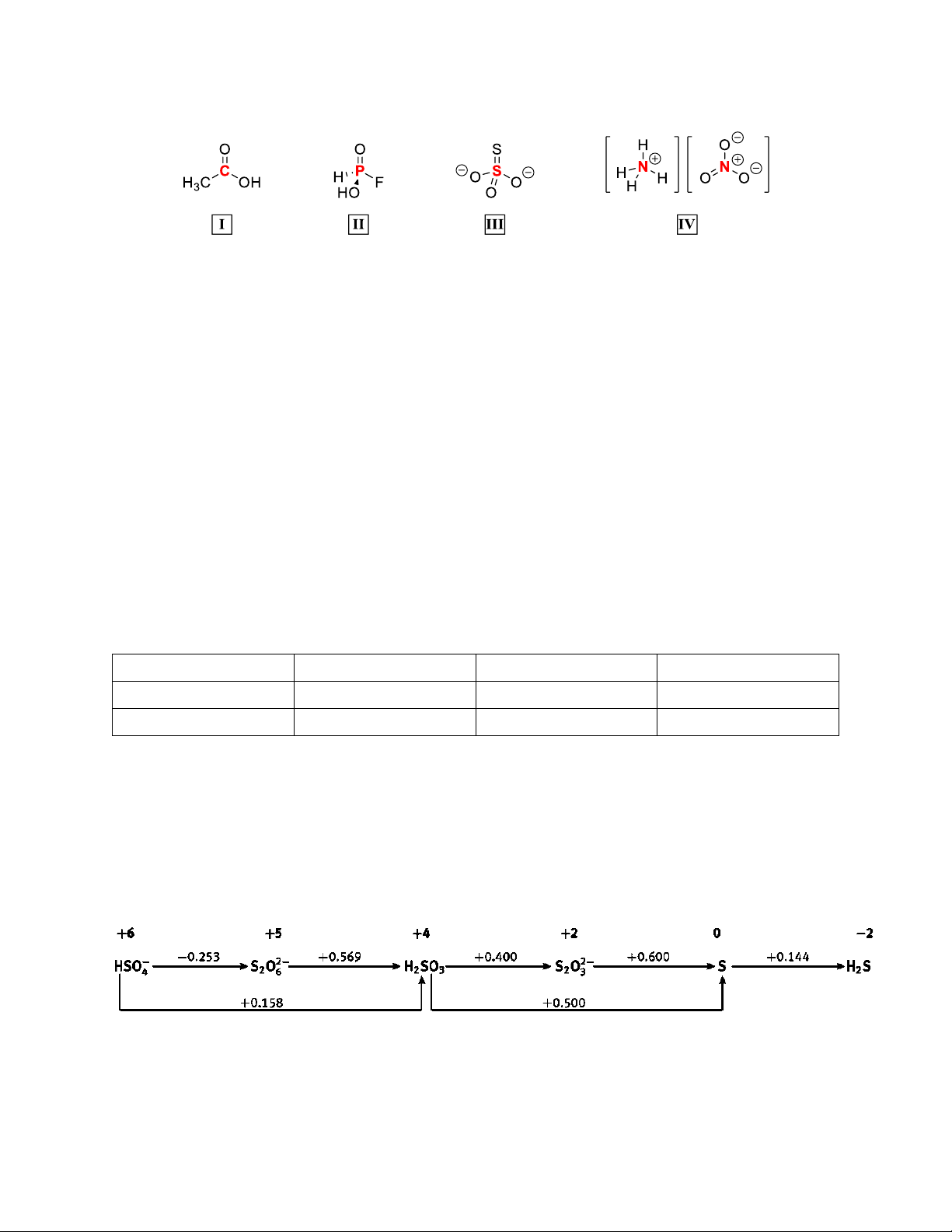
Câu 1: Xác định trạng thái oxid hóa khử của các nguyên tử được in đậm:
Câu 2: Cân bằng các phản ứng oxid hóa – khử sau theo phương pháp ion – electron:
a) K2Cr2O7 + FeSO4 + H2SO4 ⎯⎯
→Fe2(SO4)3 + Cr2(SO4)3 + H2O
b) KMnO4 + Na2SO3 + H2SO4 ⎯⎯ →MnSO4 + Na2SO4 + H2O
c) C6H12O6 + CuSO4 + KOH ⎯⎯ →C6H12O7K + Cu2O + H2O d) Br2 + KOH ⎯⎯ → KBr + KBrO3 + H2O
e) Al + NaOH + H2O ⎯⎯ → NaAlO2 + H2
Câu 3: Hoàn thành các phản ứng hóa học sau a) KClO3 + HCl ⎯⎯ →
b) SO2 + Br2 + H2O ⎯⎯ → c) KMnO4 + HCl ⎯⎯ →
d) Cl2 + NaOH (nóng) ⎯⎯ →
e) PbO2 + HClđđ ⎯⎯ →
f) KI + H2O2 + H2SO4 ⎯⎯ → g) KI + FeCl3 ⎯⎯ →
h) NaNO2 + H2O2 + H2SO4 ⎯⎯ → i) SiCl4 + H2O ⎯⎯ → k) PCl3F2 + H2O ⎯⎯ → t) SF4 + H2O ⎯⎯ → r) Na + NH3 ⎯⎯ →
Câu 4: Cho một số giá trị thế ion hóa (I) và thế khử (E°) trong bảng sau: Bán phản ứng Thế khử (V) Quá trình ion hóa Thế ion hóa (eV) Cu2+/Cu +0,34 Cu → Cu2+ + 2e– 28,01 Zn2+/Zn –0,76 Zn → Zn2+ + 2e– 27,35
Giải thích tại sao thế ion hóa của Cu và Zn tương đối giống nhau nhưng thế khử có sự khác nhau đáng kể.
Câu 5: Cho giá trị thế oxid hóa khử tiêu chuẩn của cặp Cu+/Cu là +0,521.
Hãy tính thế oxid hóa khử tiêu chuẩn của Cu+/Cu trong các điều kiện sau:
a) Có mặt ion I– (cho biết: pTCuI = 11,96)
b) Có mặt NH3 (cho biết: pK1–2 = 10,86 với K1–2 là hằng số phân li toàn phần của phức[Cu(NH3)2]+).
Hãy cho biết tính oxid hóa của Cu+ thay đổi như thế nào khi có mặt tác nhân tạo kết tủa và tạo phức.
Câu 6: Cho giản đồ latimer của sulfur như sau:
a) Cho biết môi trường hóa học (acid, trung hòa, base) của giản đồ latimer đã cho
b) Bằng tính toán, hãy cho biết các tiểu phân nào trong số các tiểu phân: H2SO3, 2
S O − , S tồn tại bền vững 2 3
trong dung dịch với môi trường ở a).
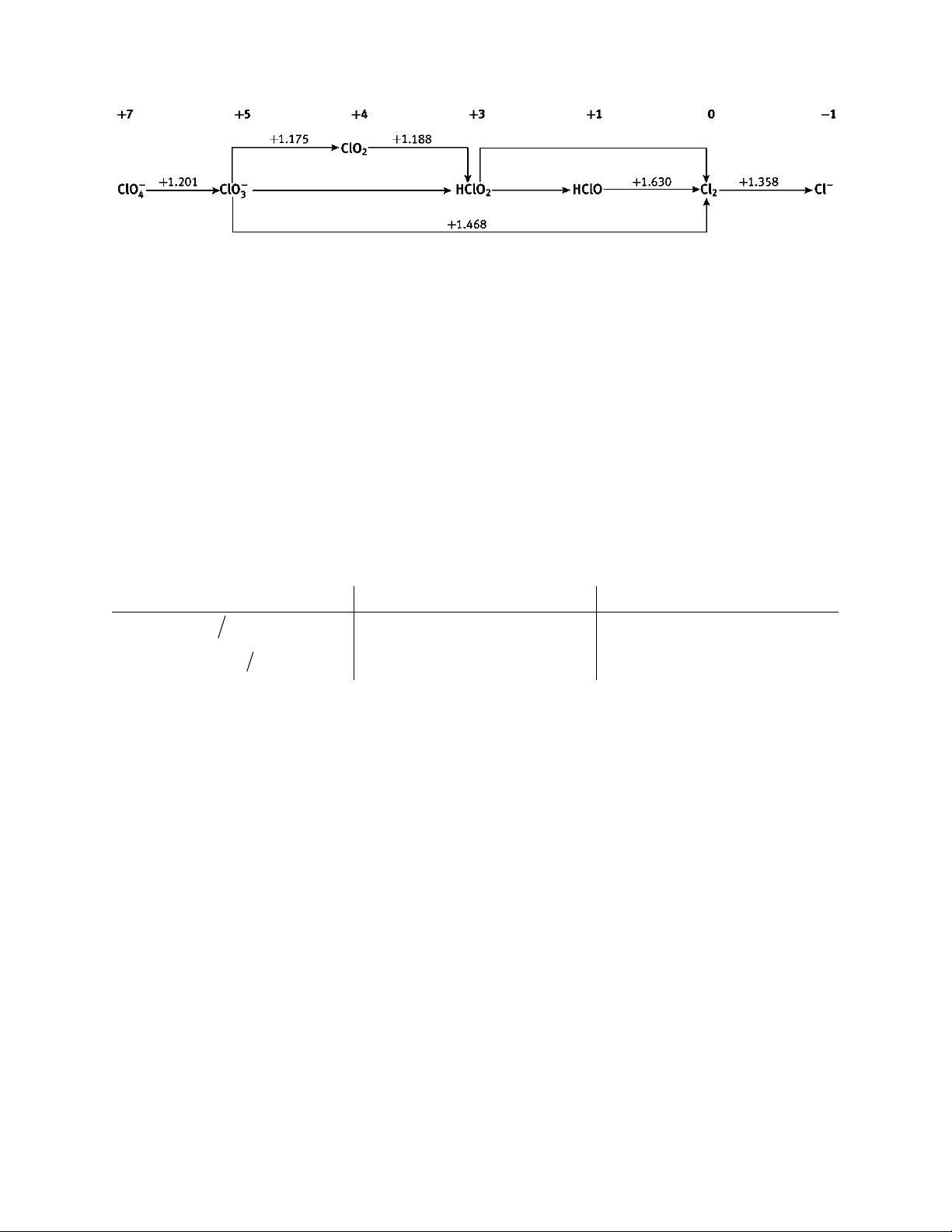
Câu 7: Cho giản đồ Latimer của nguyên tố chlorine trong môi trường acid. E˚(3) E˚(1) E˚(2)
a) Tính toán và xác định các giá trị Eo(1), Eo(2), Eo(3).
b) Cho biết các ion chlorate, chlorous acid có bền trong dung dịch không? Giải thích. Câu 8:
a) Tính hằng số cân bằng và cho biết các phản ứng sau có xảy ra hoàn toàn ở điều kiện chuẩn không?
i) NH3 + H3PO4 + MgCl2 ⟶ NH4MgPO4↓+ NH4Cl
ii) Au + NaCN + O2 + H2O ⟶ Na[Au(CN)2] + NaOH
b) Cho phản ứng: Au3+ + 2e– ⇌ Au+
Tính thế khử điều kiện của phản ứng trên khi thêm dung dịch NaCN vào hệ. So sánh khả năng oxid hóa của
Au3+ trước và sau khi thêm NaCN.
Cho biết: NH3 có pKb = 4,75; H3PO4 có pKai = 2,15; 7,20; 12,68; NH4MgPO4 có pK = 12,64; E0(Au+/Au)
= +1,68 V; E0(Au3+/Au+) = +1,41 V; E0(O2, H2O/OH–) = 0,401 V; hằng số tạo thành phức β([Au(CN)2]-) =
1038,3. Cho rằng các phản ứng đều được thực hiện ở điều kiện chuẩn.
Câu 9: Cho bảng số liệu sau:
Cặp oxid hóa khử liên hợp Thế khử chuẩn (V) Ghi chú 2 CrO − Cr OH –0,13 pH = 14 4 ( )3 H O ,H+ H O +1,76 pH = 0 2 2 2
a) Từ bán phản ứng H2O2 + 2H+ + 2e– → 2H2O, hãy tính thế khử chuẩn của H2O2/OH– (pH = 14)
b) Cho biết H2O2 có khả năng oxid hóa trong môi trường kiềm pH = 14 hay không? Nếu có hãy viết phương
trình phản ứng. Phản ứng có xảy ra “hoàn toàn” không? Giải thích. Câu 10:
a) Tính hằng số cân bằng và cho biết các phản ứng sau có xảy ra hoàn toàn ở điều kiện chuẩn không?
i) Ag2S + HCl ⟶ AgCl↓ + H2S
ii) C2H5OH + KMnO4 + H2SO4 ⟶ CH3COOH + MnCl2 + K2SO4 + H2O
b) Phản ứng định lượng Mn2+ có thể được thực hiện bằng chuẩn độ oxid hóa khử sử dụng chất chuẩn là
potassium permanganate trong môi trường trung tính.
i) Viết phương trình chuẩn độ oxid hóa khử.
ii) Tính toán và nhận xét tính hoàn toàn của phản ứng chuẩn độ trên khi đặt trong môi trường acid (pH = 3)
và môi trường base (pH = 10). Bỏ qua sự tồn tại của hydroxide trong môi trường base. Cho biết: Ag2S có
hằng số pKs = 50,10; AgCl có hằng số pKs = 9,80; H2S có hằng số phân ly acid: pKa1 = 9 và pKa2 = 13;
Eo( MnO− ,H+/Mn2+) = +1,51 V; Eo( MnO− ,H+/MnO 4 4
2) = +1,679 V; Eo(Mn3+/Mn2+) = +1,50 V; Eo(CO2,
H+/C2H5OH) = –0,329 V; Eo(CO2, H+/CH3COOH) = –0,31 V.
Phần II: Danh pháp vô cơ
Một số quy tắc trong gọi tên các chất vô cơ.
– Các tiền tố: hypo-, per-, thio-, thion-, di-, tri-, meta-, ortho-, pyro-
– Các hậu tố: -ide, -ate, -ite, -ous, -ic HX HXO Hợp chất acid XO– và muối HXO2 của halogen XO− 2 HXO3 HXO4 H3PO2 H PO− 2 2 Hợp chất acid H3PO3 và muối của H PO− phosphorus 2 3 H3PO4 H PO− 2 4 HNO3 Hợp chất acid NO− 3 và muối của HNO nitrogen 2 NO− 2 H2SO4 2 SO − 4 H2SO3 2 SO − 3 H2S2O3 2 S O − 2 3 H2S2O4 Hợp chất acid 2 S O − 2 4 và muối của H sulfur 2S2O5 2 S O − 2 5 H2S2O6 2 S O − 2 6 H2S2O7 2 S O − 2 7 H2S2O8 2 S O − 2 8 H2SO5 2 SO − 5
Một cách tóm tắt và ghi nhớ được:
Các hậu tố -ic, -ous: Gọi tên acid
Các hậu tố -ate, -ite: Gọi tên các anion từ acid tương ứng
Các hậu tổ -per, -hypo được sử
dụng để gọi tên các acid và anion từ acid
Câu 1: Hãy gọi tên các hợp chất sau: (1) Na3AsO4 (2) SCN– (3) KMnO4 (4) K2MnO4 (5) K3MnO4 (6) Na2CrO4 (7) Na2Cr2O7 (8) 2 C O − (9) HSO 2 4 3F (10) HP(O)(OH)2 (11) LiClO4 (12) N2O (13) 2 FeO − (14) CuCl (15) CaC 4 2 (16) LiN3 (17) Li3N (18) CaB2 (19) Fe2O3 (20) H2O2
Câu 2: Dựa vào tên của các hợp chất đã cho, viết công thức hóa học tương ứng (1) Caesium hypobromite (2) Copper(I) arsenate (3) Barium chromate (4) Zinc(II) dithionite (5) Carbon disulfide (6) Thiocyanic acid
Câu 3: Gọi tên các phức chất có công thức hóa học như sau:
(1) [Co(NH3)4(NO2)2][Co(NH3)2(NO2)4] (2) [Cu(NH3)4(H2O)]SO4 (3) K4[Co(NO2)6] (4) [Ni(en)3]Br2 (5) Co(NH3)3Cl3 (6) K2[CuF4(H2O)2]
Câu 4: Gọi tên các phức chất có công thức hóa học như sau:
a) Pentaamminechlorochromium(II) sulfate
b) Sodium aquabromochlorofluorocuprate(II)
c) Ammonium bis(oxalato)diiodovanadate(III)
Phần III: Mạng tinh thể
Câu 1: Một chất rắn chứa 2 nguyên tố A (MA = 65,39 g mol–1) và B (MB = 32,06
g mol–1) có ô mạng cơ sở như hình bên, với thông số mạng a = 5,96 Å.
a) Tính toán để xác định số lượng nguyên tử của các nguyên tố A và B trong một ô
mạng cơ sở? Từ đó xác định công thức hóa học của hợp chất này.
b) Tính khối lượng riêng d (g cm–3) của chất rắn này? (cho biết: NA = 6,0231023).
Câu 2: Hợp chất A được tạo thành từ kim loại X (M = 24,305 g mol–1; chiếm vị trí đỉnh và tâm của ô mạng)
và một phi kim Y (M = 1,008 g mol–1; chiếm các vị trí còn lại), có ô mạng cơ sở được cho như hình bên
(thông số mạng a = b = 4,48 Å và thông số mạng c).
a) Tính toán và xác định số lượng nguyên tử của các nguyên tố X và Y trong ô mạng cơ sở.
b) Xác định giá trị thông số mạng c. (NA = 6,022×1023). Biết mật độ khối lượng nguyên tử trong một ô
mạng cơ sở có giá trị d = 1440 kg m–3.
Câu 3: Silicon là một nguyên tố phổ biến thứ hai trong vỏ Trái Đất, đồng thời là
một á kim quan trọng trong ngành công nghiệp bán dẫn. Silicon kết tinh trong
mạng tinh thể giống kim cương.
Biết rằng khối lượng riêng của silicon là 2,33 g cm–3. Tính bán kính của nguyên tử silicon.
Câu 4: Cho cấu trúc mạng tinh thể như sau. Biết rằng lớp đối xứng của ô mạng cơ sở là 3L44L36L29PC.
a) Hãy giải thích các yếu tố đối xứng trên.
b) Xác định công thức hóa học chung của hợp chất. Câu 5:
a) Xác định cấu trúc phân tử của các hợp chất cộng hóa trị sau: [SF5]– XeF4 [PO2F2]–
b) Xác định cấu trúc tinh thể của các hợp chất sau: Hợp chất PbF4 (F tạo cầu đơn) CrF5 (F tạo cầu đơn)
Số phối trí của nguyên tử 6 6 trung tâm
c) Vật liệu NiF4 và vật liệu SiF4 nóng chảy ở các nhiệt độ khác nhau, có số phối trí của nguyên tử trung tâm
lần lượt là 6 và 4. Hãy cho biết cấu trúc tinh thể của hai iodide trên và so sánh nhiệt độ nóng chảy của chúng. Câu 6:
a) Xác định cấu trúc tinh thể của các hợp chất sau: Hợp chất ZrCl4 (Cl tạo cầu đôi) ZrCl3 (Cl tạo cầu ba)
Số phối trí của nguyên tử 6 6 trung tâm
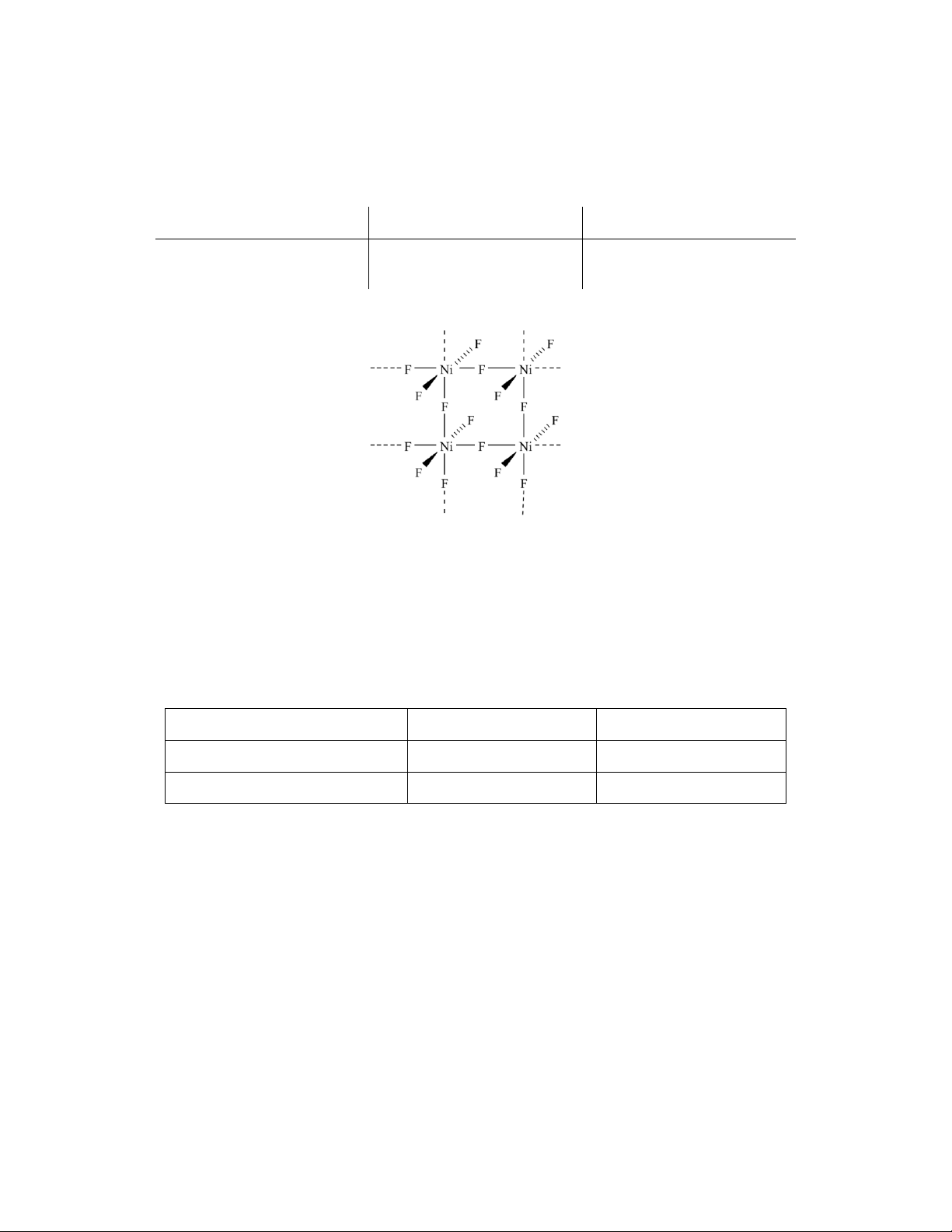
b) Hợp chất X là phức potassium của nickel(II) có lát cắt cấu trúc tinh thể được cho như sau:
Hãy xác định loại mạng tinh thể của X (không xét tới K+) và cho biết tên của phức chất này.
Câu 7: Ở trạng thái rắn, beryllium trong hợp chất BeI2 và BeF2 đều có số phối trí 4.
a) Hãy xác định cấu trúc tinh thể theo không gian (mạch, lớp, khung, đảo). Biết khi tạo cầu thì nguyên tử
iodine tạo cầu đôi, fluorine tạo cầu đơn.
b) Từ cấu trúc tinh thể của hai hợp chất trên, hãy cho biết hợp chất nào có nhiệt độ nóng chảy cao hơn.
Câu 8: Hãy cho biết cấu trúc không gian, nhiệt độ nóng chảy (cao hơn, thấp hơn hay bằng nhau) của AlF3
và AlBr3. Cho biết trong AlF3 thì Al có số phối trí 6, còn trong AlBr3 thì Al có số phối trí 4. Giải thích. Hợp chất AlF3 AlBr3 Cấu trúc không gian Nhiệt độ nóng chảy