

Preview text:
KIỂM TRA GIỮA KỲ 2 NĂM HỌC 2022-2023-ĐỀ 3
Môn: Hóa học – Lớp 10
Họ và tên học sinh:……………………………………Số báo danh:………………......Lớp…….
Cho biết Nguyên tử khối của: H =1, C = 12, O =16, Mg= 24, Al =27, N = 14).
A/ TRẮC NGHIỆM: (5.0 điểm).
Câu 1. Dựa vào phương trình nhiệt hoá học của phản ứng sau: 3Fe (s) + 4H H 0
2O (l) → Fe3O4 (s) + 4H2 (g) r 298 = +26,32 kJ Giá trị H 0 r
298 của phản ứng: Fe3O4 (s) + 4H2 (g) → 3Fe (s) + 4H2O (l) là A. +26,32 kJ. B. -26,32 kJ. C. -13,16kJ. D. +13,16 kJ.
Câu 2. Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25 K.
B. Áp suất 1 bar và nhiệt độ 298 K.
C. Áp suất 1 bar và nhiệt độ 25°C.
D. Áp suất 1 bar và nhiệt độ 25°C hay 298 K.
Câu 3. Để hàn nhanh đường ray tàu hỏa bị hỏng, người ta dùng hỗn hợp tecmit để thực hiện phản
ứng nhiệt nhôm sau: 2Al + Fe2O3 → Al2O3 + 2Fe.
Phát biểu nào sau đây sai?
A. Fe2O3 là chất oxi hóa.
B. Tỉ lệ giữa chất bị khử: chất bị oxi hóa là 2:1.
C. Al là chất khử.
D. Tỉ lệ giữa chất bị khử: chất bị oxi hóa là 1:2.
Câu 4. Phát biểu nào sau đây về số oxi hoá không đúng?
A. Trong ion đơn nguyên tử, số oxi hoá của nguyên tố bằng điện tích ion.
B. Trong đơn chất, số oxi hoá của nguyên tử bằng 0.
C. Trong tất cả các hợp chất, số oxi hoá của hydrogen là +1.
D. Số oxi hoá được viết ở dạng đại số, dấu viết trước, số viết sau.
Câu 5. Liên kết hydrogen và tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất.
D. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất.
Câu 6. Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các A. ion âm.
B. lưỡng cực vĩnh viễn.
C. lưỡng cực tạm thời.
D. lưỡng cực cảm ứng.
Câu 7. Dấu hiệu để nhận biết một phản ứng oxi hoá - khử là
A. có sự thay đổi số oxi hoá của một số nguyên tố.
B. tạo ra chất khí.
C. tạo ra chất kết tủa.
D. có sự thay đổi màu sắc của các chất.
Câu 8. Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
A. giải phóng, cung cấp.
B. giải phóng, giải phóng.
C. cung cấp, giải phóng.
D. cung cấp, cung cấp.
Câu 9. Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hoá học ở điều kiện chuẩn gọi là
A. biến thiên enthalpy chuẩn của phản ứng hoá học.
B. biến thiên enthalpy của phản ứng.
C. enthalpy tạo thành của một chất.
D. enthalpy tạo thành chuẩn của một chất. o
Câu 10. Quy ước về dấu của nhiệt phản ứng ( H ) nào sau đây là đúng? r 298 o o
A. Phản ứng tỏa nhiệt có H H r 298 > 0.
B. Phản ứng thu nhiệt có r 298 < 0. o o
C. Phản ứng thu nhiệt có H H r 298 = 0.
D. Phản ứng tỏa nhiệt có r 298 < 0.
Câu 11. Cho các quá trình hoặc phản ứng sau :
(1) Đốt củi để nấu bánh chưng bánh tét.
(2) Khi xịt cồn vào tay sát khuẩn. (3) Nung đá vôi.
(4) Sự bay hơi của nước ở ao hồ, sông, suối, biển cả.
Số quá trình hoặc phản ứng thu nhiệt là A. 3. B. 2. C. 1. D. 4.
Câu 12. Kí hiệu enthalpy tạo thành chuẩn là o o A. H H H H f . B. r . C. f 298 . D. r 298 .
Câu 13. Bản chất hình thành liên kết hydrogen là do
A. sự nhường – nhận electron.
B. các electron tự do.
C. lực hút tĩnh điện.
D. sự góp chung electron.
Câu 14. Cho phương trình nhiệt hóa học của phản ứng: N2(g) + O2(g) → 2NO(g) o
H = +179,20kJ. Phản ứng trên là phản ứng r 298 A. tỏa nhiệt. B. thu nhiệt.
C. có sự giải phóng nhiệt lượng ra môi trường.
D. không có sự thay đổi năng lượng.
Câu 15. Số oxi hóa của các nguyên tử H, Fe, Cl trong H2, Fe2+, Cl- lần lượt là A. +1; +2; −1. B. 0; +2; −1. C. +2; −2; +1. D. 0; −2; +1.
B/ Tự luận :( 5điểm).
Câu 1 (1 điểm): Viết các khả năng tạo thành liên kết hydrogen giữa một phân tử H2O và một phân tử NH3.
Câu 2 (1,5 điểm): Cho phản ứng oxi hóa khử sau: Mg + HNO3 → Mg(NO3)2 + NO + H2O.
a) Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
b) Hòa tan hoàn toàn 7,2 gam Magnesium vào dung dịch nitric acid loãng. Tính thể tích khí
nitrogen monooxide (NO) tạo thành ở điều kiện chuẩn? Câu 3 (1,5 điểm):
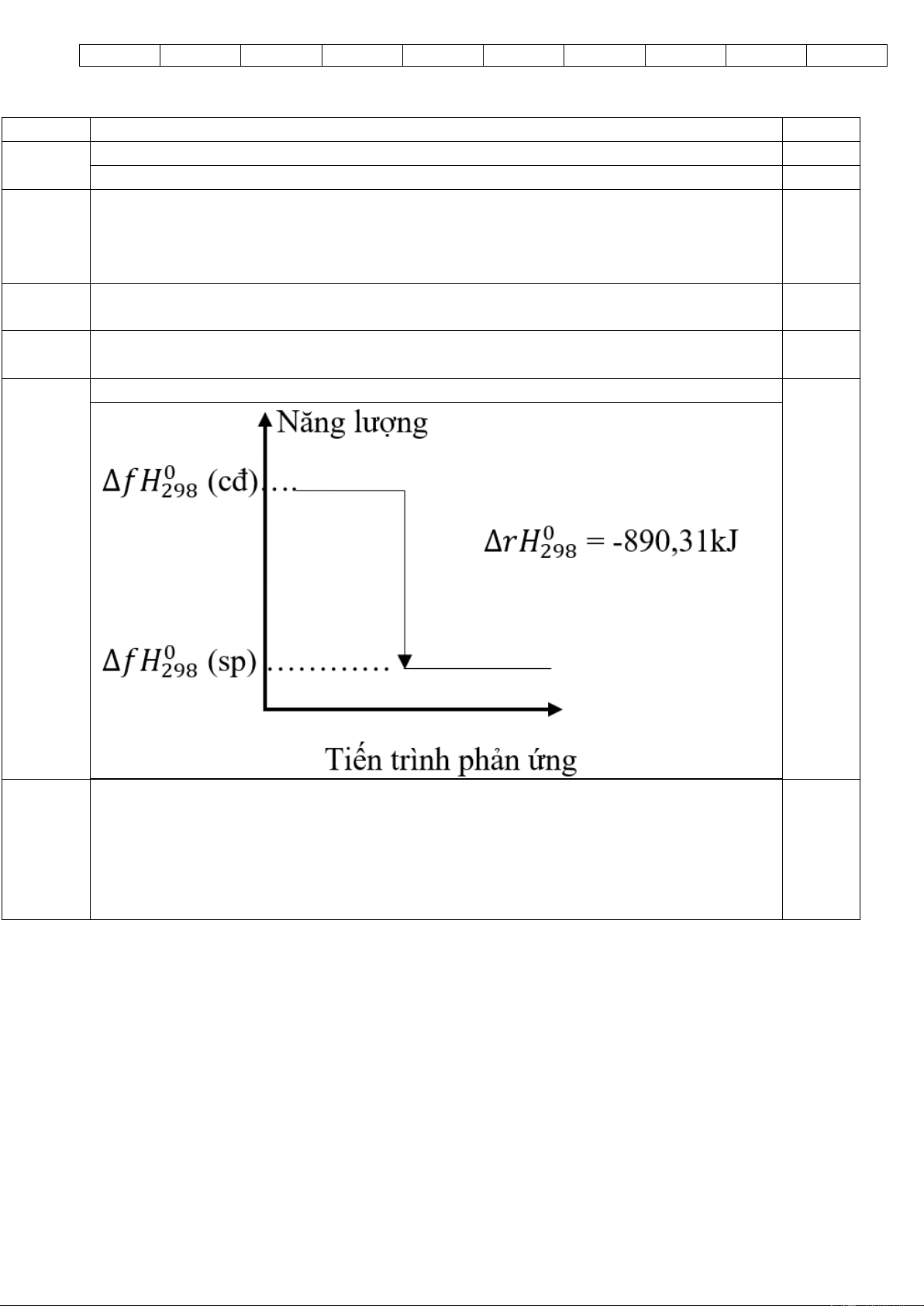
Cho phương trình hoá học của phản ứng: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
a/ Tính biến thiên enthalpy của phản ứng trên?
Cho biết nhiệt tạo thành chuẩn của các chất như sau: Chất CH4 (g) CO2 (g) H2O (l) (kJ/mol) - 74,87 − 393,5 -285,84
b/ Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng trên?
Câu 4 (1điểm): Ngày nay, dùng cồn trong nấu ăn trở nên rất phổ biến trong các nhà hàng, quán
ăn, buổi tổ chức tiệc, liên hoan, hộ gia đình. Một mẫu cồn X chứa thành phần chính là ethanol
(C2H5OH) có lẫn methanol (CH3OH).
Cho các phương trình nhiệt hóa học sau: C H 0
2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(l) r 298 =−1370kJ CH H 0
3OH(l) +3/2O2(g) → CO2(g) + 2H2O(1) r 298 =−716kJ
Biết thành phần 1 viên cồn 70 gam chứa tỉ lệ khối lượng của C2H5OH : CH3OH là 11:1 và chứa
4% tạp chất không cháy. Giả sử để nấu chín một nồi lẩu cần tiêu thụ 3200kJ, hỏi cần bao nhiêu
viên cồn để nấu chín 1 nồi lẩu đó (với hiệu suất hấp thụ nhiệt khoảng 80%)?
------ HẾT ------ ĐÁP ÁN I. TRẮC NGHIỆM 1 B 4 C 7 A 10 D 13 C 2 A 5 A 8 C 11 A 14 B 3 B 6 C 9 A 12 C 15 B II. TỰ LUẬN Mã đề 301+303 Điểm Câu 1: H-O-H…NH3 0,5đ 1đ H2N-H…OH2 0,5đ Câu 2:
B1: Xác định đúng số oxi hóa và chỉ ra chất khử, chất oxi hóa 0,25 đ a/ 1đ
B2: Viết quá trình oxi hóa và quá trình khử 0,25đ
B3: Đặt hệ số cân bằng e. 0,25đ
B4: Cân bằng 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4 H2O 0,25đ b/ 0,5đ số mol Mg = 0,3 0,25đ
nNO = 0,2 → VNO = 0,2.24,79=4,958(L) 0,25đ Câu 3:
Thay số vào công thức tìm được ∆𝑟𝐻0 1 đ 298 = -890,31 kJ a/ 1 đ
thiếu đơn vị trừ 0,25đ b/ 0,5đ 0,5 đ Câu 4: C2H5OH : x mol, CH3OH : y mol 1đ
Lập hệ 46x-352y=0, 46x+32y=70.96% Suy ra x=1,339, y=0,175 0,25đ
Nhiệt tỏa ra khi đốt 70g cồn : 1959,73kJ 0,25đ
Nhiệt hấp thụ được : 1567,784kJ 0,25đ
Số viên cồn cần dùng là 2 viên 0,25đ




