



Preview text:
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
ĐỀ CƯƠNG GIỮA HỌC KÌ I – MÔN KHOA HỌC TỰ NHIÊN 8 A. NỘI DUNG ÔN TẬP
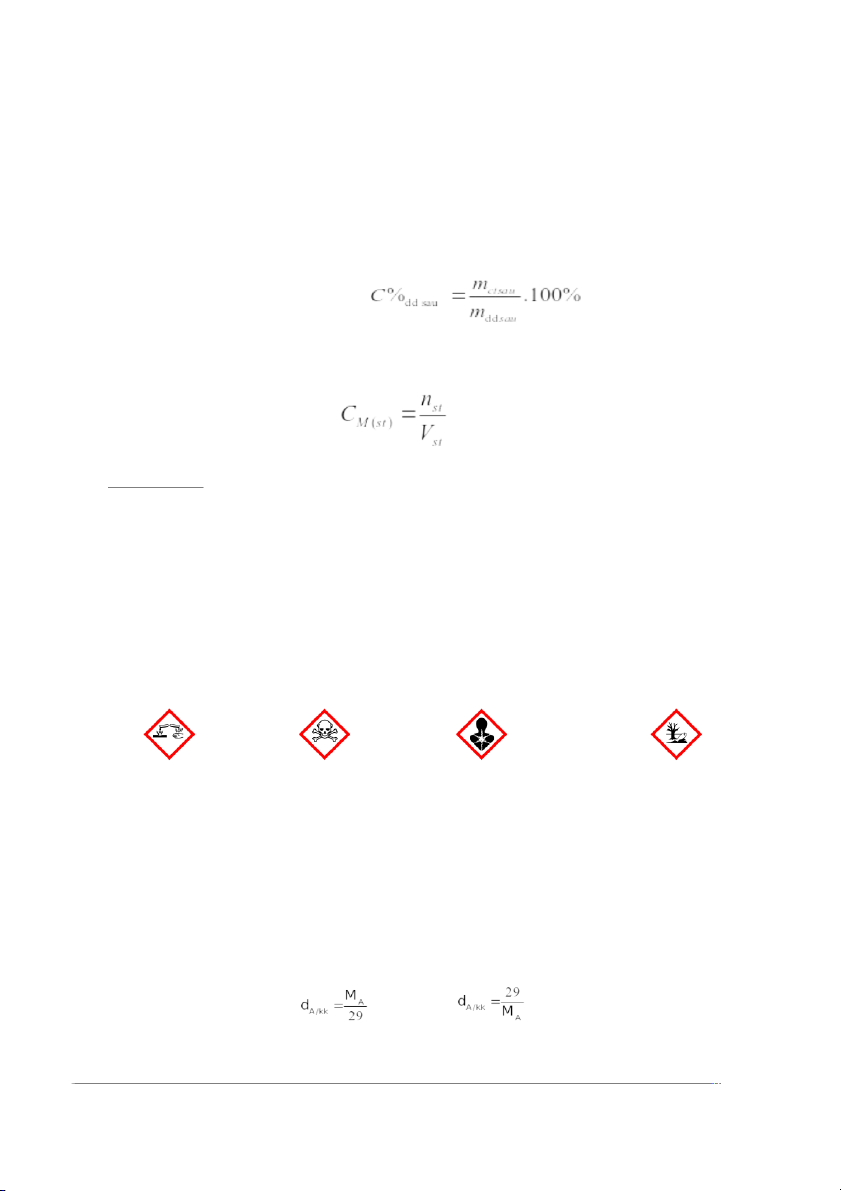
1.Các công thức tính mol và tỉ khối chất khí. 1. 2. 3. 4. 5. V = n.24,79 (l) 6.
7. A = n.6,022.10 ( phân tử, nguyên tử) 23 8. 9. (g) 10. (g) 11. 12. MA = 29. dA/kk (g) Trong đó:
- Số mol ( lượng chất) : n ( mol)
- Khối lượng chất: m (g)
-Khối lượng mol: M (g/mol)
-Thể tích mol của chất khí: V(l)
- Số phân tử, nguyên tử: A ( phân tử, nguyên tử) - Số Avogadro: N 23
A= 6,022.10 ( nguyên tử, phân tử)
- Khối lượng mol khí A, B, không khí: MA, MB, M (g) kk
- dA/B: Tỉ khối của khí A so với khí B
- dA/kk: Tỉ khối của khí A so với không khí.
2. Công thức tính độ tan: ; ; Trong đó: - Độ tan: S (g)
- mct: Khối lượng chất tan (g) = khối lượng chất = m
- m H2O: Khối lượng nước (g)
- mddbh: Khối lượng dung dịch bão hòa (g)
3. Công thức tính nồng độ % của dung dịch.
Trong đó: C%: Nồng độ % của dd (%)
mct: Khối lượng chất tan(g)- khối lượng chất :m
m : Khối lượng dung dịch(g): dd mdd= mct + mH2O
*Chú ý: Công thức tính nồng độ % của dung dịch bão hòa Trong đó : S là độ tan
4. Công thức tính nồng độ mol của dung dịch Trong đó:
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
- CM: Nồng độ mol của dd:(mol/l Hoặc M) - n: Số mol (mol)
- V: Thể tích dung dịch (lít)
*Khi trộn các dung dịch không xảy ra phản ứng. Tính lại nồng độ dung dịch sau khi trộn ta có
5. Theo nồng độ %:
+ Khối lượng dung dịch sau khi trộn: mdd sau trộn= m + m dd1 +….. dd2
+ Khối lượng chất tan sau trộn
mct sau trộn= mct1 + mct2 +…= C%1.mdd1 + C%2.mdd2 +…
+ Nồng độ % dung dịch sau trộn: - Theo nồng độ mol:
+ Số mol sau khi trộn: nst= n1 + n2 = CM1.V1 + CM2.V2 (mol)
+ Thể tích sau khi trộn: Vst = V + V 1 (lit) 2
+ Nồng độ mol của dd sau khi trộn:
B. MỘT SỐ DẠNG BÀI TẬP 1. Trắc nghiệm
Câu 1. Dụng cụ nào sau đây dùng để đo lường thể tích của dung dịch? A. Ống đong. B. Ống nghiệm.
C. Lọ đựng hóa chất D. Chén nung.
Câu 2. Những việc nào sau đây không được làm khi sử dụng hóa chất?
A. Sau khi lấy hóa chất xong cần phải đậy kín các lọ đựng hóa chất.
B. Cần thông báo ngay cho giáo viên nếu gặp sự cố cháy, nổ, đổ hóa chất, vỡ dụng cụ thí nghiệm, …
C. Sử dụng tay tiếp xúc trực tiếp với hóa chất.
D. Đọc kĩ nhãn mác, không sử dụng hóa chất nếu không có nhãn mác, hoặc nhãn mác bị mờ.
Câu 3. Thao tác lấy hóa chất nào sau đây chưa chính xác?
A. Dùng thìa thủy tinh để lấy hóa chất dạng lỏng.
B. Dùng thìa xúc hóa chất để lấy hóa chất rắn dạng bột.
C. Dùng kẹp gắp hóa chất để lấy hóa chất rắn dạng miếng.
D. Dùng ống hút nhỏ giọt để lấy hóa chất dạng lỏng.
Câu 4. Kí hiệu cảnh báo nào sau đây dùng để chỉ các chất ăn mòn? A. B. C. D.
Câu 5. Quá trình nào sau đây là biến đổi hoá học?
A. Đốt cháy cồn trong đĩa.
B. Hơ nóng chiếc thìa inox.
C. Hoà tan muối ăn vào nước.
D. Nước hoa trong lọ mở nắp bị bay hơi.
Câu 6. Quá trình nào sau đây chỉ xảy ra biến đổi vật lí?
A. Đốt cháy củi trong bếp.
B. Thắp sáng bóng đèn dây tóc.
C. Đốt sợi dây đổng trên lửa đèn cồn.
D. Để sợi dây thép ngoài không khí ẩm bị gỉ.
Câu 7. Phản ứng tỏa nhiệt là phản ứng trong đó:
A. hỗn hợp phản ứng truyền nhiệt cho môi trường. B. chất phản ứng truyền nhiệt cho sản phẩm.
C. chất phản ứng thu nhiệt từ môi trường
D. các chất sản phẩm thu nhiệt từ môi trường.
Câu 8: Trước và sau một phản ứng hóa học, yếu tố nào sau đây thay đổi?
A. khối lượng các nguyên tử.
B. số lượng các nguyên tử.
C. liên kết giữa các nguyên tử.
D. thành phần các nguyên tố.
Câu 9. Công thức đúng về tỉ khối của chất khí A đối với không khí là A. dA/kk = MA .29 B. C.
D. Cả A, B, C đều sai.
Câu 10. Số Avogadro có giá trị và kí hiệu là A. 6,022.10 , A 23 -23 23 24 N B. 6,022.10 , AN
C. 6,022.10 , NA D. 6,022.10 , NA
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
Câu 11. Ở điều kiện chuẩn nhiệt độ ( 25OC và 1bar) thì 1 mol của bất kì chất khi nào đều chiếm 1 thể tích là: A. 2,479 lít B. 24,79 lít
C. 22,79 lít D. 22,4 lít
Câu 12. Khí NO nặng hơn hay nhẹ hơn không khí bao nhiêu lần? 2
A. Nặng hơn không khí 1,6 lần.
B. Nhẹ hơn không khí 2,1 lần.
C. Nặng hơn không khí 3 lần.
D. Nhẹ hơn không khí 4,20 lần.
Câu 13. Độ tan là gì?
A. Là số gam chất đó tan trong 100 gam nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định
B. Là số gam chất đó tan trong 1 lít nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định
C. Là số gam chất đó không tan trong 100 gam nước để tạo thành dung dịch bão hòa
D. Là số gam chất đó tan trong 100 gam nước để tạo thành dung dịch chưa bão hòa ở nhiệt độ xác định
Câu 14. Dung dịch là hỗn hợp _____________ của chất tan và dung môi A. huyền phù đồng nhất B. C. chưa đồng nhất D. chưa tan
Câu 15. Nồng độ mol là gì?
A. Là số mol chất đó tan có trong trong 1 lít dung dịch.
B. Là số gam chất đó tan trong 1 lít nước.
C. Là số mol chất đó không tan trong 100 gam dung dịch.
D. Là số gam chất đó tan trong 100 gam nước.
Câu 16. Nồng độ phần trăm là gì?
A. Là số mol chất đó tan có trong trong 1 lít dung dịch.
B. Là số gam chất đó tan trong 1 lít nước.
C. Là số mol chất đó không tan trong 100 gam dung dịch.
D. Là số gam chất đó tan trong 100 gam nước.
Câu 17. Khi tăng nhiệt độ thì độ tan của chất rắn trong nước _______ A. biến đổi ít B. tăng C. giảm D. không đổi
Câu 18. Công thức tính nồng độ phần trăm của dung dịch là: A. B. C. D.
Câu 19. Công thức tính nồng độ mol của dung dịch là: A. B. C. D.
Câu 20. Cho phản ứng: A + B → C + D. Công thức về khối lượng của các chất là: A. mA = mB +mC + mD. B. mA + mB = mC + mD. C. mB = mA + mC + mD. D. mD = mA + mB + mC.
Câu 21. Khối lượng trước và sau một phản ứng hóa học được bảo toàn vì:
A. số lượng các chất không thay đổi.
B. số lượng nguyên tử không thay đổi.
C. liên kết giữa các nguyên tử không đổi.
D. không có tạo thành chất mới.
Câu 22. Đốt cháy hoàn toàn m gam hợp chất (A) cần 6,4 gam khí oxi thu được 4,4 gam khí CO và 3,6 gam 2
hơi nước. Giá trị của m là: A. 1,5. B. 1,6. C. 1,7. D. 1,8.
Câu 23. Đốt cháy một mẩu Aluminium trong khí Oxygen tạo thành Aluminium oxide (Al2O ). Phương 3 trình
hóa học biểu diễn phản ứng trên là: A. 2Al + 3O2 Al2O3 4Al + 3O B. 2 2Al2O 3 C. 4Al + 6O 2Al2O3 D. 2Al 2+ 3O2 2Al2O3
Câu 24. Đốt photphorin trong khí Oxygen thu được Điphotphorin pentaoxide (P2O ). 5 Phương trình hóa học
biểu diễn đúng quá trình trên là: A. B. C. D.
Câu 25. Đốt cháy khí amoniac (NH )
3 trong khí oxi Oxygen, thu được khí Nitrogen (N2) và nước. Phương
trình hóa học biểu diễn đúng quá trình trên là: A. B. C. D.
Câu 26. Cho phản ứng hóa học sau: Fe + 2HCl → FeCl + H 2 2
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
Tỉ lệ số mol của Fe và H là 2 A. 1:1. B. 1:2. C. 2:1. D. 1:3. Câu 27. đúng: Chọn đáp án
Công thức tính hiệu suất phản ứng theo chất sản phẩm là A. . B. . C. . D.
Câu 28. Cho phương trình:
Số mol CaCO cần dùng để điều chế được 0,2 mol Ca. 3 A. 0,2 mol. B. 0,3 mol. C. 0,4 mol. D. 0,1 mol.
Câu 29. Cho phương trình sau:
Giả sử phản ứng hoàn toàn, từ 0,6 mol KClO sẽ 3
thu được bao nhiêu mol khí oxi? A. 0,9 mol. B. 0,45 mol. C. 0,2 mol. D. 0,4 mol.
Câu 30. Mg phản ứng với HCl theo phản ứng:
Sau phản ứng thu được 2,479 lít
(đktc) khí hiđro ở 25 C và 1 bar thì khối lượng của Mg đã tham gia phản ứng là 0 A. 2,4 gam. B. 12 gam. C. 2,3 gam. D. 7,2 gam.
Câu 31. Để đánh giá mức độ diễn ra nhanh hay chậm của phản ứng hóa học người ta dùng khái niệm nào sau đây?
A. Tốc độ phản ứng
B. Cân bằng hóa học
C. Phản ứng thuận nghịch
D. Phản ứng một chiều
D. Chất xúc tác là chất làm tăng tốc độ phản ứng, có khối lượng thay đổi trong quá trình phản ứng
Câu 32. Chất làm tăng tốc độ phản ứng hóa học nhưng vẫn không bị biến đổi về mặt hóa học được gọi là A. Chất xúc tác Chất tham gia B. C. Chất sản phẩm D. Chất trung gian
Câu 33. Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây? A. Xúc tác B. Nhiệt độ C. Áp suất D. Thời gian
Câu 34. Khi tăng nhiệt độ thì tốc độ của phản ứng sẽ A. biến đổi ít B. tăng C. giảm D. không đổi
Câu 35. Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được
nấu chín (cơm, ngô, khoai, sắn) để ủ rượu? A. Nhiệt độ Xúc tác B. C. Áp suất D. Nồng độ
Câu 36. Các quả pháo hoa khi được bắn lên sẽ bốc cháy nhanh và nổ ra thành những chùm ánh sáng đẹp
mắt. Vì sao khi sản xuất pháo hoa người ta thường sử dụng các nguyên liệu ở dạng bột?
A. Nguyên liệu ở dạng bột có khối lượng nhẹ hơn
B. Nguyên liệu ở dạng bột có diện tích tiếp xúc lớn hơn
C. Nguyên liệu dạng bột có giá thành rẻ hơn
D. Nguyên liệu dạng bột có chất xúc tác
Câu 37. Phân tử acid gồm có
A. một hay nhiều nguyên tử phi kim liên kết với gốc acid.
B. một hay nhiều nguyên tử hydrogen liên kết với gốc acid.
C. một hay nhiều nguyên tử kim loại liên kết với nhóm hiđroxit (OH).
D. một hay nhiều nguyên tử kim loại liên kết với một hay nhiều gốc acid.
Câu 38. Trong số những chất có công thức hoá học dưới đây, chất nào quỳ tím đổi từ màu tím sang màu đỏ? A. HNO3. B. NaOH. C. Ca(OH)2. D. NaCl.
Câu 39. Đâu không phải là tính chất của dung dịch sunfuric acid? A. không màu tan rất ít trong nước. B. C. không bay hơi
D. làm quỳ tím chuyển từ tím sang đỏ
Câu 40. Acid H2SO loãng tác dụng với Fe tạo thành sản phẩm 4 A. Fe (SO 2 4)3 và H2. B. FeSO4 và H .2 C. FeSO4 và SO2. D. Fe (SO 2 4)3 và SO . 2
Câu 41: Khi hoà tan hoàn toàn kẽm bằng dung dịch axit clohiđric thu được dung dịch muối kẽm và khí
hiđro. Khối lượng sản phẩm sau phản ứng thay đổi như thế nào so với khối lượng chất ban đầu? A. Không đổi. B. Tăng. C. Giảm.
D. Không xác định được
Câu 42: Phản ứng tỏa nhiệt là:
A. Phản ứng có nhiệt độ lớn hơn môi trường xung quanh
B. Phản ứng có nhiệt độ nhỏ hơn môi trường xung quanh
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
C. Phản ứng có nhiệt độ bằng môi trường xung quanh
D. Phản ứng không có sự thay đổi nhiệt độ
Câu 43: Phản ứng thu nhiệt là
A. Phản ứng có nhiệt độ lớn hơn môi trường xung quanh
B. Phản ứng có nhiệt độ nhỏ hơn môi trường xung quanh
C. Phản ứng có nhiệt độ bằng môi trường xung quanh
D. Phản ứng không có sự thay đổi nhiệt độ
Câu 44: Trong phản ứng hóa học, liên kết giữa các phân tử như thế nào?
A. Không thay đổi B. Thay đổi
C. Có thể thay đổi hoặc không D. Đáp án khác
Câu 45: Dấu hiệu nào giúp ta có khẳng định có phản ứng hoá học xảy ra?
A. Có chất kết tủa (chất không tan). B. Có chất khí thoát ra (sủi bọt).
C. Có sự thay đổi màu sắc. D. Một trong số các dấu hiệu trên.
Câu 46: Những hiện tượng sau, hiện tượng nào là hiện tượng hoá học:
1. Về mùa hè thức ăn thường bị thiu
2. Đun đường, đường ngả màu nâu rồi đen đi
3. Các quả bóng bay lên trời rồi nổ tung
4. Cháy rừng gây ô nhiễm lớn cho môi trường
5. Nhiệt độ Trái đất nóng lên làm băng ở hai cực Trái đất tan dần:
Câu 47: Trong số quá trình và sự việc dưới đây, đâu là hiện tượng vật lí:
1. Hoà tan muối ăn vào nước ta được dung dịch muối ăn.
2. Có thể lặp lại thí nghiệm với chất vừa dùng để làm thí nghiệm trước đó
3. Cồn để trong lọ không kín bị bay hơi
4. Nước bị đóng băng hai cực Trái đất
5. Cho vôi sống CaO hoà tan vào nước
A.1, 2, 3, 4 B. 1, 2, 4 C. 2, 3, 4 D. 1, 4, 5
Câu 48: Nến được làm bằng parafin, khi đốt nến, xảy ra các quá trình sau: 1. Parafin nóng chảy
2. Parafin lỏng chuyển thành hơi
3. Hơi parafin cháy biến đổi thành khí CO2 và hơi nước
Quá trình nào có sự biến đổi hoá học? A. 1 B. 2 C. 3 D. Cả 1, 2, 3
Câu 49: Dung dịch bão hòa là gì?
A. Là dung dịch hòa tan chất tan B. Là dung dịch không thể hòa tan thêm chất tan
C. Là dung dịch giữa dung môi và chất tan D. Không có đáp án đúng
Câu 50: Khi hòa tan dầu ăn trong cốc xăng thì xăng đóng vai trò gì
A. Chất tan B. Dung môi C. Chất bão hòa D. Chất chưa bão hòa
Câu 51: Khi hòa tan 100 ml rượu etylic vào 50 ml nước thì
A. chất tan là rượu etylic, dung môi là nước.
B. chất tan là nước, dung môi là rượu etylic.
C. nước hoặc rượu etylic có thể là chất tan hoặc là dung môi.
D. cả hai chất nước và rượu etylic vừa là chất tan, vừa là dung môi.
Câu 52: Hai chất không thể hòa tan với nhau tạo thành dung dịch là?
A. Nước và đường B. Dầu ăn và xăng
C. Rượu và nước D. Dầu ăn và cát
Câu 53: Dung dịch là gì?
A. Hỗn hợp đồng nhất của chất tan và nước B. Hỗn hợp đồng nhất của chất tan và dung môi
C. Hỗn hợp chất tan và nước D. Hỗn hợp chất tan và dung môi
Câu 54: Trộn lẫn 2 lít dung dịch urea 0,02 M (dung dịch A) với 3 lít dung dịch urea 0,1 M (dung dịch B),
thu được 5 lít dung dịch C. Tính nồng độ mol của dung dịch C
A. 0,43 M B. 0,34 M C. 0.68 M D. 0,86 M
Câu 55: Ở nhiệt độ 25 oC, khi cho 12 gam muối X vào 20 gam nước, khuấy kĩ thì còn lại 5 gam muối không
tan. Tính độ tan của muối X. A. 35 B. 36 C. 37 D. 38
Câu 56: Ở 20 C độ tan của muối ăn( NaCl) là 36 gam. Khối lượng NaCl cần dùng để hòa tan vào 80 gam 0
nước tạo thành dung dịch bão hòa ở nhiệt độ này là
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI
A.36 gam. B. 2,22 gam. C. 45 gam. D.28,8 gam.
Câu 57: Hòa tan 40 gam NaCl vào 160 gam nước. Dung dịch tạo thành có nồng độ % là A. 40%. B. 25% C. 20%. D.4%
Câu 58: Số gam CuSO có trong 200 ml dung dịch CuSO 4 1,5M là: 4
A. 300 gam. B. 48 gam. C. 133 gam. D. 0,3 gam.
Câu 59:Trường hợp nào sau đây không tạo thành dung dịch?
A. Cho đường vào nước. B. Cho dầu ăn vào nước.C. Cho muối ăn vào nước. D. Cho rượu vào nước.
Câu 60: Độ tan của đường ở 20 C là 200 gam có nghĩa là : ở 20 0 C 0
A. 100 gam nước có thể hòa tan 200 gam đường.
B. 100 gam nước có thể hòa tan 200 gam dung dịch đường.
C. 200 gam nước có thể hòa tan 100 gam đường tạo thành dung dịch bão hòa.
D. 100 gam nước có thể hòa tan 200 gam đường tạo thành dung dịch bão hòa. 2. Tự luận
Bài 1: Thả quả trứng vào dung dịch hydrochloric acid thấy sủi bọt ở vỏ trứng. Biết rằng calcium
carbonate chất có trong vỏ trứng đã tác dụng với hydrochloric acid sinh ra Calcium chloride, khí carbon dioxide và nước.
a. Chỉ ra dấu hiệu có phản ứng hóa học xảy ra
b. Viết phương trình dạng chữ của phản ứng Bài 2: 1. Tính a. Số mol của 19,6g H2SO4
b. Khối lượng của 0,5 mol CaCO3
c. Khối lượng của 2,479 lít khí SO ở 250 3 c và 1bar
d. Thể tích ở đkc của 13,2g CO2
2. Cho hỗn hợp X gồm: 4,4g CO ; 0,25 mol SO 2 ; 2,479 lít Cl 3 2 ở đkc.
a. Tính số mol của hỗn hợp X
b. Tính khối lượng của hỗn hợp X
c. Tính thể tích ở đkc của X
d. Tính số phân tử có trong hh X
e. Trong X có bao nhiêu g nguyên tố O
f. Tính tỉ khối của hỗn hợp X so với khí H2 Bài 3:
a. Hòa tan 9 g NaCl vào 91 g nước. Tính nồng độ phần trăm của dung dịch thu được?
b. Hòa tan 117 g NaCl vào nước để được 1,25 lít dung dịch. Tính nồng độ mol của dung dịch thu được?
c. Tính khối lượng HCl có trong 200g dung dịch HCl 7.3%
d. Tính thể tích của dung dịch HCl có trong 7,3g HCl 0,5M
e. Ở 250c hòa tan 15g KNO vào 25g nước thu được dung dịch KNO 3
3 bão hòa. Tính độ tan của KNO3 ở 250C.
Bài 4: Cho 6,5 g Zinc (Zn) phản ứng với 7,3g Hydrochloric acid (HCl) tạo thành 13,6 g muối Zinc
chlorid(ZnCl2) và khí Hydrogen (H ). 2
a) Viết công thức về khối lượng của các chất trong phản ứng.
b) Hãy tính khối lượng khí Hydrogen bay lên.
Bài 5: Hãy lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng. a) Na + O2 Na O 2 e) C2H6 + O2 CO2 + H2O b) P + O2 P2O5 h) CH4 + O2 CO + H 2 O 2 c) Fe + Cl2 FeCl3 i) Na2CO3 + Ca(OH) 2 CaCO3 + NaOH d) Mg+ O 2 MgO k) FeCl3 + AgNO 3 Fe(NO3)3 + AgCl l) KClO3 → KCl + O2 m) Fe + O → Fe 2 3O4
DỰ ÁN KHOA HỌC TỰ NHIÊN 8 - THẦY DƯƠNG THÀNH TÍNH TRIỂN KHAI n) Al + O2 →Al2O3 o) Fe(OH) → Fe 3 2O + H 3 O 2 p) Zn + HCl →ZnCl + H 2 2
Bài 6: Đốt cháy hết 0,54 gam Al trong không khí thu được Aluminium oxide theo sơ đồ phản ứng: Al + O2 -- Al2O3
a) Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử và số phân tử của các chất trong phản ứng b) Tính số mol Al?
c) Tính số mol O2 và số mol Al2O3
d) Tính thể tích khí Oxygen tham gia phản ứng ở điều kiện 250C, 1bar?
e) Tính khối lượng Aluminium oxide tạo ra nếu hiệu suất phản ứng H = 100%?
f) Tính khối lượng Aluminium oxide tạo ra nếu hiệu suất phản ứng H = 90%?
Bài 7: Hòa tan 13g Mg vào 400ml dung dịch Hydrocloric acid (HCl) thu được MgCl và khí 2 huydrogen.
a. Viết PTHH .Tính thể tích khí Hydrogen thu được ở đkc
b. Tính nồng độ mol của dung dịch HCl đã dùng
Bài 8: Hòa tan 5,6 g Fe vào 200g dung dịch HCl thu được FeCl và khí Hydrogen. 2
a. Viết PTHH .Tính thể tích khí H thu được ở đkc 2
b. Tính nồng độ % của dung HCl đã dùng
c. Tính nồng độ % của dung dịch sau phản ứng.