













Preview text:
TRƯỜNG ĐẠI HỌC YERSIN ĐÀ LẠT
KHOA CÔNG NGHỆ ỨNG DỤNG
---------o0o---------- ĐỀ CƯƠNG
KHÓA LUẬN TỐT NGHIỆP
ĐÁNH GIÁ ẢNH HƯỞNG CỦA KHÁNG
SINH ĐẾN QUẦN XÃ VI SINH VẬT
TRÊN VI NHỰA TRONG MÔI TRƯỜNG
NƯỚC TẠI KHU VỰC HÀ NỘI
CBHD : TS. Ngô Thị Thúy Hường
SVTH : Nguyễn Văn Tự MSSV : 12203013
LỚP : Công nghệ sinh học K 19 Tháng 12 - 2024
THÔNG TIN CHUNG CỦA ĐỀ TÀI 1. TÊN ĐỀ TÀI
Đánh giá ảnh hưởng của kháng sinh Ciprofloxacin đén quần xã vi sinh vật trên vi
nhựa trong môi trường nước tại khu vực Hà Nội
2. THỜI GIAN THỰC HIỆN
Từ ngày 05/11/2024 đến ngày 22/03/2024 3. ĐẶT VẤN ĐỀ
3.1. Tính cấp thiết của đề tài
Vi nhựa (MPs – Microplastics) là các mảnh, sợi, hạt nhựa tổng hợp với kích thước
dưới 5mm xuất phát từ các sản phẩm từ nhựa và rác thải nhựa qua nhiều quá trình phân
rã khác nhau khiến nhựa phân mảnh thành các kích thước nhỏ hơn. Do bản chất không
phân hủy sinh học, các mảnh vi nhựa có thể tồn tại và tích tụ ở môi trường trong thời
gian dài (nước, đất, trầm tích,..), từ đó len lõi vào hệ sinh thái, gây ảnh hưởng xấu đến
sức khoẻ con người và động vật qua nhiều con đường khác nhau [20]. Các nguồn phát
thải vi nhựa ra sông bao gồm nước thải công nghiệp, hoạt động của con người, nhà máy
xử lý nước thải, hoạt động nông nghiệp,...Việc giặt quần áo bằng sợi tổng hợp trong đời
sống hàng ngày cũng là nguồn phát sinh ra hạt vi nhựa, vải lông cừu, quần áo sợi tổng
hợp từ acrylic, nylon và các chất liệu khác cũng thải ra lượng vi nhựa khác nhau khi giặt,
những hạt vi nhựa này sẽ đi vào sông cùng với nước thải sinh hoạt. Nước thải từ khu
công nghiệp và khu dân cư là nguồn ô nhiễm vi nhựa chính qua việc xả trực tiếp ra sông,
trong khi nước thải từ các thành phố và khu công nghiệp lớn thường tập trung tại các
nhà máy xử lý nước thải, mặc dù quy trình xử lý nước thải hiện tại có tác dụng xử lý vi
nhựa nhất định nhưng lượng MPs xâm nhập vào sông vẫn ở mức cao do lượng nước thải
xả ra rất lớn theo như báo cáo của Haodi Wu và cộng sự (2023) [20].
Việc lạm dụng thuốc kháng sinh trong mọi lĩnh vực hiện nay đã gây ra tình trạng
kháng thuốc ở nhiều loài vi khuẩn gây bệnh, hay còn gọi là kháng kháng sinh (ARB –
antibiotic resistant bacteria, ARGs - antibiotic resistant genes). Tình trạng kháng kháng
sinh hiện nay được biết đến với mối nguy hại đe dọa toàn cầu bởi sự đột biến của các
loài vi khuẩn với khả năng đa kháng thuốc khiến cho việc điều trị ngày càng phức tạp
[6]. Việt Nam là một trong những quốc gia có tình trạng sử dụng thuốc kháng sinh tràn
lan trong nhiều lĩnh vực bao gồm y tế, thủy sản, nông nghiệp, thú y,… được báo cáo về
dư lượng kháng sinh tồn đọng ngoài môi trường vượt mức báo động [2, 18]. Việc tồn dư
kháng sinh trong môi trường nước là nguyên nhân dẫn đến sự xuất hiện tràn lan của vi
khuẩn kháng kháng sinh. Nhiều nghiên cứu cũng đã đánh giá sự tồn dư kháng sinh trong
môi trường nước ô nhiễm ở Việt Nam với sự xuất hiện của nhiều loại kháng sinh phổ
biến và kể cả là những loại kháng sinh bị cấm sử dụng cũng được phát hiện từ nguồn
nuôi trồng thủy sản. Phổ biến trong đó là các kháng sinh thuộc nhóm fluoroquinolones
và sulfonamid có nồng độ rất cao (ppm) từ nuôi trồng thủy sản và bệnh viện. Cụ thể là
loại kháng sinh Ciprofloxacin trong nhóm fluoroquinolones được chứng minh về sự tồn
dư rộng rãi trong môi trường không chỉ ở Việt Nam mà trong các báo của các nước Đông
Nam Á đều nhắc đến loại kháng sinh này [2, 18]. Sự lắng đọng và tồn tại lâu dài của
kháng sinh trong môi trường cho phép tác động và tạo ra yếu tố stress môi trường sống
với các cộng đồng vi sinh vật thúc đẩy chúng thích nghi và hình thành kháng kháng sinh
qua nhiều con đường khách quan khác nhau [6].
Bên cạnh đó, nước thải bệnh viện là nơi tập trung của hầu hết các loại kháng sinh
sử dụng trong điều trị, là nguồn ô nhiễm đáng kể do thành phần phức tạp chứa một số
thành phần độc hại bao gồm các vi khuẩn gây bệnh, kim loại nặng, nguyên tố phóng xạ
cũng như dư lượng hóa chất và dược phẩm. Nước thải từ một số bệnh viện, các công ty
sản xuất dược phẩm và cơ sở chăm sóc sức khỏe tại các thành phố lớn ở Việt Nam như
Hà Nội và Thành phố Hồ Chí Minh có nồng độ dư lượng kháng sinh rất cao theo như
báo cáo từ Hoang Quoc Anh và các cộng sự (2021) [2]. Tại đây cũng là nơi tích tụ các
mầm bệnh từ các vi khuẩn gây hại nghiêm trọng đến sức khoẻ con người, chẳng hạn như
các vi khuẩn Gram âm bao gồm Escherichia coli, Aeromonas sp., hay Pseudomonas sp.
đều là những loài vi khuẩn phổ biến gây ra các bệnh về đường tiêu hóa, đường hô hấp
và thậm chí là những ca nhiễm trùng nặng dẫn đến tử vong. Theo một báo cáo tổng hợp
từ Christine C Nguyen và các cộng sự vào năm 2019 cho thấy rằng vi khuẩn E. coli có
khả năng kháng 15 loại kháng sinh, 9 kim loại nặng và P. aeruginosa với khả năng kháng
đến 41 loại kháng sinh và 8 kim loại nặng khác nhau [14]. Tại Việt Nam cũng đã có
những bằng chứng đầu tiên về vi khuẩn kháng kháng sinh beta-lactamase phổ rộng
(ESBL) liên quan đến vi nhựa ở các khu vực Đồng bằng sông Hồng từ nghiên cứu của
Vu Thi Thu Hien và các cộng sự (2024), trong đó có sự xuất hiện của vi khuẩn
Aeromonas sp. và Escherichia coli với xấp xỉ 11% tổng số vi khuẩn phân lập được phát
hiện mang gene kháng β-lactamase [10]. Các con số từ những nghiên cứu trên cho thấy
khả năng đa kháng thuốc của những chủng vi sinh vật này là rất nghiêm trọng, từ đó
khiến việc điều trị bằng thuốc kháng sinh đã trở nên vô nghĩa cũng như nguy cơ tử vong
ở người nhiễm trùng cũng tăng cao.
Tác động độc hại của vi nhựa, kháng sinh trong môi trường nước đang nổi lên
như một vấn đề môi trường nghiêm trọng hiện nay. Ngoài ra, màng sinh học được hình
thành bởi các loài vi sinh vật trên bề mặt của MPs có thể làm tăng độc tính hơn nữa cũng
như hình thành nơi tương tác của cộng đồng vi sinh vật và phát triển ARGs, nhưng cơ
chế hình thành màng sinh học trên vi nhựa vẫn chưa được hiểu đầy đủ do tính phức tạp
của các yếu tố khác nhau. Vậy nên, nghiên cứu hiện tại nhằm mục đích đánh giá ảnh
hưởng của kháng sinh Ciprofloxacin ở các nồng độ khác nhau đến hệ vi sinh vật cùng
sự hình thành màng sinh học trên bề mặt vi nhựa Polyethylene terephthalate (PET) cũng
như sự xuất hiện gene kháng kháng sinh theo thời gian. Việc nghiên cứu về mối liên hệ
này là rất cần thiết nhằm có cái nhìn sâu hơn về ảnh hưởng của sự tồn dư kháng sinh
trong nước đến sự thúc đẩy hệ vi sinh vật mang gene kháng kháng sinh.
3.2.1. Các nghiên cứu trong và ngoài nước về tác động của kháng sinh đến quần xã
vi sinh vật trên vi nhựa trong môi trường nước
Việt Nam là một trong những quốc gia có tình trạng sử dụng thuốc kháng sinh
tràn lan trong nhiều lĩnh vực bao gồm y tế, thủy sản, nông nghiệp, thú y,… được báo cáo
về dư lượng kháng sinh tồn đọng ngoài môi trường vượt mức báo động [2, 18]. Hiện nay
đã có một số nghiên cứu trong nước đánh giá về tình trạng ô nhiễm vi nhựa và dư lượng
kháng sinh trong các vùng nước sông ở các thành phố lớn. Nghiên cứu của Thùy Dương
và các cộng sự (2023) đã xác nhận sự xuất hiện và phân bố của MP trong trầm tích ven
sông được thu thập tại 12 địa điểm đại diện cho các con sông có dân cư và đô thị hóa
khác nhau (sông Tô Lịch, Nhuệ và Đáy) nằm ở Đồng bằng sông Hồng trong mùa khô
và mùa mưa [TLTK]. Với nồng độ MPs được phát hiện là cao hơn 60% nồng độ MPs
được báo cáo trong trầm tích ven sông ở châu Á, hình dạng sợi chiếm ưu thế và MPs
được làm chủ yếu bằng polypropylen (PP) và polyetylen (PE). Hơn nữa kết quả nghiên
cứu của tác giả cũng cho thấy mức độ ô nhiễm vi nhựa cùng rác thải hữu cơ ở các khu
vực thành thị cư dân đông đúc cao hơn nhiều so với vùng nước ven khu vực ít dân cư. [7].
Thực trạng kháng kháng sinh tại các sông ở Hà Nội và các khu vực xung quanh
đã được chỉ ra trong nhiều báo cáo. Cụ thể, nghiên cứu của Thái và các cộng sự (2018)
đã đánh giá sự tồn dư kháng sinh ở các mẫu nước được thu thập xung quanh các nhà
máy sản xuất dược phẩm, bệnh viện và trang trại nuôi trồng thủy sản quanh Hà Nội trong
năm 2016 và 2017 với 15 loại kháng sinh thuộc bốn nhóm chính (β-lactam, quinolone,
macrolide, sulfonamid) đã được phát hiện trong các mẫu ở các nồng độ khác nhau [18].
Các xét nghiệm kháng thuốc kháng sinh của tác giả cũng cho thấy tình trạng kháng thuốc
phổ biến đối với các loại kháng sinh nhóm quinolone và sulfonamid trong các mẫu được
thu thập. Đáng chú ý, kháng sinh ciprofloxacin thuộc nhóm quinolone được phát hiện ở
nồng độ rất cao lên đến 41 μg/L [18]. Hơn nữa, các nghiên cứu đánh giá ở Việt Nam về
sự tương tác giữa vi nhựa, kháng sinh đến cộng đồng vi sinh vật cùng sự hình thành gene
kháng kháng sinh trong môi trường nước vẫn còn hạn chế.
Vấn đề ô nhiễm nguồn nước cùng tình trạng kháng kháng sinh đang là mối đe dọa
nghiêm trọng trên thế giới đã và đang được nghiên cứu kĩ lưỡng trong suốt hơn 2 thập
kỷ qua. Ayush và các cộng sự (2022) đã nghiên cứu xác định các yếu tố có ảnh hưởng
quan trọng đến sự hình thành màng sinh học trên bề mặt vi nhựa và cho thấy sự hình
thành màng sinh học của vi khuẩn Pseudomonas aeruginosa trên bốn loại vi nhựa bao
gồm polyetylen, polystyrene, polypropylen và polytetrafluoroetylen với mật độ rất dày
so với môi trường nước khi không chứa vi nhựa [3]. Từ việc tạo thành màng sinh học
bám trên các vi nhựa đóng vai trò như một lớp bảo vệ giúp vi khuẩn có thể chống chịu
với môi trường và thích nghi dần từ đó hình thành ARGs. Nghiên cứu của Jie Wang và
các cộng sự (2020) đã chứng minh điều đó qua việc phân tích các hạt vi nhựa lấy từ hai
con sông đô thị hóa ở Gia Hưng, Chiết Giang, Trung Quốc. Kết quả từ định lượng các
gen kháng kháng sinh (ARGs) thông qua qPCR cho thấy ARGs được làm giàu hơn ở
các mẫu vi nhựa so với mẫu nước và cấu trúc cộng đồng vi sinh vật cũng phong phú
hơn. Các phát hiện của tác giả cho thấy vi nhựa là nơi cư trú và tương tác của hệ vi sinh
vật, làm tăng khả năng làm tăng rủi ro đối với hệ sinh thái nước ngọt và sức khỏe con
người [19]. Những phát hiện lớn trong các công bố quốc tế là cơ sở cho đề tài nghiên
cứu hiện tại để tiến hành các thử nghiệm nhằm đánh giá ảnh hưởng của kháng sinh và
kim loại tồn dư đến hệ vi sinh vật trên bề mặt vi nhựa cùng sự xuất hiện các gene kháng
kháng sinh và kim loại nặng trong môi trường nước tại Việt Nam.
Mặc dù đã có nhiều nghiên cứu về vi nhựa và kháng sinh trong môi trường nước,
nhưng mối quan hệ giữa vi nhựa PET và sự phát triển của vi khuẩn kháng thuốc dưới
tác động của ciprofloxacin vẫn chưa được làm sáng tỏ. Đặc biệt, cơ chế hình thành màng
sinh học trên bề mặt vi nhựa – một yếu tố quan trọng có thể góp phần tích lũy gen kháng
kháng sinh (ARGs) – vẫn chưa được hiểu đầy đủ. Vi nhựa PET có thể đóng vai trò là
nơi cư trú thích hợp cho vi khuẩn, tuy nhiên, sự tương tác giữa chúng trong điều kiện có
mặt ciprofloxacin vẫn còn chưa rõ ràng. Do đó, nghiên cứu này nhằm đánh giá ảnh
hưởng của vi nhựa PET đối với quần xã vi khuẩn trong nước sông Kim Ngưu, Hà Nội,
khi tiếp xúc với ciprofloxacin trong điều kiện in-vitro, đồng thời xác định sự xuất hiện
và phát triển của các gen kháng kháng sinh ở các chủng vi khuẩn gây bệnh. Việc làm rõ
mối liên hệ này sẽ cung cấp cơ sở khoa học về tác động của kháng sinh tồn dư trong môi
trường nước đối với hệ vi sinh vật, từ đó đề xuất giải pháp kiểm soát ô nhiễm và hạn chế
sự lan rộng của vi khuẩn kháng thuốc.
4. MỤC TIÊU, NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
4.1. Mục tiêu nghiên cứu
- Đánh giá sự phát triển của màng sinh học trên bề mặt vi nhựa theo
thời giancủa kháng sinh Ciprofloxacin ở các nồng độ khác nhau.
- Đánh giá mật độ các vi sinh vật trên bề mặt vi nhựa và trong môi
trường nướccùng sự khác biệt theo thời gian của các mẫu chứa kháng sinh
Ciprofloxacin ở các nồng độ khác nhau.
- Định lượng sự thay đổi về mật độ gene của một số loài vi khuẩn
như: Pseudomonas sp., E. coli và Aeromonas sp. trên bề mặt vi nhựa và
nước theo thời gian ở các nồng độ kháng sinh khác nhau.
- Chứng minh vi nhựa là nơi tích luỹ các ARGs so với môi trường
nước trong điều kiện chứa các nồng độ kháng sinh khác nhau trong định
lượng mật độ gene kháng kháng sinh.
- Theo dõi sự thay đổi của thông số môi trường theo thời gian để
phân tích mốitương quan với các thay đổi ở vi sinh vật và ARGs.
4.2. Đối tượng – phạm vi nghiên cứu
- Đối tượng: Vi nhựa Polyethylene terephthalate (PET), kháng
sinhCiprofloxacin (CIP), Mẫu nước ô nhiễm tại khu vực gần bệnh viện Thanh Nhàn (Hà Nội).
- Phạm vi nghiên cứu: Nghiên cứu được thực hiện trong điều kiện
phòng thí nghiệm tại Phòng Thí nghiệm Hóa Môi trường và Độc học Sinh
Thái, trường Đại học Phenikaa, Hà Nội.
4.3. Phương pháp nghiên cứu
2.3.1. Chuẩn bị môi trường và hóa chất
2.3.1.1. Chuẩn bị môi trường nuôi cấy vi sinh vật
Môi trường khoáng tối thiểu (MSM) - KH2PO4: 2,27 g, Na2HPO4: 5,97 g, NH4Cl:
0,5 g, MgSO4 0,25 g, CaCl2: 0,0025 g, FeSO4: 0,01 g, MnSO4: 0,0005 g, ZnSO4: 0,001
g tương ứng với 500mL môi trường theo mô tả của Shakir Ali và các cộng sự (2023) [1].
Các khoáng được pha riêng dưới dạng dung dịch trước khi trộn vào nhau và được khử
trùng ở 121ºC trong 15 phút.
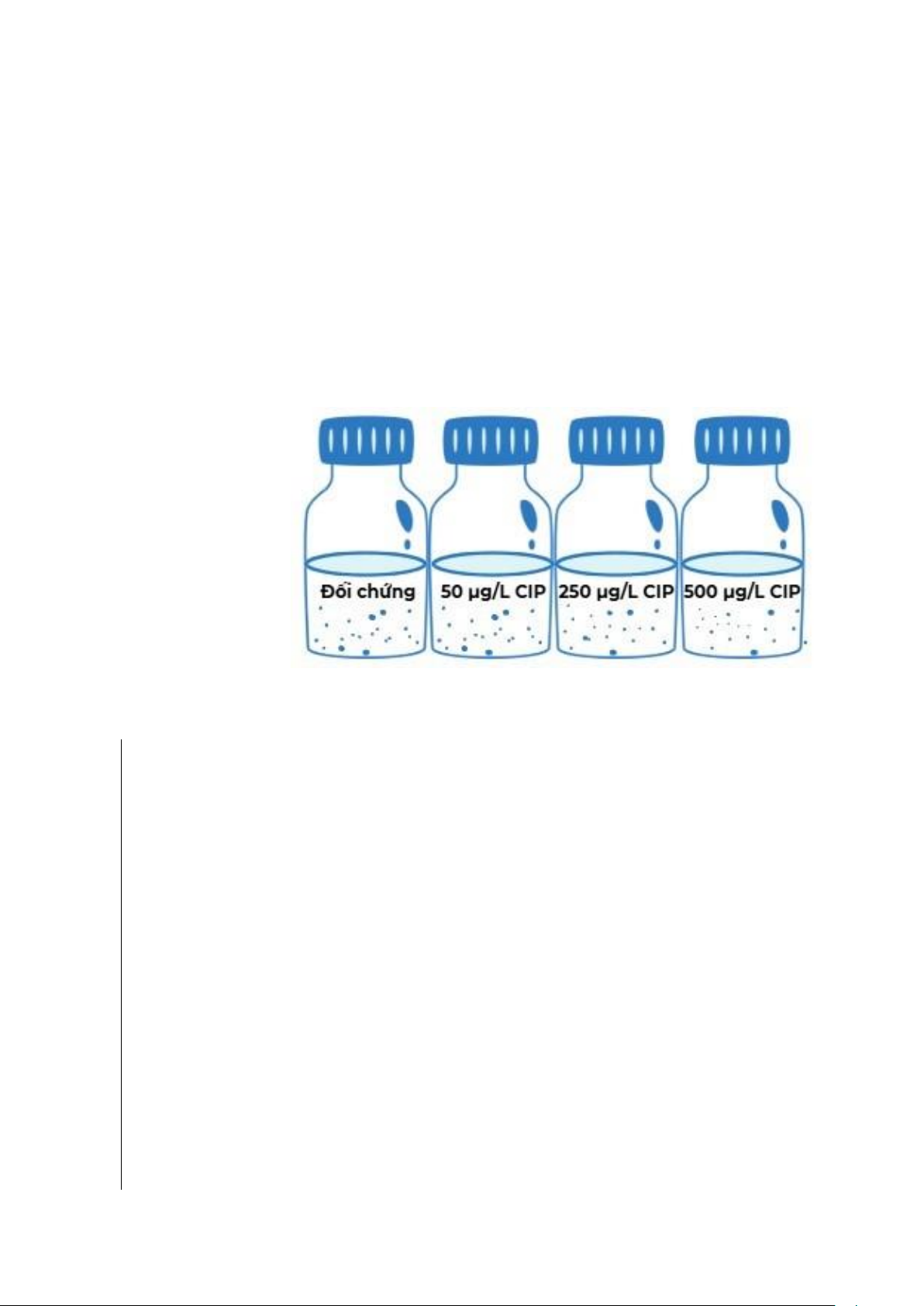
Ciprofloxacin được pha loãng 100 lần từ viên kháng sinh 500mg CIP (khối lượng
bao gồm tá dược là 710mg) bằng dung dịch NaCl 0,9% vô để tạo thành dung dịch gốc
với nồng độ 5000 µg/L để bảo quản ở -20ºC. Lọc dung dịch gốc qua filter 0,22 µm trước
khi pha loãng thành các nồng độ 50, 250 và 500 µg/L tương ứng với các nghiệm thức thử nghiệm (hình 4).
Môi trường thạch LB được chuẩn bị bao gồm Peptone 10 g/L, Cao nấm men 5g/L,
NaCl 5g/L, agar 15g/L. Đối với môi trường thạch ½ LB được chuẩn bị bằng cách giảm
1 nửa các thành phần trên ngoại trừ agar. Môi trường tổng hợp Macconkey agar được
chuẩn bị theo mô tả của hãng sản xuất với công thức 55,04 g/L.
Canh thang LB bổ sung glycerol 20% để bảo quản vi sinh vật được chuẩn bị bằng
cách cân 30g Glycerol vào cốc đọng 100ml và thêm nước cất đến vạch định mức. Bên
cạnh đó, dung dịch đệm PBS (pH 7) dùng để pha loãng mẫu, tách màng sinh học và ổn
định tế bào ở thế đẳng trương. Với thành phần của dung dịch PBS 3X được chuẩn bị
theo bảng 1. Dung dịch PBS 1X được chuẩn bị bằng cách pha loãng dung dịch PBS 3X
theo tỷ lệ 1:3 với nước cất.
Bảng 1. Thành phần dung dịch PBS 3X STT Tên thành phần
Khối lượng/thể tích cần dùng 1 Đệm phosphate 75ml 2
Sodium chloride (NaCl) – Merck 11,4g 3
Sodium hydroxide (NaOH); nồng độ 1M – Điều chỉnh đến pH Merck 7,2 – 7,4
Định mức nước nước cất đến 1L
*Chú ý: Dụng dịch đệm Phosphate được chuẩn bị trước bằng cách pha 200 mM
NaH1PO4 và 200 mM Na2HPO4 với tỉ lệ 2:8.
1 .3.1.2. Chuẩn bị hóa chất tách DNA
Bảng 2. Thành phần dung dịch đệm TER và XS Tên dung dịch cần Khối lượng/thể Tên thành phần pha tích cần dùng Nước cất tinh khiết 19,7ml 1M Tris-HCl 200µl Dung dịch đệm TER (20mL) 0,5M EDTA 40µl RNaseA 61,5µl 1M Tris-HCl 0,5 mL 0,5M EDTA 200 µL Dung dịch XS (5mL) 7,5M Ammonium acetate 0,5 mL Potassium ethyl xanthogenate 0,05 g
SDS 10% (thêm vào cuối cùng) 0,5 mL
2.3.1.3. Chuẩn bị hóa chất nhuộm Gram vi khuẩn
Các thành phần hóa chất cần chuẩn bị cho quy trình nhuộm Gram được mô tả ở Bảng 3:
Bảng 3. Thành phần pha các dung dịch nhuộm Gram vi khuẩn Tên dung dịch cần
Khối lượng/thể tích Tên thành phần pha cần dùng Crystal violet 4 g Crystal violet 1% Ethanol 95% 40 mL (200mL) Ammonium oxalate 1,6 g Nước cất 155 mL Iốt 1 g Lugol 1% (300mL) Kali iodua 2 g
Các hóa chất cần chuẩn bị cho quy trình tách DNA bao gồm: Dung dịch đệm
TER, được bảo quản ở -20ºC và dung dịch XS luôn được pha mới trước mỗi lần sử
dụng. Các thành phần được mô tả ở Bảng 2. Nước cất 297 mL Basic fucshin 1 g Fucshin kiềm Ethanol 95% Phenol 20 mL (200mL) 10 mL Nước cất 179 mL
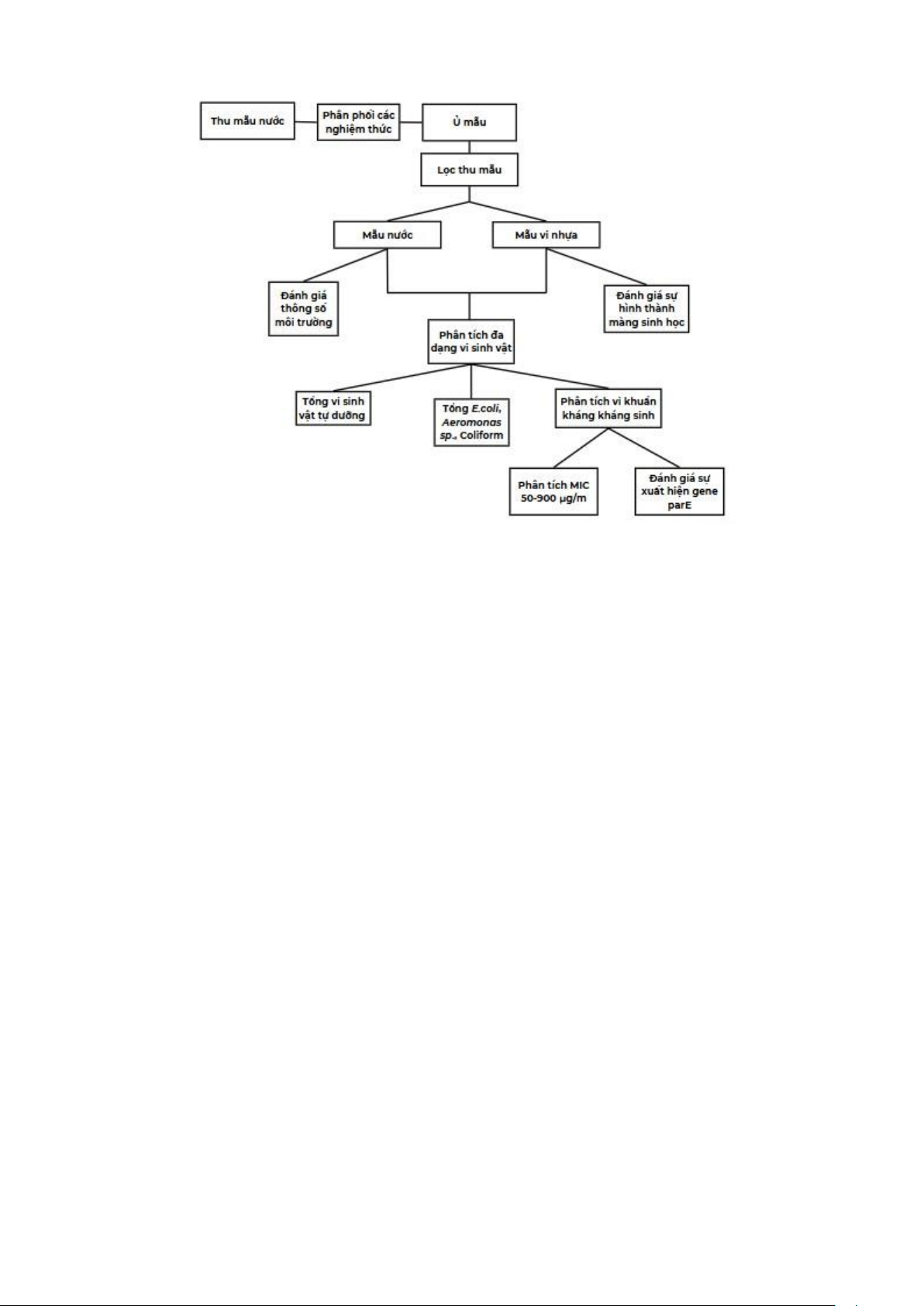
2.3.2. Thu mẫu nước và chuẩn bị mẫu thí nghiệm
Mẫu nước thu thập tại Sông Kim Ngưu, gần bệnh viện Thanh Nhàn (Hà Nội) (toạ
độ lấy mẫu: kinh độ 105°51'42''E, vĩ độ 21°0'10''N) được thu thập để bố trí thí nghiệm
trong phòng thí nghiệm. Mẫu nước sau khi mang về được lọc qua màng lọc 80 µM để
loại bỏ vi nhựa ngoài tự nhiên, phần cặn trên lưới lọc sau đó được rửa lại nhiều lần để
thu các cặn hữu cơ còn sót sau đó phân phối vào các bình Duran tương ứng với 490 mL mỗi bình.
Vi nhựa PET được khử trùng theo mô tả của Hossain và các cộng sự (2024) bằng
cách ngâm Ethanol 75º trong 6 giờ và sấy khô đến khối lượng không đổi ở 70 °C [11].
Sau đó 0,25 g được cân và chuyển vào các bình Duran 1 L đã khử trùng.
Tổng thể tích cho 1 bình thí nghiệm là 500 mL bao gồm: Môi trường khoáng tối
thiểu (MSM), kháng sinh CIP đã pha loãng, vi nhựa PET đã chuẩn bị theo mô tả ở phần
2.3.1 và mẫu nước đã lọc đạt 500 mL.
2.3.4. Thiết lập mô hình khảo sát ảnh hưởng của CIP lên sự hình thành màng sinh
học trên bề mặt vi nhựa PET
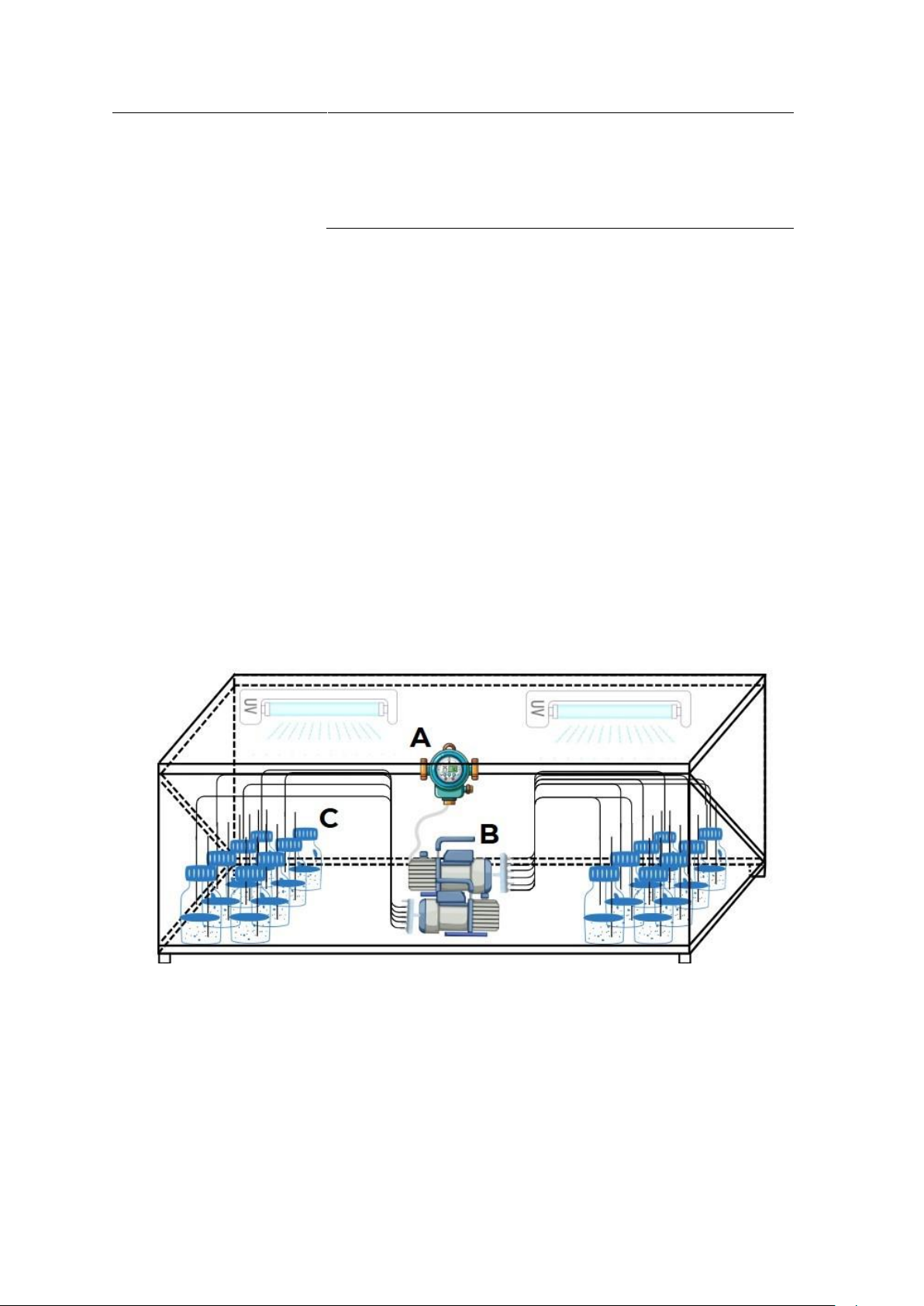
Hình 3. Hệ thống sục khí Oxy bán tự động.
A. Timer, B. Máy bơm Oxy, C. Các bình nghiệm thức thử nghiệm
Thí nghiệm được thực hiện trong hệ thống sục khí oxy bán tự động, được thiết kế
nhằm duy trì lượng oxy ổn định, đảm bảo tính đồng nhất của vi nhựa được phân bố đều
trong mẫu nước. Hệ thống tích hợp đèn UV nhằm khử trùng, ngăn ngừa nguy cơ tạp
nhiễm. Máy bơm oxy trong hệ thống được kết nối với bộ hẹn giờ (timer) bán tự động,
cài đặt hoạt động ba lần mỗi ngày, với mỗi chu kỳ sục khí kéo dài 1 giờ ở điều kiện nhiệt độ phòng (Hình 3).
Bố trí thí nghiệm trong hệ thống bao gồm 3 nghiệm thức chứa kháng sinh
ciprofloxacin ở các nồng độ khác nhau: 50 μg/L, 250 μg/L, 500 μg/L và mẫu nước chỉ
bổ sung vi nhựa PET được sử dụng làm nghiệm thức đối chứng (Hình 4). Tất cả các
nghiệm thức đều chứa hai nhóm mẫu song song (tương ứng 2 lần lặp mỗi mẫu), với các
mốc thời gian theo dõi mẫu bao gồm ngày 0, 2, 4, 8, 15, 30 và ngày 60. Thí nghiệm được
tách riêng mẫu nước và vi nhựa vào ngày phân tích nhằm đánh giá mật độ vi sinh vật
trên hai mẫu, đồng thời đánh giá sự hình thành màng sinh học đối với mẫu vi nhựa và
phân tích các thông số môi trường trong nước. Sau đó thực hiện đánh giá nồng độ kháng
sinh tối thiểu (MIC) của CIP trên các chủng được chọn làm thuần để sàng lọc các chủng
có kết quả MIC cao và xác định sự hiện diện gene kháng kháng sinh CIP (Hình 6).
Hình 4. Các nghiệm thức bổ sung kháng sinh CIP ở các nồng độ khác nhau.
Hình 5. Sơ đồ tóm tắt các chỉ tiêu phân tích mẫu
2.3.5. Phương pháp tách vi nhựa từ mẫu nước
Mẫu nước và mẫu vi nhựa được tách ra thông qua màng lọc 80 µM, phần vi nhựa
được chuyển vào các ống Eppendorf vô trùng sau đó rửa qua bằng dùng dujch đệm
Phosphate Buffer Saline 1X (1X PBS) để phân tích mật độ vi sinh vật và định lượng
màng sinh học. Mẫu nước được phân phối vào các ống eppenforf vô trùng để phân tích
mật độ vi sinh vật, phần còn lại được sử dụng để đo thông số môi trường.
2.3.6. Đánh giá sự thay đổi các thông số môi trường theo thời gian
Các thông số môi trường trong nước như pH, nhiệt độ, độ dẫn điện (EC), độ khử
oxy hóa (ORP), tổng chất rắn hòa tan (TDS), độ mặn (PSU) được đánh giá bằng máy đo
đa chỉ tiêu (HANNA instruments, HI98194, Ý), bằng cách nhúng đầu dò của máy đo
vào mẫu nước ở các nghiệm thức trong vòng 10-15 phút để máy đo ổn định thông số, ghi nhận số liệu.
2.3.7. Đánh giá sự phát triển của màng sinh học trên bề mặt vi nhựa
2.3.7.1. Định lượng sự hình thành màng sinh học trên bề mặt vi nhựa bằng phương pháp nhuộm Crystal Violet
Phương pháp nhuộm màu Crystal Violet (nhuộm CV) được sử dụng để định lượng
sự hình thành màng sinh học trên bề mặt vi nhựa theo mô tả của O'Toole và các cộng sự
(2000) với một số sửa đổi nhỏ [15]. 0,05 g PET ở các nghiệm thức được rửa bằng dung
dịch 1X PBS ba lần để loại bỏ cặn thừa. Mẫu vi nhựa sau đó được nhuộm với 0,5 mL
crystal violet 0,1% trong 45 phút ở nhiệt độ phòng trong bóng tối. Tiếp theo, các mẫu
được rửa từ 3-5 lần cho đến khi thuốc nhuộm được loại bỏ hoàn toàn và để khô ở nhiệt
độ phòng trong 45 phút. Sau đó bổ sung 1 mL ethanol 95% và ủ tiếp trong bóng tối 10
phút để hòa tan màu thuốc nhuộm. Cuối cùng, chuyển 200 μL dung dịch chứa thuốc
nhuộm đã hòa tan sang các đĩa 96 giếng để đo độ hấp thụ ở bước sóng 595 nm bằng máy
đo quang phổ. Độ hấp thụ quang học (OD) biểu thị sinh khối của màng sinh học trên bề
mặt của vi nhựa, mẫu PET không ủ được sử dụng làm mẫu trắng trong mỗi đợt phân
tích, tất cả các nghiệm được thực hiện ba lần lặp.
2.3.7.2. Phương pháp tách màng sinh học trên vi nhựa
Phương pháp tách màng sinh học trên bề mặt vi nhựa được thực hiện theo phương
pháp của Stevenson và cộng sự (2023) cùng một số sửa đổi nhỏ với mục đích tách rời
các vi sinh vật bám trên bề mặt vi nhựa để thực hiện phân tích mật độ vi sinh [16].
Khoảng 2-3 hạt thủy tinh (kích thước 2 mm) vô trùng được thêm vào các ống eppendoft
có chứa vi nhựa bổ sung PBS 1X theo tỉ lệ 1:10. Siêu âm mẫu trong 15 phút ở nhiệt độ
phòng và sau đó mẫu được lắc đều bằng máy vortex (MS3 digital, IKA, Đức) ở 3000
rpm trong 5 phút để tách màng sinh học ra khỏi bề mặt vi nhựa. Hỗn dịch màng sinh học
khi tách được bổ sung dung dịch glycerol 30% theo tỉ lệ 1:1 và lưu trữ ở -80 ºC cho đến
khi thực hiện các phân tích tiếp theo.
2.3.7.3. Định lượng mật độ vi sinh vật bằng phương pháp nuôi cấy truyền thống
Mật độ vi sinh vật tổng số trên mẫu nước và hỗn dịch đã tách màng sinh học từ
vi nhựa được xác định bằng phương pháp pha loãng theo bậc thập phân và cấy trải lên
một số môi trường phân biệt bao gồm môi trường thạch khoáng tối thiểu MSM để đánh
giá mật độ vi sinh vật tổng số, Macconkey agar đối với vi khuẩn Escherichia coli,
Aeromonas sp. và tổng số vi khuẩn Coliforms. Tất cả các đĩa được ủ mẫu ở 37ºC và đọc
kết quả sau 24 - 48 giờ.
Thực hiện đếm khuẩn lạc tổng số trên đĩa cấy đối với môi trường MSM, đối với
môi trường Macconkey được xác định dựa trên hình thái khuẩn lạc đặc trưng, bao gồm
các chủng vi khuẩn có hình dạng khuẩn lạc tròn, lồi, nhẵn ướt/khô, màu sắc từ hồng đến
đỏ, có khả năng lên men lactose được lựa chọn để định danh vi khuẩn E. coli, đồng thời
các chủng có hình dạng khuẩn lạc tròn lồi, nhăn ướt và màu từ hồng nhạt đến không
màu, không có khả năng lên men lactose được lựa chọn để đinh danh vi khuẩn
Aeromonas sp. Các dạng khuẩn lạc còn lại được phân loại thành tổng vi khuẩn Coliform
và các nhóm vi khuẩn khác.
Mật độ vi sinh vật điển hình ở mẫu nước được thể hiện bằng số logarit của đơn vị̀
hình thành khuẩn lạc trên m̉ ỗi mL (Log10 CFU/mL). Đối với mẫu vi nhựa, sau khi đã
tách hỗn dịch màng sinh học được mang sấy khô ở 70ºC trong 24h để tính được khối
lượng vi nhựa ban đầu, từ đó tính toán số logarit của đơn vị hình thành khuẩn lạc trên
mỗi gram vi nhựa (Log10 CFU/g).
Đối với mẫu nước: A = (CFU/mL) Trong đó:
N: Tổng số khuẩn lạc đếm được trên các đĩa đã chọn.
n: Số lượng đĩa cấy tại các độ pha loãng khác nhau.
V: Thể tích dung dịch cấy vào mỗi đĩa (mL). f: Độ pha loãng tương ứng.
Đối với mẫu vi nhựa: A (CFU/g) Trong đó:
N: Tổng số khuẩn lạc đếm được trên các đĩa đã chọn.
B: Khối lượng nhựa đã cấy
C: Thể tích dung dịch đệm bổ sung tách biofilm D: Độ pha loãng khi tách
biofilm n: Số lượng đĩa cấy tại các độ pha loãng khác nhau.
V: Thể tích dung dịch cấy vào mỗi đĩa (mL).
f: Độ pha loãng tương ứng.
2.3.7.4. Phương pháp xác định hình thái vi thể thông qua kỹ thuật nhuộm Gram
Các khuẩn lạc đặc trưng trên môi trường Macconkey được chọn làm thuần, tiến
hành nhuộm Gram để xác định hình thái vi thể. Bằng cách nhỏ 1 giọt dung dịch NaCl
0,9% vô trùng lên lam kính, phết nhẹ 1 lượng nhỏ khuẩn lạc vi khuẩn lên lam, để khô tự
nhiên hoặc hơ nhẹ qua ngọn lửa đèn cồn để cố định mẫu. Sau đó, nhỏ vài giọt crystal violet
lên mẫu trong 45–60 giây, rửa nhẹ bằng nước cất, sau đó cố định màu bằng dung dịch
Lugol 1% (60 giây). Tiếp theo, mẫu được tẩy bằng cồn 70% (15–20 giây) và rửa ngay để
tránh tẩy quá mức. Mẫu tiếp tục được nhuộm với fucshin 1% (45–60 giây) rồi rửa sạch,
để khô tự nhiên hoặc làm khô nhẹ. Quan sát dưới kính hiển vi với vật kính dầu 100X, điều
chỉnh ánh sáng nếu cần để tăng độ rõ nét. Các khuẩn lạc bắt màu thuốc nhuộm tím thuộc
vi khuẩn Gram dương màu đỏ của Fuchsin được xác định thuộc nhóm vi khuẩn Gram
âm. Nhằm định danh sơ bộ vi khuẩn Escherichia coli, Aeromonas sp., các chủng vi khuẩn
Gram âm được lựa chọn và được lưu giữ trên canh thang LB bổ sung glycerol 20%, bảo
quản chủng ở -80ºC cho đến khi thực hiện các phân tích tiếp theo [13].
2.3.7.5. Phương pháp tách chiết DNA tổng số
Phương pháp tách DNA vi khuẩn được thực hiện dựa theo quy trình của Tillett
và cộng sự (2000) [17]. Khuẩn lạc vi khuẩn được tạo huyền phù trong dung dịch đệm
PBS 1X, sau đó ly tâm ở 13000 rpm trong 10 phút và loại bỏ phẩn dịch nổi. Bổ sung 50
µl đệm TER và lắc mẫu bằng máy vortex ở 3000 rpm trong 30 giây, sau đó bổ 750 µL
dung dịch đệm XS (1% Potassium ethyl xanthogenate, 100 mM Tris–HCl, 20 mM
EDTA, 1% SDS và 800 mM amoni acetate) bằng cách xả nhẹ đầu tip micropipet lên
thành ống, lật ngược ống nhẹ nhàng vài lần để trộn, tránh để tạo bọt, ủ mẫu vào bể ổn
nhiệt (SL SCILAB, SB-22, Hàn) ở 70ºC trong 30 phút. Sau đó vortex mẫu trong 10 giây
và tiếp tục ủ mẫu vào đá dăm trong 30 phút và ly tâm ở 13.000 rpm trong 10 phút. Sau
quá trình ủ lạnh, chuyển toàn bộ phần dịch nổi (khoảng 750 µL) sang ống eppendoft mới
chứa 750 µL isopropanol 100%, lật ngược ống nhẹ nhàng để trộn và ủ ở nhiệt độ phòng
trong 10 phút. Tiếp tục ly tâm ở 13.000 rpm trong 10 phút, loại bỏ phần nước nổi và bổ
sung 750 µL ethanol 70% lạnh bằng cách dùng micropipet chuyển ethanol nhẹ nhàng
lên thành ống. Ly tâm ở 13.000 rpm trong 10 phút và loại bỏ ethanol, các mẫu được để
khô trong không khí dưới tủ an toàn sinh học trong khoảng 30 phút để loại bỏ hoàn toàn.
Cuối cùng bổ sung 50 µL dung dịch đệm TE và ủ mẫu qua đêm ở nhiệt độ phòng. Mẫu
DNA sau khi tách được thực hiện điện di trên máy điện di để xác định chất lượng DNA
được tách, sau đó bảo quản mẫu ở -80ºC trước khi thực hiện cách phân tích tiếp theo.
2.3.7.5. Định danh một số vi khuẩn gây bệnh trên bề mặt vi nhựa và trong môi trường nước
Phản ứng PCR được sử dụng để định danh vi khuẩn Aeromonas sp.,
Escherichia coli bằng các cặp mồi được mô tả ở Bảng 4, với chu trình nhiệt được thực
hiện theo mô tả của Phusagenomic kit PCR như sau: 95ºC trong 5 phút cho quá trình
biến tính ban đầu 95ºC, lặp lại sau đó là 35 chu kỳ với quá trình biến tính 95ºC/30 giây,
quá trình gắn mồi được thực hiện ở 50ºC/20 giây đối với cặp mồi của vi khuẩn
Aeromonas sp. và 60ºC/20 giây đối với phản ứng đa mồi phát hiện vi khuẩn E.coli. Sau
khi kết thúc chu kỳ là phần mở rộng cuối cùng ở 72ºC/5 phút. Sản phẩm PCR được phân
tích bằng phương pháp điện di ở 100V trong 30p trên gel agarose 1,5% để xác định sự
hiện diện của gene mục tiêu. Sau khi hoàn tất, gel được quan sát dưới hệ thống chụp ảnh
gel điện di sử dụng ánh sáng UV để quan sát. Sự xuất hiện của các băng DNA có kích
thước tương ứng với 3 cặp mồi cydA, lacY và ydiV được xác định là vi khuẩn E.coli và
cặp mồi aroA đối với vi khuẩn Aeromonas sp.
Bảng 4. Trình tự mồi các gene phát hiện vi khuẩn E.coli, Aeromonas sp., và gene
kháng kháng sinh nhóm fluoroquinolones STT Mồi Trình tự mồi Chiều Tài liệu dài mồi tham khảo (bp) 1 CydA - 5’-CGTATGGAGATGGTGAG-3’ F 515 [21] CydA - 3’-R-GTAGAACCAGAACGCAGT- R 5’ 2 lacY - F 5’-TTCCCACCGATGCGATT-3’ [21] 192
lacY - R 3’-GTCACTGTATGTTATTGGCG-5’ 3
ydiV - F 5’-CCATTTCTCCAGTGAAGAT-3’ [21] 330 ydiV - R 3’-CCTAACACAAGGGGATAC-5’ 1236 [4] 4 aroA - F 5’-GCTGGCATATGTATGGCA-3’
aroA - R 3’-GCTTCAGGACCATATTTCTC-5’ 5 parE - F 5’-AATCACTGACGACGAGAC-3’ 280 [8] parE - R 3’-CTTCTTCCGGGTGAATGT-5’
Bảng 5. Thành phần phản ứng PCR phát hiện gene E.coli và Aeromonas sp. E.coli Aeromonas sp. Thành phần Thể tích (µL) Thành phần Thể tích (µL) Magic Master Mix Magic Master Mix 7,5 7,5 PCR 2X PCR 2X CydA F 0,5 CydA R 0,5 aroA F 0,5 YdiV F 0,5 YdiV R 0,5 lacY F 0,5 aroA R 0,5 lacY R 0,5 Nước tinh khiết 2,5 Nước tinh khiết 3,5 Mẫu tách DNA 2 Mẫu tách DNA 3 Tổng thể tích phản Tổng thể tích phản 15 15 ứng ứng
2.3.7.6. Đánh giá khả năng kháng kháng sinh của VSV trên màng sinh học
a. Phương pháp đánh giá nồng độ kháng sinh tối thiểu (MIC)
Phương pháp đánh giá nồng độ kháng sinh tối thiểu (MIC) của ciprofloxacin trên
các chủng vi khuẩn đã chọn lọc trước đó được xác định bằng phương pháp pha loãng
thạch với dải nồng độ kháng sinh được lựa chọn theo tiêu chuẩn của Ủy ban châu Âu về
thử nghiệm độ nhạy kháng sinh (EUCAST, 2020) với một số thay đổi nhỏ [9]. Kháng
sinh ciprofloxacin được pha loãng bằng nước cất vô trùng thành các nồng độ khác nhau
và trộn đều vào môi trường thạch LB ở nhiệt độ khoảng 45 đến 50 ºC. Các chủng vi
khuẩn được nuôi tăng sinh trong môi trường canh thang LB và được pha loãng bằng
dung dịch đệm PBS 1X đến nồng độ 107 CFU/mL bằng phương pháp đo mật độ quang ở bước sóng 595 nm.
Thí nghiệm được thực hiện bằng cách nhỏ 0,1 μl dịch huyền phù vi khuẩn lên các
điểm đã được đánh dấu trên đĩa petri với khoảng cách 2,5 mm. Nước cất vô trùng được
sử dụng làm mẫu đối chứng âm. Ủ mẫu ở 37ºC trong 18-24 giờ, các nồng độ không có
sự phát triển của khuẩn lạc vi khuẩn được xác định là nồng độ kháng sinh tối thiểu của
chủng vi khuẩn đó [5]. Tỉ lệ % các chủng vi khuẩn ở các nghiệm thức trên các giá trị
MIC tương ứng được tính theo công thức: % M = Trong đó:
M: Tỉ lệ chủng vi khuẩn ở các nghiệm thức tại các giá trị MIC tương ứng
A: Số lượng chủng vi khuẩn ở các nghiệm thức tại các giá trị MIC tương ứng
N: Tổng số chủng vi khuẩn đã sàng lọc
b. Khảo sát sự xuất hiện của gene kháng kháng sinh parE thông qua PCR
Phản ứng PCR được thực hiện bằng cách sử dụng các mồi để phát hiện các gen
kháng kháng sinh ciprofloxacin. Điều kiện PCR được thực theo mô tả của Kareem và
các cộng sự (2021) [12]. Với thành phần phản ứng được mô tả ở bảng 6. Quá trình
khuếch đại DNA được thực hiện bằng máy PCR với quy trình như sau: 95ºC trong 5
phút cho quá trình biến tính ban đầu 95ºC, lặp lại sau đó là 35 chu kỳ với quá trình biến
tính 95ºC/30 giây, quá trình gắn mồi ở 50ºC/20 giây. Sau khi kết thúc chu kỳ là phần mở
rộng cuối cùng ở 72ºC/5 phút. Sản phẩm PCR được phân tích bằng phương pháp điện
di trên gel agarose 1,5% tương tự với quy trình định danh vi khuẩn đã mô tả trước đó để
xác định sự hiện diện của gene mục tiêu.
Bảng 6. Thành phần phản ứng PCR phát hiện gene kháng fluoroquinolone Thành phần Thể tích (µL) Magic Master Mix PCR 2X 7,5 parE F 0,5 parE R 0,5 Nước tinh khiết 3,5 Mẫu tách DNA 3
Tổng thể tích phản ứng 15
2.3.7.6. Phương pháp xử lý số liệu
Các nghiệm thức được lặp lại ba lần để đảm bảo độ tin cậy. Dữ liệu thu thập được
xử lý sơ bộ bằng phần mềm Microsoft Excel 2020. Phần mềm OriginPro 2024 được sử
dụng để phân tích các giá trị trung bình, độ lệch chuẩn (SD), mối tương quan giữa các
thông số môi trường đối với độ vi sinh vật và sự hình thành màng sinh học trên vi nhựa,
phép thử ANOVA được sử dụng để phân tích sự khác biệt giữa các nhóm. Mức ý nghĩa
p < 0,05 được áp dụng để xác định các mối liên hệ có ý nghĩa thống kê trong tất cả các phân tích.
5. CÁC CHƯƠNG MỤC CỦA LUẬN VĂN (DỰ KIẾN) LỜI CẢM ƠN
DANH MỤC CHỮ CÁI VIẾT TẮT
DANH MỤC CHỮ CÁI VIẾT TẮT DANH MỤC HÌNH DANH MỤC BẢNG TÓM TẮT LỜI MỞ ĐẦU
CHƯƠNG 1. TỔNG QUAN
1.1. Tổng quan về vi nhựa
1.1.1. Vai trò của nhựa trong đời sống
1.1.2. Rác thải nhựa và sự hình thành vi nhựa
1.1.3. Vi nhựa Polyethylene terephthalate (PET) trong môi trường
1.2. Kháng sinh và các tác động với môi trường
1.2.1. Vai trò của kháng sinh
1.2.2. Kháng sinh Ciprofloxacin
1.2.3. Vi khuẩn kháng kháng sinh
1.2.4. Cơ chế kháng kháng sinh Ciprofloxacin ở một số loài vi khuẩn
1.2.5. Sự tồn dư kháng sinh
1.3. Tương tác giữa hệ vi sinh vật với vi nhựa và kháng kháng sinh
1.3.1. Sự đa dạng cộng đồng vi sinh vật trên vi nhựa
1.3.2. Sự hình thành màng sinh học trên vi nhựa
1.3.3. Cơ chế hình thành và tích lũy gene kháng kháng sinh trên vi nhựa
1.4. Các nghiên cứu trong và ngoài nước về tác động của kháng sinh đến quần xã
vi sinh vật trên vi nhựa trong môi trường nước
CHƯƠNG 2. PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Địa điểm, thời gian và đối tượng nghiên cứu
2.2. Vật liệu và phương pháp nghiên cứu
2.2.1. Vật liệu 2.2.1.1. Dụng cụ 2.2.1.2. Hóa chất 2.2.1.3. Thiết bị
2.3. Phương pháp nghiên cứu
2.3.1. Chuẩn bị môi trường và hóa chất
2.3.1.1. Chuẩn bị môi trường nuôi cấy vi sinh vật
2.3.1.2. Chuẩn bị hóa chất tách DNA
2.3.1.3. Chuẩn bị hóa chất nhuộm Gram vi khuẩn
2.3.2. Thu mẫu nước và chuẩn bị mẫu thí nghiệm
2.3.3. Thiết lập mô hình khảo sát ảnh hưởng của CIP lên sự hình thành
màng sinh học trên bề mặt vi nhựa PET
2.3.4. Phương pháp tách vi nhựa từ mẫu nước
2.3.5. Đánh giá sự thay đổi các thông số môi trường theo thời gian
2.3.6. Đánh giá sự phát triển của màng sinh học trên bề mặt vi nhựa
2.3.6.1. Định lượng sự hình thành màng sinh học trên bề mặt vi nhựa bằng
phương pháp nhuộm Crystal Violet
2.3.6.2. Phương pháp tách màng sinh học trên vi nhựa
2.3.6.3. Định lượng mật độ vi sinh vật bằng phương pháp nuôi cấy truyền thống
2.3.6.4. Phương pháp xác định hình thái vi thể thông qua kỹ thuật nhuộm Gram
2.3.6.5. Phương pháp tách chiết DNA tổng số
2.3.6.6. Định danh một số vi khuẩn gây bệnh trên bề mặt vi nhựa và trong môi trường nước
2.3.7. Đánh giá khả năng kháng kháng sinh của VSV trên màng sinh học
2.3.7.1. Phương pháp đánh giá nồng độ kháng sinh tối thiểu (MIC)
2.3.7.2. Khảo sát sự xuất hiện của gene kháng kháng sinh parE thông qua PCR
2.3.8. Phương pháp xử lý số liệu
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
3.1. Sự phát triển của màng sinh học trên bề mặt vi nhựa theo thời gian
3.2. Sự biến động của quần xã vi sinh vật trên bề mặt vi nhựa và trong môi trường nước
3.2.1. Mật độ vi khuẩn tự dưỡng trong nước và trên MiPs
3.2.2. Mật độ vi khuẩn E., Aeromonas sp. và coliform
3.3. Mối tương quan giữa sự thay đổi của các thông số trường đến các thay
đổi về mật độ vi sinh vật trên màng sinh học
3.4. Khảo sát sự khả năng kháng kháng sinh trên màng sinh học
3.4.1. Kết quả nồng độ ức chế tối thiểu (MIC) của kháng sinh ciprofloxacin
ở các chủng vi khuẩn phân lập được
3.4.2. Kết quả định danh một số chủng vi khuẩn gây bệnh cùng sự xuất hiện
gene kháng kháng sinh fluroquinolones
CHƯƠNG 4. KẾT LUẬN VÀ KIẾN NGHỊ 4.1. Kết luận 4.2. Kiến nghị
TÀI LIỆU THAM KHẢO PHỤ LỤC
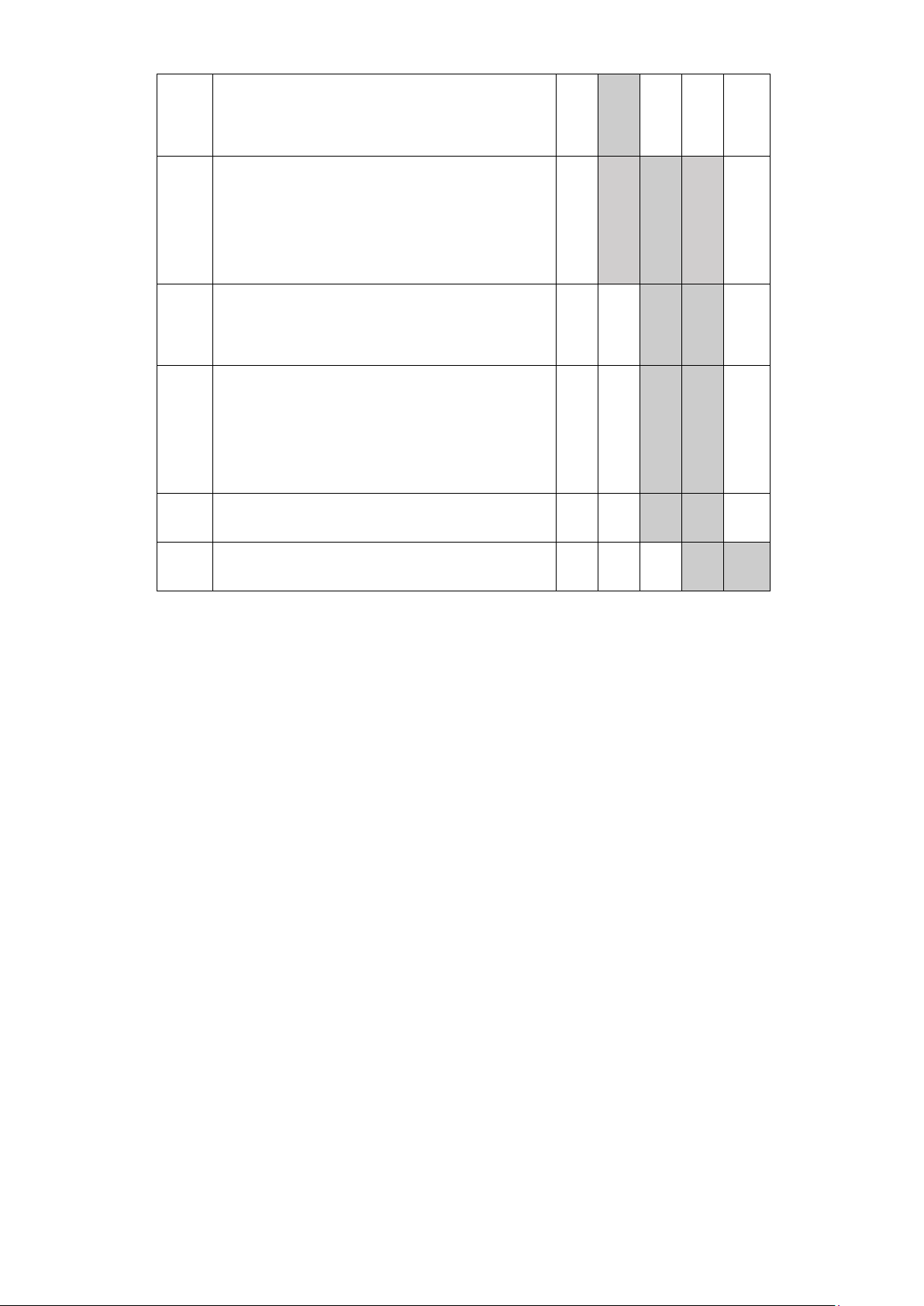
6. TIẾN ĐỘ THỰC HIỆN
Bảng 2. Tiến độ thực hiện THÁNG STT 11 12 1 2 3 NỘI DUNG
01 Tìm kiếm tài liệu, xây dựng kế hoạch thí nghiệm
02 Thu mẫu nước ô nhiễm tại khu vực
bênh viện Thanh Nhàn và bố trí thí nghiệm
03 Đánh giá tác động của kháng sinh
Ciprofloxacin ở các nồng độ khác nhau
đến: Mật độ vi sinh vật, sự hình thành
màng sinh học trên vi nhựa, sự thay đổi thông số môi trường
04 Xác định hình thái khuẩn lạc, hình thái
tế bào, định danh vi khuẩn E.coli và Aeromonas sp.
05 Đánh giá khả năng ức chế tối thiểu
(MIC) của CIP trên các chủng vi khuẩn
phân lập được, xác định sự xuất hiện
ARGs ở các loài vi khuẩn sau khi sàng lọc MIC
06 Xử lý số liệu thực nghiệm 07
Viết bản thảo và hoàn thiện đề tài
7. TÀI LIỆU THAM KHẢO 1.
Shakir Ali và các cộng sự. (2023), "Characterization of plastic degrading bacteria
isolated from sewage wastewater", Saudi Journal of Biological Sciences. 30(5), tr. 103628. 2.
Hoang Quoc Anh và các cộng sự. (2021), "Antibiotics in surface water of East and
Southeast Asian countries: A focused review on contamination status, pollution
sources, potential risks, and future perspectives", Science of The Total Environment. 764, tr. 142865. 3.
Purevdash Tsend Ayush, Je-Hyeon Ko và Hyun-Suk Oh (2022), "Characteristics of
initial attachment and biofilm formation of Pseudomonas aeruginosa on microplastic
surfaces", Applied Sciences. 12(10), tr. 5245. 4.
Alberto Cascón Soriano và các cộng sự. (1997), "RFLP-PCR analysis of the aroA gene
as a taxonomic tool for the genus Aeromonas", FEMS Microbiology Letters. 156(2), tr. 199-204. 5.
Clinical và Laboratory Standards Institute (2020), Performance standards for
antimicrobial susceptibility testing, chủ biên, Clinical and laboratory standards institute Wayne, PA. 6.
Han Dong và các cộng sự. (2021), "Interactions of microplastics and antibiotic
resistance genes and their effects on the aquaculture environments", Journal of
hazardous materials. 403, tr. 123961. 7.
Thi Thuy Duong và các cộng sự. (2023), "Microplastics in sediments from urban and
suburban rivers: Influence of sediment properties", Science of the Total Environment. 904, tr. 166330. 8.
Mohamed Elshahat và các cộng sự. (2021), "Association between mutations in
GYR A/B and PAR C/E genes of Acinetobacter Baumannii clinical isolates and
Fluoroquinolones resistance", Microbes and Infectious Diseases. 2(2), tr. 343351. 9.
T EUCAST (2020), "European committee on antimicrobial susceptibility testing",
Breakpoint Tables for Interpretation of MICs and Zone Diameters. Version 10.0. 10.
Vu Thi Thu Hien và các cộng sự. (2024), "First evidence of microplasticassociated
extended-spectrum beta-lactamase (ESBL)-producing bacteria in the Red River Delta,
Vietnam", Journal of Hazardous Materials Letters. 5, tr. 100129. 11.
Shahadat Hossain và các cộng sự. (2024), "Biodegradation of polyethylene (PE),
polypropylene (PP), and polystyrene (PS) microplastics by floc-forming bacteria,
Bacillus cereus strain SHBF2, isolated from a commercial aquafarm", Environmental
Science and Pollution Research, tr. 1-21. 12.
Sawsan Mohammed Kareem và các cộng sự. (2021), "Detection of gyrA and parC
mutations and prevalence of plasmid-mediated quinolone resistance genes in Klebsiella
pneumoniae", Infection and drug resistance, tr. 555-563. 13.
Nazia Khatoon và các cộng sự. (2014), "Bacterial succession and degradative changes
by biofilm on plastic medium for wastewater treatment", Journal of basic
microbiology. 54(7), tr. 739-749. 14.
Christine C Nguyen và các cộng sự. (2019), "Association between heavy metals and
antibiotic-resistant human pathogens in environmental reservoirs: A review", Frontiers
of Environmental Science & Engineering. 13, tr. 1-17. 15.
George O'Toole, Heidi B Kaplan và Roberto Kolter (2000), "Biofilm formation as
microbial development", Annual Reviews in Microbiology. 54(1), tr. 49-79. 16.
Emily M Stevenson và các cộng sự. (2023), "Culturing the Plastisphere:
comparing methods to isolate culturable bacteria colonising microplastics", Frontiers
in Microbiology. 14, tr. 1259287. 17.
Daniel Tillett và Brett A Neilan (2000), "Xanthogenate nucleic acid isolation from
cultured and environmental cyanobacteria", Journal of Phycology. 36(1), tr. 251-258. 18.
Phong K Thai và các cộng sự. (2018), "Occurrence of antibiotic residues and antibiotic-
resistant bacteria in effluents of pharmaceutical manufacturers and other sources
around Hanoi, Vietnam", Science of the Total Environment. 645, tr. 393-400. 19.
Jie Wang và các cộng sự. (2020), "Evidence of selective enrichment of bacterial
assemblages and antibiotic resistant genes by microplastics in urban rivers", Water
Research. 183, tr. 116113. 20.
Haodi Wu, Jing Hou và Xiangke Wang (2023), "A review of microplastic pollution in
aquaculture: Sources, effects, removal strategies and prospects", Ecotoxicology and
Environmental Safety. 252, tr. 114567. 21.
Bogumił Zimoń và các cộng sự. (2024), "Novel multiplex-PCR test for
Escherichia coli detection", Microbiology Spectrum. 12(6), tr. e03773-23.
8. Ý KIẾN CỦA GIÁO VIÊN HƯỚNG DẪN
........................................................................................................................................... ....
........................................................................................................................................... ....
........................................................................................................................................... ....
........................................................................................................................................... ....



