











Preview text:
CHƯƠNG 3: NHIỆT ĐỘNG HÓA HỌC Câu Đá án 1.
Cho những phản ứng sau được thực hiện ở điều kiện chuẩn: d 2 Sr(r) + O2(k) 2 SrO(r) ∆H0 = - 1180 kJ (1) SrCO (2) 3(r) CO2(k) + SrO(r) ∆H0 = + 234 kJ 2 O (3)
2(k) + 2 C(graphite) 2 CO2(k) ∆H0 = - 788 kJ Sr (4)
(r) + 3/2O2(k) + C(graphite) SrCO3(r)
Từ các điều kiện trên, nhiệt tạo thành ∆H0tt SrCO3 bằng : a. - 740. kJ/mol b. + 4190 kJ/mol c. + 714 kJ/mol d. - 1218 kJ/mol 2. Cho các phản ứng sau: a
1. CO2(k) CO(k) + ½ O2 (k) ΔH01 = +283 kJ
2. Sn (r ) + SnO2 (r ) 2SnO (r ) ΔH02 = + 117 kJ
3. 2SnO (r ) + O2 (k ) 2 SnO2 (r ) ΔH03 = -591 kJ
Xác định ΔH0 đối với phản ứng : SnO2 (r ) + 2CO (k) Sn (r ) + 2CO2 (k) a. – 92 kJ b. – 683 kJ c. +142 kJ
d. Các giá trị trên đều không đúng 3. Cho phản ứng 4Al(r ) + 3O 2 2Al2O3 a
Hiệu ứng nhiệt của phản ứng khi đốt cháy hoàn toàn 8,17 gam Al thành dạng Al2O3
rắn ở 250C và 1 atm. ( Biết ΔH 0
tt (nhiệt tạo thành) đối với Al2O3(r) = 1676 kJ/mol) là :
a. 254 kJ; b. 203 kJ; c. 127 kJ; d. 237 Kj a: 251,4kJ 4.
Cho các phản ứng sau đây ở 250C và 1atm d
1/2N2(k) + O2 (k) NO2(k) ΔH01 = 33,2 kJ
N2(k) + 2O2(k) N2O4 (k) ΔHo2 = 11,1 kJ
2NO2(k) N2O4 (k) ΔHo3 =? Gía trị ΔHo3 là :
a. +11,0 kJ; b. +44,3 kJ; c. +55,3 kJ; d. -55,3 kJ 5. Cho phản ứng
Fe3O4(r) + CO (kh) 3FeO (r) + CO2(kh) c ΔH 0 tt (kJ/mol) -1118 -110,5 -272 -395,5
ΔH0 đối với phản ứng trên bằng a. -263 kJ b. 54 kJ c. 17 kJ d. -50 kJ 6.
Những kỹ thuật nào dưới đây không thể sử dụng để tính ΔH của phản ứng? a
a. Sử dụng điểm nóng chảy của chất tham gia phản ứng và sản phẩm phản ứng b. Định luật Hess
c. Sử dụng nhiệt tạo thành của các chất tham gia phản ứng và sản phẩm phản ứng
d. Sử dụng nhiệt đốt cháy của các chất tham gia phản ứng và sản phẩm phản ứng 7.
Cho phản ứng có ΔH là dương, để phản ứng tự xảy ra, thì kết luận nào sau đây là a đúng: a. ΔS dương , T cao b. ΔS âm , T cao c. ΔS âm , T thấp d. ΔS dương , T thấp 8.
Khi nghiên cứu quá trình nóng chảy của nước đá. Người ta nhận thấy rằng, quá trình d tự xảy ra ở a. ΔH < 0, ΔS < 0 b. ΔH > 0, ΔS < 0 c. ΔH < 0, ΔS > 0 d. ΔH > 0, ΔS > 0 9.
Nếu quá trình có ΔH = +57,1 kJ/mol và ΔS = +175 J/K.mol, thì ở nhiệt độ nào quá c trình tự xảy ra
a. Không xảy ra ở bất kỳ nhiệt độ nào
b. Luôn xảy ra ở mọi nhiệt độ
c. Đối với tất cả nhiệt độ lớn hơn 326,30K
d. Đối với tất cả nhiệt độ nhỏ hơn 326,30K 10. Cho phản ứng
SiH4(kh) + 2O2(kh) SiO2(r ) + 2H2O(l) b Biết S0(J/mol.K) 204,5 205,0 41,84 69,91
ΔS0 đối với phản ứng trên ở 250C là : a. -353,5 J/K b. -432,8 J/K c. 595,0 J/K d. -677,0 J/K 11.
Phản ứng nào sau đây có sự biến đổi entropy dương? d
a. BF3(k) + NH3(k) F3BNH3(r)
b. 2SO2(k) + O2(k) 2SO3(k) c. N2(k) + 3H2(k) 2NH3(k)
d. 2NH4NO3(r) 2N2(k) + 4H2O(k) + O2(k) 12. Cho phản ứng
PbS(r) + HCl(kh) PbCl2(r) + H2S(kh) c ΔH0tt (kJ/mol): -98,7 -95,30 ? -33,6
Biết hiệu ứng nhiệt của phản ứng ΔH0 = -58,4 kJ ở 298K
Nhiệt tạo thành ΔH0 ở 298K của PbCl2(r) từ phản ứng trên là : a. -16,0 kJ/mol b. -47,6 kJ/mol c. -314,1 kJ/mol d. 36,2 kJ/mol 13. Cho phản ứng
SiH4(kh) + H2O2 (kh) SiO2(l) a
Biết ở 250C , phản ứng có ΔH0 = -1516 kJ và ΔS0 = -432,8 J/K .
Để phản ứng tự xảy ra thì kết luận nào sau đây là đúng:
a. Thấp hơn một nhiệt độ xác định
b. Trên một nhiệt độ xác định
c. Ở tất cả các nhiệt độ
d. Không xảy ra ở bất kỳ nhiệt độ nào 14.
Đối với một quá trình nhất định ở 127° C, ΔG = -16,20 kJ và ΔH = -17,0 kJ. c
ΔS của quá trình này ở nhiệt độ này bằng bao nhiêu? a. -6,3 J/K b. +6,3 J/K c. -2,0 J/K d. +2,0 J/K 15.
CH4(kh) + 2Cl2(kh) CCl4(l) + 2H2(kh) c ΔH0tt (kJ/mol) -78,81 0 -135,4 0 ΔG0tt (kJ/mol) -50,75 0 -65,27 0
ΔSo đối với phản ứng dưới đây ở 250C a. -360 J/K b. -66,9 J/K c. -141,17 J/K d. -487 J/K 16.
Cho phản ứng CH4(kh) + N2(kh) + 163,8 kJ HCN (kh) + NH3(kh) c
Có ΔH0 = 163,8KJ và ΔS0 = 161 J/K.
Nhiệt độ tại đó phản ứng bắt đầu xảy ra theo chiều thuận là a. 9,91K b. 1045 K c. 1017,4 K d. 1,017 K 17. Cho phản ứng
CH4(kh) + 2Cl2(kh) CCl4(l) + 2H2(kh) c ΔH0tt (kJ/mol) -78,81 0 -135,4 0 ΔGo (kJ/mol) -50,75 0 -65,27 0
ΔSo của phản ứng trên ở 250C là: a. -360 J/K b. -66,9 J/K c. -141,17 J/K d. -487/J/K 18. Chọn phát biếu sai b
a. Hệ cô lập là hệ không có trao đổi chất, không trao đổi năng lượng dưới dạng nhiệt
và công với môi trường.
b. Hệ kín là hệ không trao đổi chất và công, song có thể trao đổi nhiệt với môi trường
c. Hệ đoạn nhiệt là hệ không trao đổi chất và công, song có thể trao đổi nhiệt với môi trường.
d. Hệ hở là hệ có thể trao đổi chất và năng lương với môi trường. 19. Xét phản ứng:
NO(k) + ½ O2(k) → NO2(k), ∆Ho 98 = -7.4Kcal b 2
Phản ứng được thực hiện trong bình kín có thể tích không đổi, sau đó phản ứng được
đưa về nhiệt độ ban đầu. Hệ như thế là: a. Hệ cô lập
b. Hệ kín & đồng thể
c. Hệ kín & dị thể d. Hệ cố lập & đồng thể 20. Chọn phát biểu sai d
a. Nguyên lý 1 nhiệt động học thực chất là định luật bảo toàn năng lượng
b. Nhiệt chỉ có thể tự truyền từ vật thể có nhiệt độ cao sang vật thể có nhiệt độ thấp.
c. Hiệu ứng nhiệt của một phản ứng là lượng nhiệt tỏa ra hay thu vào của phản ứng đó.
d. Độ biến thiên entanpy của một quá trình không thay đổi theo nhiệt độ. 21.
Sự biến thiện nội năng ∆U khi một hệ thống đi từ trạng thái 1 sang trạng thái 2 bằng c
những đường đi khác nhau có tính chất sau
a. Không thay đổi do nhiệt Q và công A đều không đổi.
b. Thay đổi do nhiệt Q và công A thay đổi theo đường đi.
c. Không thay đổi và bằng Q-A theo nguyên lý bảo toàn năng lượng
d. Không thể tính được do mỗi đường đi có Q và A khác nhau. 22.
Một hệ thống hấp thu một năng lượng dưới dạng nhiệt là 200kJ. Nội năng của hệ tăng d
thêm 250kJ. Vậy trong biến đổi trên công của hệ thống có giá trị. a. 350kJ b. -350kJ c. 50kJ d. -50kJ 23. Phản ứng ở Fe điều kiện đã cho có c
2O3(r) + 3CO(k) → 2Fe(r) + 3CO2(k)
∆Ho298 = -6,9Kcal. Vậy ∆Uo298 (Kcal) của phản ứng bằng (cho R ≈ 2,10-3 kcal/mol.K) a. 6,8 b. -8,6 c. -6,9 d. -5 24.
Chọn phát biểu chính xác của định luật Hess d
a. Hiệu ứng nhiệt của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng thái của
các chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình.
b. Hiệu ứng nhiệt đẳng tích hay đẳng áp của quá trình hóa học chỉ phụ thuộc vào bản
chất của các chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình
c. Hiệu ứng nhiệt đẳng áp của quá trình hóa học chỉ phụ thuộc vào bản chất và trạng
thái của các chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình.
d. Hiệu ứng nhiệt đẳng áp hay đẳng tích của quá trình hóa học chỉ phụ thuộc vào bản
chất và trạng thái của chất đầu và sản phẩm chứ không phụ thuộc vào đường đi của quá trình. 25.
∆H của một quá trình hóa học khi chuyển từ trạng thái thứ 1 sang trạng thái thứ 2 bằng d
những cách khác nhau có đặc điểm:
a. Thay đổi theo cách tiến hành quá trình
b. Không thay đổi theo cách tiến hành quá trình
c. Có thể cho ta biết chiều tự diễn biến của quá trình ở nhiệt độ thấp
d. Cả hai đặc điểm b và c đều đúng 26. Chọn phát biểu đúng A
a. Hiệu ứng nhiệt của một phản ứng đo ở điều kiện đẳng áp bằng biến thiên entanpy,
hiệu ứng nhiệt của phản ứng đó ở điều kiện đẳng tích bằng biến thiên nội năng của hệ
b. ∆Hphản ứng > 0 khi phản ứng tỏa nhiệt
c. ∆Uphản ứng < 0 khi phản ứng thu nhiệt
d. Hiệu ứng nhiệt của một phản ứng không tùy thuộc vào điều kiện (T, P), trạng thái
của các chất tham gia và sản phẩm của phản ứng. 27.
Một phản ứng có ∆H = -200kJ/mol. Dựa trên thông tin này có thể kết luận phản ứng a
tại nhiệt độ đang xét như sau: a. Tỏa nhiệt b. Có tốc độ nhanh
c. Tự xảy ra được d. Cả a,b,c đều đúng 28.
Giá trị của ∆Ho298 của một phản ứng hóa học a
a. Tùy thuộc vào cách viết các hệ số tỷ lượng của phương trình phản ứng.
b. Tùy thuộc vào cách tiến hành phản ứng. c. a,b đều sai. d. a,b đều đúng 29.
Cho phản ứng có ∆H dương, thì kết luận nào sau đây là đúng: c
a. Không thể xảy ra tự phát ở mọi giá trị nhiệt độ.
b. Có thể xảy ra tự phát ở nhiệt độ thấp.
c. Có thể xảy ra tự phát ở nhiệt độ cao nếu biến thiên entropy của nó dương.
d. Có thể xảy ra tự phát ở nhiệt độ cao nếu biến thiên entropy của nó âm. 30.
Cho phản ứng N2 (k) + O2 = 2NO (k) ΔH0298,pu = +180,8kJ c
Ở điều kiện ở 250C, khi thu được 1 mol khí NO từ phản ứng trên thì ∆H tương ứng là a) - 180,8kJ b) 180,8kJ c) 90,4kJ d) - 90,4kJ 31.
Hiệu ứng nhiệt tạo thành tiêu chuẩn của CO2 là biến thiên entanpi của phản ứng: b
a) Ckimcương + O2 (k) = CO2 (k) ở 00C, áp suất riêng của O2 và CO2 đểu bằng 1atm
b) Cgraphit + O2 (k) = CO2 (k)
ở 250C, áp suất riêng của O2 và CO2 đểu bằng 1atm
c) Cgraphit + O2 (k) = CO2 (k)
ở 00C, áp suất chung bằng 1atm
d) Cgraphit + O2 (k) = CO2 (k)
ở 250C, áp suất chung bằng 1atm 32.
Hiệu ứng nhiệt của một phản ứng bằng: d
a) Tổng nhiệt tạo thành sản phẩm trừ tổng nhiệt tạo thành các chất đầu
b) Tổng nhiệt đốt cháy các chất đầu trừ tổng nhiệt đốt cháy các sản phẩm
c) Tổng năng lượng liên kết trong các chất đầu trừ tổng năng lượng liên kết trong các sản phẩm d) Tất cả đều đúng 33.
Chọn trường hợp đúng: Ở điều kiện tiêu chuẩn, phản ứng: H2 (k) + 1/2O2 (k) = H2O (l) d
phát ra một lượng nhiệt là 245,17kJ. Từ đây suy ra:
a) HIệu ứng đốt cháy tiêu chuẩn của H2 là -245,17kJ/mol
b) Nhiệt tạo thành tiêu chuẩn của nước lỏng là -245,17kJ/mol
c) Hiệu ứng nhiệt phản ứng trên là -245,17kJ
d) Cả ba câu trên đều đúng 34.
Biết rằng nhiệt tạo thành tiêu chuẩn của B2O3 (r), H2O (l), CH4 (k) và C2H2 (k) lần c
lượt bằng: -1273,5; -285,8: -74,7; +2,28 (kJ/mol). Trong bốn chất này, chất dễ bị phân
hủy thành đơn chất nhất về mặt nhiệt động học : a) H2O b) CH4 c) C2H2 d) B2O3 35.
Trong các hiệu ứng nhiệt (ΔH) của các phản ứng cho dưới đây, giá trị nào là hiệu ứng B nhiệt đốt cháy?
1) C (gr) + 1/2O2 (k) = CO (k) ΔH0298 = -110,55kJ
2) H2 (k) + 1/2O2 (k) = H2O (l) ΔH0298 = -571,20kJ
3) H2 (k) + 1/2O2 (k) = H2O (k) ΔH0298 = -237,84kJ 4) C (gr) + O2 (k) = CO2 (k) ΔH0298 = -393,50kJ a) 4 b) 2, 4 c) 1, 2, 3, 4 d) 2 36.
Lập công thức tính hiệu ứng nhiệt (ΔH0) của phản ứng B A, thông qua hiệu ứng A
nhiệt của phản ứng sau (biết các phản ứng trên xảy ra ở cùng điều kiện T, P) A C ΔH1 C D ΔH2 B D ΔH3
a) ΔH0 = ΔH3 - ΔH1 – ΔH2
b) ΔH0 = ΔH3 + ΔH2 – ΔH1
c) ΔH0 = ΔH2 - ΔH1 – ΔH3 d) ΔH0 = ΔH1 + ΔH2 + ΔH3 37.
Lập công thức tính hiệu ứng nhiệt (ΔH0) của phản ứng B A, thông qua hiệu ứng B
nhiệt của phản ứng sau (biết các phản ứng trên xảy ra ở cùng điều kiện T, P) A C ΔH1 D C ΔH2 B D ΔH3 a) ΔH0 = ΔH1 - ΔH2 + ΔH3
b) ΔH0 = ΔH3 + ΔH2 – ΔH1
c) ΔH0 = ΔH2 - ΔH1 – ΔH3 d) ΔH0 = ΔH1 + ΔH2 + ΔH3 38. Từ hai phản ứng: a (1) A + B = C + D ΔH1 (2) E + F = C + D ΔH2
Thiết lập được công thức tính ΔH3 của phản ứng A + B = E + F (biết các phản ứng
trên xảy ra ở cùng điều kiện T, P) a) ΔH3 = ΔH1 - ΔH2 b) ΔH3 = ΔH1 + ΔH2
c) ΔH3 = ΔH2 – ΔH1 d) ΔH3 = -ΔH1 - ΔH2 39. Cho biết:
2NH3 (k) + 5/2O2 (k) 2NO (k) + 3H2O (k) A ΔH0tt,298(kJ/mol) -46,3 0 +90,4 -241,8
Hiệu ứng nhiệt của phản ứng trên bằng : a) -452kJ b) 452kJ c) +406,8kJ d) -406,8kJ 40.
Khi đốt cháy than chì bằng oxy người ta thu được 33g khí cacbonic và có 70,9 kcal B
thoát ra ở điều kiện tiêu chuẩn, vậy nhiệt tạo thành tiêu chuẩn của khí cabonic có giá trị (kcal/mol): a) -70,9 b) -94,5 c) 94,5 d) 68,6 41.
Cho các phản ứng sau ở điều kiện chuẩn D C (r) + O2 (k) = CO2 (k) ΔH01 = -94 kcal/mol H2 (k) + 1/2O2 (k) = H2O (l) ΔH02 = -68,5 kcal/mol
CH3OH (l) + 1/2O2 (k) = CO2 (k) + 2H2O (l) ΔH03 = -171 kcal/mol
Nhiệt tạo thành tiêu chuẩn (kcal/mol) của CH3OH lỏng bằng : a) +60 b) -402 c) +402 d) -60 42.
Cho các phản ứng sau ở cùng điều kiện B
(1) 2SO2 (k) + O2 (k) = 2SO3 (k) ΔH1 = -196kJ
(2) 2S (r) + 3O2 (k) = 2SO3 (k) ΔH2 = -790kJ (3) S (r) + O2 (k) = SO2 (k) ΔH3 = ? ΔH3 có giá trị bằng : a) -594kJ b) -297kJ c) 594kJ d) 297kJ 43. C
Cho phản ứng Mg(r) + O2(k) → MgO(r)
Biết lượng nhiệt tỏa ra khi đốt cháy 3g kim loại Mg 76kJ ở 250C và 1atm.
∆H0tt (KJ/mol) của MgO (r) là (Biết MMg =24g): a) +608kJ b) +304kJ c) -608kJ d) -304kJ 44. Cho phản ứng :
CH4 (k) + 2O2 (k) = CO2 (k) + 2H2O (l) C
Biết ∆H0tt KJ/mol) : -74,85 -393,51 -285,84 (kJ/mol)
∆H của phản ứng trên bằng : a) -604,5kJ b) 890,34kJ c) -890,34kJ d) 604,5kJ 45. Chon phát biểu đúng: B
1) Entropi của chất nguyên chất ở trạng thái tinh thể hoàn chỉnh, ở không độ tuyệt đối bằng không.
2) Ở không độ tuyệt đối, biến thiên entropi trong các quá trình biến đổi các chất ở
trạng thái tinh thể hoàn chỉnh đều bằng không.
3) Trong hệ hở, tất cả các quá trình tự xảy ra là những quá trình có kèm theo sự tăng entropi.
4) Entropi của chất ở trạng thái lỏng có thể nhỏ hơn entropi của nó ở trạng thái rắn. a) 1 b) 1, 2 c) 1, 2, 3 d) 1, 2, 3, 4 46.
Một chất ở trạng thái nhiệt độ càng cao thì: A a) Entropi càng lớn b) Entropi càng bé c) Entropi không thay đổi
d) Một trong 3 câu a, b, c đúng với chất cụ thể 47.
Quá trình chuyển pha rắn thành pha lỏng có: B a) ΔH < 0, ΔS > 0 b) ΔH > 0, ΔS > 0 c) ΔH < 0, ΔS < 0 d) ΔH > 0, ΔS < 0 48.
Chọn câu đúng. Phản ứng: 2A (k) + B (l) = 3C (r) + D (k) có: C a) ΔS = 0 b) ΔS > 0 c) ΔS < 0
d) Không dự đoán được 49. Trong các phản ứng sau: C N2(k) + O2(k) = 2NO (k) (1) 2CH4(k) = C2H2(k) + 2H2(k) (2) 2SO2(k) + O2(k) = 2SO3(k) (3)
Giá trị ΔS của các phản ứng tăng dần theo thứ tự a) 1, 2, 3 b) 2, 1, 3 c) 3, 1, 2 d) 2, 3, 1 50. Trong các phản ứng sau: b N2 (k) + O2 (k) = 2NO (k) (1) KClO4 (r) = KCl (r) + 2O2 (k) (2) C2H2 (k) + H2 (k) = C2H6 (k) (3)
Chọn phản ứng có ΔS lớn nhất , ΔS nhỏ nhất (cho kết quả theo thứ tự vừa nêu) a) 1, 2 b) 2, 3 c) 3, 2 d) 3, 1 51. Cho 3 phản ứng: A H2O (l) H2O (k) (1) ΔS1 2Cl (k) Cl2 (k) (2) ΔS2
C2H2 (k) + H2 (k) C2H4 (k) (3) ΔS3
Dấu của ΔS1, ΔS2, ΔS3 là
a) ΔS1 > 0, ΔS2 < 0, ΔS3 < 0
b) ΔS1 < 0, ΔS2 < 0, ΔS3 > 0 c) Cả 3 ΔS đều dương d) Cả 3 ΔS đều âm 52. Cho phản ứng: SO2 (k) + 1/2O2 (k) = SO3 (k) A Biết S0 (J/mol.K): 248 205 257
Giá trị ∆S0 của phản ứng trên là : a) -93,5 b) 93,5 c) 196 d) -196 53.
Một phản ứng ở điều kiện đang xét có ΔG < 0 thì: B
a) Xảy ra tự phát trong thực tế
b) Có khả năng xảy ra tự phát trong thực tế
c) Ở trạng thái cân bằng d) Không xảy ra 54.
Phản ứng không thể xảy ra ở bất cứ giá trị nhiệt độ nào nếu tại nhiệt độ đó phản ứng D này có:
a) ΔH < 0, ΔS > 0 b) ΔH > 0, ΔS > 0 c) ΔH < 0, ΔS < 0 d) ΔH > 0, ΔS < 0 55. Phản ứng thu nhiệt: C
a) Không thể xảy ra ở mọi giá trị nhiệt độ
b) Có thể xảy ra ở nhiệt độ thấp
c) Có thể xảy ra ở nhiệt độ cao nếu biến thiên entropi của nó dương
d) Có thể xảy ra ở nhiệt độ cao nếu biến thiên entropi của nó âm 56.
Ở một điều kiện xác định, phản ứng A B có ∆H > 0 có thể tiến hành đến cùng. D
Kết luận nào sau đây là đúng :
a) ΔSpu > 0 và nhiệt độ tiến hành phản ứng cũng phải đủ cao
b) Phản ứng B A ở cùng điều kiện của câu a có ΔGpu > 0
c) Phản ứng B A có thể tiến hành ở nhiệt độ thấp và có ΔSpu < 0 d) Tất cả đều đúng 57.
Phản ứng 3O2 (k) + 2O3 (k) ở đktc có ΔH0298 = 284,4 kJ; ΔS0298 = 139,8 J/mol.K. Giả a
sử ∆H và ∆S không phụ thuộc nhiệt độ. Vậy phát biểu nào dưới đây là phù hợp với quá trình phản ứng:
a) Ở nhiệt độ cao, phản ứng diễn ra tự phát
b) Ở nhiệt độ thấp, phản ứng diễn ra tự phát
c) Phản ứng xảy ra tự phát ở mọi nhiệt độ
d) Phản ứng không xảy ra tự phát ở mọi nhiệt độ 58.
Chọn câu chính xác. Cho phản ứng tổng quát aA + bB cC + dD có ΔH0298 < 0. B
a) Phản ứng luôn xảy ra ở bất kỳ nhiệt độ nào
b) Ở nhiệt độ cao, chiều của phản ứng còn phụ thuộc vào ΔS
c) Phản ứng không thể xảy ra ở nhiệt độ thường
d) Phản ứng chỉ xảy ra ở nhiệt độ cao 59.
Cho phản ứng 2Mg (r) + CO2 (k) = 2MgO (r) + Cgraphit. ΔH0298 = -822,7kJ. B
Về phương diện nhiệt động hóa học, phản ứng này có thể (cho biết S0298 (J/mol.K) của
Mg (r), CO2 (k), MgO (r) và Cgraphit lần lượt bằng 33, 214, 27 và 6):
a) Xảy ra tự phát ở nhiệt độ cao
b) Xảy ra tự phát ở mọi nhiệt độ
c) Yếu tố t0 ảnh hưởng không đáng kể
d) Không tự phát xảy ra ở nhiệt độ cao 60.
Chọn đáp án đầy đủ: C
Một phản ứng có thể tự xảy ra khi:
1) ΔH < 0, ΔS < 0, t0 thường 2) ΔH < 0, ΔS > 0
3) ΔH > 0, ΔS > 0, t0 thường
4) ΔH > 0, ΔS > 0, t0 cao a) 1 và 2 đúng b) 1, 2, 3, 4 đúng c) 1, 2 và 4 đúng d) 2 và 4 đúng 61.
Đa số các phản ứng xảy ra ở nhiệt độ cao có: B a) biến thiên entropi âm
b) biến thiên entropi dương c) biến thiên entanpi âm
d) biến thiên entanpi dương 62. Chọn câu sai. B
a) Phản ứng có ΔG0 < 0 có thể xảy ra tự phát
b) Phản ứng có ΔG0 > 0 không thể xảy ra tự phát
c) Phản ứng tỏa nhiệt nhiều thường có khả năng xảy ra ở nhiệt độ thường
d) Phản ứng có các biến thiên entanpi và entropi đều dương có khả năng xảy ra ở nhiệt độ cao. 63. Chọn phát biểu sai: D
a) Một phản ứng tỏa nhiệt mạnh có thể xảy ra tự phát ở nhiệt độ thường
b) Một phản ứng thu nhiệt mạnh chỉ có thể xảy ra tự phát ở nhiệt độ cao
c) Một phản ứng hầu như không thu hay phát nhiệt nhưng làm tăng entropi có thể xảy
ra tự phát ở nhiệt độ thường
d) Một phản ứng thu nhiệt mạnh nhưng làm tăng entropi có thể xảy ra tự phát ở nhiệt độ thường 64.
Để dự đoán phản ứng có thể xảy ra tự phát hoàn toàn ở nhiệt độ thường, ta có thể dựa D
trên dấu của các đại lượng nào sau đây : 1) ΔG0 < 0 2) ΔS0 >0 3) ΔH0 < 0 a) 2 b) 1, 2 và 3 c) 2 và 3 d) 1 và 3 65. Chọn trường hợp sai: B
Tiêu chuẩn có thể cho biết phản ứng xảy ra tự phát được về mặt nhiệt động là: a) ΔH0 < 0, ΔS0 > 0
b) Công chống áp suất ngoài A > 0 c) ΔG0 < 0
d) Hằng số cân bằng K lớn hơn 1 66.
Phản ứng CaCO3 (r) CaO (r) + CO2 (k) là phản ứng thu nhiệt mạnh. Xét dấu ΔH0, d
ΔS0, ΔG0 của phản ứng này ở 250C:
a) ΔH0 < 0, ΔS0 < 0, ΔG0 < 0
b) ΔH0 < 0, ΔS0 > 0, ΔG0 > 0
c) ΔH0 > 0, ΔS0 > 0, ΔG0 < 0
d) ΔH0 > 0, ΔS0 > 0, ΔG0 > 0 67.
Căn cứ trên dấu ΔG0298 của 2 phản ứng sau: C PbO2 (r) + Pb (r) = 2PbO (r) ΔG0298 < 0 SnO2 (r) + Sn (r) = 2SnO (r) ΔG0298 > 0
Trạng thái oxy hóa dương bền hơn đối với các kim loại chì và thiếc là: a) Chì (+2), thiếc (+2) b) Chì (+4), thiếc (+2) c) Chì (+2), thiếc (+4) d) Chì (+4), thiếc (+4) 68. Chọn phát biểu sai: A
1) Có thể kết luận ngay là phản ứng không xảy ra tự phát khi ΔG0 của phản ứng này lớn hơn 0
2) Có thể kết luận ngay là phản ứng không tự xảy ra khi ΔG0 của phản ứng này lớn
hơn 0 tại điều kiện đang xét
3) Một hệ tự xảy ra luôn làm tăng entropi
4) Chỉ các phản ứng có ΔG0pu < 0 mới xảy ra tự phát trong thực tế a) 1, 3 và 4 b) 1 và 3 c) 1 và 4 d) 3 69.
Cho một phản ứng hóa học với |Ho|>>|T.So|. Ở điều kiện chuẩn, trong trường hợp C
nào thì phản ứng này tự xảy ra: a. Ho 0; So 0 b. Ho 0; So 0 c. Ho 0; So 0
d. Phản ứng không thể tự xảy ra trong mọi trường hợp. 70. Cho phản ứng:
2 NO2 khí ⇋ N2O4 khí có Ho = -58,03 kJ; So = -176,52 J/mol.K. C
Ở nhiệt độ nào sau đây phản ứng bắt đầu có thể xảy ra theo chiều thuận. a. 263 K b. 273 K c. 329 K d. 473 K 71.
Cho các phương trình phản ứng: A H2S khí + 3/2 O2 khí ⇋ H2O khí + SO2 khí (1) H o = -518,59 kJ 1 S rắn + O2 khí ⇋ SO2 khí (2) H o = -296,90 kJ 2 H2 khí + 1/2 O2 khí ⇋ H2O khí (3) H o = -241,84 kJ 3
Tính nhiệt tạo thành (kJ) của hidrosulfur H2S: a. - 20,15 b. - 64,18 c. - 1057,3 d. - 1101,31 72.
Tính giá trị H o (kJ) của phản ứng: B 298
C2H5OH Iỏng + CH3COOH lỏng ⇋ CH3COOC2H5 lỏng + H2O lỏng
Nếu biết nhiệt đốt cháy ở điều kiện tiêu chuẩn của rượu etylic, acid, acetic, ester và
nước Iần lượt là -1366,91; -873,79, -2254,21 và -285,83 kJ/mol: a. -299,4 b. 299,4 c. 13,5 d. -13,5 73.
Từ các phương trình sau đây: . d C rắn + 2 N2O khí ⇋ CO2 khí + 2 N2 khí (1) H o = -556,61 kJ 1 C rắn + O2 khí ⇋ CO2 khí (2) H o = -393,51 kJ 2
Tính nhiệt tạo thành của N2O: a. -81,55 kJ b. 81,55 kJ c. -163,1 kJ d. 163,1 kJ 74.
Xác định entalpi của biến đổi: S đơn tà ⇋
S mặt thoi từ các phương trình nhiệt hóa C học sau đây: S đơn tà + O2 ⇋ SO2 khí H o = +297,2 kJ 1 S mặt thoi + O2 ⇋ SO2 khí H o = +296,9 kJ 2 a. -594,1 kJ b. -0,3 kJ c. 0,3 kJ d. 594,1 kJ 75.
Nhiệt tạo thành của oxid nhôm là -1675 kJ/mol. Nhiệt lượng tỏa ra (kJ) khi tạo thành B 10 gam oxid nhôm là : a. - 39,2 b. -164,2 c. -400,3 d. -1675 76.
Tính hiệu ứng nhiệt của phản ứng CaO rắn + CO2 khí ⇋ CaCO3 rắn nếu khi tương D
tác 140 gam CaO tỏa ra một nhiệt lượng là 441 kJ. a. - 393 kJ b. 37,6 kJ c. - 37,6 kJ d. - 177 kJ 77.
Lượng nhiệt tỏa ra khi đốt cháy 3,04 gam kim loại magnesium Mg là 76,16 kJ. Nhiệt B
tạo thành (kJ/moI) của oxid magnesium MgO là: a. - 301 b. - 601 c. 601 d. 1202 78.
Cho các phản ứng sau đây: D 2 Sn rắn + O2 khí ⇋ 2 SnO rắn H o = - 572 kJ 1 2 CO khí ⇋ 2 C rắn + O2 khí H o = 221 kJ 2 SnO rắn
+ C rắn ⇋ Sn rắn + CO khí ∆H03 = ? Giá trị ∆H03 bằng : a. - 396,7 b. - 351,4 c. 175,5 d. 351,4 79. Cho các phản ứng sau : d 2 Ti rắn + 3 Cl2 khí ⇋ 2 TiCl3 rắn H o = +1435,88 kJ 1 TiCl 3 rắn + 1/2 Cl2 khí ⇋ TiCl4 lỏng H o = +83,26 kJ 2
∆H0tt (kJ/mol) của TiCl4 bằng : a. -801,2 b. -83,26 c. 676,8 d. 801,2 80. Cho phản ứng: 2 Al rắn + 3 Cl2 khí ⇋ 2 AICl3 rắn D Biết S0(J/mol.K) 28,3 222,96 110,7
∆S0(J/mol.K) của phản ứng trên bằng: a. -221,4 b. 725,48 c. -668,88 d. -504,08 81. Cho phản ứng A 2 Ag2S rắn + 2H2O lỏng ⇋ 4 Ag rắn + 2 H2S khí + O2 khí Biết ∆H0tt (kJ/mol) -32,6 -285,8 -20,6
∆H0 của phản ứng bằng : a. 595,6 kJ b. 495,6 kJ c. 585,6 kJ d. 485,6 kJ 82.
Cho phản ứng : NH4NO3 rắn ⇋ N2O khí + 2 H2O khí B Biết NH4NO3 rắn N2O khí H2O khí H o (kJ/mol) -365,10 81,55 -241,84 298 So (J/mol.K) 150,6 220,0 188,74 298
G o (kJ) của phản ứng bằng: 298 a. + 169,9 b. -169,9 c. -269,9 d. +269,9 83.
Cho phản ứng : 3 SiO2 rắn + 4 B rắn ⇋ 3 Si rắn + 2 B2O3 rắn A Biết SiO2 rắn B rắn Si rắn B2O3 rắn o H (kJ/mol) -859,3 0 0 -1264 298 o S (J/mol.K) 42,09 5,87 18,72 53,85 298 o
G (kJ) của phản ứng bằng : 298 a. +45,7 b. -45,7 c. +98,74 d. -98,74 84. Cho phản ứng
CH4 khí + 2 O2 khí ⇋ CO2 khí + 2 H2O lỏng a Biết CH4 khí O2 khí CO2 khí H2O Iỏng H o (kJ/mol) -74,848 0 -393,51 -285,84 298
∆H0 (kJ) của phản ứng bằng a. 890,34 b. -890,34 c. -74,848 d. 74,848 85.
Tính lượng nhiệt tỏa ra khi cho 1 lít khí hidro tác dụng với khí clor ở điều kiện tiêu D
chuẩn, biết sinh nhiệt tiêu chuẩn (nhiệt tạo thành tiêu chuẩn) Ho298,tt của HCllà -92,30 kJ/mol : a. -1,97 kJ b. -0,98 kJ c. -4,12 kJ d. -8,24 kJ 86.
Đối với một quá trình không thuận nghịch, năng lượng tự do G : D a. Luôn luôn bằng 0. b. Luôn luôn dương. c. Luôn luôn âm.
d. Dương hay âm tùy trường hợp. 87.
Đặc trưng tự diễn biến của môt quá trình được quyết định chủ yếu qua sự biến đổi C a. Entalpi. b. Entropi. c. Năng lượng tự do. d. Nhiệt độ. 88.
Một quá trình tự xảy ra có thể được định nghĩa là một quá trình : A
a. Có khả năng tự diễn tiến mà không cần tác động từ bên ngoài hệ. b. Xảy ra rất nhanh.
c. Luôn luôn có sự tỏa nhiệt.
d. Có khả năng xảy ra nhờ một chất xúc tác. 89. Cho phản ứng C2H6 khí + 7/2 O2 khí ⇋ 2 CO2 khí + 3 H2O lỏng D Các giá trị H o được cho như sau : 298 C2H6 khí CO2 khí H2O lỏng o H (kJ/mol) -85 -394 -286 298
Ho (kJ) của phản ứng trên có trị số là: a. Ho = 595 b. Ho = -595 c. Ho = 1561 d. Ho = -1561 90.
Trong một biến đổi kín thì: B a. H = 0 b. S = 0 c. G = 0 d. a, b, c đều đúng 91.
Cho các phương trình nhiệt hóa học sau: d H1 C2H4 (k) + 3 O2 (k) 2 CO2 (k) + 2 H2O (l) H2 C2H6 (k) + 7/2 O2 (k) 2 CO2 (k) + 3 H2O (l) H3 H2 (k) + 1/2 O2 (k) H2O (l) H4 C2H4 (k) + H2 (k) C2H6 (k)
Biết rằng các phản ứng trên đều thực hiện ở cùng một áp suất thì mối liện hệ giữa các
giá trị nhiệt động trên là:
a. H4 = H1 + H2 - H3 b. H4 = H1 - H2 -
c. H4 = H1 + H2 + H3 d. H4 = H3 - H2 + 92.
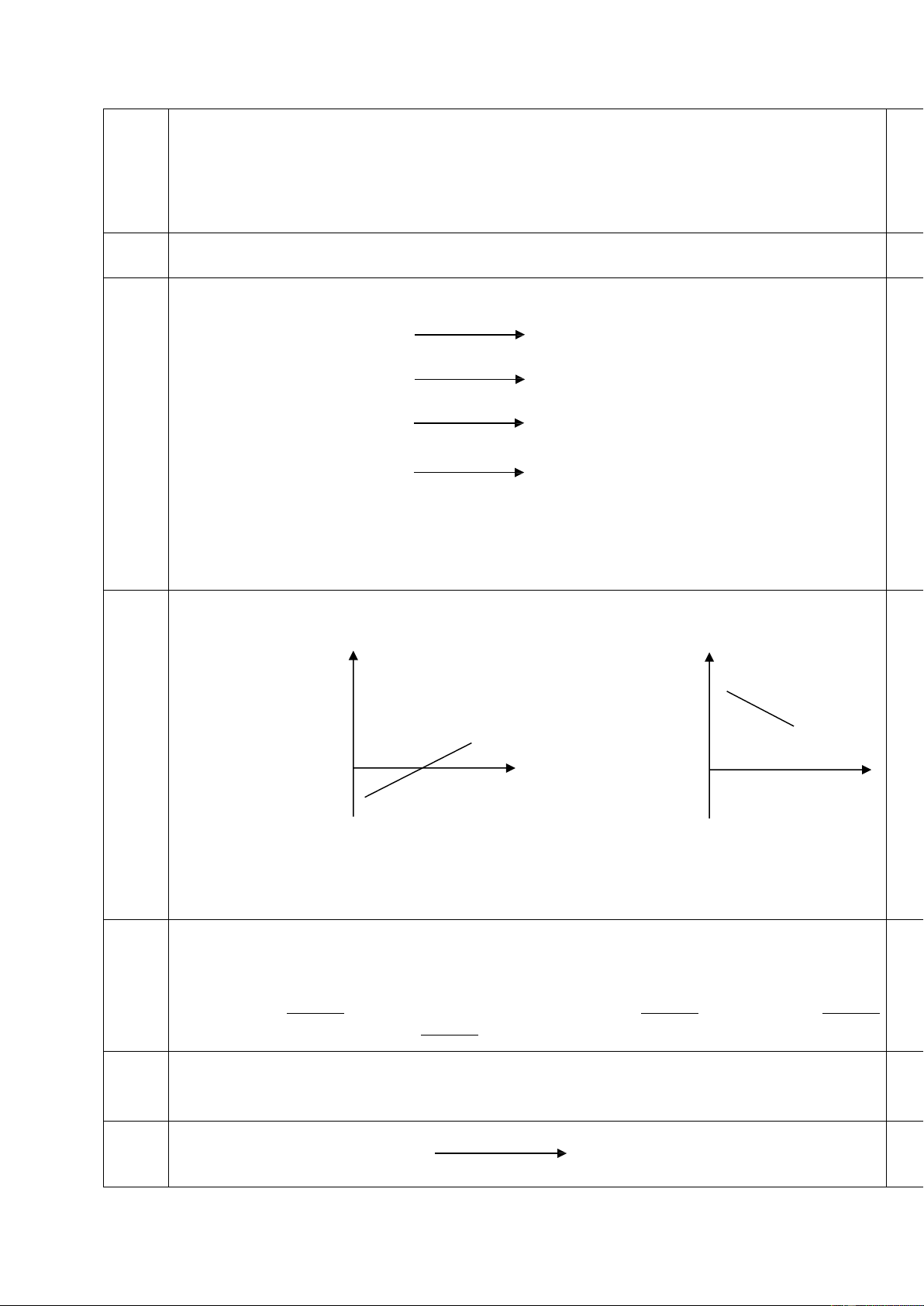
Giả sử H, S không phụ thuộc nhiệt độ, đồ thị biểu diễn sự phụ thuộc của G vào nhiệt độ b
của các phản ứng (1), (2) được mô tả bởi các hình vẽ sau: G G 0 T 0 T (1) (2)
Kết luận nào sau đây là đúng: a.
Phản ứng (1) có H < 0, S > 0; phản ứng (2) có H > 0, S < 0 b.
Phản ứng (1) có H < 0, S < 0; phản ứng (2) có H > 0, S > 0 c.
Phản ứng (1) có H > 0, S > 0; phản ứng (2) có H < 0, S < 0 d.
Phản ứng (1) có H < 0, S > 0; phản ứng (2) có H < 0, S < 0 93.
Giả sử H, S không phụ thuộc nhiệt độ. Ở nhiệt độ T1 thế đẳng áp của 1 phản ứng là G1, ở b
nhiệt độ T2 thế đẳng áp của phản ứng trên là G2. Vậy S của phản ứng trên được tính bởi công thức:
a. ∆𝑆 = ∆𝐺1−∆𝐺2 b. ∆𝑆 =
c. ∆𝑆 = ∆𝐺1+∆𝐺2
d. ∆𝑆 = ∆𝐺1−∆𝐺2 𝑇1−𝑇2 ∆𝐺1−∆𝐺2 𝑇1+𝑇2 𝑇1+𝑇2 𝑇2−𝑇1 94.
Để một phản ứng luôn xảy ra ở mọi điều kiện thì phản ứng đó phải có: A a.H < 0, S > 0 a. H > 0, S > 0 c.H < 0, S < 0 d.H < 0, S < 0 95. Cho phản ứng: B 2 NO2 (k) N2O4 (k)
Dấu H, S của phản ứng trên là: a. H < 0, S > 0 b. H < 0, S < 0 c. H > 0, S > 0
d. Không dự đoán được 96.
Một phản ứng thu nhiệt đang xảy ra, phát biểu nào sau đây là đúng khi nói về giá trị S của A phản ứng trên:
a. Phản ứng trên có S luôn luôn dương b.
Phản ứng trên có S luôn luôn âm
c. Phản ứng trên có S ≥ 0 d.
Không thể dự đoán dấu S dựa vào dữ kiện đã cho




