










Preview text:
10/5/2022
ĐẠI HỌC ĐÀ NẴNG
Mục tiêu học phần
TRƯỜNG ĐẠI HỌC BÁCH KHOA
Cung cấp một cách có hệ thống kiến thức cơ bản về cấu tạo các chất hóa
học, về sự tương tác và cách nhận thức vận động của chúng trong tự nhiên. HÓA ĐẠI CƯƠNG
- Giúp sinh viên nắm được một số quy luật về sự vận động của các chất,
từ đó dự đoán khả năng, chiều hướng và giới hạn của các quá trình hóa
học, những hiện tượng kèm theo cũng như các yếu tố thúc đẩy hoặc kìm hãm các quá trình đó.
TS. NGUYỄN HOÀNG MINH
Bộ môn: Công nghệ sinh học nhminh@dut.udn.vn 1 2 1 10/5/2022
Tài liệu tham khảo
Nội dung học phần 1.
Vũ Đăng Độ, Cơ sở lý thuyết các quá trình hóa học. NXB
- Chương 1: Các khái niệm và định luật cơ bản của hóa
Giáo dục, Hà Nội. 2006 học 2.
Vũ Đăng Độ, Trịnh Ngọc Châu, Nguyễn Văn Nội, Bài tập Cơ
sở lý thuyết các quá trình hóa học. NXB Giáo dục, Hà Nội.
- Chương 2: Cấu tạo nguyên tử và hệ thống tuần hoàn 2007 các nguyên tố hóa học 3.
Lê Mậu Quyền, Hóa học Đại cương. NXB GD Việt Nam
- Chương 3: Cấu tạo phân tử và liên kết hóa học 4.
Lê Mậu Quyền, Bài tập Hóa học Đại cương. NXB GD Việt Nam
- Chương 4: Nhiệt động học 5.
Bùi Thị Huệ, Bài giảng Cơ sở lý thuyết hóa học, NXB XD 2003
- Chương 5: Động hóa học và xúc tác
- Chương 6: Dung dịch và dung dịch điện ly - Chương 7: Hóa keo
- Chương 8: Điện hóa học 3 4 2 10/5/2022
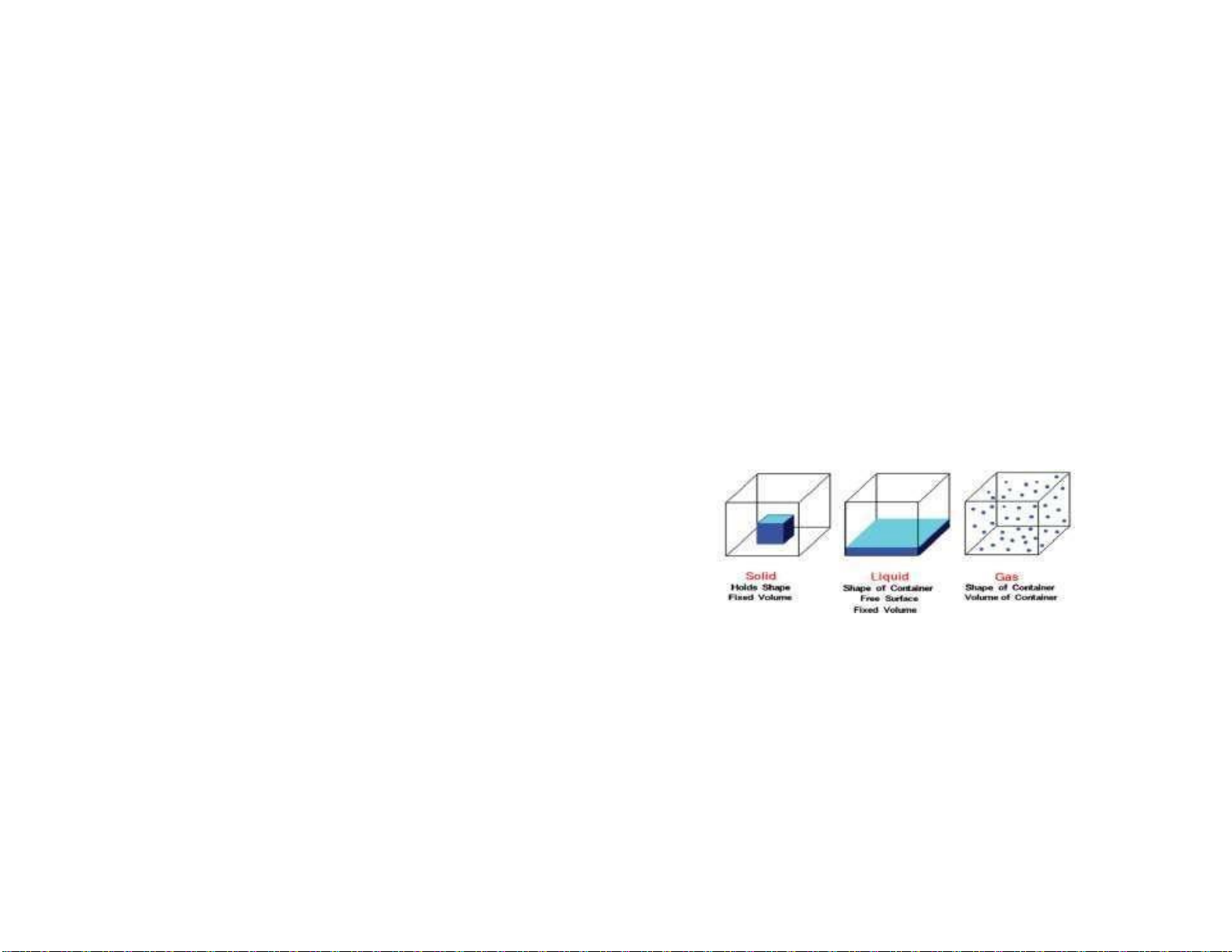
1.1. Giới thiệu chung 1.1. 1. Vật chất Chương - Rắn, lỏng, khí I
- Nguyên tố, nguyên tử, hợp chất, hỗn hợp - Kim loại, phi kim
MỘT SỐ VẤN ĐỀ CƠ SỞ CỦA HÓA HỌC 5 6 3 10/5/2022 1.1. 2. Nguyên tố 1.1. 5. Đơn chất
Là chất có cùng loại nguyên tử
Nguyên tố hóa học là dạng vật chất đơn giản nhất, chỉ chứa 1
loại nguyên tử và có những đặc điểm lý hóa riêng biệt 1.1. 6. Hợp chất 1.1. 3. Nguyên tử
Là chất gồm hai hay nhiều nguyên tố kết hợp với nhau theo một
tỉ lệ nhất định và có thể phân chia thành các chất nhỏ hơn bằng
Là một khái niệm chỉ một dạng tồn tại cụ thể của nguyên tố hoá phản ứng hóa học
học. Vì thế, khi nói đến nguyên tử cụ thể thì cũng có nghĩa là nói đế 1.1. 7. Hỗn hợp
n một nguyên tố hoá học
Chứa 2 hay nhiều chất khác nhau và có thể được phân tách bằng 1.1. 4. Phân tử phương pháp vật lý
Là một cấu tử độc lập do hai hay nhiều nguyên tử kết hợp với nhau 1.1. 8. Ion
Là phần tử tích điện tích âm hay dương 7 8 4 10/5/2022
1.1. 9. Đặc điểm vật lý và hóa học của vật chất
- Một hỗn hợp gồm nhiều chất khác nhau về đặc điểm vật lý có
thể tách nhờ phương pháp vật lý
- Đặc điểm vật lý: mùi, màu, nhiệt độ nóng chảy, độ dẫn điện,
khối lượng riêng. Sự thay đôi vật lý xảy ra khi một chất thay đổi
dạng vật lý của nó, không phải thành phần cấu tạo nên nó. Vì
vậy, sự thay đổi vật lý dẫn đến sự thay đổi đặc điểm vật lý khác biệt. VD. Đá tan chảy
- Đặc điểm hóa học là khi một chất thể hiện khi nó thay đổi
thành hay tương tác với một chất khác. Ví dụ, sự ăn mòn, phản
ứng acid. Sự thay đổi hóa học (phản ứng hóa học) xảy ra khi 1
chất bị biến đổi thành chất khác. 9 10 5 10/5/2022
1.1. 10. Năng lượng của Vật chất
- Thế năng: năng lượng do vị trí của vật
- Động năng: năng lượng do chuyển động của vật
Năng lượng không sinh ra và mất đi, nó chỉ chuyển từ dạng này sang dạng khác. 11 12 6 10/5/2022
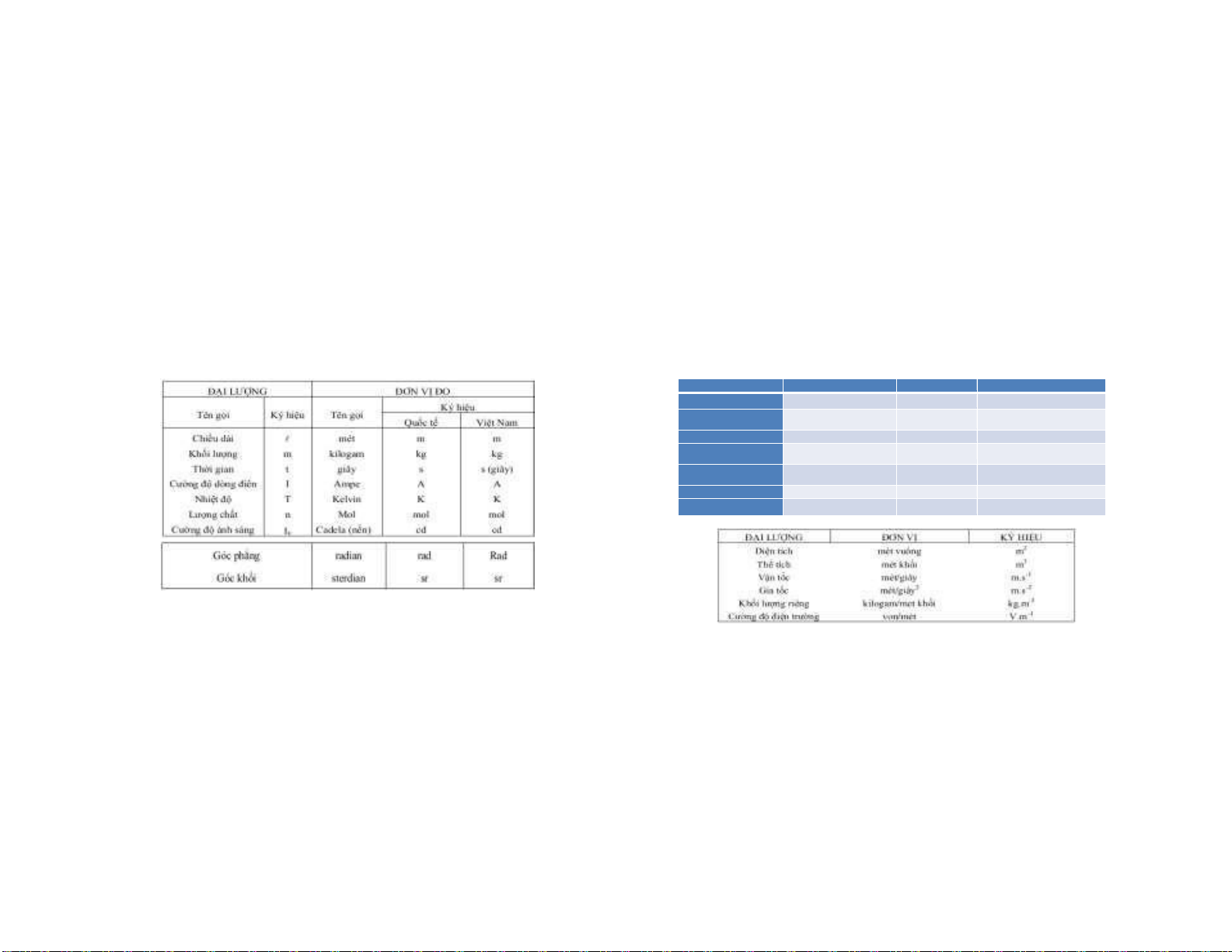
1.1.11. Hệ SI cơ sở Hệ SI mở rộng ĐẠI LƯỢNG ĐƠN VỊ KÝ HIỆU KHÁI NIỆM Lực Niuton (Newton) N kg.m.s-2 Áp suất Patean (Pascal) Pa N,m2 (hay kg.m-1.s-2) Năng lượng Jun (Joule) J kg.m2 .s-2 Công suất Oat (Watt) W J.s-1 (hay kg.m2 .s-3) Điện tích Culong (Coulomb) C A.S Điện thế Von (Volt) V J.C-1 (hay J.A-1 .s-1) Tần số Hec (Hertz) Hz s-1 13 14 7 10/5/2022
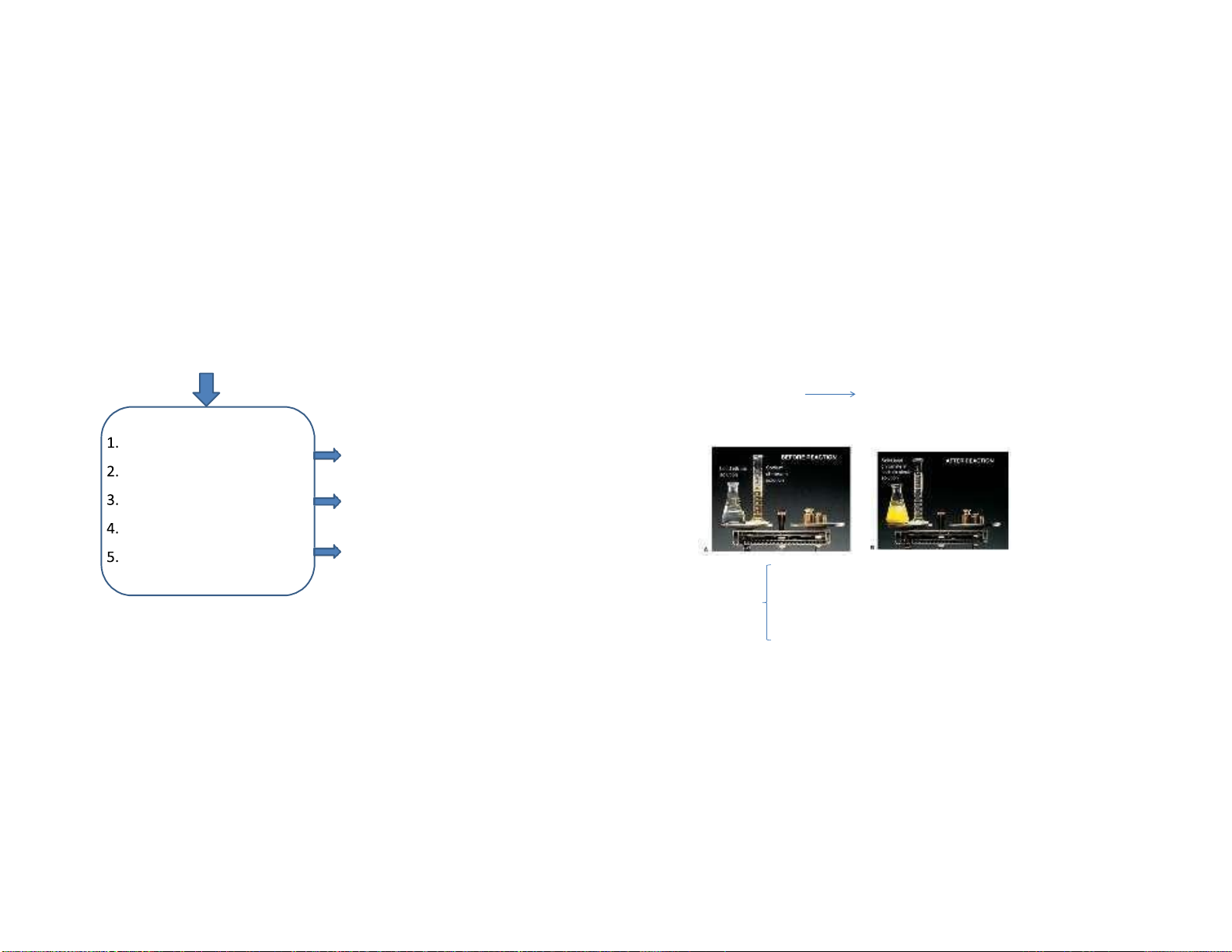
1.2.1. Định luật bảo toàn khối lượng
1.2. Các định luật cơ bản của hóa học
Khối lượng của sản phẩm phản ứng bằng khối lượng của các chất tham gia phản ứng Mg + 1/2O2 MgO m = m Mg + mO2 MgO
ĐL bảo toàn khối lượng
Học thuyết nguyên tử - phân tử
ĐL thành phần không đổi ĐL tỷ lệ bội
Tính toán định lượng trong hóa học ĐL tỷ lệ thể tích Hóa học hiện đại ĐL Avogadro
- Cân bằng phản ứng hóa học Ứng dụng:
- Tính khối lượng các chất trong phản ứng hóa học
- Cân bằng vật chất trong nhà máy hóa chất 1 1 5 6 15 16 8 10/5/2022
1.2.2. Định luật thành phần không đổi
1.2.3. Định luật tỷ lệ bội
Một hợp chất, dù được điều chế bằng cách nào cũng luôn có thành
Nếu 2 nguyên tố tạo thành với nhau một số hợp chất hóa học thì phần không đổi.
những phần khối lượng của nguyên tố này kết hợp với cùng một
Ví dụ: khí carbonic có thể điều chế bằng cách:
khối lượng của nguyên tố kia sẽ tỷ lệ với nhau như tỷ lệ của các số C + O2 nguyên đơn giản CO2
Xét 2 hợp chất được hình thành từ C và O, gọi là Carbon oxit I và carbon oxit II CaCO T 3
CO2 luôn có tỷ lệ khối lượng C và O
tương ứng là 27,3% và 72,7%
Mỗi hợp chất được đặc trưng
bằng một công thức hóa học. 1 1 7 8 17 18 9 10/5/2022
1.2.4. Định luật tỷ lệ thể tích
Ở cùng điều kiện nhiệt độ và áp suất, thể tích các khí phản ứng với
nhau, cũng như thể tích của các khí tạo thành trong phản ứng, tỷ lệ
với nhau như tỷ lệ của những số nguyên đơn giản.
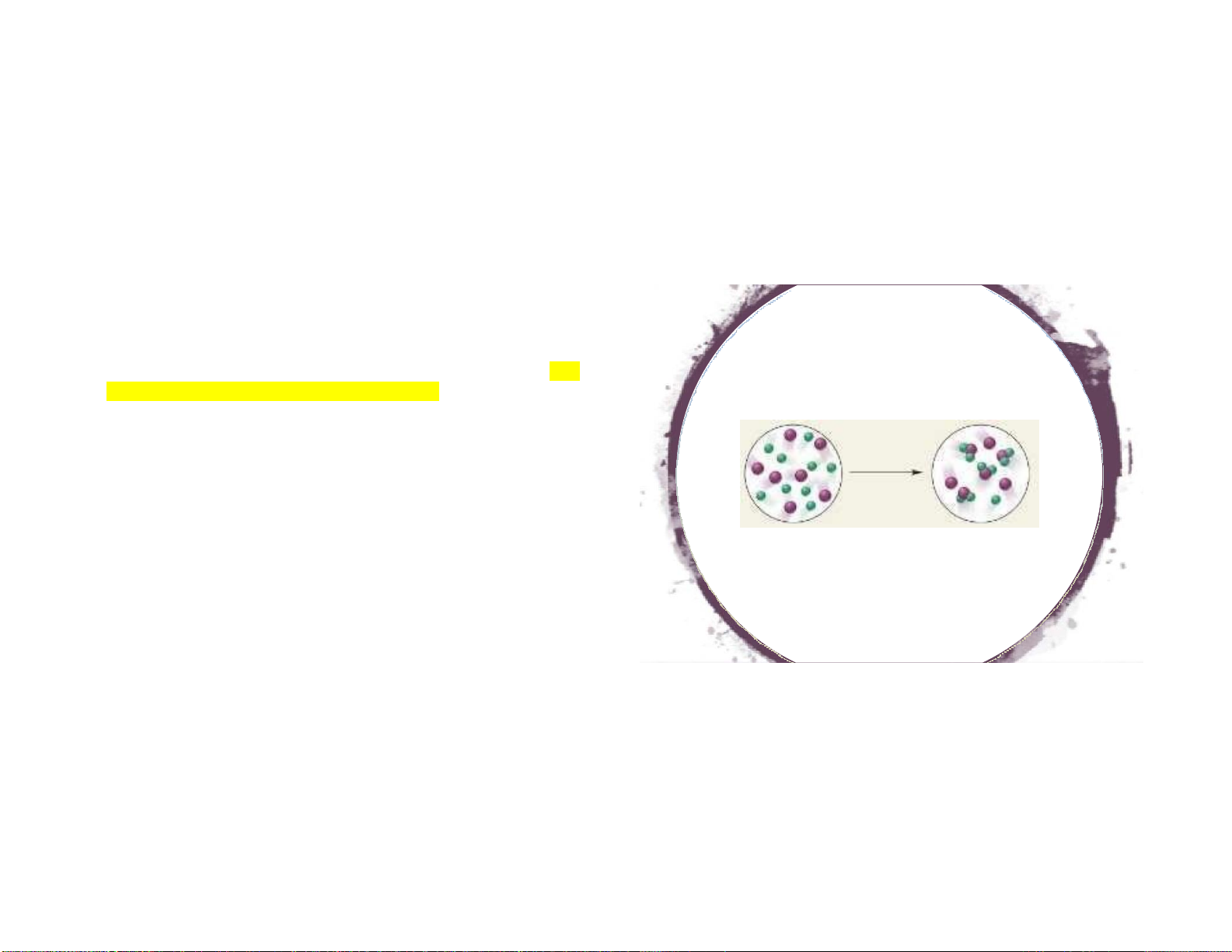
1.2.5. Định luật Avogadro
Ở cùng điều kiện nhiệt độ và áp suất, những thể tích bằng nhau
của các khí đều chứa cùng một số phân tử Hệ quả:
- Số Avogadro: Số phân tử chứa trong 1 mol chất. N = 6,023.1023 Đị
- Thể tích 1 mol khí ở đktc (P = 101325 Pa = 1,013 bar = 1 atm, T
nh luật nào được mô tả trong hình? = 273K) = 22,4 L
-Có thể dùng quy tắc tam suất để tính V khí tham gia p/ư và khí tạo thành 1 9 19 20 10 10/5/2022
1.3. Phương trình trạng thái khí
AD1: Xác định CTPT của một HC khí, biết rằng để đốt một thể tích khí
này cần 5 thể tích oxy và khi đốt một thể tích khí này cần 4 thể tích clo
1.3.1. Phương trình trạng thái khí lí tưởng
(sản phẩm là C và HCl). Các khí được đo ở cùng nhiệt độ và áp suất.
Khí lí tưởng: Là một loại khí tưởng tượng, có kích thước vô cùng nhỏ
(thể tích thực = 0) so với thể tích khối khí và không tương tác với nhau.
Phương trình trạng thái của khí lí tưởng: PV = nRT 2 2 1 2 21 22 11 10/5/2022
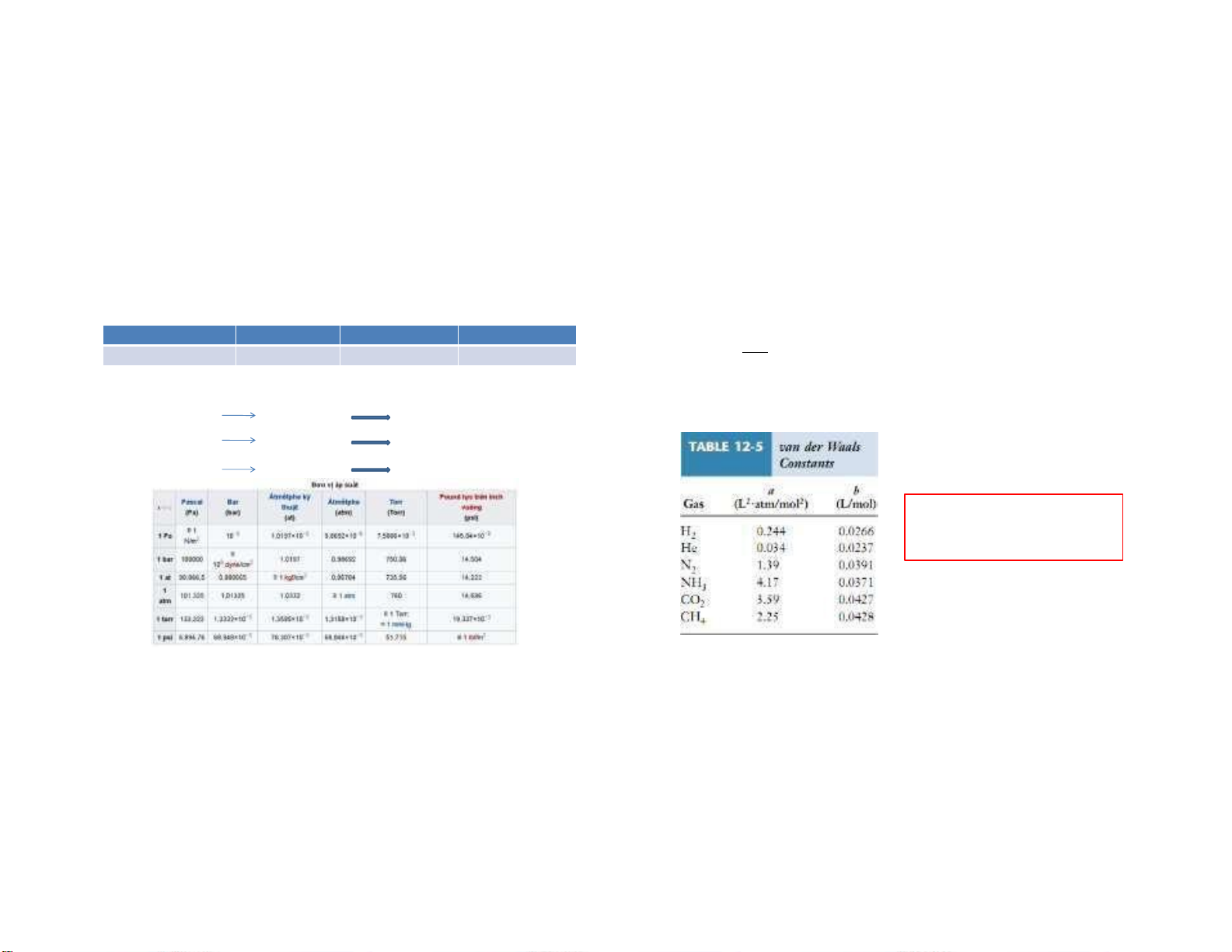
1.3.2. Phương trình trạng thái khí thực Đơn vị P, V N/m2, L Atm, L mmHg, mL n a 2 (P +
)(V − nb) = nRT
Phương trình van der Waals Giá trị R (/mol.K) 8,314 (J) 0,082 (L.atm) 62400 (mmHg.mL) V 2 Với n xác định:
a: Hằng số đặc trưng cho tương tác giữa các phân tử khí - Khi T = const PV = const Định luật Boyle
b: Hằng số đặc trưng cho kích thước của các phân tử khí - Khi P = const V1/T1 = V2/T2 Định luật Charles - Khi V = const P1/T1 = P2/T2 Định luật Gay-Lussac
Nếu không có chú thích gì thì
có thể xem các khí thực là lí tưởng 23 2 4 23 24 12 10/5/2022 k
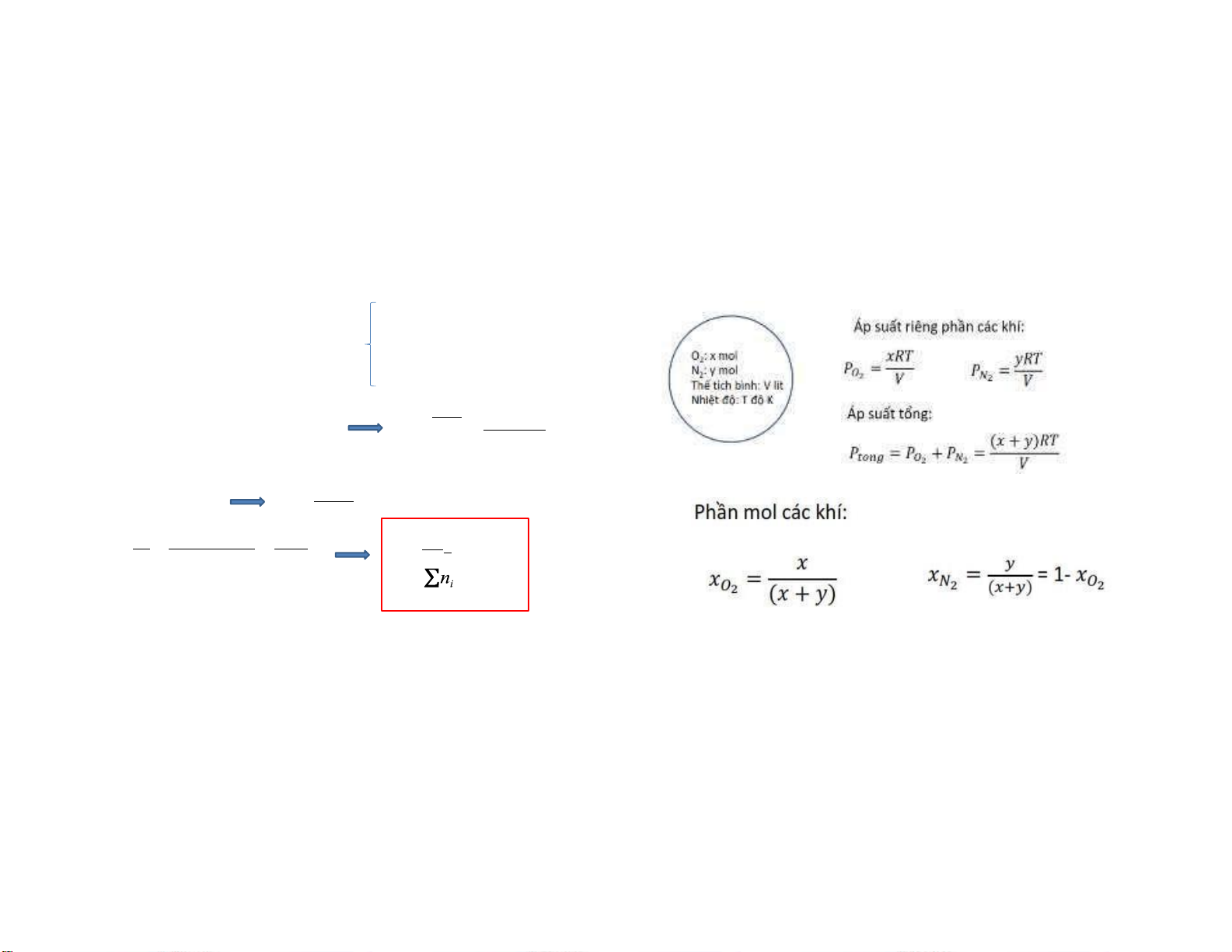
1.3.3. Khái niệm về áp suất riêng
Tổng số mol: n = Σ n i phần i=1
Hỗn hợp khí lí tưởng có: Áp suất: P Thể tích: V k Σn k nRT iRT
PV = nRT = Σn RT P = = i=1 i V V i=1
Áp suất riêng của khí i trong hỗn hợp là: PV = n RT RT P = ni i i i V
Pi = niTR /V = ni
P = n i P = x P k k Σ i k i P n Σn i RT /V i i=1 i=1 i=1
xi: nồng độ phần mol của khí i trong hỗn hợp 9 25 26 13 10/5/2022
AD2: Một bình 10L chứa 0,2 mol methane, 0,3 mol hydrogen, 0,4 mol
AD3: Một bình 15L chứa 6,65g N2 được nối với một bình có thể tích nitrogen ở 25oC.
6L chứa 5g O2. Mở van nối giữa 2 bình để các khí trộn lẫn vào nhau.
Hãy xác định áp suất riêng phần của mỗi khí và áp suất tổng cộng ở
a) Tính áp suất trong bình (đơn vị atm) nhiệt độ 25oC
b) Tính áp suất riêng phần của mỗi cấu tử khí trong hỗn hợp 27 28 27 28 14 10/5/2022
1.4. Cách biểu diễn nồng độ dung dịch
1.4. Cách biểu diễn nồng độ dung dịch
1.4.3. Nồng độ molan (m):
1.4.1. Nồng độ phần trăm
Là số gam chất tan có trong 100 gam dung dịch
Là số mol chất tan có trong 1kg dung môi
mct, mdm, mdd lần lượt là khối lượng chất tan, khối lượng dung môi và khối lượng dung dịch.
1.4.2. Nồng độ mol:
Là số mol chất tan có trong 1 lít dung dịch
n, V lần lượt là số mol chất tan và thể tích dung dịch (lít) 29 30 15 10/5/2022
1.4.4. Khái niệm về đương lượng
1.4.4.2. Đương lượng của các hợp chất
1.4.4.1. Đương lượng của các nguyên tố
a) Trong phản ứng trao đổi:
Đương lượng của 1 nguyên tố là số phần khối lượng của nguyên tố
Đương lượng của acid HnX bằng KLPT của acid chia cho số proton trao
đó kết hợp hay thay thế 1,008 phần khối lượng hydro trong các đổi phản ứng hóa học. H
Đương lượng của base M(OH)n bằng KLPT của hydroxide chia cho số 2 + 1/2O2 H2O
ĐLO = 8 (1 đương lượng) nhóm hydroxyl trao đổi Fe + 2HCl FeCl2 + H2 ĐLFe = 28
Đương lượng của muối MpXq bằng KLPT của muối chia cho tổng số
Đương lượng của 1 nguyên tố bằng KLNT của nguyên tố chia cho hóa
điện tích dương của các ion kim loại (hay tổng số điện tích âm của ion trị của nó gốc acid) ĐL = A/n
Nguyên tố có nhiều hóa trị khác nhau sẽ có nhiều giá trị
Ca(OH)2 + 2H3PO4 → Ca(H2PO4)2 + 2H2O
đương lượng khác nhau ĐLCa(OH)2 = 74/2 = 37
Đương lượng gam: khối lượng của chất đó biểu diễn bằng gam có trị ĐLH3PO4 = 98/1 = 98
số bằng đương lượng của nó. ĐLO = 8g 12 32 31 32 16 10/5/2022
b) Trong phản ứng oxy hóa – khử:
Đương lượng hợp chất bằng KLPT của hợp chất đó chia cho
số electron mà nó trao đổi
2KMnO4 + 5H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 5O2 + 8H2O ĐLKMnO4 = 158/5=31,6 ĐLH2O2 = 34/2 = 17
1.4.4.3. Nồng độ đương lượng
Nồng độ đương lượng được biểu diễn bằng số đương lượng gam
chất tan trong 1 lít dung dịch. Kí hiệu là N.
Trong phản ứng hóa học: N1V1 = N2V2 33 34 33 34 17 10/5/2022
AD 5: Asen tạo thành 2 oxide, trong đó 1 oxide chứa 65,2% As
AD 4: Xác định đương lượng của kim loại và của lưu huỳnh
và oxide còn lại chứa 75% As. Biết đương lượng của oxy = 8.
biết nếu 3,24g kim loại tạo thành 3,48g oxide và 3,72g sulfua.
Xác định đương lượng của As trong các oxide
Biết đương lượng của O = 8. 35 36 35 36 18 10/5/2022
AD 6: Nhiệt đốt cháy của CH4 và C2H6 lần lượt là 890,35 kJ/mol và
AD 7: Một hệ thống thiết bị phản ứng gồm 2 bình ghép nối tiếp. Bình
1559,88 kJ/mol. Trong kĩ thuật phẩm chất của nhiên liệu được đánh
1 có thể tích 2,125 L chứa SO2 ở áp suất 2,750 atm, bình 2 có thể tích
giá qua lượng nhiệt giải phóng bởi một đơn vị khối lượng hỗn hợp
1,500 L chứa O2 ở áp suất 0,5 atm. Cả 2 khí đều ở nhiệt độ 80oC.
cháy. Chất nào sẽ là nhiên liệu tốt hơn khi:
Người ta mở van để 2 bình thông với nhau.
a) Oxy được lấy từ bên ngoài
a) Xác định nồng độ phần mol của SO2 trong hỗn hợp, áp suất tổng
b) Oxy được dự trữ cùng với chất cháy.
và áp suất riêng phần các khí trong hỗn hợp khi giả thuyết chưa
xảy ra phản ứng giữa SO2 và O2.
b) Dẫn hỗn hợp khí vào xúc tác để xảy ra phản ứng tạo thành SO3,
sau đó hỗn hợp phản ứng được dẫn quay lại hệ thống 2 bình nói
trên. Hãy xác định nồng độ phần mol của các khí trong hỗn hợp
và áp suất tổng nếu phản ứng giữa SO2 và O2 được xem là hoàn toàn. 37 38 37 38 19




