
















Preview text:
Phạm Thành Lý- HĐC
Phần giữa kỳ bạn đọc sách, xem slide bgiang Phần CUỐI KỲ :
NHIỆT ĐỘNG LỰC HÓA HỌC
I/ Nguyên lý thứ nhất của nhiệt động lực học và nhiệt hóa học:
1. Nguyên lí thứ nhất của nhiệt động học:
Nguyên lí thứ nhất của nhiệt động học thực chất là định luật bảo toàn năng lượng: Năng
lượng của một hệ cô lập luôn luôn bảo toàn. Biểu thức tổng quát : ∆U = Q - A (1)
Hệ tỏa nhiệt hoặc sinh công thì: Q < 0, A > 0.
Hệ thu nhiệt hoặc nhận công thì: Q > 0, A <0. 2. Nhiệt hóa học:
Trong phản ứng hóa học thường gặp dạng công giãn nở: A = P ∆V= ∆nRT QP = ∆H QV = ∆U P Q 1 T = nRTln(V /V 2 ) 1 =nRTln P 2
c. Quan hệ giữa nhiệt đẳng tích và nhiệt đẳng áp:
Từ (2‟) : ∆H = ∆U + P ∆V = ∆U + ∆nRT QP = QV + ∆nRT (5)
∆n: biến thiên số mol khí trong quá trình phản ứng.
T: nhiệt độ tuyệt đối (K).
R: hằng số khí với R = 8,314 J/mol. K = 1,987 cal/mol.K = 0,082 l.atm/mol.K
- Đối với phản ứng xảy ra ở pha rắn, lỏng : ∆n = 0 nên QP = QV
- Đối với phản ứng xảy ra ở pha khí: QP = QV + ∆nRT
3. Các trạng thái chuẩn: 1
Phạm Thành Lý- HĐC
- Trạng thái chuẩn ở nhiệt độ T của chất khí là trạng thái của khí đó được coi là khí lý tưởng
ở nhiệt độ T và áp suất chuẩn 1 atm.
- Trạng thái chuẩn ở nhiệt độ T của chất lỏng hoặc tinh thể là trạng thái của chất đó ở nhiệt
độ T và áp suất chuẩn 1 atm.
- Điều kiện chuẩn của phản ứng: 25oC (298 K), 1 atm.
∆H được tính ở điều kiện chuẩn cho 1 mol chất kí hiệu là: ∆Ho2 98 .
∆H ở nhiệt độ T(K), 1atm kí hiệu là: ∆HoT . ∆Ho T( đơn chất ) = 0.
4. Phương pháp xác định hiệu ứng nhiệt của các phản ứng hóa học:
a. Dựa vào định luật Hess và các hệ quả của định luật Hess:
a.1) Định luật Hess:
Hiệu ứng nhiệt của một phản ứng hóa học chỉ phụ thuộc vào bản chất và trạng thái của các
chất phản ứng và sản phẩm phản ứng chứ không phụ thuộc vào cách tiến triển của quá trình, nghĩa là
không phụ thuộc vào số lượng và đặc trưng của các giai đoạn trung gian.
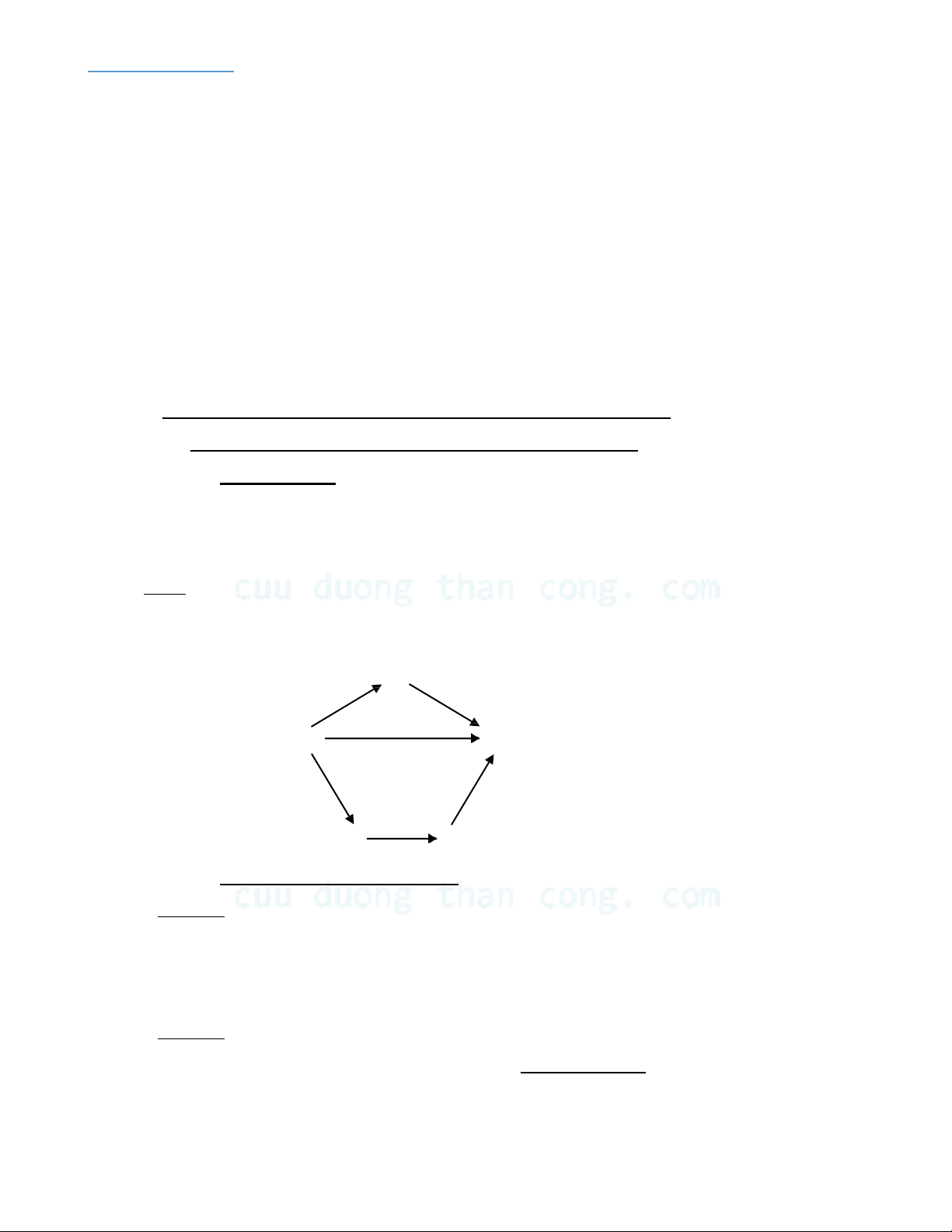
Ví dụ: Giả sử có 3 cách chuyển hệ từ trạng thái đầu X đến trạng thái cuối Y ứng với các hiệu
ứng nhiệt theo sơ đồ sau:
Theo định luật Hess ta có : ∆H = ∆H1 + ∆H2 = ∆H3 + ∆H4 + ∆H5 A ∆H1 ∆H2 X Y ∆H ∆H3 ∆H5 B C ∆H4
a.2) Các hệ quả của định luật Hess: * Hệ quả 1:
Hiệu ứng nhiệt của phản ứng thuận bằng hiệu ứng nhiệt của phản ứng nghịch nhưng ngược dấu
∆H thuận = - ∆H nghịch (6) * Hệ quả 2:
Hiệu ứng nhiệt của một phản ứng bằng tổng nhiệt tạo thành của sản phẩm trừ tổng sinh nhiệt của chất đầu. 2
Phạm Thành Lý- HĐC ∆Hphản –
ứng = Σ ∆Hs(sản phẩm) Σ ∆Hs(chất đầu) (7) * Hệ quả 3:
Hiệu ứng nhiệt của một phản ứng bằng tổng nhiệt đốt cháy của các chất đầu trừ tổng thiêu nhiệt của sản phẩm. ∆Hphản –
ứng = Σ ∆Ht(chất đầu) Σ ∆Ht(sản phẩm) (8)
b. Dựa vào năng lượng liên kết:
Phản ứng hóa học về bản chất là phá vỡ liên kết cũ và hình thành liên kết mới. Do đó, tại
nhiệt độ T và áp suất không đổi, ta có: ∆Hphản –
ứng = Σ Ei đầu Σ Esản phẫm (9) t t th a n g _ h o a H H H H p tu _ S i O 2 S i p li _ O
m a n g _ t th e _ n g tu _ S i O 2 2 1 H t t H th o a H p ly H H H N a C l N a C l N a C l N a C l 2 2 t t th o a 3 p ly 1 p ly
t t _ n g u y e n _ tu C H C l
t t _ n g u y e n _ tu C H C l H H H H H 3 ; H 3 3 E E C H C l C H C l C H C l C H C l C H C C l 3 2 2 2 2 3 3 CP = CV + R
∆HT2 = ∆HT1 + ∆CP(T2 – T1)
b.2) Trường hợp đẳng tích:
Xét tương tự trường hợp trên với dU = CV dT , ta được: T 2
∆HT2= ∆HT1 + ∆Cv dT(13) T 1
Nếu ∆CV không phụ thuộc vào nhiệt độ thì:
∆HT2 = ∆HT1 + ∆CV(T2 – T1) * P = const T 2 S p T 1 Với Cp là hằng số: T 2 S C ln (9) T1 3
Phạm Thành Lý- HĐC * V = const T S C ln 2 (10) v v T1
(Cv là hằng số trong khoảng T1, T2).
của khí lý tưởng: V T S n R ln 2 n C ln 2 (Cv=const) (11) v V T 1 1 P T Hoặc: S n R ln 1 n C ln 2 (Cp=const) (12) p P T 2 1
2. Thế nhiệt động G và F:
Đối với phản ứng hóa học diễn ra ở điều kiện chuẩn thì: G0 = G0ht.sản phẩm - G0ht.chất đầu (15) Ở đây,
là biến thiên năng lượng tự do chuẩn của sự hình thành hợp chất từ các đơn
chất. Đối với đơn chất = 0.
III/ Cân bằng hóa học:
1. Định luật tác dụng khối lượng:
Định luật tác dụng khối lượng là biểu thức toán học về những điều kiện cụ thể xác định cân
bằng hoá học. Giả sử nghiên cứu phản ứng có dạng tổng quát sau đây: Δ n Δ n
b. Đối với những phản ứng dị thể có sự tham gia của chất khí: aA(r) + bB(k) = gG(k)
Hằng số cân bằng Kp được biểu thị qua áp suất riêng phần lúc cân bằng: g P G K = P b P B
Trong trường hợp phản ứng xảy ra trong dung dịch loãng: 4
Phạm Thành Lý- HĐC ν ' ν ' 1 2 B B . . . 1 2 K = C ν ν 1 2 A A . . . 1 2
[ ] biểu thị nồng độ mol lúc cân bằng.
- Trong một khoảng nhiệt độ T1 – T2 không lớn, nếu giá trị hiêụ ứng nhiệt H của phản ứng
hoá học được chấp nhận không đổi thì phép tích phân cho kết quả sau:
3. Sự chuyển dịch cân bằng hoá học. Nguyên lí Le Chatelier (Lơ Satơliê):
a. Khái niệm về sự chuyển dịch cân bằng hoá học. Nguyên lí Le Chatelier:
Mọi sự thay đổi của các yếu tố xác định trạng thái của một hệ cân bằng sẽ làm
cho cân bằng chuyển dịch về phía chống lại những thay đổi đó.
Chúng ta sẽ minh họa nguyên lí này qua việc xét ảnh hưởng của sự thay đổi (tăng hay giảm)
nồng độ của các chất phản ứng và sản phẩm phản ứng, nhiệt độ và áp suất.
b. Ảnh hưởng của nồng độ:
Giả sử có phản ứng: aA + bB □ cC + dD C c .C d Δ G o o C D = Δ G + RTlnK = ΔG + RTln c a b C .C A B Lúc cân bằng ΔG = 0. Như vậy:
- Khi tăng nồng độ của các chất phản ứng cân bằng sẽ chuyển dịch từ trái sang phải và ngược lại
- Khi tăng nồng độ của các chất sản phẩm phản ứng cân bằng sẽ chuyển dịch từ phải sang trái.
c. Ảnh hưởng của nhiệt độ:
Từ phương trình: ∆G0 = ∆HO - T∆SO = -RTlnK
Khi tăng nhiệt độ thì cân bằng đều chuyển dịch về phía phản ứng thu nhiệt, giảm thì theo chiều tỏa nhiệt.
d. Ảnh hưởng của áp suất:
Khi tăng áp suất chung của cả hệ, cân bằng sẽ chuyển dịch về phía có số phân tử khí ít hơn để chống lại
sự tăng của áp suất. Và ngược lại, khi giảm áp suất chung của cả hệ, cân bằng sẽ chuyển dịch về phía
có số phân tử nhiều hơn. 5
Phạm Thành Lý- HĐC
Xét cân bằng pha ở trạng thái P1, T1 và P2, T2 thì (**) có dạng: P H 1 1 ln 2 P R T T 1 1 2 IV/ Dung dịch:
1. Nồng độ phần trăm khối lượng: C% là số gam chất tan có trong 100g dung dịch. (đơn vị: %) m C % ct x1 0 0 % m dd Trong đó:
- C% là nồng độ phần trăm khối lượng. (%)
- mct là khối lượng chất tan. (g)
- mdd là khối lượng dung dịch. (g)
2. Nồng độ mol: CMlà số mol chất tan có trong 1lít dung dịch. (đơn vị: mol/l) V Trong đó:
- CM là nồng độ mol. (mol/l)
- n là số mol chất tan. (mol)
- V là thể tích dung dịch. (l)
3. Nồng độ đương lượng gam: CNlà số đương lượng gam chất tan có trong 1 lít dung dịch. (đơn vị: đlg/l)
4. Nồng độ molan: milà số mol chất tan i có trong 1 kg dung môi. (đơn vị mol/kg)
5. Nồng độ phần mol:Xilà tỉ số giữa số mol của cấu tử i chia cho tổng số mol chất có trong dung dịch. n i X i n i 6. Độ tan:
- Là số gam chất tan tan trong 100g dung môi cho dung dịch bão hòa tại nhiệt độ xác định.
- Là số gam chất tan có trong 1lít dung dịch bão hòa. 6
Phạm Thành Lý- HĐC
- Định luật Henry về độ tan của chất khí trong chất lỏng:
Nếu C là nồng độ chất khí trong chất lỏng và P là áp suất riêng của khí thì: C=k.P, với k là
hệ số Henry, chỉ phụ thuộc vào nhiệt độ.
7. Áp suất thẩm thấu:
Định luật Van‟Hoff về áp suất thẩm thấu của dung dịch: .V = n RT hay: = i.R C T
Trong đó:- π: áp suất thẩm thấu. (atm)
- n: số mol chất tan. (mol)
- V: thể tích dung dịch. (l)
- C: nồng độ mol chất tan. (mol/l)
- T: nhiệt độ tuyệt đối. (0K)
- R: hằng số khí. (R = 0,082 atm.l/mol.0K)
8. Định luật Raoult I: “Độ giảm tương đối áp suất hơi bão hòa của dung môi trên dung dịch
bằng phần mol chất tan không bay hơi”. 0 p p p n A A B X 0 o B p p n n A A B Trong đó: - 0
p : là áp suất hơi của dung môi nguyên chất. A
- pA: là áp suất hơi của dung môi. - nB: số mol chất tan. - nA: số mol dung môi. - XB: phần mol chất tan.
Với những dung dịch rất loãng ta có: n n X B => p B n n A A
9. Độ tăng điểm sôi của dung dịch: t = i.K s s . Cm 7
Phạm Thành Lý- HĐC Trong đó:
- T : là độ tăng điểm sôi của dung dịch. s 2 s
- Ks: hằng số nghiệm sôi; với: K c o n s t . s
- Cm: nồng độ molan của chất tan.
10. Độ hạ băng điểm của dung dịch: t = i.Kdd . Cm dd Trong đó: -
: là độ hạ băng điểm của dung dịch. 2 b
- Kb: hằng số nghiệm lạnh; với: K c o n s t . b 1 0 0 0 n c , A
11.Định luật Raoult II: “Độ tăng nhiệt độ sôi và độ hạ nhiệt độ đông đặc của dung dịch loãng
chất tan không điện ly tỉ lệ thuận với nồng độ molan chất tan trong dung dịch”. 0 p p p n A A B X
, X là phần mol của chất tan k bay hơi 0 o B p p n n A A B
12. Độ điện ly: là đại lượng đặc trưng cho mức độ điện ly của một chất. Nó là tỉ số giữa nồng
độ chất đã điện ly với nồng độ hòa tan. x 1 0 0 % 0 Trong đó: - : độ điện ly. -
: là nồng độ chất đã điện ly. - : là nồng độ hòa tan.
Notes: Quá trình sonvat hóa làm giảm độ hỗn loạn S
0 , quá trình hòa tan khí vào lỏng thì
, còn rắn vào lỏng thì S 0 .
13. Hằng số điện ly: 8
Phạm Thành Lý- HĐC 2 Nếu □ 1 ta có: 1- 1 thì: .
b. Phương pháp xác định hằng số tốc độ ở 2 nhiệt độ: k T lg 2 k 2 , 3 0 3 R T T T 1 2 1
b. Thuyết phức chất hoạt động:
Thuyết này vẫn giữ nguyên những luận điểm cơ bản của thuyết va chạm hoạt động song có
phát triển thêm ý kiến cho rằng trong quá trình phản ứng xuất hiện một sản phẩm trung gian tạm thời
gọi là phức chất hoạt động. Giữa phức chất hoạt động và các chất tham gia phản ứng và các sản phẩm
có cân bằng và cân bằng này có thể được nghiên cứu bằng con đường nhiệt động thông thường. Thực
vậy nếu A và B là các chất đầu, C và D là các sản phẩm, X là phức chất hoạt động (sản phẩm trung
gian trước khi phân hủy thành sản phẩm) thì cân bằng sau được thiết lập:
Phản ứng dây chuyền: a. Định nghĩa:
Phản ứng dây chuyền là loại phản ứng phức tạp, trong đó có sự hình thành các tiểu phân
hoạt động (những gốc hay nguyên tử tự do). Những tiểu phân hoạt động này tham gia vào phản ứng và
lại tạo ra những tiểu phân hoạt động mới. Những tiểu phân mới này lại lặp lại quá trình trên làm cho
phản ứng phát triển xa hơn. K T T 2 1
a. Quy tắc Van’t Hoff: T 2 10 = v2/v1 K T dạng tíc h phâ n: (H ệ thức Arrhe n ius) 9
Phạm Thành Lý- HĐC
Tích số tan:Đặc trưng cho sự phân ly của chất điện ly khó tan (mức độ tan ra) Đọc SGK: 421 -423. T A B S m n m n ( m n ) m n .f A B m n
+ T càng nhỏ càng khó tan (pT càng lớn càng ít tan )
+ Thêm ion chung-→ giảm độ tan
+ T fu thuộc vào hệ số hoạt độ (hoạt độ lại phụ thuộc vào lực ion, lực ion tăng làm giảm hệ số hoạt độ) S phụ
thuộc vào dmoi, bản chất chất điện ly,nhiệt độ, lực ion.
+ Khi thêm ion lạ vào dd chất điện ly khó tan: nếu ion lạ tạo kết tủa với 1 loại ion trong chất điện ly đó, tạo chất
kém điện ly, chất bay hơi…thì S tăng lên. Nếu k có phản ứng gì thì S TĂNG lên do hệ số hoạt độ tăng.
+ Cho chất A+ B fan ly ra ion , nếu: m n n m [ C ] .[ D ] T
: Kết tủa không xuất hiện C D n m Ngược lại: m n n m [ C ] .[ D ] T : xuất hiện kết tủa C D n m
Phương Pháp Giải Bài Tập
1. Tìm nồng độ ion bão hòa, phân ly khi biết T (suy ra pH…); mối quan hệ giữa T và S
(14.4 ;14.8 - SBT)
2. Cho T, CM của các ion muối. Tìm pH tại đó bắt đầu xuất hiện kết tủa (OH - ) ; p H 1 4 O H
3. Cho CM hỏi có kết tủa hay không?(14.14- SBT)
4. Ion nào kết tủa trước, kết tủa sau cùng? (VD 14.15) Chương IV: ĐIỆN HÓA HỌC
Cân bằng ptrinh oxh-khu trong pin:
2HNO3 + 3H2S → 2NO + 3S + 4H2O H+ + Cr 2- 2+ 2O7 +Fe →
KMnO4 + H2S + H2SO4→ MnSO4 + S + K2SO4 + H2O MnO - 4 + 8H+ + 5e → Mn2+ + 4H2O H2S – 2e → S + 2H+ 10
Phạm Thành Lý- HĐC => 2MnO -
4 + 16H+ + 5H2S → 2Mn2+ + 8H2O + 5S + 10H+
Hay: 2KMnO4 + 5H2S + 3H2SO4→ 2MnSO4 + 5S + K2SO4 + 8H2O Anod (cực âm): qt oxh
Catod(cực dương): qt khử ; electron từ âm sang dương, dđ thì ngược lại. E = [ O x h ] o o ; o lo g ([Oxh]+ne [Khu]) n [ K h u ] 16.5 (SBT) ( A n o d : H 2 H O 2 e □ 2 H O 2 ( k ) 2 ( l) 3 ( d d ) C a to d : 2 H O 2 e H 2 H O 3 2 ( k ) 2 ( l) 2 2 0 , 0 5 9 [ H ] 0 , 0 5 9 [ H ] o o lo g 0 , 0 5 9 p H ; lo g 0 ; E V ( ) ( ) p in 2 P 2 P H H
a. Sức điện động tăng khi pha loãng vì pH tăng (tăng độ điện ly) 2 0 , 0 5 9 [ H ]
b. Thế điện cực (2) giảm khi [H+] giảm vì pH giảm o lo g 0 , 0 5 9 p H ( 2 ) 2 P H 2
c. Nếu điện cực làm bằng kim loại thì nơi xảy ra qt oxh thì điện cực tan ra. Tại điện cực (1) có khí H2 bay ra. Pin điện
+ Viết sơ đồ pin: nào âm, dương(anod- catod)? + Phương trình Nerst, 1 0
, nói chung lấy cái lớn trừ cái nhỏ + Ảnh hưởng của pH:
Vd: Tính thế oxh – khử của cặp 3 3 A s O / A s O
trong môi trường pH = 8. Biết 4 3 3 3 A s O 2 H 2 e □ A s O H O ; E
pH tăng thế khử tc giảm, khả năng oxh của… giảm,tính khử của… tăng.
+ Ảnh hưởng của sự tạo thành hợp chất ít tan:
Vd: Đánh giá khả năng phản ứng của Cu và Ag+ khi có dư Cl- : Cu +2Ag+ = 2Ag + Cu2+ 11
Phạm Thành Lý- HĐC
Gợi ý - Lời giải ngắn gọn Đá p án
Ag+ +e □ Ag ; Ag+ + Cl -+e □ AgCl ; E0 „ AgCl/Ag+= E0 Ag+/Ag+0,059 log[Ag+].[Cl- ]= E0 Ag+/Ag+0,059logT
= 0,799 + 0,059 log 10 -9,75= 0,224 V < E0 của Cu2+/Cu (0,34V)
Vd: Tính thế điện cực tiêu chuẩn của Cu2+/Cu+ khi có mặt ion OH- .Cho 0 1 9 , 6 6 3 , 5 1 0 ; T 1 0 C u ( O H ) C u ( O H ) 2 C u / C u o x h
Biểu thức kinh nghiệm: 0 , 0 5 9 lo g o x h .......................... k h u T T
1 ................................................ 2 Cu2++e □ Cu+, Ce4++e Ce3+ 1 9 , 6 6 Vậy 1 0 0 0 C u ( O H ) 0 , 0 5 9 lo g 2 0 , 1 6 0 , 0 5 9 lo g . . . .V 3 , 5 C u / C u C u / C u T 1 0 C u ( O H )
+ Thế oxh –khử của chất khử liên hợp, không liên hợp(dd đệm thế ) (Ce, Fe )
+ Hỏi cặp này có thễ oxh cặp kia không? 0 0 n E n E + 0 1 1 2 2 E 3 n 3
+ Điện cực trơ (khí, điện hóa); hidro,kim loại
+ Kim loại tiếp xúc với một muối ít tan của nó trong dung dịch của một muối khác có cùng anion. T Ví dụ: 0 n 2 H g C l 2 2 ; H g 2 2 C l 0 , 0 5 9 T A g C l 0 - Điện cực Ag - AgCl Ag/AgCl, KCl E E lg 1 [ C l ] T 0 , 0 5 9 H g C l - Điện cực calomen: Hg/Hg 0 2Cl2, KCl: E E lg 2 2 2 2 C l 12
Phạm Thành Lý- HĐC 1. Thế - Lấy sau – đầu đẳng B
- Nhớ nhân hệ số pt; 2 3 7 .2 3 9 4 , 4 5 0 , 7 8 1 7 , 7 k J áp 2. Pin
( ) A g A g ( A g B r ) A g 0 , 0 1 M ( A g N O ) A g ( ) 3 điện 0 0 0 , 0 5 9 lo g [ A g ] ; 0 , 0 5 9 lo g [ A g ] hóa 1 2 C 0 , 0 5 9 0 , 0 5 9 (Pin 7 E lo g 0 , 0 1 lo g [ A g ] 0 , 2 4 5 V [ A g ] 7 . 1 0 p in ( ) ( ) 2 2 nồng 1 1 2 1 3 độ) T ( [ A g ] ) 4 , 9 5 . 1 0 2 1 3 1 8 / 3 2 2 1 . 0 . 7 7 1 3 . 0 . 3 5 3 F e F e F e ; n . n . n . 0 , 9 8 V n n 3. C 3 3 1 1 2 2 2 2 3
-Chuyển về dạng pt ion. Viết Kcb. Thêm bớt cho xuất hiện K a,b , T… 14 4. [ H N O ] . [ N H O H ] K 1 0 B K 2 4 n cb 3 ,1 4 4 , 7 6 [ N H ] . [ N O ] K .K 1 0 . 1 0 4 2 a b H N O 2 N H 4 O H a. S chất khí giảm 5.
b. S phụ thuộc vào bản chất dung môi D
c. Cùng loại thì giảm S chứ 20 2 . 1 0 6. [ O H ] ; p H 1 4 lo g [ O H ] 5 A 0 , 0 2 7.
Luôn nhớ khi cho chất tan không bay hơi vào dmoi thì áp suất hơi bão hòa sẽ giảm C 8. C n ( ) ( ) ( ) 2 ( 0 , 7 7 0 ,1 5 ) 9. 21 C K 1 0 0 , 0 5 9 1 0 0 , 0 5 9 1 0 10.
Vì chúng cùng là chất ít bay hơi, i=1, k phân ly ra ion B
Trật tự: số ion phân ly tăng dần 0 tăng, 0 giảm 11. t t D s o i dd 6 2 . 1 0 12. S ; p H 1 4 lo g [ O H ] B OH 0 , 0 2 13.
Pha loãng độ điện ly tăng lên D 14. 2.Chưa chắc 3.Giảm G C 15. B 16. C 13
Phạm Thành Lý- HĐC K a 17. C C M 18. A i 1 0 , 8 4 19. D m 1 2
2. chất lỏng nguyên chất chứ k phải…dd lỏng 20.
4. giảm, chứ k phải…tăng… C
5. Phụ thuộc vào nhiều yếu tố nữa, nhưng P càng lớn khả năng bay hơi mới cao -Khó phân hủy: 21. H , dễ phân hủy H C m in m a x 22. D 23. Nhớ nhân 64 vì đv: J/K D 24. Lấy sau trừ đầu B 25. B 26. 6 H I H S O 3 I S 4 H O C 2 4 2 2 27.
càng lớn càng có tính OXH, càng nhỏ (âm) càng mang tính khử B
Cường độ: k pthuộc vào lượng chất (d,p,t, tfan..). Dung độ: thông số tỉ lệ với lượng chất 28. B (V, kg, mol, G …). 1, 1 1 .V . 1 0 0 0 29. 20 A 6 2 . 8 30. C 31. G
R T ln K p <0 phản ứng diễn ra tự phát D 32. G R T ln K p D 33. 2 H 3 1 0 , 4 k J B C u O 34.
Anod : xảy ra qt oxh; catod xảy ra quá trình khử. D 14
Phạm Thành Lý- HĐC ( )
A g A g 0 , 0 0 1 M A g 0 , 1 M A g ( ) ( 1 ) ( 2 ) o 0 , 0 5 9 A g A g e : lo g [ A g ] ( ) ( 1 ) A g / A g 1 o 0 , 0 5 9 A g e A g : lo g [ A g ] ( ) ( 2 ) A g / A g 1 0 , 1 0 , 0 5 9 lo g 0 , 1 1 8 V ( ) ( ) 0 , 0 0 1
Khi pin ngừng hoạt động:
và vì đây là pin nồng độ, pin ngừng hoạt động khi 2 ( ) ( )
nồng độ 2 điện cực bằng nhau và khi đó [Ag+ ] = 0 ,1 0 , 0 0 1 0 , 0 5 0 5 M 2 1, 8 6 . 1, 5 7 3 . 1 0 0 0 35. t i. k .C 2 . =10 B d d d m 5 8 , 5 . 1 0 36.
Trước – sau (phản ứng cháy- hợp chất hữu cơ) B 37.
Tăng nhiệt độ: thu nhiệt; hạ áp suất tăng số mol. (3) chỉ có 1 chất khí D 38. C 39.
Giảm nhiệt độ Kp tăng: tăng tốc độ p/ứng pứ tỏa nhiệt D 40. C 1 3 1 3 41. H H H 3 H . 9 4 6 . 4 3 6 3 . 3 8 8 3 7 k J C t t N H p lN p lH 3 2 2 lk N H 2 2 2 2 42. A C 3 0 2 7 , 2 2 , 8 k J / ; p m o l . K T 1 0 3 H H C d T 2 8 3 . 1 0 2 , 8 . ( T 2 9 8 )
. . . ? Tuy nhiện vì oxi không nguyên chất nên 2 9 8 K p T 0
nhiệt lượng đó là nhiệt cung cấp để đốt cháy, nâng nhiệt độ hỗn hợp gồm 1 . 8 0 / 2 0 2 m o l 43. D 2
N2 và 1 mol CO2 . Ta có pt sau: T T 2 8 3 0 0 0 1 . C ( C O ) d T 2 . C ( N ) d T ( T 2 9 8 ) .( 3 0 2 . 2 7 , 2 ) 2 8 3 0 0 0 T 3 6 5 1 K p 2 p 2 2 9 8 2 9 8 15
Phạm Thành Lý- HĐC ( )
P t ( r ) C l (1 M ) C l (1a tm ) C l ( k , 1 a tm ) C l ( 0 , 1 M ) P t ( ) (1 ) 2 2 ( 2 )
Điện cực khí cần có các thanh kim loại trơ (Pt…) để tạo mạch kín, truyền ion
+ Suất điện động giảm khi pha loãng dd ở điện cực 44. A
+Viết bên trái là anod – cực âm: xảy ra quá trình oxh; anod : xảy ra qt khử. ( ) : 2 C l 2 e C l ; ( ) : C l 2 C l 2 e 2 2
+ Suất điện đông của pin là : 1 1 1 0 , 0 5 9 lo g 0 , 0 5 9 lo g 0 , 0 5 9 lo g 0 , 0 5 9 V [ C l ] [ C l ] 0 , 1 ( 2 ) (1 ) V 2 45. A n R T ln ; A
0 :mới sinh công dãn nở , tăng số mol khí C V 1 Đề 6
Gợi ý - Lời giải ngắn gọnĐỀ 6 Đá p án n n 4 . 0 , 0 0 5 2 . 0 , 1 4 3 3 3 2 2 .n n n 0 , 1 5 V A 3 3 1 1 2 2 1 n 2 1 1 1 5 G G G 2 8 , 7 k J B 1 2 3 2 2 6 i ( m 1) 1 0 , 3 .( 3 1) 1 1, 6 C 7
Nhiệt tạo thành, năng lượng liên kết:sau – đầu; nhiệt đốt cháy: đầu - sau A 8
Ddịch chất tan không bay hơi mới được D 10 G H T . S 0 T 8 3 5 K D 2 x 2 1 2 1 2 3 2 2
2 H g O □ □□ □□ 2 H g O P P P ; P P K P . P . 4 K 2 K H g O p 3 x 3 2 3 3 3 9 9 16 11 a A 2x 2x x 256 G R T ln K 8 , 3 1 4 . ( 5 0 0 2 7 3 ) . ln 1 4 4 5 5 , 9 J p 27
Phạm Thành Lý- HĐC a-2x 2x x 1 . 1 0 0 0 12 t K .C 2 , 3 5 . 0 , 3 M 1 6 8 g / m o l D s s m M . 5 0 H 2 .E 1 .E 1 6 3 6 , 7 k J / m o l; H 2 E 4 3 5 , 5 k J / m o l; 2 9 8 K _ C H C H C C 2 9 8 K _ H H H 2 2 2 H 6 .E E 2 8 2 4 , 7 k J / m o l 2 9 8 K _ C H C H C C 2 6 H H 2 H H 2 8 2 4 , 7 2 . 4 3 5 , 5 1 6 3 6 , 7 3 1 7 k J 2 9 8 K _ C H 2 9 8 K _ H 2 9 8 K _ C H 2 6 2 2 2 Notes: 13 tt th an g _ h o a H H H H C p tu _ S i O 2 S i p li _ O 2
m an g _ tth e _ n g tu _ S i O 2
Năng lượng mạng ion NaCl: 1 t t th o a p ly p li io n d u o n g p ly io n a m m a n g _ t in h _ th e H H H H H H N a C l N a C l N a C l N a C l 2 2
Nhiệt tạo thành CH3Cl: 3 1 t t th o a p ly p ly
t t _ n g u y e n _ tu C H C l
t t _ n g u y e n _ tu C H C l H H H H H 3 ; H 3 3 E E C H 3 C l C H 2 C l 2 C H 3 C l C H 3 C l C H C C l 2 2
351,624-351,460 = 0,164 = i.1,19. 0 , 5 0 6 .1 0 0 0 15 2 2 , 4 6 . 1 7 6 C
So sánh entropy: entropy ít trường hợp bằng 0
+ Càng phức tạp: entropy càng lớn: O
3>O2>O (k); P trắng
+ Entropy của chất khí luôn lớn hơn lỏng>rắn: N2O5 ran < N2O (K) 16
+ Trong chu kỳ từ trái → phải: entropy có xu hướng giảm(kim loai ) và tăng khi càng về A
cuối: Vì entropy thể hiện mức độ hỗn loạn của hệ. Li hoat dộng hơn Be và Bo; Cl2 hoạt động hơn S
+ Dạng thù hình: graphit > kim cương
+ Nhiệt độ càng cao, áp suất càng nhỏ → entropy càng lớn m 17 i.R C T i.R . T A M 2 .(1 , 7 1 , 4 ) 19 10 K 1 0 0 , 0 5 9 1, 4 . 1 0 17
Phạm Thành Lý- HĐC 2 HCN CN-+H+;
0 , 0 8 5 0 , 8 5 . Ap dụng công thức: K C . M 0 , 1 1 23 D 0,1
CB:0,1-0,085.0,1 0,085.0,1 0,085.0,1 ; K= (0,085.0,1)2/(0,1-0,1.0,085)=7,9.10-4 1 1 1 t H H p h a n _ ly H H 1 2 Br 1 B r 2 2 2 B r ( lo n g ) B r ( k h i ) 2 B r ( k ) 2 2 2 2 0 H H
3 2 5 k J / m o l; B r ( k ) 1e B r ; H H 3 2 5 k J / m o l p h a n _ u n g 3 24 Br B r D 1 1 tt H H H H 3 2 5 0 , 5 . 1 9 0 3 1 . 0 , 5 2 1 4 . 5 kJ/mol Br 3 2 1 2 2 P 2 , 7 26 x P 0 , 6 2 5 D P 2 , 7 1 0 0 0 0 , 0 5 9 0 , 0 1 3 28 lo g ( ) 0 , 0 2 8 9 V n 2 D 3 n 1, 3 . 1 0 0 K H 1 1 29 n 2 ( ) B K R T T 1 1 2 T 30 11 [ O H ] 3 4 , 6 4 . 1 0 p H 1 4 lo g [ O H ] 3 , 7 C 0 , 1 34
NaClO3+2MnO2+6NaOH→3Na2MnO4+NaCl+3H2O D 35 Kc=0,22/0,12=4 C P V 2 . 1 6 , 2 9 S n R T ln 1 n R T ln 2 2 R ln 3 R ln 2 5 R ln 2 ; P V n R T V 1 6 , 2 9 l 1 1 1 1 36 P V 1 6 , 2 9 2 1 D G T . S 2 9 8 .5 .8 , 3 1 4 . ln 2 8 5 8 6 , 6 1k J 37 T= const, A P . V n R T 1 . 8 , 3 1 4 .(1 7 7 2 7 3 ) 3 7 4 1, 3 J B 38 H U n R T ; 3 1 4 1, 3 1, 5 .8 , 3 1 4 .( 2 7 2 7 3 ) H O k h i, C H _ lo ng C 2 _ 6 6 0 0 , 0 5 9 [ H A s O 4 ] 41 lo g 0 0 , 0 2 3 5 0 , 0 5 9 p H 0 p H 0 , 4 A 2 ] 2 2 [ I ] .[ H ] A . 1 0 0 0 42 t K .C k . 5 .k .A / M D d d m d 2 0 0 .M 18
Phạm Thành Lý- HĐC 2 3 2 3 3 8 3 [ z n ] . [ S ] .P T . 1 0 8 43 7 1 7 1 K N O Z n S cb . 1 0 3 . 1 0 2 2 3 3 B [ H ] . [ N O ] . [ S ] ( K .K ) 27 3 a 1 a 2 19