










Preview text:
NHÓM 12 – LỚP DT_HK213 MỤC LỤC
Thành viên tham gia. ....................................................................................................... 0
Lời nói đầu ........................................................................................................................ 3
BẢNG KẾT QUẢ THÍ NGHIỆM ......................................................................................4
BÀI 2: NHIỆT PHẢN ỨNG .............................................................................................. 5
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG ............................................................................... 9
BÀI 8: PHÂN TÍCH THỂ TÍCH ...................................................................................... 13 1 TỔ HÓM
6_1P20–2_LHỚKP2D2T3_HK213 3
BÀI 2: NHIỆT PHẢN ỨNG
I. Tiến trình thí nghiệm
1. Thí nghiệm 1: Nhiệt dung của nhiệt lượng kế
Đặt ống đong trên mặt phẳng cố định rồi cho nước cất vào (đặt mắt phải ngang với vạch
50ml và mặt cong nhất phải chạm vạch 50) cho vào cốc cắm nhiệt kế và đo nhiệt độ t1 lấy ống
đông lấy tiếp 50ml nước nóng (đúng thể tích) và cho vào bình nhiệt lượng kế cắm nhiệt kế và đo
nhiệt độ t2 rửa và lau khô nhiệt kế để trả về nhiệt độ phòng (không được thiếu bước này) mở
nút ra lắp phễu rót phần nước nguội trong cốc vào trong bình nhiệt lượng kế rồi lấy phễu ra lắp nhiệt
kế lên lắc đều cho nước nóng và nước thường trao đổi nhiệt và xác định nhiệt độ t3 (thí nghiệm làm một lần)
2. Thí nghiệm 2: Nhiệt trung hòa HCl và NaOH
Đầu tiên rửa cây buret, cây buret nào chứa hóa chất nào thì tráng bằng hóa chất đó đóng
khóa buret bằng tay trái đổ hóa chất lên đầy cây buret và chỉnh cây buret (phải làm hết bọt khí và
chỉnh buret về 0) mở khóa buret chứa dung dịch NaOH (lấy 25ml, chú ý không xả hết cây buret)
cắm nhiệt kế vào cốc chứa NaOH xác định nhiệt độ t1 lấy bình nhiệt lượng kế ra cho dưới cây
HCl, lấy 25ml dung dịch HCl cho vào bình nhiệt lượng kế rửa và lau khô, trả nhiệt kế về nhiệt độ
phòng rồi mới cắm vào bình nhiệt lượng kế đo nhiệt độ t2 lắp phễu lên rót phần NaOH từ trong
cốc vào trong bình nhiệt lượng kế, lấy phễu ra và đóng nút lại, lắc đều lên đo nhiệt độ t3 (thí nghiệm làm hai lần)
3. Thí nghiệm 3: Nhiệt hòa tan CuSO4 khan (lưu ý CuSO4 dễ hút ẩm)
Dùng ống đong lấy 50ml nước cất cho vào bình nhiệt lượng kế, cắm nhiệt kế vào đo nhiệt độ
t1 cân nhanh gần bằng 4g CuSO4 khan, ghi lại khối lượng đó mở hẳn nắp bình nhiệt lượng kế,
trút phần chất rắn vào đậy nắp lại, lắp nhiệt kế và lắc đều (nhiệt tỏa ra là nhiệt hòa tan của CuSO4
vào nước), xem nhiệt độ lên cao nhất (cực đại) rồi sau đó giảm lấy nhiệt độ cao nhất (cực đại) là t2
(thí nghiệm làm hai lần)
4. Thí nghiệm 4: Xác định nhiệt hòa tan NH4Cl
Dùng ống đong lấy 50ml nước cất cho vào bình nhiệt lượng kế cắm nhiệt kế vào và đo nhiệt
độ t1 cân nhanh gần bằng 4g NH4Cl và ghi lại khối lượng đó mở hẳn nắp bình nhiệt lượng kế ra
và trút phần chất rắn vào đậy nắp lại, lắp nhiệt kế lên và lắc đều (nhiệt tỏa ra là nhiệt hòa tan của
NH4Cl vào nước), xem nhiệt độ lên cao nhất (cực đại) rồi sau đó giảm lấy nhiệt là t2 (thí nghiệm làm hai lần) 4
II. Kết quả thí nghiệm
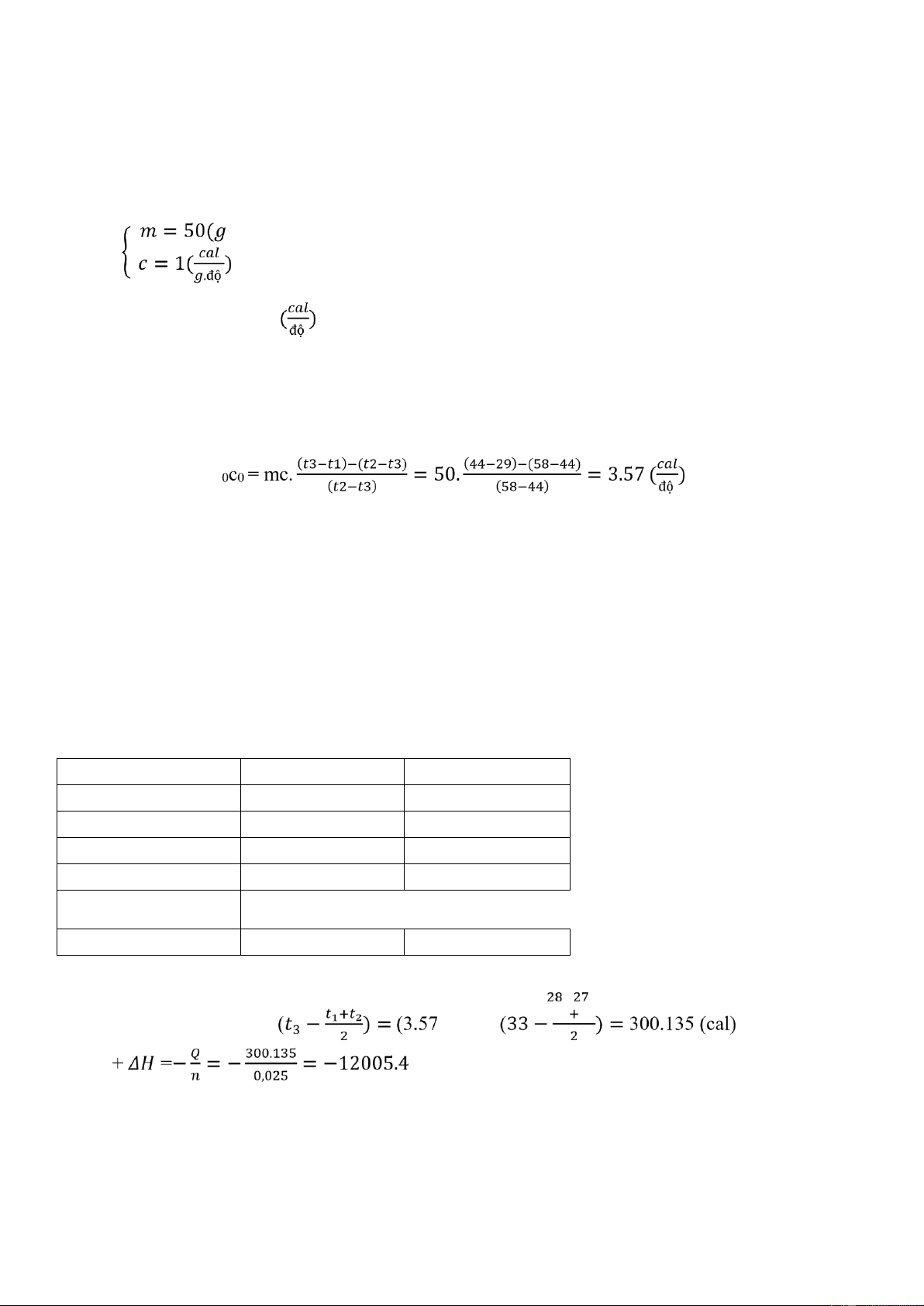
1. Thí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế ) - Ta có: →mc = 50.1 = 50 𝑡1 = 290𝑡
- Ta lại có: { 𝑡2 = 580𝑡
𝑡3 = 𝑡1 + 𝑡2 = 440𝑡 - Ta có công thức: m
2. Thí nghiệm 2: Hiệu ứng nhiệt phản ứng trung hoà HCL và NaOH CNaCl0.5M =1(cal/g.độ)
𝑡NaCl0.5M = 1.02 (g/ml) nNaCl0.5M = 0.05 x 0.5 = 0.025 (mol) m0c0 tb = 3.33 (cal/độ) VNaOH = 25ml, VHCl = 25ml Nhiệt độ ℃ Lần 1 Lần 2 t1 26 27 t2 28 27.5 t3 32.5 33 Q(cal) Qtrung bình (cal) 309.23 𝑡𝑡 (cal/mol) -12005.4 -13096.8 - Tính giá trị
+ m = (VNaOH +VHCl) x 1.02 = (25 + 25) x 1.02 = 51 (g) + Q = (m0c0 +mc) × + 51) ×
(cal/mol) 𝑡𝑡 < 0 nên phản ứng tỏa nhiệt. 5
3. Thí nghiệm 3: Nhiệt hòa tan CuSO4 khan – kiểm tra định luật Hess
CCuSO4 =1(cal/g.độ); mCuSO4 =4g ; nCuSO4 = mCuSO4 /160 mnước = 50g m0c0 tb = 3.57 (cal/độ) Nhiệt độ ℃ Lần 1 Lần 2 t1 29.5 29.5 t2 33.5 33 m cân 4.01 4.02 𝑡𝑡 (cal/mol) 𝑡𝑡𝑡𝑡(cal/mol)
Với m = 50+4 = 54g; n = mCuSO4 /160 =4/160 = 0.025 mol
Q = (m0c0 +mc) × (t2-t1)=(3.57 + 54) × (34-29)=287.85 (cal) (cal/mol)
𝑡𝑡 < 0 nên phản ứng tỏa nhiệt.
Tính toán tương tự với lần thí nghiệm thứ hai và lần thứ ba.
4. Thí nghiệm 4: Xác định nhiệt hòa tan của NH4Cl CNH4Cl = 1(cal/g.độ)
nNH4Cl = mNH4Cl /53.5 = 4/53.5 =0.075 (mol) Nhiệt độ ℃ Lần 1 Lần 2 t1 29.5 29 t2 25.5 25 𝑡𝑡 Q(cal) 𝑡𝑡 (cal/mol) 𝑡𝑡𝑡𝑡(cal/mol) 3326.27 Với m = 50 +4 = 54g Q = (m0c0 +mc) × (t2-t1)= (cal/mol)
𝑡𝑡 > 0 nên phản ứng tỏa nhiệt. 6
Tính toán tương tự với lần thí nghiệm thứ hai và lần thứ ba. III. Trả lời câu hỏi
1. 𝑡𝑡𝑡𝑡 của phản ứng HCl + NaOH → NaCl +H20 sẽ được tính theo số mol HCl hay NaOH
khi cho 25ml dung dịch HCl 2M tác dụng với 25ml dung dịch NaOH 1M ? Tại sao ? Trả lời:
nNaOH = 1×0,025 = 0,025 mol nHCl
TỔ 6_P02_HK=22×30,025 = 0,05 mol NaOH + HCl → NaCl + H2O 0,025 0,05
→ HCl dư → ∆HTB được tính dựa trên số mol của NaOH. Vì lượng HCl dư không tham gia phản
ứng trên nên không sinh nhiệt.
2. Nếu thay HCl 1m bằng HNO3 1m thì kết quả thí nghiệm có thay đổi gì không? Trả lời:
Nếu thay HCl bằng HNO3 thì thí nghiệm 2 không có gì thay đổi vì HCl và HNO3 đều là axit
mạnh phân ly hoàn toàn và HNO3 tác dụng với NaOH là phản ứng trung hòa.
3. Tính H3 bằng lý thuyết theo định luật Hess. So sánh với kết quả thí nghiệm. Hãy xem 6
nguyên nhân có thể gây ra sai số trong thí nghiệm này:
o Mất nhiệt do nhiệt lượng kế o Do nhiệt thiết kế o
Do dụng cụ đong thể tích hóa chất o Do cân
o Do sunfat đồng bị hút ẩm o Do lấy nhiệt dung
riêng dung dịch sunfat đồng bằng 1 cal/mol.độ
Theo em sai số nào là quan trọng nhất, giải thích? Còn nguyên nhân nào khác không? Trả lời: - Theo định luật Hess
H3lt = H1 + H2 = -18,7 + 2,8 = -15,9 ( kcal/mol) = -15900 ( cal/mol)
- Theo thực nghiệm: H3tn = -16052,4 ( cal/mol)
TỔ C ósự ch ênh lệch quá lớn giữa thực nghiệm và lý thuyết 6_ P02 _H K223
Theo em, mất nhiệt do nhiệt lượng kế là quan trọng nhất. Vì trong quá trình làm thí nghiệm
thao tác không chính xác, nhanh chóng dẫn đến thất thoát nhiệt ra môi trường bên ngoài. 7
CuSO4 khan dễ hút ẩm, trong quá trình cân và đưa vào làm thí nghiệm không nhanh khiến
cho đồng sunfat bị hút ẩm ảnh hưởng đến kết quả thí nghiệm.
BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG I/ Thực hành
1. Xác định bậc phản ứng theo 𝑡𝑡𝑡𝑡𝑡𝑡𝑡.
Chuẩn bị 3 ống nghiệm chứa 𝑡2𝑡𝑡4 và 3 bình tam giác chứa Na2S2O3 và 𝑡2𝑡 theo bảng sau: TN Ống nghiệm V(ml) Erlen
𝑡𝑡𝑡𝑡𝑡 0,4M
V(ml) 𝑡𝑡𝑡𝑡𝑡𝑡𝑡 0,1M V(ml) 𝑡𝑡𝑡 1 8 4 28 2 8 8 24 3 8 16 16
- Dùng Pipet vạch lấy axit cho vào ống nghiệm.
- Dùng Buret cho nước vào 3 erlen.
- Tráng Buret bằng Na2S2O3 0,1M rồi tiếp tục dùng Buret cho Na2S2O3 vào 3 Erlen.
- Lần lượt cho phản ứng từng cặp ống nghiệm và Erlen như sau:
✓ Đổ nhanh axit trong ống nghiệm vào erlen.
✓ Bấm đồng hồ ( khi 2 dung dịch tiếp xúc nhau).
✓ Lắc nhẹ, sau đó để yên quan sát, khi thấy dung dịch chuyển sang đục thì bấm đồng hồ.
Lặp lại thí nghiệm lấy giá trị trung bình.
2. Xác định bậc phản ứng theo 𝑡𝑡𝑡𝑡𝑡.
Thao tác tương tự phần 1 với lượng axit và Na2S2O3 theo bảng sau: TN Ống nghiệm V(ml) Erlen
𝑡𝑡𝑡𝑡𝑡 0,4M
V(ml) 𝑡𝑡𝑡𝑡𝑡𝑡𝑡 0,1M V(ml) 𝑡𝑡𝑡 1 4 8 28 2 8 8 24 8 3 8 8 16
II. Kết quả thí nghiệm.
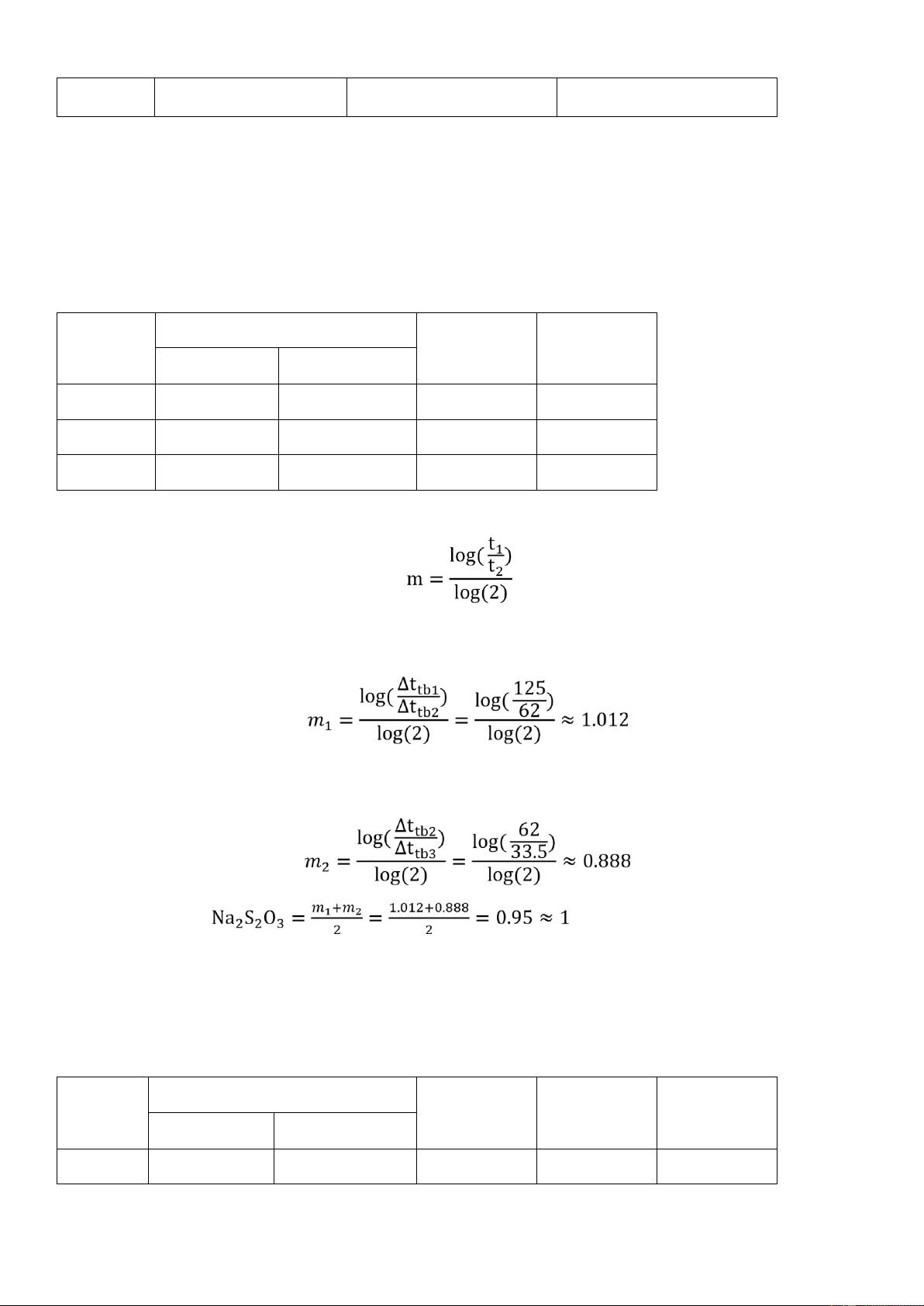
1. Bậc phản ứng theo 𝑡𝑡𝑡𝑡𝑡𝑡𝑡. TN
Nồng độ ban đầu (M) ∆𝑡𝑡 ∆𝑡𝑡 𝑡𝑡𝑡𝑡𝑡𝑡𝑡 𝑡𝑡𝑡𝑡𝑡 1 0.1 0.4 120s 134s 2 0.1 0.4 66s 74s 3 0.1 0.4 43s 40s Ta có : Từ TN1 và TN2 ta có: Từ TN2 và TN3 ta có: Bậc phản ứng theo TỔ 6_P02_HK223
2. Bậc phản ứng theo 𝑡𝑡𝑡𝑡𝑡. TN
Nồng độ ban đầu (M) ∆𝑡𝑡 ∆𝑡𝑡 ∆𝑡𝑡𝑡 𝑡𝑡𝑡𝑡𝑡𝑡𝑡 𝑡𝑡𝑡𝑡𝑡 1 0.1 0.4 75 80 9 2 0.1 0.4 66 74 3 0.1 0.4 61 67 Từ TN1 và TN2 ta có: Từ TN2 và TN3 ta có: Bậc phản ứng theo
III. Trả lời câu hỏi.
1. Trong TN trên, nồng độ của 𝑡𝑡𝑡𝑡𝑡𝑡𝑡và của 𝑡𝑡𝑡𝑡𝑡 đã ảnh hưởng thế nào lên vận tốc phản ứng?
Viết lại biểu thức tính vận tốc phản ứng. Xác định bậc của phản ứng. Trả lời:
- Nồng độ của Na2S2O3 tỉ lệ thuận với tốc độ phản ứng. Nồng độ của 𝑡2𝑡𝑡4 hầu như không ảnh
hưởng tới tốc độ phản ứng.
- Biểu thức tính vận tốc: V = k. [Na2S2O3]0.888. [𝑡2𝑡𝑡4]0.153
- Bậc phản ứng: 0.888 + 0.153 = 1.041
2. Cơ chế của phản ứng trên có thể được viết như sau:
𝑡2𝑡𝑡4 + Na2S2O3 → Na2SO4 + H2S2O3 (1) TỔ 6_P02_HK223 H2S2O3 → H2SO3 + S (2)
Dựa vào kết quả thí nghiệm có thể kết luận phản ứng (1) hay (2) là phản ứng quyết định vận tốc
phản ứng tức là phản ứng xảy ra chậm nhất hay không? Tại sao? Lưu ý trong các thí nghiệm trên,
lượng axit 𝑡2𝑡𝑡4 luôn luôn dư so với Na2S2O3. 10 Trả lời:
- (1) là phản ứng trao đổi ion nên phản ứng xảy ra rất nhanh.
- (2) là phản ứng oxi hóa khử nên tốc độ phản ứng xảy ra rất chậm
=> Phản ứng 2 là phản ứng quyết định tốc độ phản ứng.
3. Dựa trên cơ sở của phương pháp thí nghiệm thì vận tốc xác định được trong các thí nghiệm
trên được xem là vận tốc trung bình hay vận tốc tức thời? Trả lời:
- Vận tốc được xác định bằng
( biến thiên nồng độ của lưu huỳnh không đáng kể trong
khoảng thời gian ∆𝑡) nên vận tốc trong các thí nghiệm trên được xem là vận tốc tức thời.
4. Thay đổi thứ tự cho 𝑡𝑡𝑡𝑡𝑡 và 𝑡𝑡𝑡𝑡𝑡𝑡𝑡 thì bậc phản ứng có thay đổi hay không? Tại sao? Trả lời:
- Thay đổi thứ tự cho 𝑡2𝑡𝑡4 và Na2S2O3thì bậc phản ứng không thay đổi. Ở một nhiệt độ xác định,
bậc phản ứng chỉ phụ thuộc vào bản chất của hệ ( nồng độ, nhiệt độ, diện tích bề mặt, áp suất) mà
không phụ thuộc vào thứ tự chất phản ứng. TỔ 6_P02_HK223
BÀI 8: PHÂN TÍCH THỂ TÍCH 1, Thí nghiệm 1:
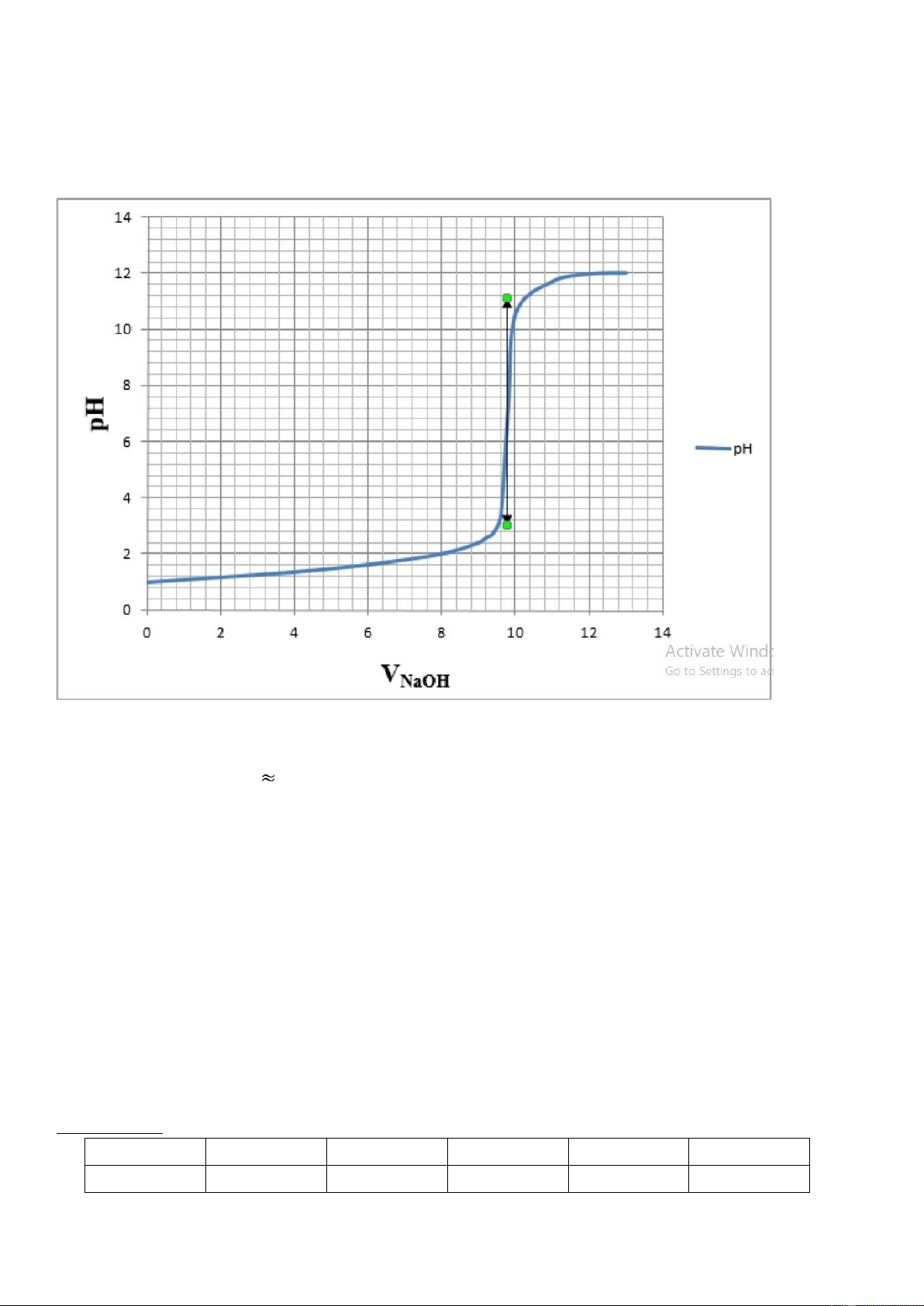
Xây dựng đường cong chuẩn độ một axit mạnh bằng một bazơ mạnh dựa theo bảng: 11
Dựa trên đường cong chuẩn độ, xác định bước nhảy pH, điểm tương đương và chất chỉ thị thích hợp.
Từ bảng số liệu trên. Ta vẽ được đường cong chuẩn độ như sau:
Từ đồ thị ta xác định được các giá trị gần đúng: • Bước nhảy pH 10,2
• Điểm tương đương: 𝑡𝑡𝑡𝑡 ≈ 7 2. Thí nghiệm 2:
Tráng buret bằng dung dịch NaOH 0,1N, sau đó cho từ từ dung dịch NaOH 0,1N vào buret. Chỉnh mTứỔ c d
6u_nPg02d_ịcHhKn2g2a3ng vạch 0.
Dùng pipet 10 ml lấy 10 ml dung dịch HCl chưa biết nồng độ vào erlen 150ml, thêm 10 ml nước cất và 2 giọt phenolphtalein.
Mở khóa buret nhỏ từ từ dung dịch NaOH xuống erlen, vừa nhỏ vừa lắc nhẹ đến khi dung dịch trong
erlen chuyển sang màu hồng nhạt bền thì khóa buret. Đọc thể tích dung dịch NaOH đã dùng.
Lặp lại thí nghiệm hai lần nữa để tính giá trị trung bình. Bảng số liệu: Lần V HCl (ml) VNaOH (ml) CNaOH (N) CHCl (N) Sai số 1 10 8.9 0.1 0.000 12 2 10 8.5 0.1 0.000 3 10 8.7 0.1 0.000
Ta tính được sai số tuyệt đối của mỗi lần đo theo công thức:
∆𝑡𝑡𝑡𝑡_𝑡 = |𝑡𝑡𝑡𝑡_𝑡 − 𝑡𝑡𝑡𝑡| →
Các giá trị sai số được thể hiện ở bảng trên. Sai số trung bình:
Suy ra, nồng độ HCl cần dùng là:
𝑡𝑡𝑡𝑡 = 0.1073 ± 0.0004 (𝑡) 3. Thí nghiệm 3:
Tiến hành tương tự thí nghiệm 2 nhưng thay chất chỉ thị phenolphtalein bằng metyl da cam. Màu
dung dịch đổi từ đỏ sang cam. Lần 𝑡𝑡𝑡𝑡(𝑡𝑡)
𝑡𝑡𝑡𝑡𝑡(𝑡𝑡) 𝑡𝑡𝑡𝑡𝑡(𝑡) 𝑡𝑡𝑡𝑡(𝑡) Sai số 1 10 8.5 0.1 0.107 0.0003 2 10 8.4 0.1 0.106 0.0007 3 10 8.2 0.1 0.107 0.0003
Ta tính được sai số tuyệt đối của mỗi lần đo theo công thức: TỔ 6_P02_HK223
∆𝑡𝑡𝑡𝑡_𝑡 = |𝑡𝑡𝑡𝑡_𝑡 − 𝑡𝑡𝑡𝑡| →
Các giá trị sai số được thể hiện ở bảng trên. Sai số trung bình:
Suy ra, nồng độ HCl cần dùng là:
𝑡𝑡𝑡𝑡 = 0.1067 ± 0.0004 (𝑡) 4. Thí nghiệm 4:
Tiến hành tương tự thí nghiệm 2 nhưng thay chất dung dịch HCl bằng dung dịch axit axetic. Làm thí
nghiệm 2 lần với lần đầu dùng chất chỉ thị phenolphtalein, lần sau dùng metyl da cam. 13
4a: Chuẩn độ 𝑡𝑡3𝑡𝑡𝑡𝑡 với phenolphtalein: Lần 𝑡𝑡𝑡 𝑡 3𝑡𝑡𝑡𝑡 𝑡𝑡𝑡𝑡(𝑡𝑡) 𝑡𝑡𝑡𝑡𝑡(𝑡) 𝑡𝑡𝑡3𝑡𝑡𝑡𝑡 Sai số (𝑡𝑡) (𝑡) 1 10 8.5 0.1 0.109 0.0007 2 10 8.4 0.1 0.108 0.0003 3 10 8.5 0.1 0.108 0.0003
Ta tính được sai số tuyệt đối của mỗi lần đo theo công thức:
∆𝑡𝑡𝑡3𝑡𝑡𝑡𝑡_𝑡 = |𝑡𝑡𝑡3𝑡𝑡𝑡𝑡_𝑡 − 𝑡𝑡𝑡3̅ 𝑡 | Các giá
trị sai số được thể hiện ở bảng trên. Sai số trung bình:
Suy ra, nồng độ 𝑡𝑡3𝑡𝑡𝑡𝑡 cần dùng là:
𝑡𝑡𝑡𝑡 = 0.1083 ± 0.0004 (𝑡) 4b: Chuẩn
độ 𝑡𝑡3𝑡𝑡𝑡𝑡 với metyl da cam: Lần
𝑡𝑡𝑡3𝑡𝑡𝑡𝑡 (𝑡𝑡)
𝑡𝑡𝑡𝑡𝑡(𝑡𝑡) 𝑡𝑡𝑡𝑡𝑡(𝑡)
𝑡𝑡𝑡3𝑡𝑡𝑡𝑡 (𝑡) 1 10 3.5 0.1 0.036 2 10 3.8 0.1 3 10 3.6 0.1
II. TRẢ LỜI CÂU HỎI:
1. Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ có thay đổi hay không, tại sao?
Thay đổi nồng độ HCl và NaOH thì đường cong chuẩn độ không thay đổi vì đương lượng phản ứng
của các chất vẫn không thay đổi, chỉ có bước nhảy là thay đổi và điểm pH tương đương vẫn không t đổ ế
nồng độ nhỏ thì bước nhảy nhỏ và ngược lại. T hỔ
ay6_Pi.0N2_Hu Kdù2n2g3
2. Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 cho kết quả nào chính xác hơn, tại sao?
Phenol phtalein giúp ta xác định chính xác hơn vì bước nhảy pH của phenol phtalein khoảng từ 8-
10. Bước nhảy của metyl orange là 3.1-4.4 mà điểm tương đương của hệ là 7 (do axit mạnh tác dụng
với bazơ mạnh) nên thí nghiệm 2 (Phenol phtalein) sẽ cho kết quả chính xác hơn.
3. Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit axetic bằng chỉ thị màu nào
chính xác hơn, tại sao? 14
Phenol phtalein giúp ta xác định chính xác hơn vì bước nhảy pH của phenol phtalein khoảng từ 810.
Bước nhảy của metyl orange là 3.1-4.4 mà điểm tương đương của hệ là >7 (do axit yếu tác dụng với bazơ mạnh).
4. Trong phép phân tích thể tích nếu đổi vị trí của NaOH và axit thì kết quả có thay đổi không, tại sao?
Trong phép phân tích thể tích nếu đổi vị trí NaOH và axit thỉ kết quả vẫn không thay đổi vì bản chất
phản ứng không thay đổi, vẫn là phản ứng trung hòa và chất chỉ thị cũng sẽ đổi màu tại điểm tương đương. --- HẾT --- TỔ 6_P02_HK223 15 16
Document Outline
- Thành viên tham gia. 0
- BÀI 2: NHIỆT PHẢN ỨNG
- I. Tiến trình thí nghiệm
- 1. Thí nghiệm 1: Nhiệt dung của nhiệt lượng kế
- 2. Thí nghiệm 2: Nhiệt trung hòa HCl và NaOH
- 3. Thí nghiệm 3: Nhiệt hòa tan CuSO4 khan (lưu ý CuSO4 dễ hút ẩm)
- 4. Thí nghiệm 4: Xác định nhiệt hòa tan NH4Cl
- II. Kết quả thí nghiệm
- 1. Thí nghiệm 1: Xác định nhiệt dung của nhiệt lượng kế
- 2. Thí nghiệm 2: Hiệu ứng nhiệt phản ứng trung hoà HCL và NaOH
- 3. Thí nghiệm 3: Nhiệt hòa tan CuSO4 khan – kiểm tra định luật Hess
- 4. Thí nghiệm 4: Xác định nhiệt hòa tan của NH4Cl
- III. Trả lời câu hỏi
- 1. 𝜟𝑯𝒕𝒃 của phản ứng HCl + NaOH → NaCl +H20 sẽ được tính theo số mol HCl hay NaOH khi cho 25ml dung dịch HCl 2M tác dụng với 25ml dung dịch NaOH 1M ? Tại sao ?
- Trả lời:
- 2. Nếu thay HCl 1m bằng HNO3 1m thì kết quả thí nghiệm có thay đổi gì không?
- Trả lời:
- 3. Tính H3 bằng lý thuyết theo định luật Hess. So sánh với kết quả thí nghiệm. Hãy xem 6 nguyên nhân có thể gây ra sai số trong thí nghiệm này:
- Theo em sai số nào là quan trọng nhất, giải thích? Còn nguyên nhân nào khác không?
- Trả lời:
- BÀI 4: XÁC ĐỊNH BẬC PHẢN ỨNG
- I/ Thực hành
- II. Kết quả thí nghiệm.
- III. Trả lời câu hỏi.
- 1. Trong TN trên, nồng độ của 𝐍𝐚𝟐𝐒𝟐𝐎𝟑và của 𝑯𝟐𝑺𝑶𝟒 đã ảnh hưởng thế nào lên vận tốc phản ứng? Viết lại biểu thức tính vận tốc phản ứng. Xác định bậc của phản ứng.
- 2. Cơ chế của phản ứng trên có thể được viết như sau:
- 3. Dựa trên cơ sở của phương pháp thí nghiệm thì vận tốc xác định được trong các thí nghiệm trên được xem là vận tốc trung bình hay vận tốc tức thời?
- 1, Thí nghiệm 1:
- BÀI 8: PHÂN TÍCH THỂ TÍCH
- 2. Thí nghiệm 2:
- 3. Thí nghiệm 3:
- 4. Thí nghiệm 4:
- II. TRẢ LỜI CÂU HỎI:
- 1. Khi thay đổi nồng độ HCl và NaOH, đường cong chuẩn độ có thay đổi hay không, tại sao?
- 2. Việc xác định nồng độ axit HCl trong các thí nghiệm 2 và 3 cho kết quả nào chính xác hơn, tại sao?
- 3. Từ kết quả thí nghiệm 4, việc xác định nồng độ dung dịch axit axetic bằng chỉ thị màu nào chính xác hơn, tại sao?
- 4. Trong phép phân tích thể tích nếu đổi vị trí của NaOH và axit thì kết quả có thay đổi không, tại sao?




