



Preview text:
(Sinh viên không được sử dụng tài liệu)
SV PHẢI NỘP LẠI ĐỀ - NẾU KHÔNG SV SẼ NHẬN ĐIỂM KHÔNG CHO CẢ MÔN HỌC
Họ, tên thí sinh:..................................................................... Mã sinh viên: .............................
Chữ ký SV:…………………Buổi học (sáng hay chiều? Thứ mấy? Tiết mấy?):……………………….. Chữ ký Giám thị Chữ ký Giám khảo Số câu đúng
Điểm bài kiểm tra BẢNG TRẢ LỜI 1 2 3 4 5 6 7 8
9 10 11 12 13 14 15 16 17 18 19 20 A B C D
21 22 23 24 25 26 27 28 29 30 A B C D
Câu 1: Cho các quá trình sau:
(1) Khi lực đẩy cân bằng lực hút, các ion dừng lại và cách nhau một khoảng cách nhất định
(2) Các nguyên tử sẽ tiến hành cho nhận electron để tạo thành các cation và anion
(3) Giữa chúng xuất hiện lực đẩy giữa các vỏ electron
(4) Các ion ngược dấu sẽ hút nhau và tiến lại gần nhau
Theo lý thuyết tĩnh điện hiện đại, cơ chế tạo thành liên kết ion theo trật tự các quá trình sau: A. 4 – 3 – 1 – 2 B. 2 – 4 – 1 – 3 C. 1 – 4 – 3 – 2 D. 2 – 4 – 3 – 1
Câu 2: Nguyên tử của nguyên tố X có tổng số electron nằm trên phân lớp d là 3. Có các phát biểu sau đây về X:
(a) Nguyên tử X có 23 hạt mang điện (b) X là nguyên tố họ s
(c) Electron cuối cùng của X có số lượng chính n = 4
(d) X thuộc chu kỳ 4, nhóm IIA
(e) Ở trạng thái bình thường X có 3 electron độc thân
Số các phát biểu SAI là: A. 4 B. 3 C. 5 D. 2
Câu 3: Vò trí trong baûng heä thoáng tuaàn hoaøn cuûa nguyeân toá coù caáu hình electron: 1s22s22p63s23p63d44s2 laø:
A. Chu kyø 4, phaân nhoùm IIB
B. Chu kyø 3, phaân nhoùm IIB
C. Chu kyø 4, phaân nhoùm VIB
D. Cấu hình electron khoâng tồn tại
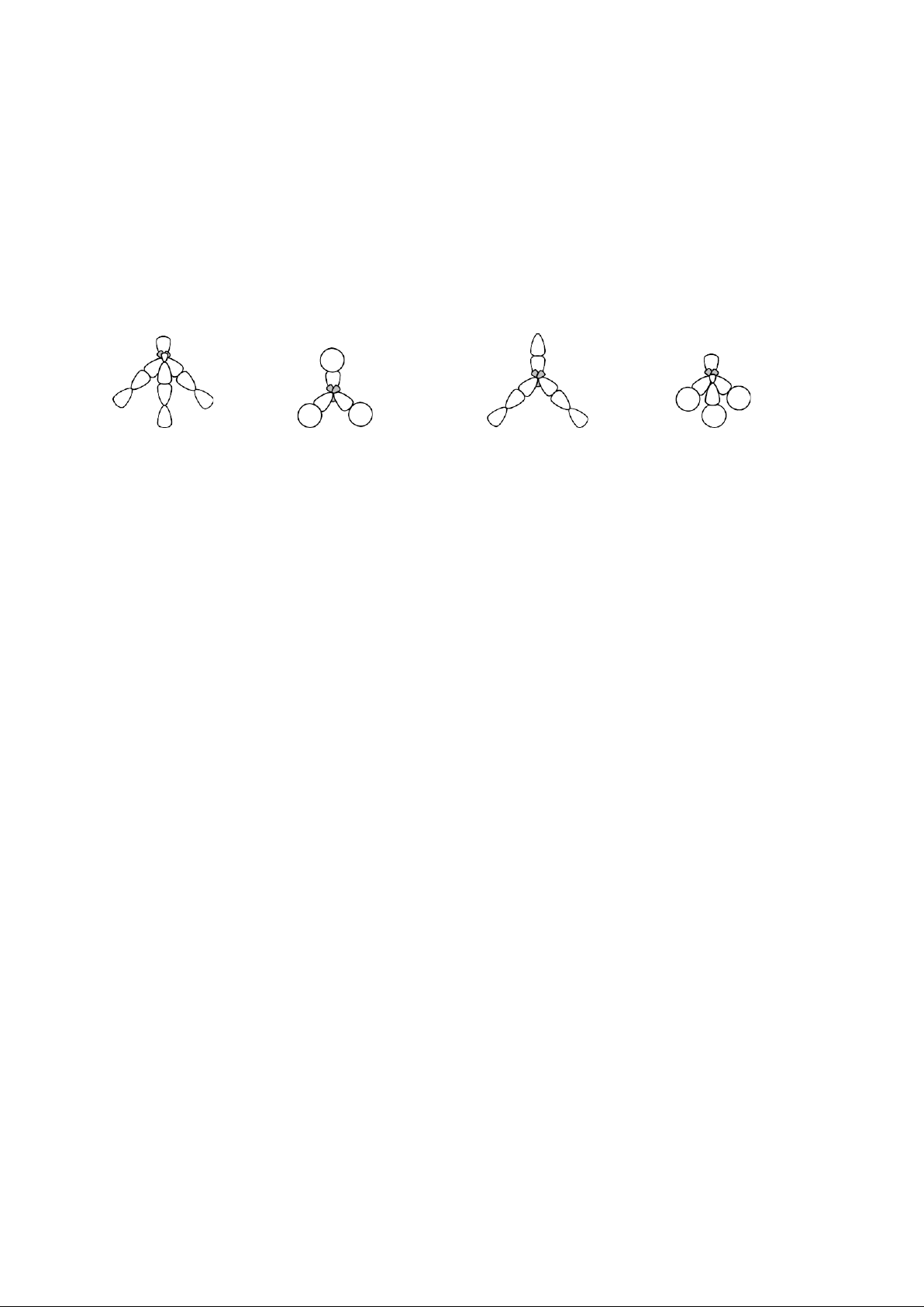
Câu 4: Hình ảnh nào sau đây là phù hợp với cấu trúc của phân tử BH3 trong không gian. Biết (ZB = 5, ZH = 1) A. B. C. D.
Câu 5: Phát biểu nào sau đây là SAI:
A. Số electron độc thân của S (Z = 16) có thể có là 2
B. Nguyên tử N có 5 electron hóa trị và có thể tạo được 4 liên kết cộng hóa trị
C. Nguyên tố Clo có thể có 1, 3, 5, 7 electron độc thân
D. Cr (Z = 24) có 6 electron độc thân ở trạng thái bình thường
Câu 6: Ion X2+ có phân lớp electron cuối cùng là 3d6. Bộ bốn số lượng tử của electron cuối cùng trong ion
X3+ là: (với giá trị ml xếp tăng dần)
A. n = 3, l = 2, ml = 2, ms = +1/2
B. n = 3, l = 2, ml = 0, ms = +1/2
C. n = 4, l = 0, ml = 0, ms = -1/2
D. n = 3, l = 2, ml = - 2, ms = -1/2
Câu 7: Đồng trong tự nhiên có 2 đồng vị là 65Cu và 63Cu. Khối lượng nguyên tử trung bình của đồng là 63,54.
Clo trong tự nhiên có 2 đồng vị là 35Cl (chiếm 75,77%) và 37Cl. Tính thành phần phần trăm theo khối lượng
của 65Cu trong phân tử CuCl2. A. 87,24% B. 73% C. 27% D. 12,76%
Câu 8: Số cặp electron hóa trị liên kết và không liên kết của nguyên tử trung tâm trong phân tử CH4 lần lượt
là: (Cho biết ZC = 6, ZH = 1) A. (4, 0) B. (1, 3) C. (2, 2) D. (3, 1)
Câu 9: Khi dự đoán trạng thái lai hóa của SO2, gọi σ là số nguyên tử biên, X là tổng số electron hóa trị trong
phân tử, phát biểu nào sau đây là đúng:
A. σ = 2, X = 16, lai hóa sp3, cấu trúc góc
B. σ = 3, X = 24, lai hóa sp3, cấu trúc tháp
C. σ = 2, X = 18, lai hóa sp2, cấu trúc góc
D. σ = 2, X = 18, lai hóa sp2, cấu trúc đường thẳng
Câu 10: Cho nguyeân töû X, Y coù boä 4 soá löôïng töû cuûa electron cuoái cuøng laàn löôït laø (1, 0, 0, +1/2) vaø (3, 1,
-1, -1/2). Coù caùc phaùt bieåu sau ñaây veà phaân töû X2Y:
(a) X2Y coù lieân keát ion.
(b) X2Y coù nguyeân töû trung taâm coù traïng thaùi lai hoùa sp
(c) X2Y coù tính baõo hoøa vaø tính ñònh höôùng
(d) X2Y coù caáu truùc hình hoïc phaân töû laø caáu truùc ñöôøng thaúng
Phaùt bieåu naøo laø ñuùng: A. (b) B. (c) C. (a) D. (d)
Câu 11: Thuyết cơ học lượng tử không chấp nhận điều nào sau đây:
A. Ở trạng thái cơ bản, các electron sắp xếp sao cho số electron độc thân là nhiều nhất
B. Số lượng tử spin cho biết chiều tự quay của electron xung quanh trục của nó
C. Trong một nguyên tử không có 2 electron có cùng bốn số lượng tử
D. Số lượng tử orbital (l) xác định mức năng lượng của electron
Câu 12: Cho các yếu tố sau:
(1) Độ âm điện của các nguyên tử trong phân tử
(2) Sự lai hóa của nguyên tử trung tâm
(3) Cặp electron hóa trị tự do trong phân tử (4) Độ dài liên kết
(5) Năng lượng liên kết
Các yếu tố có ảnh hưởng đến độ lớn góc hóa trị của phân tử là: A. (2, 3) B. (1, 2 ) C. (3, 4) D. (4, 5)
Câu 13: Cho các phân tử sau đây: F2, CO2, H2, CH4, CCl4. Số lượng các phân tử có moment lưỡng cực KHÁC
KHÔNG là: (Cho biết ZF = 9, ZC = 6, ZO = 8, ZH = 1, ZCl = 17) A. 2 B. 3 C. 0 D. 1
Câu 14: Liên kết chủ yếu có mặt trong hợp chất KBr là: A. Liên kết Hidro
B. Liên kết cộng hóa trị C. Liên kết ion
D. Liên kết kim loại
Câu 15: Phát biểu nào sau đây là đúng đối với phân tử CO2
A. Coù baäc lieân keát baèng 1
B. Coù 2 lieân keát
C. Coù 2 lieân keát coäng hoùa trò
D. Phaân töû coù tính phaân cöïc
Câu 16: Cho phân tử CH≡C-CH=C=C=CH2. Số liên kết σ và liên kết π trong phân tử này lần lượt là: A. (9 – 5) B. (4 – 11) C. (5 – 9) D. (11 – 4)
Câu 17: Góc tạo bởi các orbital lai hóa sp2 thông thường là: A. 109o28’ B. 90o C. 120o D. 180o
Câu 18: Cho các phát biểu sau:
(a) Khi tạo liên kết thì liên kết π được hình thành đầu tiên và có vai trò định hướng phân tử
(b) Nếu trong phân tử có liên kết π nhiều tâm thì phân tử có bậc liên kết không phải là số nguyên
(c) Liên kết đôi kém bền hơn liên kết ba
(d) Sự định hướng của liên kết cộng hóa trị được quyết định bởi sự lai hóa của nguyên tử trung tâm tham gia tạo liên kết Phát biểu SAI là: A. (a) B. (d) C. (b) D. (c)
Câu 19: Nguyên tử X có electron cuối cùng mang bộ bốn số lượng tử n = 3, l = 0, ml = 0, ms = +1/2.Nguyên
tử X có số hạt mang điện lớn hơn hạt không mang điện là 10 hạt. Tỷ số giữa số hạt không mang điện và số hạt
mang điện trong hạt nhân của X là: A. 0,92 B. 1,09 C. 1,9 D. 0,52
Câu 20: Theo thuyết liên kết hóa trị VB thì hình ảnh nào sau đây KHÔNG là hình ảnh của orbital (các orbital) lai hóa: A. B. C. D.
Câu 21: Hình ảnh sau đây mô tả quá trình lai hóa nào của các orbital nguyên tử: A. sp3 B. s3p C. sp D. sp2
Câu 22: Có tối đa bao nhiêu nguyên tử có cùng các số lượng tử sau: n = 2, l = 2 A. 6 B. 10 C. 8 D. 0
Câu 23: Cho các yếu tố sau đây:
(1) Sự lai hóa của nguyên tử trung tâm
(2) Cấu trúc hình học của phân tử
(3) Cặp electron hóa trị tự do trong phân tử
(4) Độ dài liên kết giữa các nguyên tử trong tử trong phân tử
Các yếu tố có ảnh hưởng đến tính phân cực của một phân tử cộng hóa trị là: A. (1, 3, 4) B. (1, 2, 3) C. (1, 2, 3, 4) D. (2, 3, 4)
Câu 24: Các nguyên tố có độ âm điện cao nhất trong bảng hệ thống tuần hoàn thuộc nhóm: A. Khí hiếm B. Kim loại kiềm
C. Kim loại kiềm thổ D. Halogen
Câu 25: Lieân keát ion coù caùc ñaëc tröng cô baûn laø:
A. Tính khoâng baõo hoaø, khoâng ñònh höôùng vaø khoâng phaân cöïc
B. Tính khoâng baõo hoaø, khoâng ñònh höôùng vaø phaân cöïc
C. Tính khoâng baõo hoøa, ñònh höôùng vaø khoâng phaân cöïc
D. Tính baõo hoøa, khoâng coù ñònh höôùng vaø phaân cöïc
Câu 26: Nguyeân toá R taïo hôïp chaát khí vôùi hidro coù coâng thöùc RH3. Trong oxit cao nhaát, nguyeân toá R chieám
xaáp xæ 43,67% khoái löôïng. Nguyeân töû khoái cuûa R laø: A. 14 B. 31 C. 32 D. 16
Câu 27: Cho các phát biểu sau:
(a) Liên kết ion là liên kết phân cực mạnh
(b) Liên kết cộng hóa trị là liên kết không phân cực
(c) orbital s che phủ với orbital s sẽ tạo thành liên kết cộng hóa trị kiểu σ
(d) orbital p che phủ với orbital p sẽ tạo thành liên kết cộng hóa trị kiểu π
(e) liên kết đôi có bậc liên kết bằng 2
Số các phát biểu đúng là: A. 4 B. 2 C. 1 D. 3
Câu 28: Cho 3 ion: K+, Ar, Cl-. Năng lượng ion hóa của các tiểu phân được sắp xếp giảm dần là: A. K+ > Cl- > Ar B. Cl- > Ar > K+ C. K+ > Ar > Cl- D. Ar > K+ > Cl-
Câu 29: Có các phát biểu sau đây về liên kết hóa học:
(a) Liên kết hóa học có bản chất điện
(b) Các electron tham gia tạo liên kết được gọi là các electron hóa trị
(c) Độ dài liên kết càng tăng thì năng lượng liên kết càng giảm
(d) Bậc liên kết càng tăng thì năng lượng liên kết càng tăng
(e) Liên kết ion không có tính định hướng
Có bao nhiêu phát biểu là ĐÚNG: A. 4 B. 3 C. 5 D. 2
Câu 30: Cho các nguyên tử Li (Z = 3), C (Z = 6), N (Z = 7), O (Z = 8), Na (Z = 11)
Sắp xếp các nguyên tử trên theo chiều tăng dần năng lượng ion hóa thứ nhất.
A. Na < Li < C < O < N
B. Na < Li < C < N < O
C. Li < Na < C < N < O
D. Li < Na < C < O < N HẾT




