





Preview text:
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học
CHƯƠNG 9B: CÂN BẰNG HÓA HỌC HỆ THỐNG KIẾN THỨC
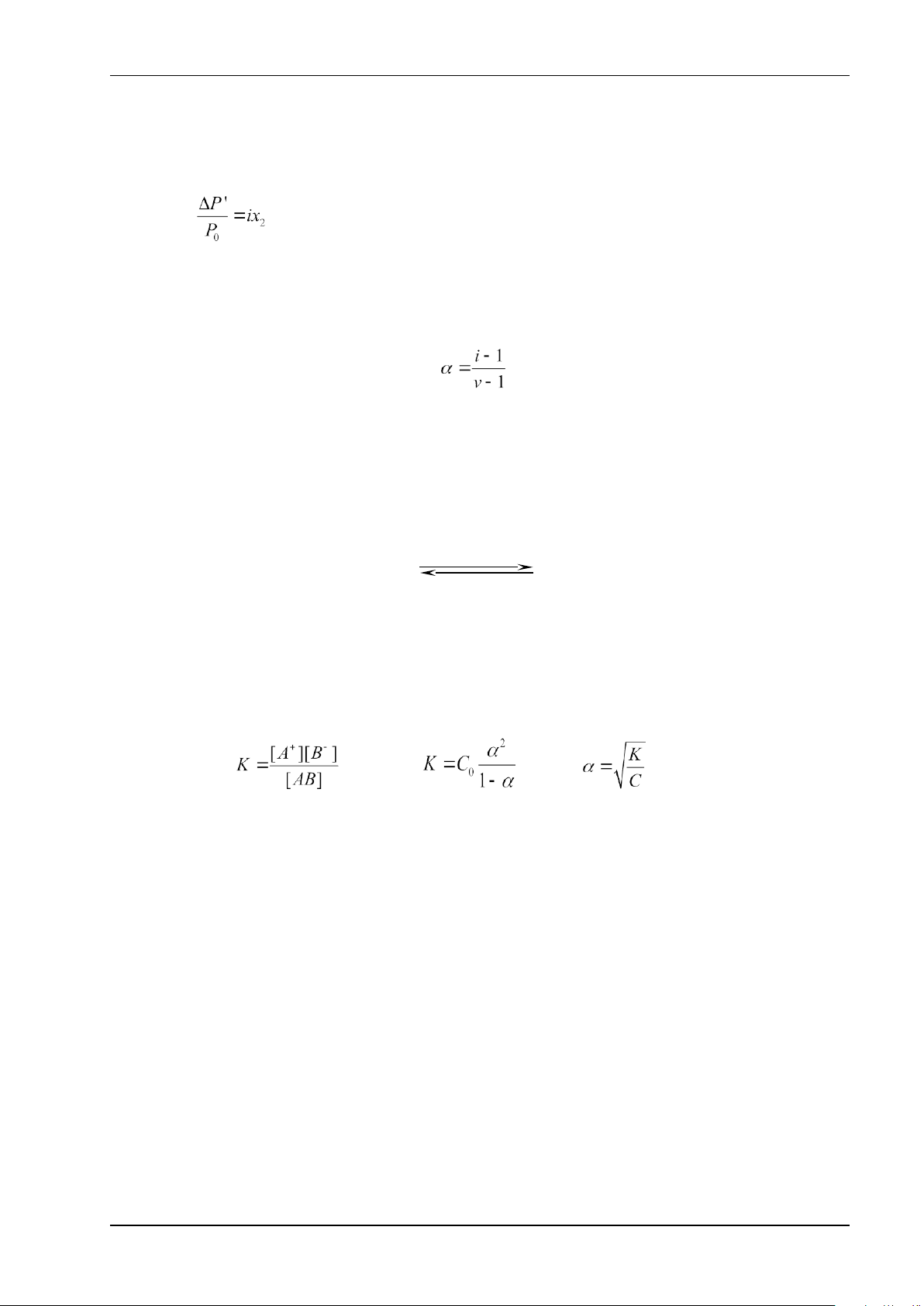
1. Dung dịch điện ly u’ = i CMRT Δt’s = i x Ks x Cm
Δt’đ = i x Kđ x Cm
• Hệ số hiệu chỉnh i >1.
✓ Mối liên hệ giữa i và α: ✓
✓ Hệ số i càng lớn ⟶ P’ càng thấp, ts’ càng cao, tđ’ càng thấp, u’ càng cao.
• Khả năng điện ly của các chất:
✓ Hợp chất ion > hc CHT phân cực mạnh > hc CHT phân cực yếu > hc CHT không phân cực
✓ Chất điện ly mạnh: acid mạnh, base mạnh, muối tan.
✓ Chất điện ly yếu: acid hữu cơ, base hữu cơ, acid vô cơ yếu, một số muối.
2. Cân bằng trong dung dịch chất điện ly yếu AB (dd) Ion hóa A+ (dd) + B- (dd) Ban đầu C Phân tử hóa 0 Phân ly C0α C0α C 0α Cân bằng C0-C0α C0α C0α (α<5%)
3. Thuyết acid – base. Độ pH pH = -lg[H+] pOH = -lg[OH-] pK = -lgK
Tích số ion của nước ở 25oC: KH2O = [H+][OH-] = 10-14 pKH2O = pH + pOH = 14
Một cặp acid base liên hợp: Ka x Kb = KH2O = 10-14 pKa + pKb = pKH2O = 14
4. Tính pH của các dung dịch acid hoặc base
❖ Dung dịch acid mạnh: phân ly hoàn toàn
• CM lớn: HnA ⟶ An- + nH+ Ban đầu CA Điện ly CA CA nCA Còn lại 0 CA nCA 1
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học [H+] = nCA
• CM nhỏ (dung dịch loãng): tính thêm [H+] do sự điện ly của nước đóng góp H2O OH- + H+
❖ Dung dịch base mạnh: phân ly hoàn toàn
• CM lớn: B(OH)n ⟶ Bn+ + nOH- Ban đầu CB Điện ly CB CB nCB Còn lại 0 CB nCB [OH-] = nCB
• CM nhỏ (dung dịch loãng): tính thêm [OH-] do sự điện ly của nước đóng góp H2O OH- + H+
❖ Dung dịch acid yếu: (nếu acid yếu nhiều nấc thì chỉ tính như acid yếu phân ly một nấc đầu tiên) HA A- + H+ Ban đầu CA Điện ly x x x Cân bằng CA - x x x Do đó :
❖ Dung dịch base yếu: BOH B+ + OH- Ban đầu CB Điện ly x x x Cân bằng CB - x x x Do đó : Lưu ý :
❖ Với base hữu cơ hoặc NH3 công thức không thể hiện dạng BOH thì viết phương trình
điện ly bằng cách cộng thêm H2O để phân ly ra OH-.
Ví dụ: aniline C6H5NH2 + H2O C6H5NH +3 + OH-
❖ Với các hydroxyt lưỡng tính như Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3,… sự điện ly
của chúng trong nước có thể xảy ra theo kiểu acid hoặc base tùy thuộc môi trường dung dịch. Ví dụ: Trong môi trường acid Zn(OH)2 Zn2+ + 2OH- 2
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học Trong môi trường base Zn(OH)2 2H+ + ZnO2 2- Ví dụ: Trong môi trường acid Al(OH)3 Al3+ + 3OH- Trong môi trường base Al(OH)3 H+ + AlO2 - + H2O
5. Sự điện ly của chất điện ly ít tan ❖ Tích số tan AmBn (r) mAn+ + nBm– S mS nS
S: độ tan (mol/lit) là nồng độ dung dịch bão hòa
❖ Khả năng tạo kết tủa:
- Nếu Q > T ⟶ tạo kết tủa (dung dịch quá bão hòa).
- Nếu Q < T ⟶ kết tủa tan (dung dịch chưa bão hòa).
- Nếu Q = T ⟶ dung dịch bắt đầu kết tủa hoặc kết tủa bắt đầu tan.
❖ Ảnh hưởng của các ion đến độ hòa tan:
- Khi thêm chất có ion lạ làm tăng độ tan S của chất điện ly ít tan.
- Khi thêm ion cùng loại làm giảm độ tan S của chất điện ly ít tan.
Lưu ý: khi trộn 2 dung dịch thì phải tính toán lại thể tích dung dịch tổng cộng. 3
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học BÀI TẬP:
1. Trong dung dịch nồng độ 0,1 M , độ điện ly của acid acetic bằng 1,32%. Ở nồng độ nào
của dung dịch để độ điện ly của nó bằng 90%. ĐS : 2,15.10-6
2. Tính nồng độ H3O+ (H+) và độ pH của các dung dịch sau : a) HNO3 0,1 M b) ; 10-6 M c) KOH 0,5 M ; 10-6 M
d) CH3COOH 0,1 M, biết rằng ở nhiệt độ khảo sát, acid acetic có độ điện ly α = 1,33%
e) CH3COOH 0,1 M ở 25 oC, biết rằng ở nhiệt độ khảo sát Ka(CH3COOH) = 1,76.10-5
f) HCOOH 0,1 M ở 25o C, biết rằng ở nhiệt độ khảo sát Ka(HCOOH) = 1,77.10-4
g) HCN 0,2 M ở 25 oC, biết rằng ở 25 oC, Ka(HCN)= 6,17.10-10 h) H2SO4 10-4 M i) NH4OH 0,1 M có pKb=4,8
j) 1 lit dung dịch H2SO4 10-4 M cho vào 4 lit dung dịch KOH 10-4 M
k) Hỗn hợp 1 lit dung dịch H2SO4 0,1 M và 1 lit dung dịch CH3COOH 0,1 M có độ điện ly α=1%
ĐS : a) 1,0; 5,99; b) 13,7; 8,00; c) 2,88 ; d) 2,87 ; e) 2,37 ; f) 4,95
3. Độ hòa tan của PbI2 ở 18 oC bằng 1,5.10-3 M. Tính :
a) Nồng độ của ion Pb2+ và I- trong dung dịch bão hòa PbI2 ở 18 oC.
b) Tích số hòa tan của PbI2 ở 18 oC.
c) Khi thêm KI vào thì độ hòa tan của PbI2 tăng hay giảm? Vì sao?
d) Muốn giảm độ hòa tan của PbI2 đi 15 lần, thì phải thêm bao nhiêu mol KI vào trong 1 lít dung dịch bão hòa PbI2?
ĐS : a) 1,5.10-3 ; 3.10-3 M ; b) 1,35.10-8 , d) 1,14.10-2 mol.
4. Tích số hòa tan của Ag2SO4 bằng 7.10-5. Tính độ hòa tan của bạc sulfat biểu diễn bằng mol/lit và g/lít.
ĐS : 2,6.10-2 mol/lít ; 8,1 g/lít
5. Độ hòa tan của canxi oxalat CaC2O4 trong dung dịch muối amoni oxalat (NH4)2C2O4
0,05M sẽ nhỏ hơn trong nước nguyên chất bao nhiêu lần, nếu độ điện ly biểu kiến của amoni
oxalat bằng 70% và tích số hòa tan của canxi oxalat bằng 3,8.10-9 ? ĐS : 565 lần
6. Tính xem có kết tủa BaSO4 hay không nếu trộn lẫn hai thể tích bằng nhau của hai dung
dịch BaCl2 0,01 M và CaSO4 bão hòa. Cho biết tích số tan của BaSO4 và CaSO4 lần lượt bằng 1,08.10-10 và 6,1.10-5 . ĐS : có kết tủa
7. Một dung dịch acid HCOOH trong nước có pH = 3. Hãy tính nồng độ mol/lít của acid
biết hằng số điện ly của nó ở nhiệt độ khảo sát bằng 2,1.10-4. ĐS : 5,76.10-3 M
8. Có tạo thành kết tủa Ag3PO4 hay không khi :
a) Trộn lẫn 1 thể tích dung dịch Na3PO4 0,005 M với 4 thể tích AgNO3 0,005 4
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học
b) Trộn lẫn 4 thể tích dung dịch Na3PO4 0,001 M với 1 thể tích AgNO3 0,02 M
Cho biết T(Ag3PO4) = 1,8.10-18.
ĐS : a) 6,4.10-11, b) 5,12.10-11: đều có kết tủa.
9. Tính nồng độ CM của dung dịch HCOOH để 95% acid này không bị điện ly. Cho biết ở 25oC, KHCOOH = 1,77.10-4. ĐS : 0,067 M
10. Ở một nhiệt độ T, dung dịch acid HCN có nồng độ 0,2 M có hằng số Ka = 4,9.10-10. Xác
định nồng độ H3O+ và độ điện ly α ?
ĐS : α = 4,95.10-5 , [H3O+] = 0,99.10-5
11. Trộn hai thể tích bằng nhau của hai dung dịch BaCl2 0,02 M và Na2SO4 0,001 M. Hỏi có
kết tủa BaSO4 không ? cho biết T(BaSO4) = 1,08.10-10. ĐS : Có kết tủa
12. Tính nồng độ OH- , pH và phần trăm ion hóa của dung dịch NH3 0,2 M. Biết rằng hằng số
base của NH3 ở 25oC là Kb = 1,8.10-5. ĐS : pH = 11,28 , α = 0,95%
13. Xác định nồng độ Ba2+ cần thiết để bắt đầu kết tủa BaSO4 khi cho muối dễ tan BaCl2
dạng tinh thể vào dung dịch Na2SO4 1,5.10-3 M. Giả sử việc thêm muối BaCl2 không làm thay đổi
thể tích dung dịch. Cho biết ở nhiệt độ khảo sát, TBaSO = 1,1.10-10. 4 ĐS : 7,3.10-8M
14. Hãy thiết lập công thức tính độ pH của dung dịch acid mạnh và acid yếu đơn bậc, áp
dụng tính độ pH của dung dịch H2SO4 0,005 M và HCOOH 0,1 M, biết KHCOOH = 2,1.10-4, ở
25oC. Giả sử H2SO4 phân ly hoàn toàn 2 nấc. ĐS: 2; 2,35
15. Trộn dung dịch Pb(NO3)2 0,01 M với dung dịch H2SO4 0,01 M với thể tích bằng nhau.
Chứng minh rằng dung dịch sau khi trộn có kết tủa PbSO4. Cho biết tích số tan của PbSO4 là
1.38.10-8. Tìm nồng độ mol/lit của ion Pb2+ và S 4
O 2- trong dung dịch bão hòa thu được sau khi
PbSO4 ngừng không lắng xuống nữa. ĐS : 1,17.10-4
16. a) Tính độ hòa tan, pH, pOH của dung dịch bão hòa Zn(OH)2. Biết tích số tan của
Zn(OH)2 ở 25oC là 4,3.10-17.
b) Nếu trộn hai thể tích bằng nhau của dung dịch ZnCl2 0,002 M với dung dịch NaOH
0,02 M thì có xuất hiện kết tủa không Zn(OH)2 không ?
ĐS : 2,2.10-6; 8,65; có kết tủa
17. a) Cho dung dịch acid HClO 0,1 M (Ka=5.10-8 ở 25 oC). Hãy viết cân bằng điện ly, xác
định độ điện ly α, nồng độ H+ và pH của dung dịch ở 25 oC.
b) Có kết tủa CaCO3 hay không khi trộn lẫn 2 thể tích CaCl2 0,0001 M với 3 thể tích
Na2CO3 0,0005 M, biết TCaCO3 = 9,3.10-9 ở 25 oC.
ĐS: 7,07.10-4; 4,15; có kết tủa
18. A là dung dịch HCl có pH=1. B là dung dịch Ba(OH)2 có pH=13.
a) Tính nồng độ mol của chất tan, nồng độ mol của từng ion có trong dung dịch A cũng như dung dịch B. 5
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học
b) Trộn 2,25 lit dung dịch A với 2,75 lit dung dịch B được 5,00 lit dung dịch C. Tìm pH của dung dịch C. ĐS: 0,1 M, 0,05 M, pH=12
19. Có 1 lit dung dịch HNO3 2 M.
a) Cần thêm vào một lit dung dịch acid trên bao nhiêu lit dung dịch NaOH 1,8 M để thu
được dung dịch có pH=1?
b) Cần thêm vào một lit dung dịch acid trên bao nhiêu lit dung dịch NaOH 1,8 M để thu
được dung dịch có pH=13? ĐS: 1,0 lit, 1,235 lit
20. Cho hai dung dịch chứa lượng nước như nhau. Dung dịch A chứa 0,2 mol CaCl2, dung
dịch B chứa 0,5 mol saccharose (C12H22O11). Cả hai dung dịch này sôi ở cùng một nhiệt độ ở một
áp suất xác định. Tính độ điện ly biểu kiến của CaCl2 trong nước.
21. Một dung dịch acid benzoic C6H5COOH có pH=2,85. Tính nồng độ dung dịch acid này
biết ở nhiệt độ khảo sát acid benzoic có Ka=6,46.10-5. ĐS: 0,032 M
22. Thêm từ từ NaOH rắn vào dung dịch Mg(NO3)2 0,01 M (giả sử không có sự thay đổi thể
tích). Tính pH tại đó Mg(OH)2 bắt đầu kết tủa. Cho biết tích số tan của Mg(OH)2 tại 25oC là 1,2.10-11. ĐS: pH=9,54
23. Cho 5 ml dung dịch Ca(NO3)2 0,02M vào ống nghiệm 1 và 5 ml dung dịch AgNO3
4.10-3M vào ống nghiệm 2. Sau đó đồng thời cho vào 2 ống nghiệm trên mỗi ống 5 ml
dung dịch Na3PO4 0,1 M. Biết tích số tan của Ca3(PO4)2 và Ag3PO4 ở nhiệt độ khảo sát
lần lượt là 1,2.10-26 và 1,8.10-18. Hỏi ống nào có xuất hiện kết tủa.
24. Ở 25oC, tích số tan của SrSO4 bằng 3,8.10-7. Khi trộn 1 thể tích dung dịch SrCl2 0,004M
với 4 thể tích dung dịch K2SO4 0,002 M thì có kết tủa SrSO4 không ?
25. Tính pH của dung dịch H2SO4 0,1M, biết acid này phân ly hoàn toàn nấc thứ nhất còn nấc
thứ 2 phân ly với hằng số acid Ka=1,2x10-2.
26. Cho dung dịch chứa a gam chất điện ly có phân tử lượng là A trong m gam nước. Biết
dung dịch này sôi ở nhiệt độ ts, hằng số nghiệm sôi của nước là Ks, bậc phân ly của A là
q. Tính độ điện ly biểu kiến của A trong nước theo các giá trị đã cho biết thí nghiệm này
được thực hiện ở áp suất 1atm.
27. Cho 1 lit dung dịch CaCl2 2.10-2M vào 1 lit dung dịch Na2SO4 2.10-2M. Hỏi có kết tủa
CaSO4 hay không, biết TCaSO =6.10-5. 4
28. Tích số tan của Zn(OH)2 ở 25oC được ký hiệu là T. Hãy thiết lập biểu thức tính pH của
dung dịch bão hòa Zn(OH)2 ở nhiệt độ đó và biểu thức tính ΔG0 của phản ứng hòa tan
Zn(OH)2 trong dung dịch bão hòa ở nhiệt độ đã cho theo T.
29. Dung dịch A là dung dịch SrCl2 có chứa 0,159 g chất tan trong 1 lít dung dịch. Dung dịch
B là dung dịch bão hòa CaSO4 ở 25oC. Biết tích số hòa tan ở 25oC của SrSO4 và của
CaSO4 lần lượt bằng 3,8.10-7 và 6,1.10-5. Hỏi khi trộn 20 ml dung dịch A với 20 ml dung
dịch B ở 25oC thì có xuất hiện kết tủa không ? 6
BÀI TẬP HÓA ĐẠI CƯƠNG
Chương 9: Cân bằng hóa học
30. Tính pH của các dung dịch sau đây ở 25oC:
a) Dung dịch hypobromua HBrO 0,105 M. Biết pKa=8,6.
b) Dung dịch Ba(OH)2 8,82.10-3M. ĐS: 4,79; 12,24
31. Hòa tan 0,02 mol NH3 và 0,01 mol KOH thành 1 lít dung dịch. Tính nồng độ ion amoni
trong dung dịch này. Cho biết hằng số base của NH3 là KNH3 = 1,8x10-5. ĐS: 3,6.10-5M 7




