



Preview text:
9/12/2025 Chương 4 ĐỘNG HÓA HỌC
TỐC ĐỘ PHẢN ỨNG HÓA HỌC Nội dung chương 4: -Giới thiệu chung
- Định nghĩa tốc độ phản ứng
- Biểu diễn phương trình tốc độ phản ứng - Cơ chế phản ứng
- Thiết lập phương trình động học cho phản ứng: + Bậc 0 + bậc 1 + Bậc 2 9/12/2025
I. Định nghĩa tốc độ phản ứng
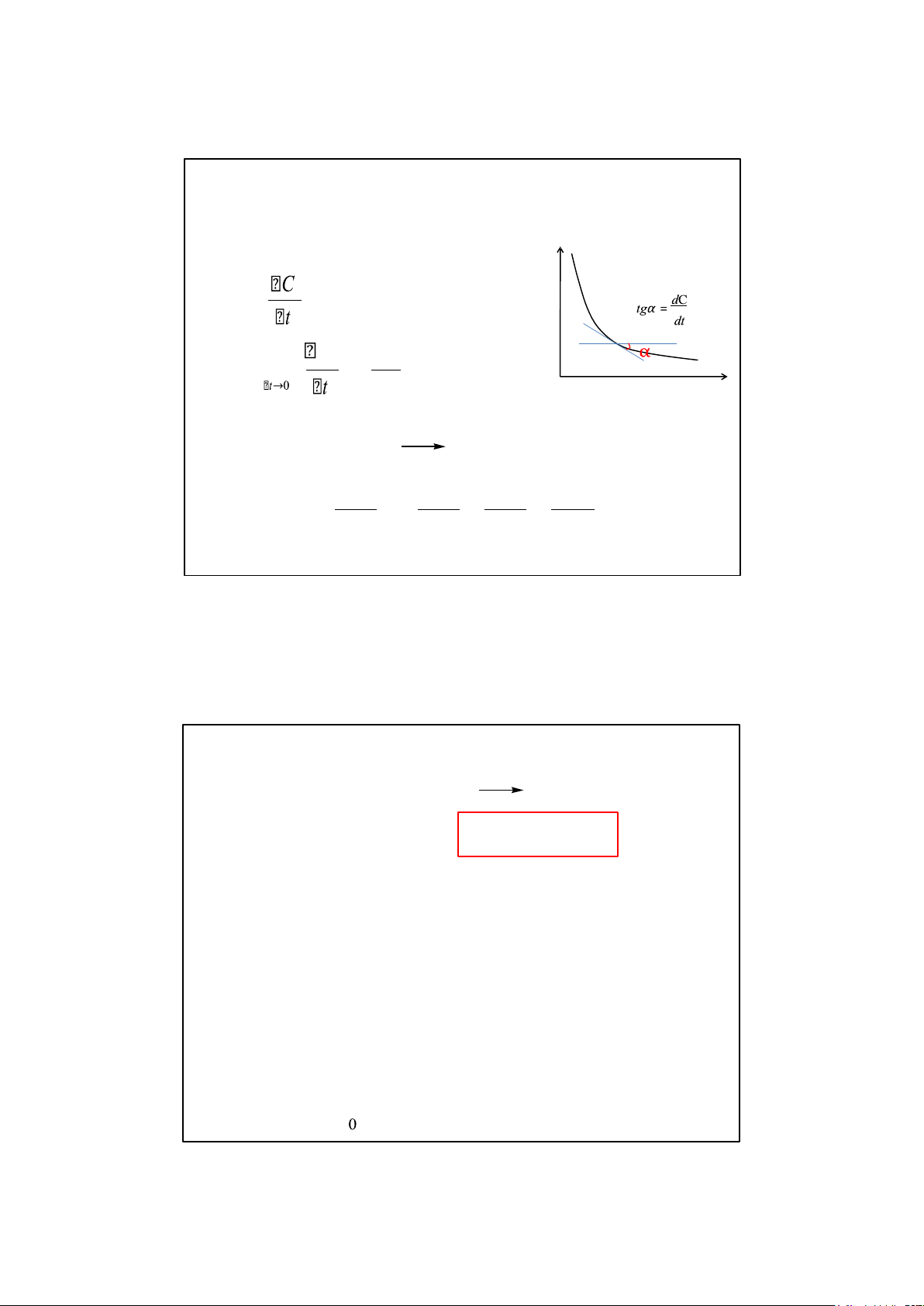
Tốc độ phản ứng là sự biến thiên nồng độ các chất phản ứng (hay sản
phẩm phản ứng) trong một đơn vị thời gian C V = Vận tốc trung bình dC V = lim( C) = Vận tốc tức thời dt t aA + bB cC + dD
V = – dCA = – dCB = dCC = dCD a.dt b.dt c.dt d.dt
I. Phương trình biểu diễn tốc độ phản ứng Xét phản ứng: aA + bB cC + dD
Định luật tác dụng khối lượng: V = k.[A]a[B]b
a: bậc phản ứng riêng của A
b: bậc phản ứng riêng của B
a + b: bậc phản ứng tổng
k: hằng số tốc độ phản ứng
Để xác định bậc phản ứng riêng của một chất người lấy rất dư các chất
phản ứng còn lại, lúc đó xem như nồng độ các chất rất dư là hằng số
trong suốt quá trình phản ứng
VD: trong phản ứng trên khi lấy rất dư B thì:
V = k.[A]a[B ]b = k'[A]a Với k’ = k[B ]b 0 9/12/2025 Lưu ý:
Với những phản ứng không tuân theo định luật tác dụng khối lượng thì:
V = k.[A]a'[B]b' a’ ≠ a; b’ ≠ b
Những phản ứng không tuân theo định luật tác dụng khối lượng thường
là các phản ứng phức tạp (có nhiều giai đoạn, nhiều phân tử tham gia phản ứng) Ví dụ: [H ][Br ]1/ 2 H2 + Br V = k 2 2 [HBr 2 ] 2HBr 1+ k ' [Br ] 2 Br 2Br Khơi mào 2 Br + H2 HBr + H Phát triển mạch H + Br2 HBr + Br H + Br HBr Ngắt mạch
Trường hợp chung: a, b là các hằng số, được xác định bằng thực nghiệm. 9/12/2025
➢ Để phản ứng xảy ra thì cần phải có sự va chạm đồng thời của a
phân tử A và b phân tử B và các va chạm này phải:
- Có năng lượng xác định (yếu tố năng lượng)
- Có định hướng xác định (yếu tố định hướng)
Các phân tử thỏa mãn 2 yếu tố này gọi là các phân tử hoạt động
Va chạm giữa các phân tử hoạt động gọi là va chạm hoạt động
➢ Với phản ứng xảy ra qua nhiều giai đoạn thì tốc độ của phản ứng
sẽ là tốc độ của giai đoạn chậm nhất
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
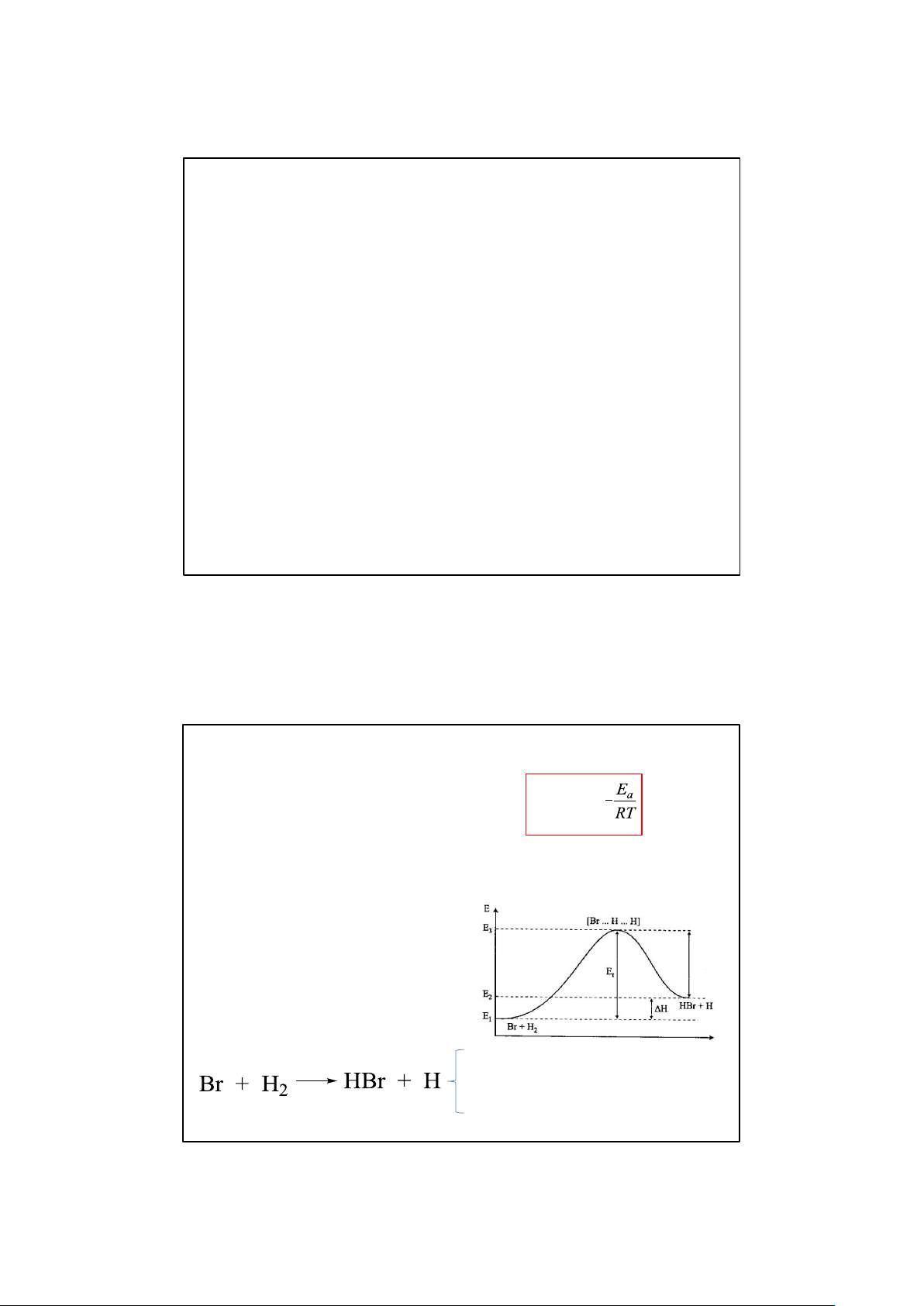
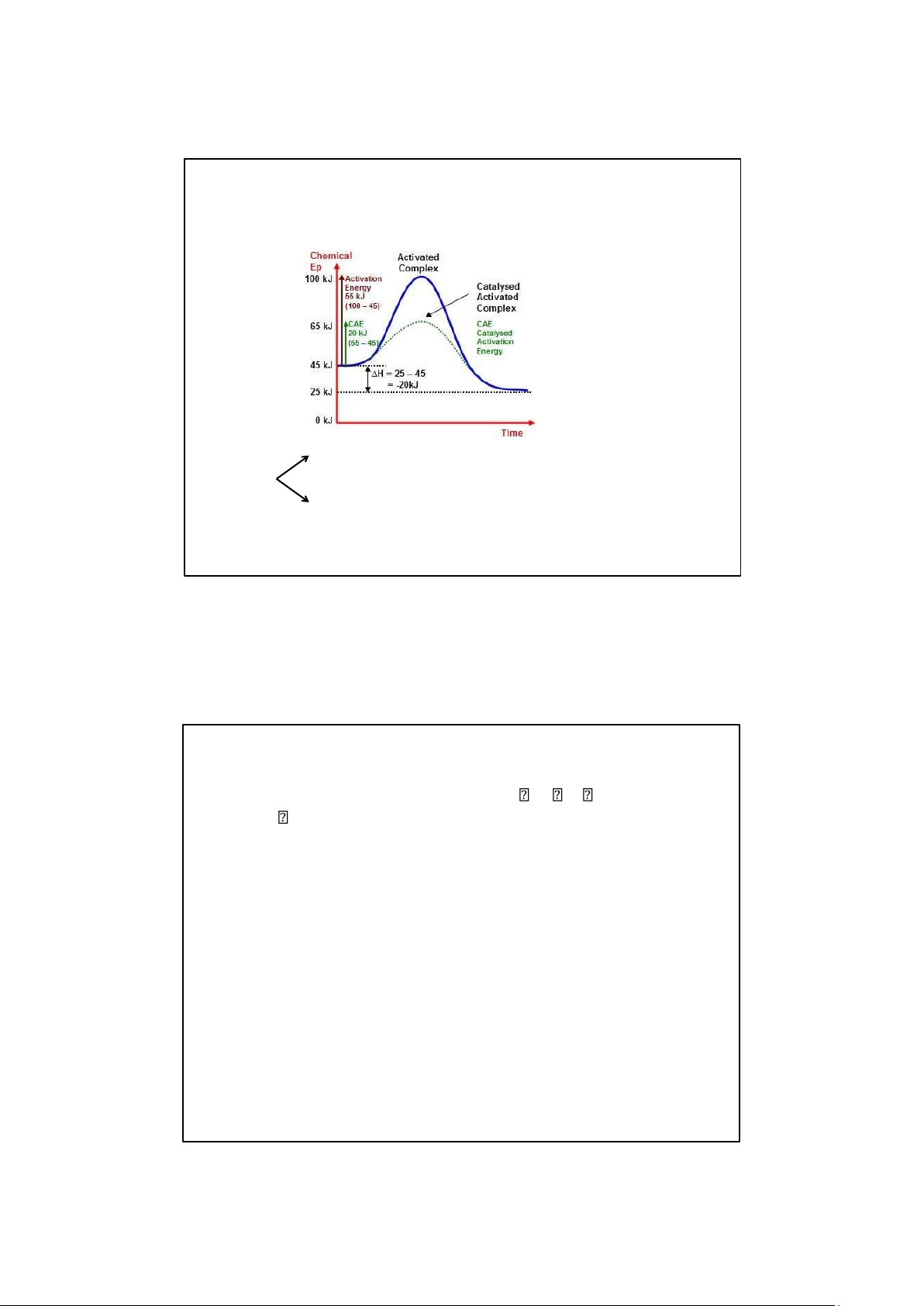
1. Ảnh hưởng của nhiệt độ Phương trình Arrhenius: k = A.e
k: hằng số tốc độ
R: Hằng số khí (R = 8,314 J/mol.K = 6,314 Pa.m3/mol.K
A: đặc trưng cho yếu tố định hướng của các phân tử hoạt động
Ea: Tổng năng lượng hoạt động
hóa của các chất tham gia phản Ea Ea
ứng (năng lượng hoạt hóa của phản ứng) Ví dụ: P/ư thuận: Ea = E3 – E1 P/ư ngịch: Ea = E3 – E2 9/12/2025
Hiệu ứng nhiệt của phản ứng: ∆H = Ea(t) – Ea(ng) E 1
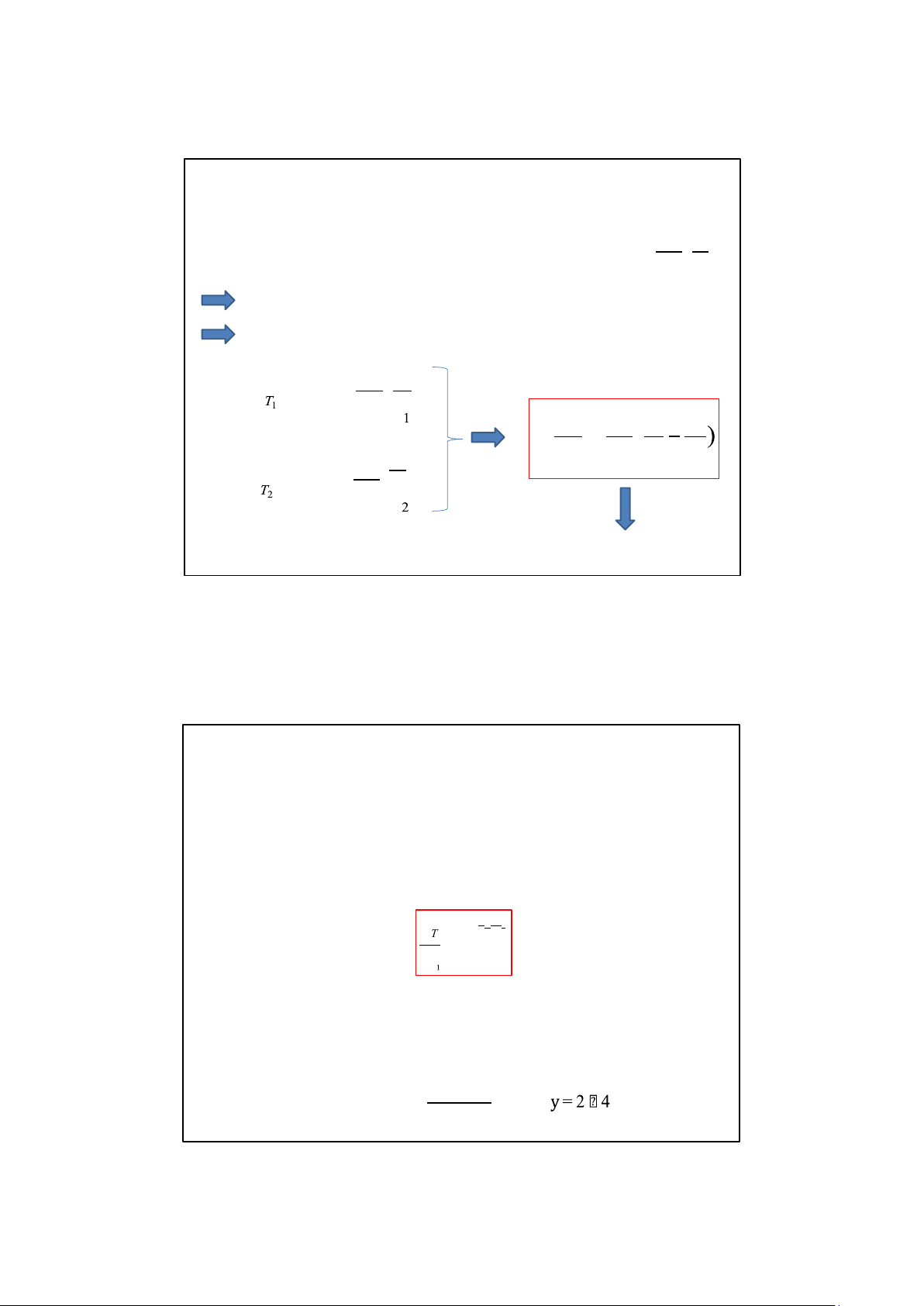
Dạng logarite của phương trình Arrhenius: lnk = ln A– a . R T
Quan hệ giữa lnk và 1/T là quan hệ tuyến tính
Để xác định E → xác định k ở một số T → lập đồ thị → E/R E 1
lnk = ln A– a . R T k T2 a E 1 1 ln = ( E 1 kT R T T
lnk = ln A– a . 1 1 2 R T
Biết được kT1, kT2 sẽ tính được Ea
Quy tắc Van’t Hoff về ảnh hưởng của nhiệt độ đến tốc độ phản ứng:
Van’t Hoff nhận thấy rằng: khi nhiệt độ tăng 10o thì tốc độ phản ứng
thương tăng từ 2 đến 4 lần
Nếu nhiệt độ phản ứng tăng từ T1 đến T2 thì: V T2 –T1 T 10 2 = y VT
y: Hệ số nhiệt độ của tốc độ phản ứng: là số lần tăng tốc độ phản ứng khi nhiệt độ tăng 10o k y = (T +10) kT 9/12/2025
2. Ảnh hưởng của xúc tác
Chất xúc tác: làm tăng tốc độ phản ứng
Xúc tác đồng thể: chất x/t và chất p/ư ở cùng 1 pha Xúc tác
Xúc tác dị thể: chất x/t và chất p/ư ở các pha khác nhau
Chất ức chế: làm giảm tốc độ phản ứng
http://www.smartlearner.mobi/science/ReactionRatesEquilibrium/Rates_3.htm
a) Đặc điểm của quá trình xúc tác
- Không làm thay đổi đặc trưng nhiệt động ( H, S, G) của phản
ứng (nếu G âm thì nó vẫn cứ âm), cụ thể:
+ Nếu phản ứng không xảy ra về mặt nhiệt động thì thêm xúc tác
cũng không làm phản ứng xảy ra,
+ Chất xúc tác không làm thay đổi cân bằng phản ứng
- Sự xúc tác có tính chọn lọc: chỉ xúc tác cho 1 phản ứng hoặc 1 loại phản ứng 9/12/2025 b) Cơ chế xúc tác ➢ Xúc tác đồng thể
+ Chất xúc tác tham gia vào phản ứng trung gian với các chất phản ứng
làm giảm năng lượng hoạt động hóa của hệ ➢ Xúc tác dị thể
+ Phản ứng xúc tác xảy ra trên bề mặt tiếp xúc pha
+ Hấp phụ hóa học đóng vai trò quan trọng, vì:
- Nồng độ chất p/ư tại bề mặt xt tăng
- Chất phản ứng bị hoạt hóa
III. Cơ chế phản ứng
Là tập hợp tất cả các giai đoạn cơ sở của phản ứng Br2 2Br Khơi mào Br + H2 HBr + H Phát triển mạch H + Br2 HBr + Br H + Br HBr Ngắt mạch
Nguyên tắc thiết lập cơ chế phản ứng
+ Thu thập dữ liệu thực nghiệm của phản ứng
+ Viết các phản ứng có thể
+ Giả sử một cơ chế phản ứng
+ Kiểm tra sự phù hợp với thực nghiệm 9/12/2025
Một cơ chế được chấp nhận khi nó giải thích thỏa đáng các dữ liệu thực nghiệm
+ Một phản ứng có thể có nhiều cơ chế
+ Cơ chế được chấp nhận hôm nay nhưng ngày mai có thể sẽ
không được chấp nhận.
Mọi cơ chế chỉ là giả thuyết
IV. Các phương trình động học của phản ứng hóa học
Là phương trình biểu diễn quan hệ giữa nồng độ chất phản ứng và thời gian phản ứng
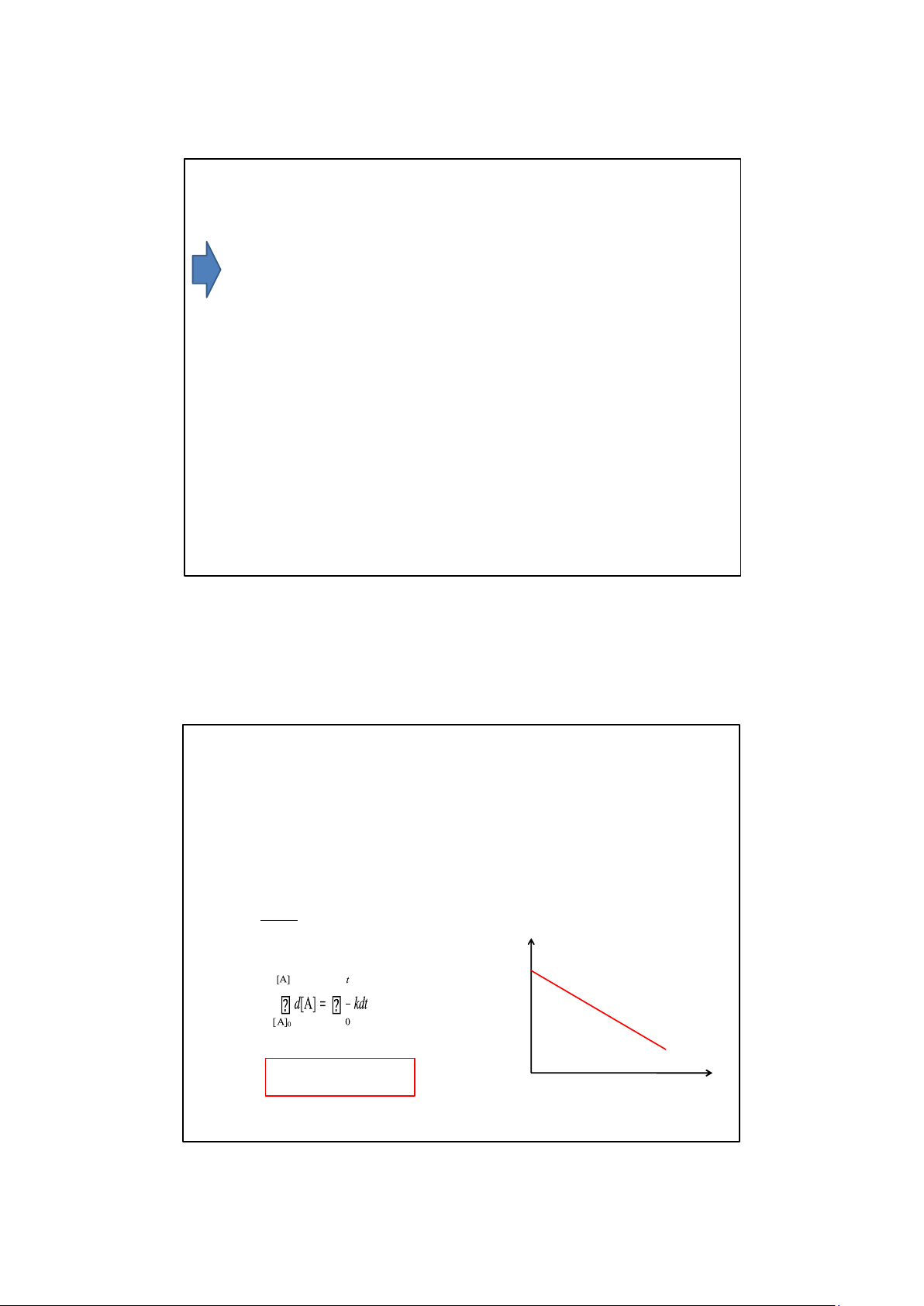
1. Phản ứng bậc không
Là phản ứng mà tốc độ không phụ thuộc nồng độ d[A] V = – = k d[A] = –kdt dt [A] [A] 0 [A] = [A]0 – kt 0 t 9/12/2025
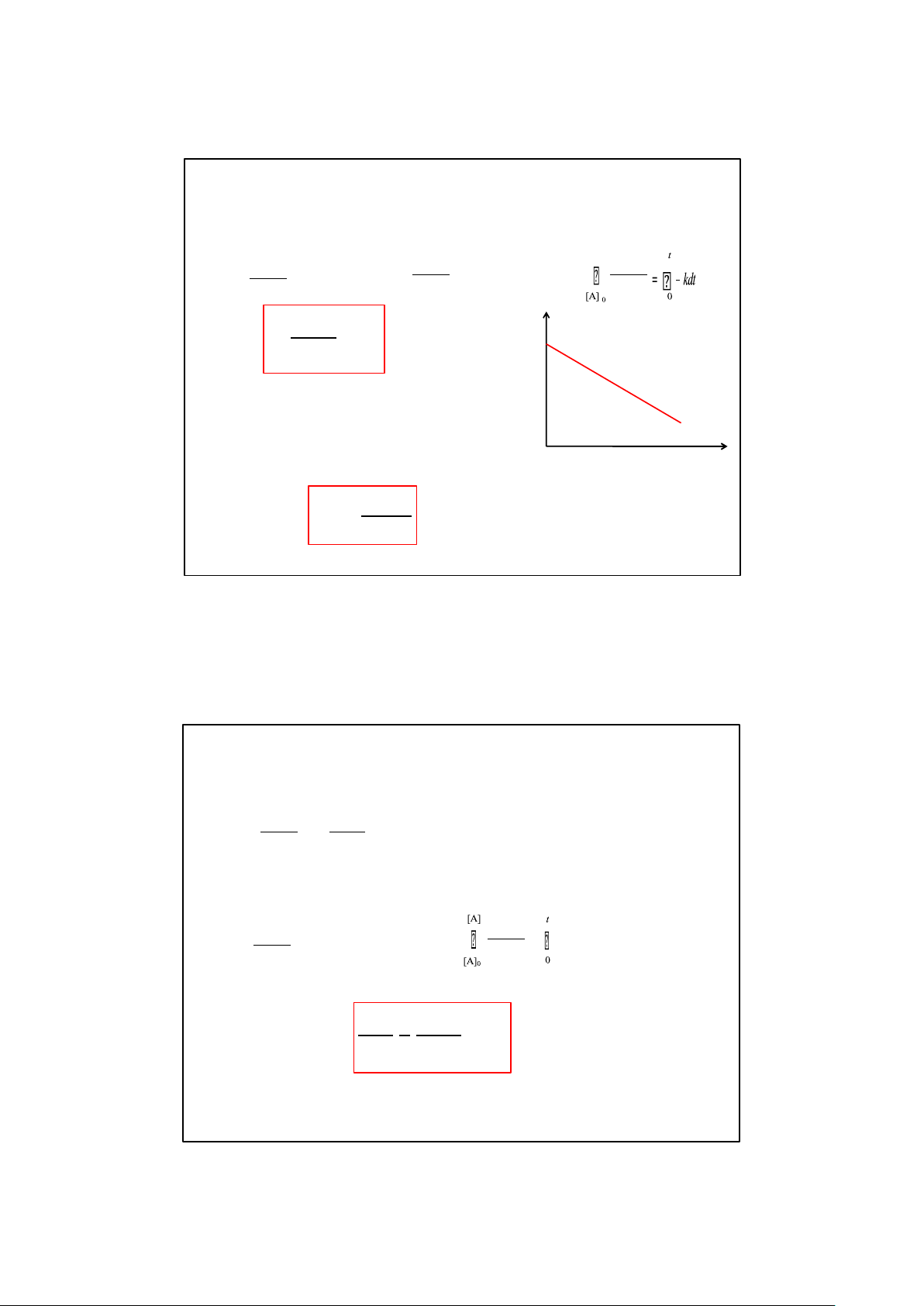
2. Phản ứng bậc một
Phản ứng bậc 1 có dạng: A → Sản phẩm [A] d[A] d[A] d[A] V = – = k[A] = –kdt dt [ A] [A] [A]0 ln[A] ln = kt ln[A]0 [A]
➢ Thời gian nữa phản ứng:
Là thời gian lượng chất phản ứng bị tiêu thụ một nữa 0 t t = 0,693 1/ 2 k
2. Phản ứng bậc hai
Phản ứng bậc 2 có dạng: A + B → Sản phẩm d[A] d[B] V = – = – = k[A][B] dt dt
Trường hợp đơn giản: Nồng độ ban đầu và hệ số tỷ lượng của A và B như nhau d[A] d[A] – = k[A]2 = – kdt [A]2 dt 1 1 = kt [A] [A]0 9/12/2025
Xác định bậc phản ứng Cách 1:
Vẽ đồ thị trong excel theo các bậc phản ứng khác nhau, sau đó so sánh R2 Cách 2:
Xác định k theo các bậc biến thiên, nếu k không đổi thì có thể kết luận BÀI TẬP 1, 3, 6, 8, 10, 11 SGK 9/12/2025




