





Preview text:
ĐỀ CƯƠNG ÔN TẬP CUỐI KÌ II - MÔN HOÁ HỌC 10 NĂM HỌC 2024-2025
I. PHẢN ỨNG OXI HOÁ – KHỬ
1. Khái niệm cơ bản - Phản ứng oxi hóa-khử
- Chất khử (chất bị oxi hóa)
- Chất oxi hóa (chất bị khử) - Quá trình oxi hóa - Quá trình khử
2. Cách xác định số oxi hóa
3. Cân bằng phản ứng oxi hóa-khử: Phương pháp thăng bằng electron
II. BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HOÁ HỌC
- Khái niệm phản ứng tỏa nhiệt, thu nhiệt
- Khái niệm enthalpy tạo thành (nhiệt tạo thành) ∆ 𝑜 𝑜
𝑓𝐻298 và biến thiên enthalpy (nhiệt phản ứng) ∆𝑟𝐻298 của phản ứng hoá học
- Ý nghĩa của dấu và giá trị ∆ 𝑜 𝑟𝐻298. - Công thức tính: o Từ enthalpy tạo thành:
o Từ năng lượng liên kết:
III. TỐC ĐỘ PHẢN ỨNG
- Định nghĩa tốc độ phản ứng, công thức tính tốc độ trung bình.
- Viết biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. Ý nghĩa hầng số tốc độ phản ứng.
- Các yếu tố ảnh hưởng: Nồng độ, áp suất (với khí), nhiệt độ, diện tích bề mặt, chất xúc tác. Ý nghĩa
hệ số nhiệt độ Van’t Hoff.
- Vận dụng kiến thức tốc độ phản ứng hoá học vào giải thích một số vấn đề trong cuộc sống và sản xuất. IV. NHÓM HALOGEN
1. Đặc điểm chung của nhóm Halogen:
- Vị trí trong bảng tuần hoàn, cấu hình electron lớp ngoài cùng.
- Tính chất vật lý (trạng thái, màu sắc, nhiệt độ sôi, độ tan...).
- Xu hướng nhận electron, độ âm điện.
- Cấu tạo nguyên tử, phân tử.
2. Tính chất hóa học đặc trưng:
- Tác dụng với kim loại (tạo muối halogenua). - Tác dụng với hydrogen.
- Tác dụng với nước, dung dịch kiềm.
- Tác dụng với dung dịch halide.
- Khả năng oxi hóa của các halogen (F₂ > Cl₂ > Br₂ > I₂).
3. Điều chế chlorine
V. BÀI TẬP (tất cả các bài tập trong SGK và SBT) LUYỆN TẬP
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn
Câu 1. Trong các chất sau, chất nào trong đó chlorine có số oxi hóa thấp nhất? A. Cl2. B. KCl. C. NaClO. D. KClO3.
Câu 2. Trong các chất sau, chất nào trong đó chlorine có số oxi hóa cao nhất? A. Cl2. B. KCl. C. NaClO. D. KClO3.
Câu 3. Cho phản ứng hoá học: H2SO4 đặc + 8HI → 4I2 + H2S + 4H2O.
a. Trong phản ứng trên, chất đóng vai trò chất oxi hoá là A. HI. B. H2SO4. C. H2S. D. H2O.
b. Trong phản ứng trên, chất đóng vai trò chất khử là A. HI. B. H2SO4. C. I2. D. H2O.
Câu 4. Phát biểu nào sau đây là đúng khi nói về phản ứng của copper (II) sulfate với iron? Biết phương trình
hoá học xảy ra như sau: CuSO4 + Fe → FeSO4 + Cu.
A. Nguyên tử iron bị khử.
B. Copper (II) sulfate bị oxi hóa.
C. Nguyên tử iron nhận electron.
D. Copper (II) sulfate là chất nhận electron.
Câu 5. Phát biểu nào sau đây là đúng khi nói về phản ứng của copper (II) sulfate với magnesium? Biết phương
trình hoá học xảy ra như sau: CuSO4 + Mg → MgSO4 + Cu.
A. Nguyên tử magnesium bị khử.
B. Copper (II) sulfate bị oxi hóa.
C. Nguyên tử magnesium nhường electron.
D. Copper (II) sulfate là chất nhường electron.
Câu 6. Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm?
A. Phản ứng tỏa nhiệt. B. Phản ứng thu nhiệt.
C. Phản ứng oxi hóa – khử. D. Phản ứng phân hủy.
Câu 7. Biến thiên enthalpy của phản ứng nào sau đây có giá trị dương?
A. Phản ứng tỏa nhiệt. B. Phản ứng thu nhiệt.
C. Phản ứng oxi hóa – khử. D. Phản ứng phân hủy.
Câu 8. Enthalpy tạo thành chuẩn của các đơn chất bền bằng
A. +1 kJ mol-1. B. -1 kJ mol-1. C. +2 kJ mol-1. D. 0 kJ mol-1.
Câu 9. Loại phản ứng nào sau đây cần phải cung cấp năng lượng trong suốt quá trình phản ứng?
A. Phản ứng tạo gỉ kim loại.
B. Phản ứng quang hợp.
C. Phản ứng nhiệt phân.
D. Phản ứng đốt cháy.
Câu 10. Biến thiên enthalpy chuẩn của phản ứng nào dưới đây chính là enthalpy tạo thành chuẩn của AlCl3(s)?
A. Al(s) + 3Cl2(g) → AlCl3(s).
B. Al(s) + 3Cl(g) → AlCl3(s). 3
C. 3HCl(aq) + Al(OH)3(s) → AlCl3(s) + 3H2O(l).
D. Al(s) + Cl2(g) → AlCl3(s). 2
Câu 11. Biến thiên enthalpy chuẩn của phản ứng nào dưới đây chính là enthalpy tạo thành chuẩn của NO(g)? 1 1 1
A. N2(g) + O2(g) → NO(g).
B. NO(g) + O2(g) → NO2(g). 2 2 2
C. N2(g) + O2(g) → 2NO(g).
D. NH3(g) + 2O2(g) → NO(g) + 3H2O(l).
Câu 12. Cho phản ứng hoá học xảy ra ở điều kiện chuẩn sau: 2NO2(g) (đỏ nâu) ⎯⎯ → N2O4(g) (không màu) Biết NO2 và N2O4 có o
H tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng f 298
A. toả nhiệt, NO2 bền vững hơn N2O4.
B. thu nhiệt, NO2 bền vững hơn N2O4.
C. toả nhiệt, N2O4 bền vững hơn NO2.
D. thu nhiệt, N2O4 bền vững hơn NO2.
Câu 13. Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 ⎯⎯
→ 2HCl. Biểu thức tốc độ trung bình của phản ứng là C C C C C C − A. H2 Cl2 HCl v = = = . B. H2 Cl2 HCl v = = = . t t t t t t − C − C C − C − C C C. H2 Cl2 HCl v = = = . D. H2 Cl2 HCl v = = = . t t t t t 2 t
Câu 14. Cho phản ứng đơn giản sau: 2NO(g) + O2 (g) → 2NO2 (g). Biểu thức tốc độ của phản ứng là A. v = k[NO]2 [O2]. B. v = k[NO][O2]. C. v = k[NO2]2. D. v = k[NO]2.
Câu 15. Yếu tố nào sau đây không ảnh hưởng đến tốc độ của phản ứng chỉ có chất rắn?
A. Nhiệt độ. B. Áp suất.
C. Diện tích tiếp xúc. D. Chất xúc tác.
Câu 16. Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu
3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời
gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t1 < t2 < t3.
B. t1 = t2 = t3.
C. t3 < t2 < t1. D. t2 < t1 < t3.
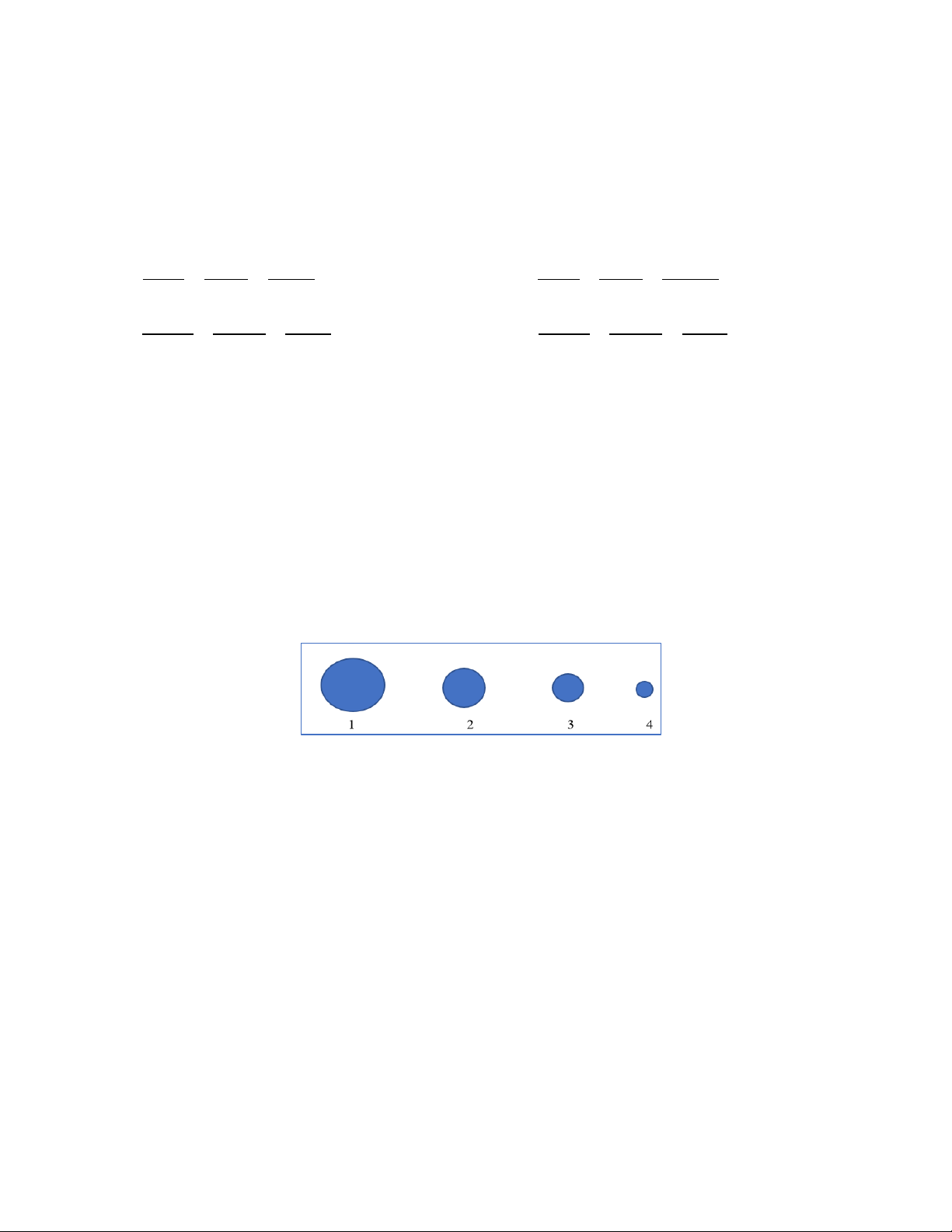
Câu 17. Cho lần lượt 100 gam đá vôi (CaCO3) phản ứng với dung dịch HCl 2 M dư. Đá vôi được dùng ở dạng
hạt kích cỡ được kí hiệu như sau
Phản ứng nào xảy ra chậm nhất? A. 3. B. 1. C. 2. D. 4.
Câu 18: Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây không đúng khi
giải thích cho việc sử dụng nồi áp suất?
A. Tăng áp suất và nhiệt độ lên thức ăn.
B. Giảm hao phí năng lượng.
C. Giảm thời gian nấu ăn.
D. Tăng diện tích tiếp xúc thức ăn và gia vị.
Câu 19: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6.
Câu 20: Phát biểu nào đúng khi nói về nhóm halogen?
A. Các halogen tác dụng với hydrogen tạo khí hydrogen halide.
B. Trong nhóm halogen, từ fluorine đến iodine, tính oxi hoá tăng dần.
C. Các halogen không độc, không màu, không tan trong nước.
D. Halogen tồn tại ở dạng đơn chất trong tự nhiên.
Câu 21: Phát biểu nào không đúng khi nói về nhóm halogen?
A. Đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hoá trị có cực.
B. Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy tăng dần.
C. Trong dãy hydrogen halide, từ HF đến HI, năng lượng liên kết giảm dần.
D. Các nguyên tố halogen tồn tại ở dạng hợp chất trong tự nhiên, phổ biến là muối của flourine và chlorine.
Câu 22. Trong nhóm halogen, từ fluorine đến iodine, tính oxi hoá biến đổi như nào? A. Tăng dần. B. Giảm dần. C. Không đổi. D. Tuần hoàn.
Câu 23. Trong nhóm halogen, từ fluorine đến iodine, nhiệt độ nóng chảy biến đổi như nào? A. Tăng dần. B. Giảm dần. C. Không đổi. D. Tuần hoàn.
Câu 24: Phản ứng hoá học giữa hydrogen và chlorine xảy ra trong điều kiện:
A. Trong bóng tối, nhiệt độ thường. B. Khi có ánh sáng.
C. Ở nhiệt độ thấp.
D. Trong bóng tối, nhiệt độ cao.
Câu 25: Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là A. F2. B. Cl2. C. Br2. D. I2.
Câu 26. Phản ứng hóa học nào dưới đây viết sai? o a /s t A. H ⎯⎯→ ⎯⎯→ 2 + Cl2 2HCl. B. Fe + Cl2 FeCl2. o t C. 2Al + 3Cl ⎯⎯ → 2 2AlCl3. D. Cl2 + H2O HCl + HClO.
Câu 27: Trong phòng thí nghiệm người ta thường điều chế chlorine bằng cách nào?f
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl có màng ngăn.
C. phân huỷ khí HCl.
D. cho HCl đặc tác dụng với MnO2 ; KMnO4…
Câu 28: Trong công nghiệp người ta thường điều chế chlorine bằng cách
A. điện phân nóng chảy NaCl.
B. điện phân dung dịch NaCl có màng ngăn.
C. cho F2 đẩy Cl2 ra khỏi dd NaCl.
D. cho HCl đặc tác dụng với MnO2, đun nóng.
PHẦN II. Câu trắc nghiệm đúng sai
Câu 1. Các nguyên tố nhóm VIIA được gọi là nguyên tố halogen. Tiến hành thí nghiệm cho dung dịch của các
halogen Cl2, Br2, I2 vào các muối sodium halide: NaCl, NaBr, NaI. Kết quả thu được như sau: I2 Br2 Cl2 NaI Không phản ứng Có phản ứng Có phản ứng NaBr Không phản ứng Không phản ứng Có phản ứng NaCl Không phản ứng Không phản ứng Không phản ứng
a) Halogen có tính oxi hóa mạnh nhất là I2.
b) Tính oxi hóa của các halogen Cl2, Br2, I2 được xếp theo chiều giảm dần là I2 > Br2 > Cl2.
c) Phương trình phản ứng giữa Br2 và NaI được viết như sau: Br2 + 2NaI → 2NaBr + I2.
d) Thí nghiệm trên dùng để so sánh tính oxi hóa của các phân tử halogen.
Câu 2. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O (g) → 2NO (g) . (1) 2 2
a) Biểu thức tốc độ của phản ứng (1) là 2 v = k[NO] [O ] . 2
b) Khi tăng nồng độ thì tốc độ phản ứng tăng.
c) Ở nhiệt độ không đổi, khi nồng độ NO tăng 3 lần, nồng độ O2 không đổi thì tốc độ phản ứng tăng 3 lần.
d) Trong biểu thức tính tốc độ phản ứng, hằng số tốc độ (k) chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Câu 3. Cho phản ứng đơn giản sau: H2(g) + Cl2(g) → 2HCl(g)
a) Biểu thức tốc độ tức thời phản ứng là v = k.[H ].[Cl ] 2 2 .
b) Trong phản ứng trên, khi tăng nồng độ tốc độ phản ứng tăng.
c) Khi nồng độ H2 giảm 2 lần và giữ nguyên nồng độ Cl2 tốc độ phản ứng giảm 4 lần.
d) Tốc độ phản ứng tỉ lệ thuận với nồng độ của của H2, Cl2 với số mũ là hệ số tỉ lượng của chất đó trong phương trình phản ứng.
PHẦN III: Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 1. Trong số các đơn chất halogen sau: F2, Cl2, Br2, I2. Có bao nhiêu chất là chất khí ở nhiệt độ thường?
Câu 2. Trong số các đơn chất halogen sau: F2, Cl2, Br2, I2. Có bao nhiêu chất là chất lỏng ở nhiệt độ thường?
Câu 3. Dẫn 7,437 L khí chlorine (ở đkc) vào bình chứa 2,8 gam iron. Sau phản ứng thu được bao nhiêu gam chất rắn?
Câu 4. Thả một mảnh magnesium có khối lượng 0,3 gam vào dung dịch HCl loãng. Sau 6 giây thấy mảnh
magnesium tan hết. Hãy tính tốc độ trung bình của phản ứng hòa tan magnesium (g/s).
Câu 5. Phản ứng giữa sulfur dioxide và oxygen là tỏa nhiệt 0 2SO H 2(g) + O2(g) ⎯⎯ → 2SO3(g) r 298 = -197kJ 1
Giá trị biến thiên enthalpy của phản ứng SO3(g) ⎯⎯
→ SO2 + 2 O2 (g) là bao nhiêu?
Câu 6: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243
kJ/mol, Eb (H – Cl) = 432 kJ/ mol. Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? o t
Câu 7. Cho phản ứng hóa học: 3Cl ⎯⎯→ 2 + 6KOH 5KCl + KClO3 + 3H2O.
a. Số nguyên tử chlorine đóng vai trò chất khử trong phương trình phản ứng đã cho là bao nhiêu?
b. Số nguyên tử chlorine đóng vai trò chất oxi hoá trong phương trình phản ứng đã cho là bao nhiêu?
Câu 8. Cho phản ứng đơn giản: A + 2B → C. Cho biết nồng độ ban đầu của chất A là 0,3 M; chất B là 0,5 M
và hằng số tốc độ k = 0,4. Tính tốc độ phản ứng tại thời điểm t khi nồng độ chất A giảm 0,1 M.
PHẦN IV: Tự luận
Câu 1. Cho các phản ứng oxi hóa – khử: 1) KMnO4 + KNO2 + H2SO4 ⎯⎯
→ MnSO4 + K2SO4 + KNO3 + H2O
2) FeSO4 + KMnO4 + H2SO4 ⎯⎯
→ Fe2(SO4)3 + MnSO4 + K2SO4 + H2O 3) Na2SO3 + KMnO4 + H2O ⎯⎯ → Na2SO4 + MnO2 + KOH 4) Cr2O3 + KNO3 + KOH ⎯⎯ → K2CrO4 + KNO2 + H2O 5) K2Cr2O7 + HCl ⎯⎯ → KCl + CrCl3 + Cl2 + H2O 6) NaClO + KI + H2SO4 ⎯⎯ → I2 + NaCl + K2SO4 + H2O 7) CrI3 + Cl2 + KOH ⎯⎯ → K2CrO4 + KIO4 + KCl + H2O 8) Fe3O4 + HNO3 ⎯⎯ → Fe(NO3)3 + NxOy + H2O o 9) FeS t ⎯⎯→ 2 + H2SO4 đặc Fe2(SO4)3 + SO2 + H2O o 10) M t ⎯⎯→ xOy + H2SO4 đặc M2(SO4)n + SO2 + H2O 11) Mg + HNO3 ⎯⎯
→ Mg(NO3)2 + N2O + N2 + NH4NO3 + H2O
Biết tỉ lệ mol của N2O : N2 : NH4NO3 là 1 : 1 : 1.
a, Xác định số oxi hóa của các nguyên tố trong phương trình hóa học trên.
b, Xác định chất khử, chất oxi hóa.
c, Viết quá trình oxi hóa, quá trình khử.
d, Cân bằng phương trình hóa học trên theo phương pháp thăng bằng electron.
Câu 2. Dựa vào bảng sau: Chất C3H8(g) CO2(g) H2O(g) C6H6(l) o H -105,00 -393,50 -241,82 +49,00 f 298 (kJ/mol)
1.Viết 2 PTHH đốt cháy propane C3H8(g) và benzene C6H6(l) trong khí oxygen tạo thành CO2(g) và H2O(g).
2. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen,
tạo thành CO2(g) và H2O(g).
3. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol propane C3H8(g) trong khí
oxygen, tạo thành CO2(g) và H2O(g).
4. So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt
cháy hoàn toàn 1,0 g benzene C6H6(l).
Câu 3. Bromine là nguyên liệu điều chế các hợp chất chứa bromide trong y dược, nhiếp ảnh, chất nhuộm, chất
chống nổ cho động cơ đốt trong, thuốc trừ sâu,… Để sản xuất bromine từ nguồn nước biển có hàm lượng 82,4
gam NaBr/m3 nước biển người ta dùng phương pháp thổi khí chlorine vào nước biển. Lượng khí chlorine cần
dùng phải nhiều hơn 10% so với lí thuyết. Cần bao nhiêu gam khí chlorine để điều chế bromine có trong 120 m3 nước biển?
Câu 4. Làm muối là nghề phổ biến tại nhiều vùng ven biển Việt Nam. Một hộ gia đình tiến hành làm muối
trên ruộng muối chứa 200 000 L nước biển. Giả thiết 1 L nước biển có chứa 30g NaCl và hiệu suất quá trình
làm muối thành phẩm đạt 60%. Khối lượng muối hộ gia đình thu được bao nhiêu kg.
Câu 5. Theo tính toán của các nhà khoa học, để phòng bệnh bướu cổ và một số bệnh khác, mỗi người cần bổ
sung 1,5.10-4 g nguyên tố iodine mỗi ngày. Nếu lượng iodine đó chỉ được bổ sung từ muối iodine (có 25g KI
trong một tấn muối) thì mỗi người cần bao nhiêu gam muối ăn mỗi ngày?
Câu 6. Phosgene là một chất độc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 -0,3
mg/L, gây tử vong sau khoảng 15 phút. Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than
hoạt tính. Biết: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl)= 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C≡O) = 1075 kJ/mol.
Hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene từ CO và Cl2.
Câu 7. Trong chế độ dinh dưỡng của trẻ sơ sinh và trẻ nhỏ rất chú trọng thành phần sodium chloride (NaCl)
trong thực phẩm. Theo khuyến cáo của Tổ chức Y tế thế giới (WHO), lượng muối cần thiết trong 1 ngày đối
với trẻ sơ sinh là 0,3 g, với trẻ dưới 1 tuổi là 1,5 g, dưới 2 tuổi là 2,3 g. Nếu trẻ ăn thừa muối sẽ ảnh hưởng đến
hệ bài tiết, thận, tăng nguy cơ còi xương,... Trẻ ăn thừa muối có xu hướng ăn mặn hơn bình thường và là một
trong những nguyên nhân làm tăng huyết áp, suy thận, ung thư khi trưởng thành. Tính lượng Ion chloride trong
NaCl cho cơ thể mỗi ngày ở nhóm trẻ dưới 2 tuổi.
Câu 8. Lactic acid hay acid sữa là hợp chất hóa học đóng vai trò quan trọng
trong nhiều quá trình sinh hóa, lần đầu tiên được phân tách vào năm 1780 bởi
nhà hóa học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân
tử C3H6O3, công thức cấu tạo: CH3 - CH(OH) – COOH
Khi vận động mạnh cơ thể không đủ cung cấp oxygen, thì cơ thể sẽ chuyển
hóa glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể
(lactic acid tạo thành từ qua 1trinh2 này sẽ gây mỏi cơ) theo phương trình sau: C6H12O6(aq) ⎯⎯ → 2C3H6O3(aq) 0 H = -150 kJ r 298
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hóa glucose thành lactic acid.
Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng lactic acid tạo ra từ quá trình
chuyển hóa đó (biết 1cal = 4,184 J)
Câu 9. Theo qui định nồng độ cho phép của bromine trong không khí là 2.10-5 g/l. Trong một phân xưởng sản
xuất bromine, người ta đo được nồng độ của bromine là 1.10-4 g/l. Tính khối lượng dung dịch (theo kg)
ammonia 20% phun khắp xưởng đó (có kích thước 100m.200m.6m) để khử độc hoàn toàn lượng bromine trong
không khí. Biết rằng NH3 + Br2 ⎯⎯
→ N2 + NH4Br. Các chất khí đo ở điều kiện chuẩn.



