







Preview text:
TRƯỜNG ĐẠI HỌC KHOA HỌC TỰ NHIÊN - ĐHQGHN ------- VŨ HẢI DƯƠNG K64 Sinh học
ĐỀ CƯƠNG ÔN TẬP HỌC PHẦN
THỰC TẬP HÓA ĐẠI CƯƠNG
Mã học phần : CHE1069
Mã học kỳ: HK201 - Học kỳ 1 năm 2020 - 2021 Tháng 12/2020 MỤC LỤC
CÂU HỎI BÀI 2. PHA DUNG DỊCH VÀ CHUẨN ĐỘ 3
CÂU HỎI BÀI 3. MỘT SỐ KỸ THUẬT TÁCH CHẤT VÀ PHÂN TÍCH
ĐỊNH TÍNH CÁC ION TRONG CÙNG DUNG DỊCH MẪU BẰNG PHƯƠNG PHÁP GIẤY SẮC KÝ 5
CÂU HỎI BÀI 4. PHÂN TÍCH ĐỊNH TÍNH MỘT SỐ ION TRONG CÙNG DỊCH MẪU 5
CÂU HỎI BÀI 5. XÁC ĐỊNH NHIỆT HÒA TAN VÀ SỨC ĐIỆN ĐỘNG CỦA PIN ĐIỆN HÓA 7
CÂU HỎI BÀI 7. CÁC YẾU TỐ ẢNH HƯỞNG TỚI TỐC ĐỘ PHẢN ỨNG HÓA HỌC 8
CÂU HỎI BÀI 8. ĐỘNG HỌC PHẢN ỨNG BẬC 2 - PHẢN ỨNG THỦY PHÂN ESTE 10
CÂU HỎI BÀI 10. ĐIỀU CHẾ VÀ XÁC ĐỊNH ĐỘ TINH KHIẾT CỦA ASPIRIN 10 2
CÂU HỎI BÀI 2. PHA DUNG DỊCH VÀ CHUẨN ĐỘ
Câu 1. Trong quá trình chuẩn độ H C O bằng NaOH và KMnO hãy cho biết điểm 2 2 4 4
tương đương; viết phương trình phản ứng từ đó suy ra các tính nồng độ NaOH và
KMnO 4 theo H 2 C 2 O 4 . Ở đầu buret thường có bọt khí, làm như nào để khắc phục ? Trả lời
Điểm mà tại đó hai chất trong hai dung dịch phản ứng vừa đủ với nhau được
gọi là điểm tương đương của phép chuẩn độ và được nhận biết nhờ sự đổi màu của chất chỉ thị.
Trong quá trình chuẩn độ NaOH, KMnO b ằng H đ iểm t ương đ ương x uất 4 2 C 2 O 4
hiện khi ta thấy trong bình nón chuẩn độ xuất hiện dung dịch màu hồng tím nhạt bền trong 30 giây.
Ở đầu buret thường có bọt khí, ta sẽ khắc phục bằng các thêm dung dịch vào
buret và mở van, xả bọt khí và dung dịch thừa ra ngoài cho đến vạch định mức. Câu 2.
a. Trình bày cách pha 250mL dung dịch chuẩn H 2 C 2 O 0,025 M từ tinh thể axit 4
oxalic H 2 C 2 O 4 .2H 2 O (M = 126,066 g/mol) và nước c ất. C ân phân tích và c ác d ụng
cụ thủy tinh dùng để pha chế được cung cấp đầy đủ. Trả lời
Pha 250 mL dung dịch H 2 C 2 O 4 0,025 M từ tinh thể axit oxalic H 2 C 2 O 4 .2H 2 O
- Bước 1. Tính toán ban đầu 250 mL H C O 0,025 M → n = 0,25.0,025 = 0,00625 mol 2 2 4 H2C2O4 → m = 0,00625.126,066 = 0,7879 g H2C2O4.2H2O
- Bước 2. Dùng cân phân tích cân chính xác 0,7879 g H 2 C 2 O 4 .2H 2 O tinh thể
chuyển qua phễu vào bình định mức 250 mL
- Bước 3. Tráng tất cả các dụng cụ 3 lần (thuyền cân, phễu) bằng nước cất vào
bình định mức với thể tích 2/3 bình, lắc kỹ cho hoàn tan
- Bước 4. Thêm nước cất đến vạch định mức của bình, lắc kỹ.
b. Trình bày cách pha 500 mL dung dịch c huẩn NaOH c ó n ồng độ k hoảng 0,05 M từ
NaOH rắn ( M = 39,997 g/mol) và nước cất. Trả lời
- Bước 1. Tính toán ban đầu 500 mL H C O 0,05 M → n = 0,5.0,05 = 0,025 mol 2 2 4 H2C2O4 → m = 0,025.39,997 = 0,9999 g H2C2O4.2H2O
- Bước 2. Dùng cân phân tích cân chính xác 0,9999 g NaOH rắn chuyển qua
phễu vào bình định mức 500 mL. Chú ý cân nhanh vì NaOH có thể phản ứng với CO trong không khí. 2
- Bước 3. Tráng tất cả các dụng cụ 3 lần (thuyền cân, phễu) bằng nước cất vào
bình định mức với thể tích 2/3 bình, lắc kỹ cho hoàn tan
- Bước 4. Thêm nước cất đến vạch định mức của bình, lắc kỹ. 3
c. Nồng độ chính xác dung dịch NaOH được xác định như sau: chuyển dung dịch
NaOH ở ý b lên buret; lấy chính xác 10,0 mL dung dịch chuẩn H C O 0,025 M 2 2 4
vừa pha chế được ở ý a vào b ình nón, thêm 5 g iọt c hỉ t hị p henolphtalein; t iến h ành
chuẩn độ đến khi xuất hiện màu hồng nhạt bền thì tiêu tốn 9,75 mL dung dịch
NaOH. Viết phương trình phản ứng chuẩn độ, thiết lập công thức và t ính n ồng đ ộ
chính xác của dung dịch NaOH. Trả lời
Phương trình phản ứng chuẩn độ NaOH bằng H C O 0,025 M: 2 2 4
H C O + NaOH → Na C O + 2H O 2 2 4 2 2 4 2
Tại điểm tương đương, khi kết thúc quá trình chuẩn độ thì n
NaOH đã dùng = 2n NaOH ban đầu → C NaOH V NaOH = 2C H2C2O4. V H2C2O4 → C = (2C V )/V
= (2.0,025.10)/9.75 = 0,0513 M NaOH H2C2O4. H2C2O4 NaOH
Câu 3. Trong thí nghiệm xác định nồng độ của dung dịch KMnO bằng dung dịch 4
chuẩn H 2 C 2 O 4 , các nhận định sau đây là đúng hay sai, giải thích ngắn gọn? Sửa lại phát biểu sai.
a. Phép chuẩn độ này không cần dùng thêm chất chỉ thị Trả lời
Đúng. Ta dựa vào màu của KMnO để nhận biết điểm tương đương trong chuẩn độ. 4
Màu của lượng dư KMnO tím hồng, phản ứng tự chỉ thị. 4
b. Phản ứng xảy ra trong môi trường axit mạnh, có thể dùng H SO hoặc HCl 2 4 Trả lời
Đúng. Đây là phản ứng xảy ra trong môi trường axit và cần được cung cấp lượng
proton cho phản ứng. Cả H SO và HCl đều có thể cung cấp proton c ho p hản ứ ng x ảy 2 4 ra.
c. Phải đun dung dịch đến nhiệt độ 60 - 70 o C rồi mới chuẩn độ Trả lời
Đúng. Đây là phản ứng xảy ra chậm trong môi trường ở nhiệt đ ộ p hòng. Đ un n óng s ẽ
đẩy nhanh tốc độ của phản ứng, đảm bảo xác định chính xác lượng KMnO để phản 4
ứng vừa đủ với H 2 C 2 O 4 .
d. Công thức tính nồng độ dung dịch KMnO : C = (5.C . V ) : 4 KMnO4 H2C2O4 H2C2O4 (2.V ) KMnO4 Trả lời
Sai. Theo phương trình phản ứng:
5H C O + 2KMnO + 3H SO → 2MnSO + K SO + 10CO + 8H O 2 2 4 4 2 4 4 2 4 2 2
Tại điểm tương đương thì 5n = 2n KMnO4 thêm vào H2C2O4 ban đầu
→ 5.C KMnO4 .V KMnO4 = 2.C H2C2O4 . V H2C2O4 → C KMnO4 = (2.C H2C2O4 . V H2C2O4 ) : (5.V KMnO4 ) 4
CÂU HỎI BÀI 3. MỘT SỐ KỸ THUẬT TÁCH CHẤT VÀ PHÂN TÍCH ĐỊNH
TÍNH CÁC ION TRONG CÙNG DUNG DỊCH MẪU BẰNG PHƯƠNG PHÁP GIẤY SẮC KÝ
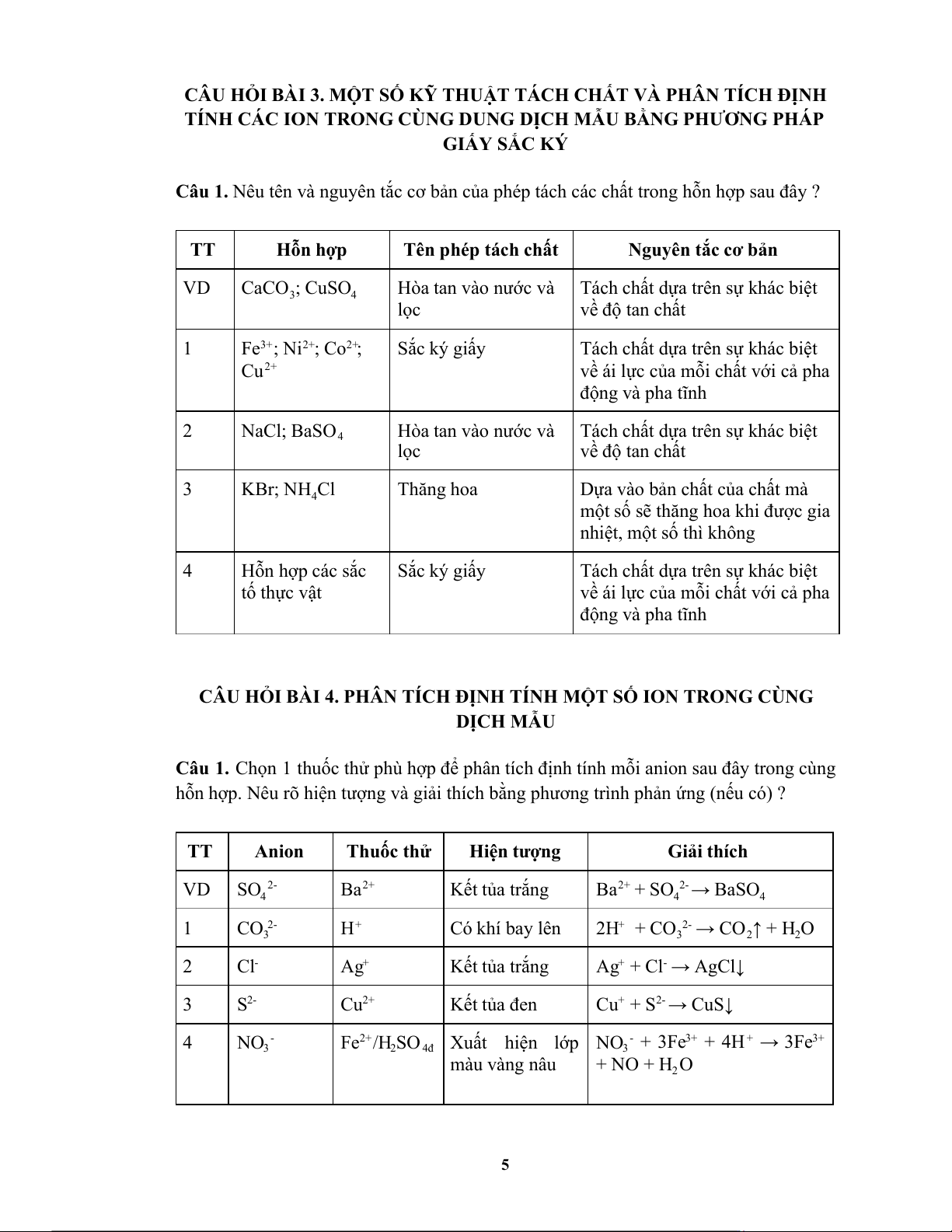
Câu 1. Nêu tên và nguyên tắc cơ bản của phép tách các chất trong hỗn hợp sau đây ? TT Hỗn hợp
Tên phép tách chất
Nguyên tắc cơ bản VD CaCO ; CuSO
Hòa tan vào nước và Tách chất dựa trên sự khác biệt 3 4 lọc về độ tan chất 1 Fe 3+ ; Ni 2+ ; Co 2+ ; Sắc ký giấy
Tách chất dựa trên sự khác biệt Cu 2+
về ái lực của mỗi chất với cả pha động và pha tĩnh 2 NaCl; BaSO 4
Hòa tan vào nước và Tách chất dựa trên sự khác biệt lọc về độ tan chất 3 KBr; NH Cl Thăng hoa
Dựa vào bản chất của chất mà 4
một số sẽ thăng hoa khi được gia
nhiệt, một số thì không 4 Hỗn hợp các sắc Sắc ký giấy
Tách chất dựa trên sự khác biệt tố thực vật
về ái lực của mỗi chất với cả pha động và pha tĩnh
CÂU HỎI BÀI 4. PHÂN TÍCH ĐỊNH TÍNH MỘT SỐ ION TRONG CÙNG DỊCH MẪU
Câu 1. Chọn 1 thuốc t hử p hù h ợp đ ể phân t ích đ
ịnh t ính mỗi anion sau đây trong c ùng
hỗn hợp. Nêu rõ hiện tượng và giải thích bằng phương trình phản ứng (nếu có) ? TT Anion Thuốc thử Hiện tượng Giải thích VD SO 2- Ba 2+ Kết tủa trắng Ba 2+ + SO 2- → BaSO 4 4 4 1 CO 2- 2- 3 H + Có khí bay lên
2H + + CO 3 → CO 2 ↑ + H 2 O 2 Cl - Ag + Kết tủa trắng Ag + + Cl - → AgCl↓ 3 S 2- Cu 2+ Kết tủa đen Cu + + S 2- → CuS↓ 4 NO - - + 3Fe 3+ + 4H + → 3Fe 3+ 3
Fe 2+ /H 2 SO 4đ Xuất hiện lớp NO 3 màu vàng nâu + NO + H 2 O 5 Fe 2+ + NO → FeNO 2+ (vàng nâu) 5 CH 3 COO - H 2 SO 4 đ Có mùi dấm
CH 3 COO - + H + ⇄ CH 3 COOH
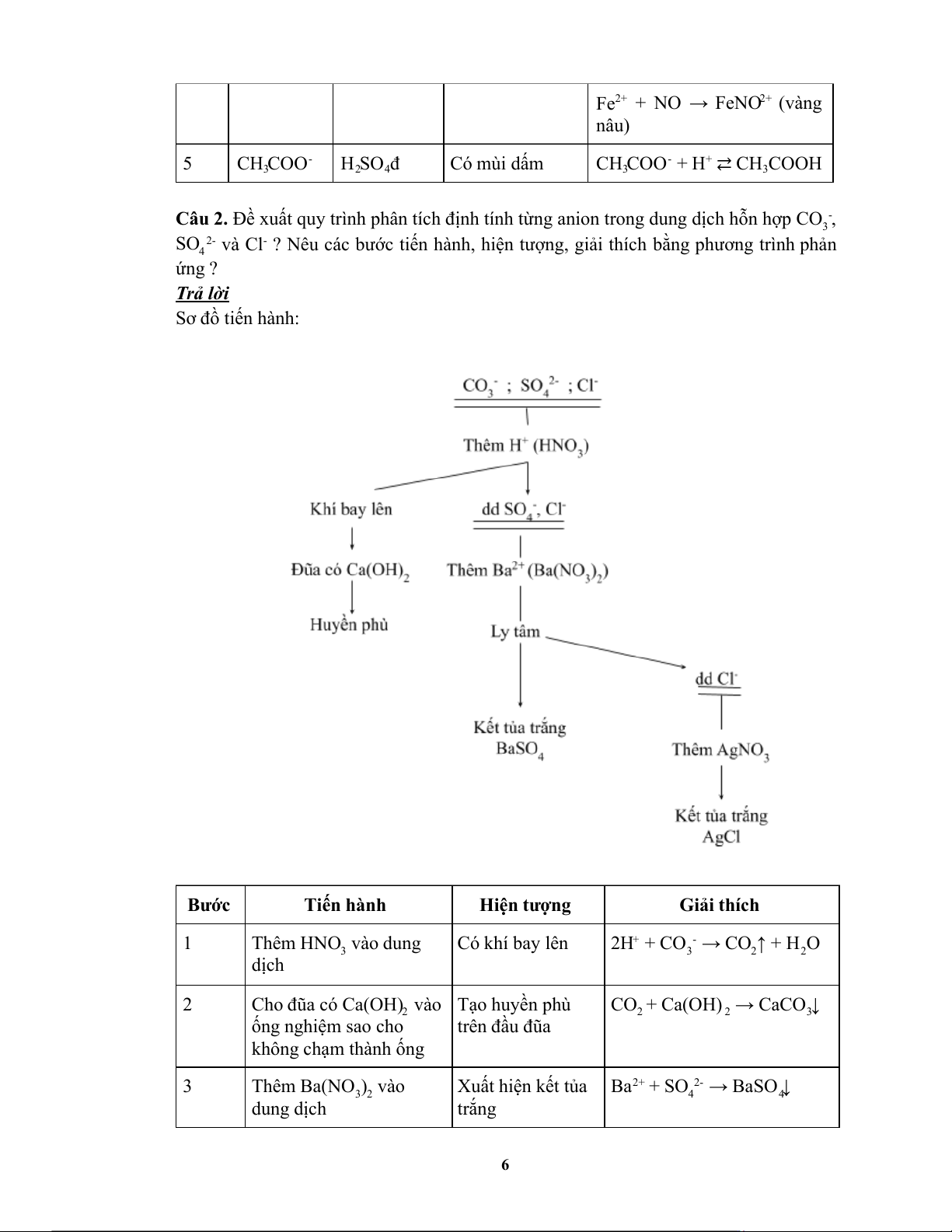
Câu 2. Đề xuất quy trình phân tích định tính từng anion trong dung dịch hỗn hợp CO - , 3
SO 2- và Cl - ? Nêu các bước tiến hành, hiện tượng, giải thích bằng phương trình p hản 4 ứng ? Trả lời
Sơ đồ tiến hành: Bước Tiến hành Hiện tượng Giải thích 1 Thêm HNO vào dung Có khí bay lên 2H + + CO - → CO ↑ + H O 3 3 2 2 dịch 2
Cho đũa có Ca(OH) vào Tạo huyền phù CO + Ca(OH) → CaCO ↓ 2 2 2 3 ống nghiệm sao cho trên đầu đũa không chạm thành ống 3 Thêm Ba(NO ) vào
Xuất hiện kết tủa Ba 2+ + SO 2- → BaSO ↓ 3 2 4 4 dung dịch trắng 6 4
Ly tâm loại bỏ kết tủa BaSO 4 5 Thêm AgNO 3 vào dung
Xuất hiện kết tủa Ag + + Cl - → AgCl↓ dịch trắng
CÂU HỎI BÀI 5. XÁC ĐỊNH NHIỆT HÒA TAN VÀ SỨC ĐIỆN ĐỘNG CỦA PIN ĐIỆN HÓA
Câu 1. Viết cấu tạo của pin nồng đ ộ g ồm hai đ iện đ iện c ực C u k im l oại n húng v ào h ai
dung dịch CuSO có nồng độ lần lượt là 1 N v à 0 ,01 N ? C ho b iết v ai t rò c ủa c ầu m uối 4
? Trong trường hợp này tính sức điện động của pin. Biết thế điện cực tiêu chuẩn của cặp E o = 0,34 V Cu/Cu2+ Trả lời
Cấu tạo của pin : (-) Cu|CuSO 0,01N | CuSO 1N|Cu (+) 4 4
Cầu muối trong pin có vai trò cho phép các electron di chuyển từ dung dịch n ày s ang
dung dịch khác, giống như một chiếc dây dẫn để đóng kín mạch điện
Sức điện động của pin: E = φ + - φ - 0,059 0,059 → E = E o Cu/Cu2+ +
log [Cu 2+ ] + - (E o Cu/Cu2+ + log [Cu 2+ ] - ) 2 2 0,059 [Cu2+ + ] 0,059 1 = log = log = 0,059. 2 [Cu2+ ]− 2 0,01
Câu 2. Trình bày công thức xác định nhiệt h òa t an c ủa m uối K Cl t rong nước, n êu t ên
và đơn vị các đại lượng trong công thức ? Quá trình hòa tan KCl tỏa nhiệt hay thu nhiệt ? Trả lời C .Δt.M
Công thức xác định nhiệt hòa tan của muối KCl trong nước: Δ H K KCl KCl = - gKCl Trong đó:
ΔH : Nhiệt hòa tan của muối KCl trong nước (kcal/mol) KCl
C K : Nhiệt dung của hệ nhiệt lượng kế (kcal/độ)
Δ t : Biến thiên nhiệt độ của hệ nhiệt lượng kế (độ)
M : Phân tử khối của KCl ( đvC) KCl
g : Khối lượng muối KCl hòa tan (g) KCl
Quá trình hòa tan KCl là quá trình thu nhiệt.
Câu 3 . Viết sơ đồ pin v à p hản ứ ng x ảy r a t rong pin Danien - J acobi. V iết p hương t rình
tính giá trị sức điện động và so sánh giá trị x và y của pin Ganvani nồng độ sau:
(+) Cu|CuSO 4 (C = x mol/l) | CuSO 4 (C = y mol/l)|Cu (-). 7 Trả lời
Sơ đồ pin Daniel - Jacobi: (-) Zn|ZnSO | CuSO |Cu (+) 4 4
phản ứng xảy ra trong pin là: Cu 2+ + Zn → Cu + Zn 2+ 0,059 x
Giá trị sức điện động của pin Ganvani nồng độ: E = log 2 y
Vì E luôn dương (>0) → log x > 0 → log x - log y > 0 y
→ log x > log y → x > y
Câu 4 : Trong thí nghiệm xác định nhiệt hòa tan của KCl trong nước, tại sao phải làm 3 giai
đoạn khi xác định nhiệt hòa tan ? Trả lời
Trong thí nghiệm xác định nhiệt hòa tan KCl trong nước, ta cần làm qua 3 giai đoạn:
- Giai đoạn 1: Ổn định nhiệt độ. Ban đầu khi bắt đầu khuấy, nhiệt độ của nước chưa ổn
định và có thể trao đổi nhiệt với môi trường bên ngoài. Vì vậy, cần thời gian khoảng
3 phút để nhiệt độ nước trong bình khuấy được ổn định.
- Giai đoạn 2: Giảm nhiệt. Sau khi đổ KCl vào bình khuấy, nhiệt độ lúc này trong bình
bắt đầu giảm, do có hiệu ứng nhiệt của quá trình hòa tan nên nhiệt độ nhanh chóng thay đổi.
- Giai đoạn 3: Tăng chậm. Khi muối đã tan hết, nhiệt độ không thay đổi nữa. Lúc này,
dung dịch trong bình khuấy sẽ hấp thụ nhiệt từ môi trường và bắt đầu tăng lên chậm.
CÂU HỎI BÀI 7. CÁC YẾU TỐ ẢNH HƯỞNG TỚI TỐC ĐỘ PHẢN ỨNG HÓA HỌC
Câu 1. Viết phương trình phản ứng xảy ra giữa natri thiosunfat và axit sunfuric ? Nếu
tăng nồng độ natri thiosunfat lên gấp đôi thì thời gian phản ứng (đến khi xuất hiện kết
tủa trắng) nhanh hay chậm hơn ? Vì sao ? Trả lời
Phương trình phản ứng: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S↓ + H 2 O + SO 2 ↑
Nếu tăng nồng độ của Na 2 S 2 O lên gấp đôi thì thời gian phản ứng sẽ nhanh h ơn v ì k hi 3 đó, mật đ ộ của N a S O tăng cao hơn, như v ậy, k hả n ăng x ảy r a v a c hạm h oạt đ ộng của 2 2 3 sẽ cao hơn.
Câu 2. Hãy trình bày các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học ? Trong thí
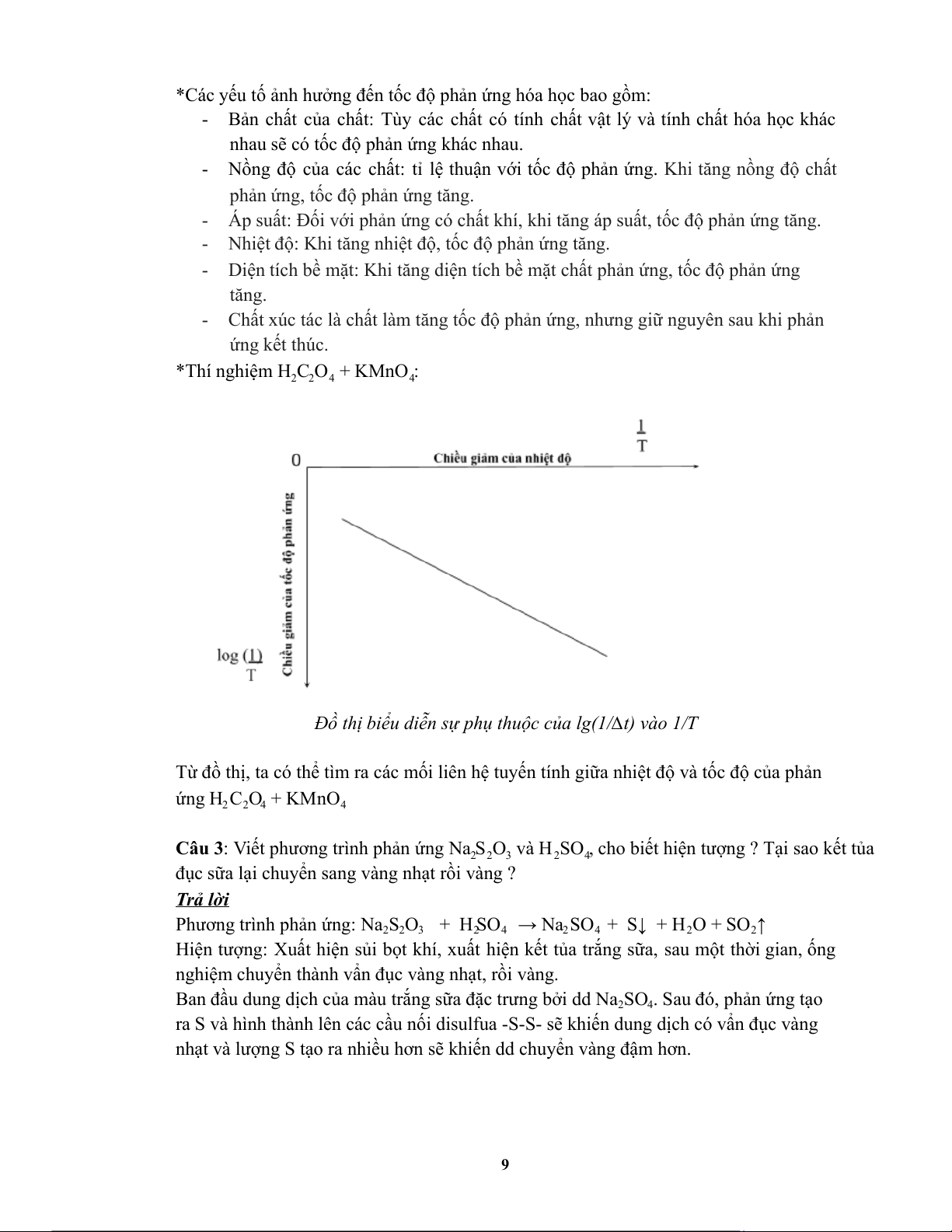
nghiệm H C O + KMnO vẽ dạng của đồ thị biểu diễn sự phụ thuộc của lg(1/∆t) vào 2 2 4 4
1/T (trong đó ∆t là thời gian mất màu, T là nhiệt độ phản ứng). Từ đồ thị này có thể thu được thông tin gì ? Trả lời 8
*Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học bao gồm:
- Bản chất của chất: Tùy các chất có tính chất vật lý và tính chất hóa học khác
nhau sẽ có tốc độ phản ứng khác nhau.
- Nồng độ của các chất: tỉ lệ thuận với tốc độ phản ứng. Khi tăng nồng độ chất
phản ứng, tốc độ phản ứng tăng.
- Áp suất: Đối với phản ứng có chất khí, khi tăng áp suất, tốc độ phản ứng tăng.
- Nhiệt độ: Khi tăng nhiệt độ, tốc độ phản ứng tăng.
- Diện tích bề mặt: Khi tăng diện tích bề mặt chất phản ứng, tốc độ phản ứng tăng.
- Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng giữ nguyên sau khi phản ứng kết thúc. *Thí nghiệm H C O + KMnO : 2 2 4 4
Đồ thị biểu diễn sự phụ thuộc của lg(1/∆t) vào 1/T
Từ đồ thị, ta có thể tìm ra các mối liên hệ tuyến tính giữa nhiệt độ và tốc độ của phản ứng H 2 C 2 O 4 + KMnO 4
Câu 3 : Viết phương trình phản ứng Na S O và H SO , cho biết hiện tượng ? Tại sao kết tủa 2 2 3 2 4
đục sữa lại chuyển sang vàng nhạt rồi vàng ? Trả lời
Phương trình phản ứng: Na 2 S 2 O 3 + H 2 SO 4 → Na 2 SO 4 + S↓ + H 2 O + SO 2 ↑
Hiện tượng: Xuất hiện sủi bọt khí, xuất hiện kết tủa trắng sữa, sau một thời g ian, ố ng
nghiệm chuyển thành vẩn đục vàng nhạt, rồi vàng.
Ban đầu dung dịch của màu trắng sữa đặc trưng bởi dd Na 2 SO 4 . Sau đó, phản ứng tạo
ra S và hình thành lên các cầu nối disulfua -S-S- sẽ khiến dung dịch có vẩn đục vàng
nhạt và lượng S tạo ra nhiều hơn sẽ khiến dd chuyển vàng đậm hơn. 9
CÂU HỎI BÀI 8. ĐỘNG HỌC PHẢN ỨNG BẬC 2 - PHẢN ỨNG THỦY PHÂN ESTE
Câu 1 . Trình bày quy trình và công thức xác định năng lượng hoạt hóa của phản ứng
thủy phân este etyl axetat trong môi trường kiềm Trả lời
Quy trình xác định năng lượng hoạt động hóa:
Thí nghiệm 1: Sử dụng phương pháp chuẩn độ ngược để xác định lượng NaOH đã
phản ứng thủy phân etyl axetat tại các thời gian khác nhau. Ta sẽ xác định đ ược hằng
số tốc độ phản ứng tại nhiệt độ T 1
Thí nghiệm 2: Lặp lại thí n ghiệm 1 n hưng ở n hiệt đ ộ + 10 o C. T a sẽ xác đ ịnh đ ược hằng
số tốc độ phản ứng tại nhiệt độ T = T + 10 o C 2 1
Tính toán: Từ k 1 ; k 2 ; T 1 ; T 2 , ta xác định được năng lượng hoạt hóa E: k k
Ta sẽ có: ln 2 = E ( 1 - 1 ) → E = (R.ln 2 ) : ( 1 - 1 ) k 1 R T 1 T 2 k1 T 1 T 2 Trong đó:
E : năng lượng hoạt hóa : J/mol
R: hằng số khí lý tưởng = 8,314 J/mol.K
Câu 2. Viết phương trình phản ứng thủy phân etyl axetat trong môi trường kiềm của
NaOH. Làm thế nào để dừng phản ứng này khi nó đang xảy ra ? Giải thích ? Trả lời
Phương trình thủy phân etyl axetat trong môi trường kiềm:
CH COOC H + NaOH → CH COONa + C H OH 3 2 5 3 2 5
Để dừng phản ứng lại, ta sẽ trung hòa hết kiềm và kìm hãm phản ứng lại. T a cho hỗn
hợp vào lượng dư axit để phản ứng hoàn toàn với NaOH. Khi đó CH 3 COOC 2 H sẽ 5
không bị thủy phân nữa.
CÂU HỎI BÀI 10. ĐIỀU CHẾ VÀ XÁC ĐỊNH ĐỘ TINH KHIẾT CỦA ASPIRIN
Câu 1: Viết phương trình phản ứng điều chế aspirin từ axit salicylic và acetic
anhydride. Nêu vai trò của H SO trong quá trình điều chế aspirin? 2 4 Trả lời 10
Vai trò của H 2 SO 4 đặc là cung cấp proton cho quá trình proton hóa, đồng thời cũng giúp hấp
thu nước trong phản ứng.
Câu 2: Trong phản ứng tổng hợp aspirin, tác nhân axit nào được dùng để làm tăng tốc độ
phản ứng ? Kể tên các tác nhân đó. Tính hiệu suất phản ứng tổng hợp aspirin (C 9 H 8 O 4 , M = 180,2 g
/mol). Biết khi dùng 2g salicylic axit (C 7 H 6 O 3 , M = 1 38,1 g /mol) p hản ứ ng v ới 5 m l
acetic anhydride (C H O , M = 102,1 g/mol, d = 1 ,08 g /ml) t hì t hu đ ược 0 ,986g a spirin t inh 4 6 3 khiết ? Trả lời
Hai tác nhân axit đó là: H SO đặc và acetic anhydride 2 4
Tính toán: 2g axit salicylic → n = 2 = 0,0145 ml axit salicylic 138,1 5 ml acetic anhydride → m anhydride = 1,08 . 5 = 5,4 g 5,4 → n = = 0,0529 ml anhydride 102,1 axit salicylic acetic anhydride aspirin axit axetic
Dựa vào phương trình phản ứng và số mol các chất →. acetic anhydride dư → n = n = 0,0145 mol aspirin lý thuyết axit salicylic → m = 0,0145.180,2 = 2,6097 g aspirin lý thuyết 0,986
→ Hiệu suất của quá trình: H = .100% = 37,78% 2,6097 11




