

Preview text:
ĐỀ THAM KHẢO SỐ 2
ĐỀ KIỂM TRA CUÓI KÌ I LỚP 11 MÔN: HÓA HỌC (Đề có 3 trang)
Thời gian làm bài: 45 phút, không kể thời gian phát đề
Họ, tên thí sinh: ……………………………………………… Mã đề thi: 1102
Số báo danh: ………………………………………………….
Cho nguyên tử khối: H = 1, C = 12, N = 14, O = 16, S = 32.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi
thí sinh chỉ chọn một phương án. (3 điểm)
Câu 1. Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó
A. nồng độ chất tham gia bằng nồng độ sản phẩm.
B. tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
C. nhiệt độ phản ứng không đổi.
D. phản ứng dừng lại.
Câu 2. Theo thuyết Bronsted - Lowry, H2O đóng vai trò gì trong phản ứng sau: 2 S − H O HS− OH− + + 2 A. Chất oxi hóa. B. Chất khử. C. Acid. D. Base.
Câu 3. Trong khí quyển, khi có sấm sét nitrogen bị oxi hóa để tạo thành oxide của nitrogen. Oxide được tạo thành là A. carbon monoxide. B. nitrogen monoxide. C. sulfur dioxide. D. nitrogen dioxide.
Câu 4. Phân biệt được đung dịch NH4NO3 và (NH4)2SO4 bằng thuốc thử là dung dịch A. KCl. B. NaOH. C. KOH. D. Ba(OH)2.
Câu 5. Một bạn học sinh muốn chứng minh tính oxi hoá mạnh của dung dịch nitric acid đặc. Thí nghiệm
nào sau đây giúp bạn học sinh đó chứng minh được tính chất trên?
A. Cho NaHCO phản ứng với dung dịch HNO đặc, giải phóng khí CO . 3 3 2
B. Hoà tan kim loại Cu trong dung dịch HNO đặc, tạo thành dung dịch màu xanh. 3
C. Đặt hai thanh đũa thuỷ tinh nhúng vào ammonia đậm đặc và dung dịch nitric acid đậm đặc cạnh nhau, thấy bốc khói trắng.
D. Cho Al(OH) vào dung dịch nitric acid đặc thì tan và tạo thành dung dịch. 3
Câu 6. Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A. sản xuất sulfuric acid.
B. lưu hóa cao su tự nhiên.
C. bào chế thuốc đông y.
D. điều chế thuốc bảo vệ thực vật.
Câu 7. Cho dãy chất: C2H4; C6H5CH3; C2H5OH; C2H5Cl; HCOOH. Nhận xét nào sau đây đúng?
A. Các chất trong dây đều là dẫn xuất của hydrocarbon.
B. Các chất trong dãy đều là hydrocarbon.
C. Các chất trong dãy đều là hợp chất hữu cơ.
D. Các chất trong dãy có cả chất vô cơ và hữu cơ nhưng đều là hợp chất của carbon.
Câu 8. Phương pháp nào sau đây không phải là phương pháp tách biệt và tinh chế hợp chất hữu cơ?
A. Phương pháp điện phân.
B. Phương pháp chiết
C. Phương pháp kết tinh.
D. Sắc kí cột.
Câu 9. Chất nào sau đây có công thức phân tử trùng với công thức đơn giản nhất? A. CH3COOH. B. C6H6. C. C2H4Cl2. D. C2H5OH.
Câu 10. Những hợp chất hữu cơ khác nhau nhưng có cùng công thức phân tử được gọi là các chất
A. đồng phân của nhau.
B. đồng đẳng của nhau.
C. đồng vị của nhau.
D. đồng khối của nhau.
Câu 11. Bước sơ cứu đầu tiên cần làm ngay khi một người sulfuric acid đậm đặc đổ vào tay gây bỏng là
A. rửa với nước lạnh nhiều lần để giảm lượng acid bám trên da.
B. trung hoà acid bằng kiềm đặc.
C. băng bó tạm thời vết bỏng bằng băng sạch.
D. uống bù nước điện giải.
Câu 12. Phát biểu nào sau đây là đúng?
A. Hợp chất hữu cơ thường có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. Hợp chất hữu cơ thường bền với nhiệt và khó cháy.
C. Các nguyên tử trong phân tử hợp chất hữu cơ liên kết với nhau chủ yếu bằng liên kết cộng hóa trị.
D. Phản ứng hóa học của các chất hữu cơ thường xảy ra nhanh, theo một hướng nhất định.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai. (2 điểm)
Câu 1. Sulfur dioxide tác dụng vớinitrogen dioxide (NO khi có xúc tác để chuyển hoá thành sulfur 2 )
trioxide theo phản ứng có phương trình hoá học sau: SO ( g) + NO (g) xúc tác ⎯⎯⎯→
⎯⎯⎯SO g + NO g o 1 Δ H 41,8 kJ mol− = − 2 2 3 ( ) ( ) r 298 Chất NO g NO( g) SO g 3 ( ) 2 ( ) Nhiệt tạo thành ( 1 kJ mol− ) 33,2 91,3 -329
Ở 298 K, hệ đạt trạng thái cân bằng chứa SO 4,0 M; NO 0,50 M; SO 3 M và NO 2 M. 2 2 3
a) Phản ứng trên là phản ứng toả nhiệt.
b) Các chất SO và NO sinh ra có thể hấp thụ bởi CaO tạo thành sản phẩm có ích. 3
c) Nhiệt tạo thành của SO theo tính toán là 1 229,1 kJ mol− . 2
d) Nếu thêm vào hệ 1,50 mol NO thì nồng độ NO ở trạng thái cân bằng mới là 2,84M . Giả sử hệ được 2
đặt trong bình dung tích 1,0 lít.
Câu 2. Ethanol là hợp chất hữu cơ có nhiều trong đồ uống có cồn, được sản xuất bằng cách lên men ngũ
cốc, trái cây hoặc các nguồn đường khác. Công thức hóa học của ethanol là C2H5OH.
a) Theo cách phân loại dựa trên thành phần các nguyên tố hóa học, ethanol thuộc loại dẫn xuất hydrocarbon.
b) Trong phân tử ethanol, nguyên tố carbon chiếm 42,174 % về khối lượng.
c) Ethanol tan vô hạn trong nước do tạo liên kết hydrogen với nước.
d) Để thu lấy rượu (dung dịch ethanol) có lẫn trong cơm rượu sau khi lên men, người ta sử dụng phương pháp chưng cất.
PHẦN III. Câu hỏi trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4. (2 điểm)
Câu 1. Sulfur trioxide được điều chế theo phương trình hóa học: V O 2 5 2SO (g) + O (g) 2SO (g) H = 1 − 98,4 kJ . o 2 2 3 r 450 5 − 00 C
Cho các biện pháp (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm
chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Liệt kê những biện pháp
làm cân bằng trên chuyển dịch theo chiều thuận theo dãy số thứ tự tăng dần.
Câu 2. Cho các phản ứng sau đây: o t (1) NH ⎯⎯→ 3 + HCl ⎯⎯ → NH4Cl. (2) 4NH3 + 3O2 2N2 + 6H2O. o t , xt o t (3) 4NH ⎯⎯⎯ → ⎯⎯→ 3 + 5O2 4NO + 6H2O. (4) 2NH3 + 3CuO 3Cu + 2N2↑ + 3H2O.
Có bao nhiêu phản ứng trong đó NH3 thể hiện tính khử?
Câu 3. Có bao nhiêu đồng phân cấu tạo ứng với công thức phân tử C4H9Cl?
Câu 4. Than đá antraxit là nguồn nguyên liệu chính để sản xuất điện trong các nhà máy điện than ở Việt
Nam. Một trong những ưu điểm của loại than này là hàm lượng lưu huỳnh thấp (< 0,6%). Theo kế hoạch,
để đạt tổng công suất điện than là 47600 MW trong năm 2025, cần tiêu thụ 95 triệu tấn than. Thể tích SO2
(điều kiện chuẩn) tối đa tạo ra trong một ngày là x.103 (m3). Tính giá trị của x (làm tròn kết quả đến hàng đơn vị)?
PHẦN IV. Câu hỏi tự luận. Thí sinh trả lời từ câu 1 đến câu 3. (3 điểm)
Câu 1 (1 điểm): Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50 mL dung
dịch NaOH 0,4 M vào 100 mL dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong
hỗn hợp dung dịch còn dư ion OH–. Phần ion dư này cần 10 mL HCl 0,2 M để trung hoà. Tính nồng độ mol.L–1 của mẫu A.
Câu 2 (1 điểm): Sulfur dioxide là chất khí, không màu, có mùi hắc, độc,… Đặc biệt, khí sulfur dioxide là
một trong những tác nhân gây mưa acid. Hãy đề xuất các biện pháp nhằm giảm lượng khí sulfur dioxide
thải vào bầu khí quyển?
Câu 3 (1 điểm): Acetic acid được sử dụng rộng rãi trên thế giới trong nhiều ngành công nghiệp khác nhau
như tạo ra polymer ứng dụng trong sơn, chất kết dính, là dung môi hoà tan các chất hoá học, sản xuất và
bảo quản thực phẩm, đặc biệt dùng để sản xuất giấm.
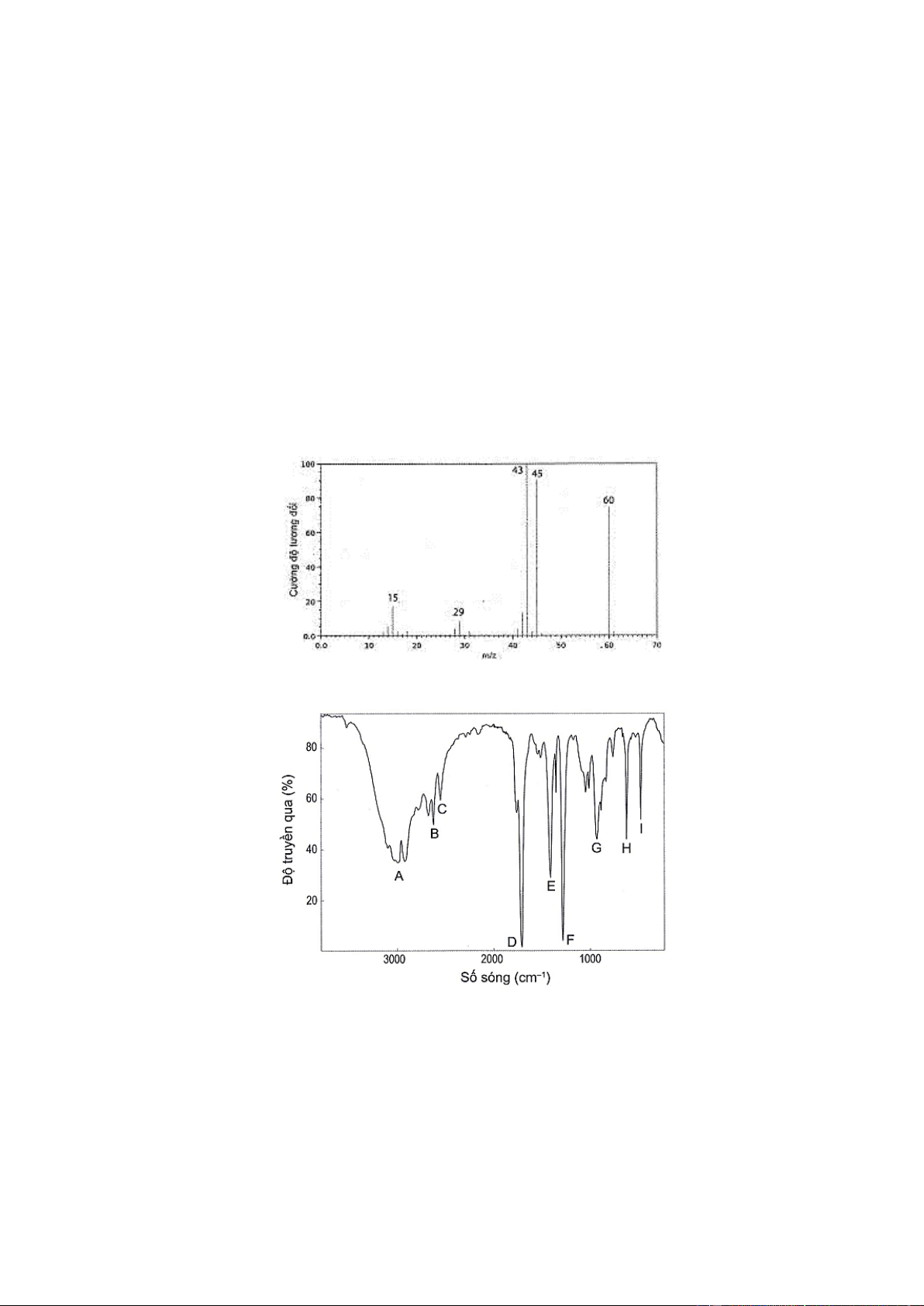
a) Lập công thức phân tử của acetic acid, biết kết quả phân tích nguyên tố của acetic acid có 40% C; 53,33%
O về khối lượng; còn lại là H. Phân tử khối của acetic acid được xác định trên phổ khối lượng tương ứng
với peak có giá trị m/z lớn nhất.
b) Dựa vào phổ IR bên, hãy cho biết có thể xác định được nhóm chức carboxyl có trong acetic acid từ peak nào.
------------------------- HẾT -------------------------
- Thí sinh không sử dụng tài liệu.
- Giám thị không giải thích gì thêm.



