






Preview text:
Đề thi giữa học kì 1 khoa học tự nhiên lớp 7
Bộ sách- Chân trời sáng tạo
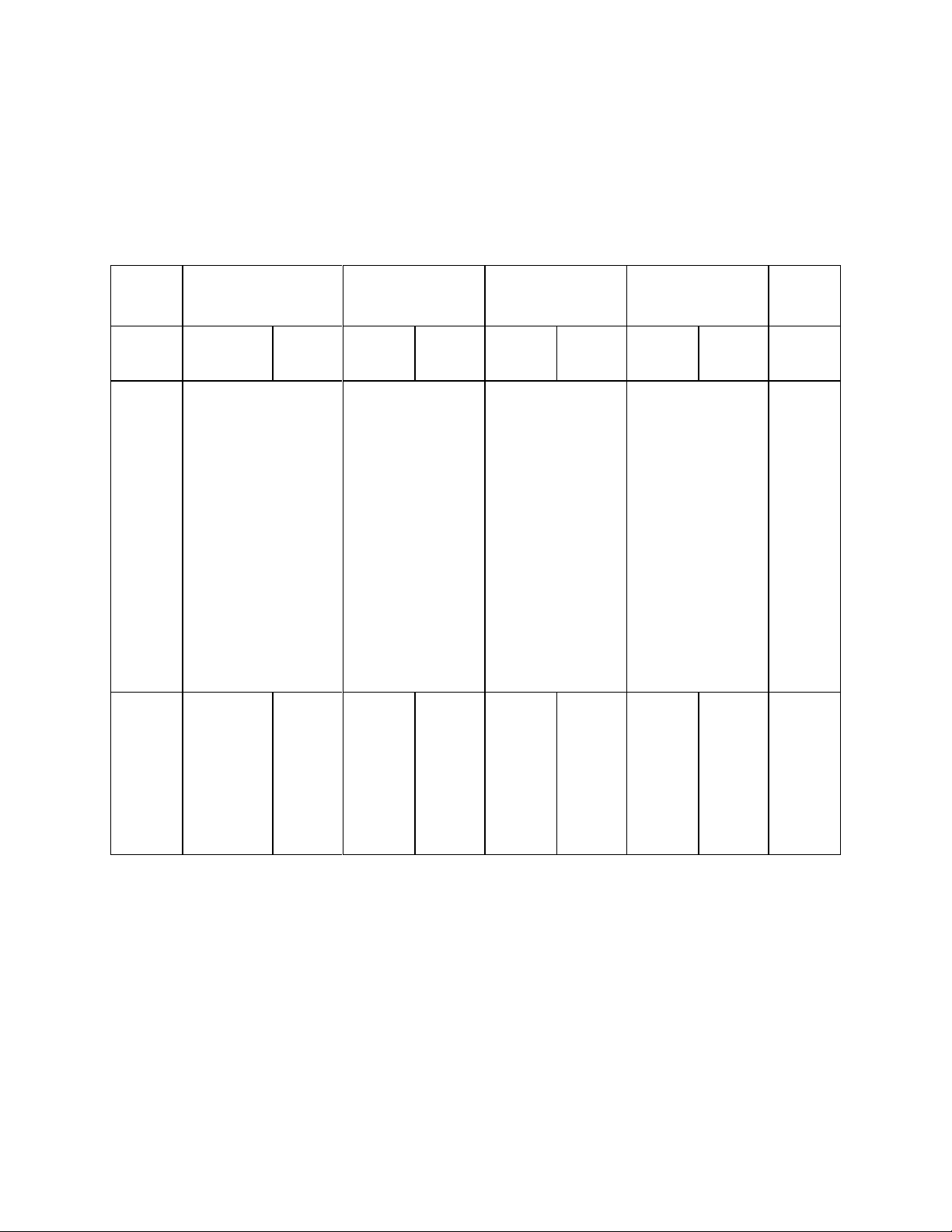
A. Ma trận đề thi giữa kì 1 môn Khoa học tự nhiên 7 Nhận biết Thông hiểu Vận dụng Vận dụng cao Cộng TNKG TL TNKG TL TNKG TL TNKG TL Biểu diễn Tính số hạt trong nguyên tố hóa Nội nguyên tử: Số p, học Xác định 2 dung 1.
số e, số n (Dạng nguyên tố khi Nguyên
Xác định nguyên nâng cao) biết bài toán tử - tố khi biết số p, tổng số hạt và Nguyên Xác định nguyên
cấu tạo nguyên tố khi biết bài hiệu các hạt cả tố hóa
tử p, khối lượng toán số hạt dạng cả 2 nguyên tố học
nguyên tử, bài hiệu hoặc tỉ lệ toán tính số hạt hạt đơn giản Số câu 2 5 1 1 9 Số điểm 0,75 1,25 1 0,25 3 Tỉ lệ % 7,5% 12,5% 10% 2,5% 30% Xác định vị trí nguyên tử dựa vào bảng tuần Nội hoàn - Nguyên tắc sắp dung 2 xếp bảng tuần Xác định số lớp hoàn Bảng e, số e lớp ngoài
tuần Cấu tạo bảng tuần cùng của nguyên tố dựa vào bảng hoàn hoàn (Số thứ tự tuần hoàn các chu kì, nhóm, ...) nguyên Xác định kim
tố hóa Tên gọi của các loại, phi kim, khí học nhóm IA, IIA,... hiếm Vẽ sơ đồ cấu tạo nguyên tử. Số câu 5 15 1 21 Số điểm 1,25 3,75 2 7 Tỉ lệ % 12,5% 37,5% 20% 70% Tổng số 5 17 5 1 1 28 + 2 câu
B. Đề thi giữ học kì I Khoa học tự nhiên 7
ĐỀ KIỂM TRA GIỮA HỌC KÌ I
MÔN: Khoa học tự niên 7
I. Trắc nghiệm khách quan (7 điểm)
Khoanh vào chữ cái đặt trước câu trả lời đúng
Câu 1. Các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo thứ tự tăng dần của A. khối lượng. B. số proton. C. tỉ trọng. D. số neutron.
Câu 2. Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết
A. Số thứ tự của nguyên tố B. Số hiệu nguyên tử
C. Số electron lớp ngoài cùng D. Số lớp electron
Câu 3. Trong bảng tuần hoàn tên gọi của nhóm IIA là A. Nhóm kim loại kiềm
B. Nhóm kim loại kiềm thổ C. Nhóm Halogen D. Nhóm khí hiếm
Câu 4. Số thứ tự nhóm A trong hệ thống bảng tuần hoàn cho biết:
A. Số electron lớp ngoài cùng B. Số lớp electron C. Số hiệu nguyên tử
D. Số thứ tự của nguyên tố
Câu 5. Dựa vào bảng tuần hoàn, ta xác định được vị trí của nguyên tố Calcium là: A. Chu kỳ 2, nhóm IVA B. Chu kỳ 2, nhóm IIA C. Chu kỳ 4, nhóm IIA D. Chu kỳ 4, nhóm VIA
Câu 6. Biết vị trí của nguyên tố X như sau: chu kì 2, nhóm VIA. Số lớp electron và
electron lớp ngoài cùng của nguyên tử X lần lượt là
A. 4 và 2 B. 2 và 6 C. 6 và 2 D. 2 và 4
Câu 7. Biết cấu tạo của nguyên tử R có 3 lớp electron, lớp ngoài cùng có 5 electron. Dựa
vào bảng tuần hoàn hóa học thì nguyên tố X là: A. Chlorine B. Phosphorus C. Nitrogen D. Oxygen
Câu 8. Dựa vào bảng tuần hoàn ta xác định được số lớp electron và số electron lớp ngoài
cùng của nguyên tố Nitrogen lần lượt là: A. 2 và 5 B. 5 và 2 C. 2 và 7 D. 7 và 2
Câu 9. 2 nguyên tử A nặng bằng 7 nguyên tử oxygen. Xác định nguyên tố A A. Cu B. Ca C. Fe D. Ba
Câu 10. 5 nguyên tử oxygen được biểu diễn là: A. 5O2 B. 5O C. O5 D. O5
Câu 11. Nguyên tố Sodium có cùng số lớp electron với nguyên tố nào sau đây A. Calcium B. Magnesium C. Oxygen D. Potassium
Câu 12. Nguyên tố Magnesium có cùng số electron lớp ngoài cùng với nguyên tố nào sau đây: A. Aluminium B. Carbon C. Nitrogen D. Calcium
Câu 13. Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 2
electron. Vị trí của nguyên tố X là
A. Thuộc chu kỳ 3, nhóm VIA
B. Thuộc chu kỳ 3, nhóm IIA
C. Thuộc chu kỳ 2, nhóm IIIA
D. Thuộc chu kỳ 2, nhóm VIA
Câu 14. Dãy nào sau đây gồm các nguyên tố đều là Halogen A. F, Cl, Br, I B. Mg, Ca, Sr, Ba C. He, Ne, Ar, Kr D. Li, Na, K, Rb
Câu 15. Dãy nào sau đây gồm các nguyên tố đều là phi kim A. F, O, Ca, C B. Ca, N, Br, H C. O, N, C, Br D. K, F, Ca, Mg
Câu 16. Dãy chất nào sau đây gồm các nguyên tố đều là kim loại A. Ca, Ba, Na, N B. Cl, Cu, Al, Fe C. Cu, Ca, O, Fe D. Cu, Ca, Fe, Na
Câu 17. Dãy chất nào sau đây gồm các nguyên tố đều là khí hiếm A. Fe, Cl, Br, I B. Mg, Ca, Sr, Ba C. Li, Na, K, Rb D. He, Ne, Ar, Kr
Câu 18. Nguyên tố X có số hiệu nguyên tử là 12, chu kì 3, nhóm IIA trong bảng tuần
hoàn các nguyên tố hóa học. Phát biểu nào sau đây đúng:
A. Điện tích hạt nhân là 12+, 3 lớp electron, lớp ngoài cùng có 2 electron
B. Điện tích hạt nhân là 12+, 1 lớp electron, lớp ngoài cùng có 3 electron
C. Điện tích hạt nhân là 12+, 3 lớp electron, lớp ngoài cùng có 1 electron
D. Điện tích hạt nhân là 12+, 2 lớp electron, lớp ngoài cùng có 3 electron
Câu 19. Tính chất của nguyên tố Bromine gần giống với tính chất của nguyên tố nào trong các nguyên tố sau: A. Chlorine B. Magnesium C. Oxygen D. Potassium
Câu 20. Nguyên tử X có tổng số hạt cơ bản là 82. Hạt mang điện nhiều hơn số hạt không
mang điện là 22. Số proton là: A. 28 B. 29 C. 26 D. 30
Câu 21.Nguyên tử X có tổng số hạt là 58, trong đó số hạt proton là 19. Số electron lớp ngoài cùng của X là: A. 2 B. 4 C. 3 D. 1
Câu 22. Nguyên tử X có tổng số hạt là 52, trong đó số proton là 17. Số electron và số
neutron của X lần lượt là: A. 17 và 18 B. 18 và 19 C. 17 và 19 D. 18 và 17
Câu 23. Có các phát biểu sau về nguyên tử
a) Điện tích của hạt proton bằng điện tích hạt electron
b) Khối lượng hạt proton bằng khối lượng hạt electron
c) Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân
d) Khoảng không gian giữa vỏ nguyên tử và hạt nhân là một vùng trống rỗng
e) Trong cùng 1 nguyên tử luôn có hạt proton bằng số hạt electron Số phát biểu sai là: A. 3 B. 4 C. 2 D. 1
Câu 24. Nguyên tử X có tổng số hạt cơ bản là 28, trong đó số hạt không mang điện
chiếm 35,7%. Nguyên tố X đó là: A. Chlorine B. Flourine C. Bromine D. Potassium
Câu 25. Trong một nguyên tử có số proton bằng 5, số electron trong các lớp của vỏ
nguyên tử, viết từ lớp trong ra lớp ngoài, lần lượt là A. 1, 8, 2. B. 2, 8, 1. C. 2, 3. D. 3, 2.
Câu 26. Hạt nhân một nguyên tử fluorine có 9 proton và 10 neutron. Khối lượng của một
nguyên tử flourine xấp xỉ bằng A. 9 amu B. 10 amu C. 19 amu D. 28 amu
Câu 27. Một nguyên tử của nguyên tố hóa học X có tổng số hạt (proton, neutron,
electron) là 46. Trong đó số hạt không mang điện ít hơn số hạt mang điện là 14. R là A. Chlorine B. Flourine C. Phosphorus D. Potassium
Câu 28. Lí do những nguyên tố hóa học của nhóm IA không tìm thấy trong tự nhiên:
A. Vì chúng là những kim loại không hoạt động.
B. Vì chúng là những kim loại hoạt động.
C. Vì chúng do con người tạo ra.
D. Vì chúng là kim loại kém hoạt động.
II. Tự luận (3 điểm)
Câu 29. Điền từ thích hợp vào chỗ trống: nguyên tử; neutron; electron; proton; lớp vỏ electron; hạt nhân.
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) …….. Nguyên tử được tạo nên
từ (2) ……….và (3) ………….
b) (4) …………..nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) …………. và (6) …………
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) ………. và các
hạt không mang điện tích được gọi là (8) ………….
d) (9) ………… chuyển động quanh hạt nhân nguyên tử.
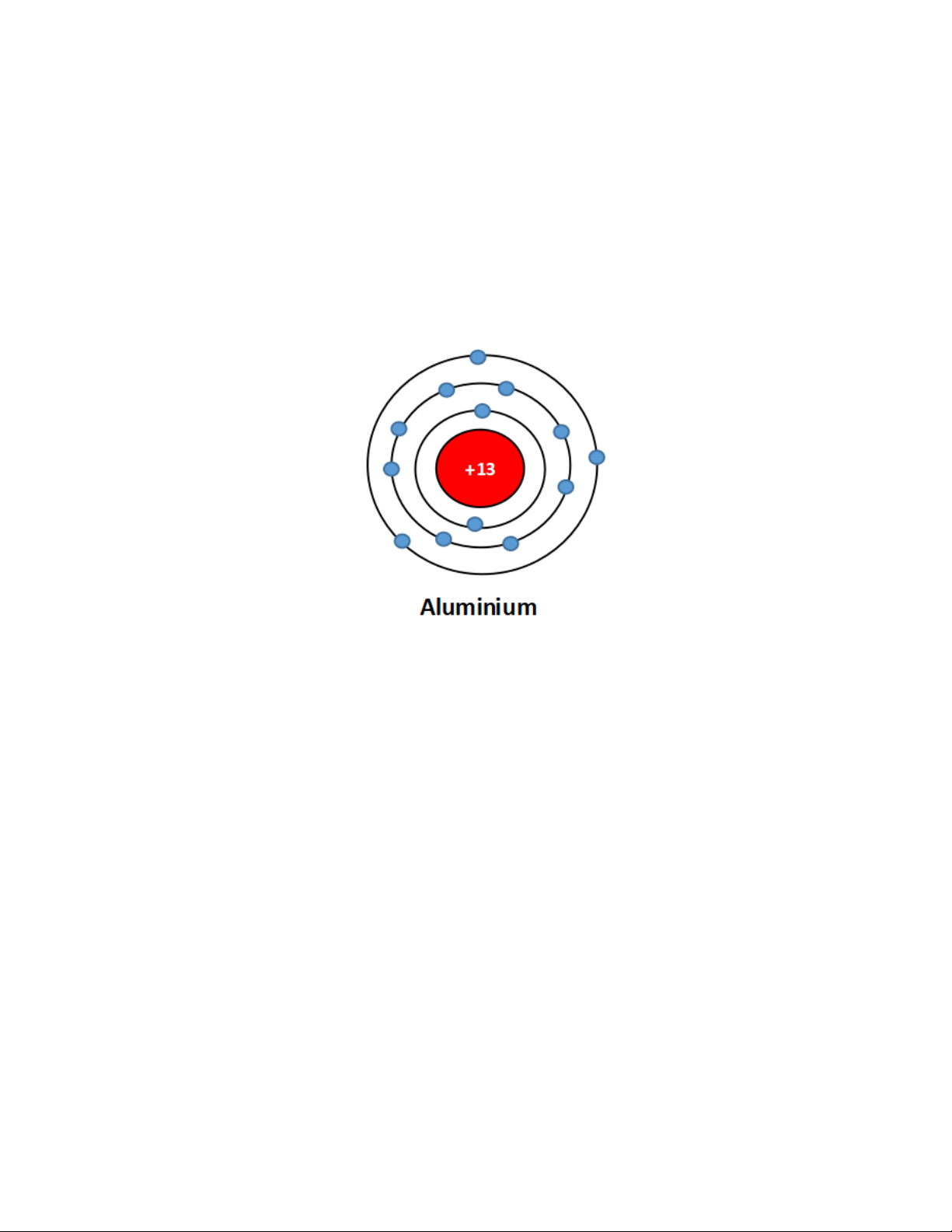
Câu 30. Tổng số hạt proton, neutron, electron của nguyên tố X là 40, trong đó số hạt
mang điện nhiều hơn số hạt không mang điện là 12. Xác định số p, n, e của X và vẽ sơ đồ
cấu tạo của nguyên tử nguyên tố X.
C. Đáp án đề kiểm tra giữa học kì 1 Khoa học tự nhiên 7
I. Trắc nghiệm khách quan (7 điểm) 1B 2D 3B 4A 5C 6B 7A 8A 9C 10B 11B 12D 13B 14A 15C 16D 17D 18A 19A 20C 21D 22A 23C 24B 25C 26A 27C 28B
II. Tự luận (3 điểm) Câu 1.
a) Thành phần chính tạo nên mọi vật chất được gọi là (1) nguyên tử. Nguyên tử được tạo
nên từ (2) hạt nhân và (3) lớp vỏ electron.
b) (4) Hạt nhân nằm ở trung tâm nguyên tử. Hạt nhân được tạo bởi (5) proton và (6) neutron.
c) Các hạt mang điện tích dương trong hạt nhân nguyên tử được gọi là (7) proton và các
hạt không mang điện tích được gọi là (8) neutron.
d) (9) Electron chuyển động quanh hạt nhân nguyên tử. Câu 2.
Gọi số hạt proton = số hạt electron = p Gọi số hạt notron = n
Ta có : Tổng số hạt : 2p + n = 40
Hạt mang điện nhiều hơn không mang điện là 12 : 2p - n = 12 Suy ra p = 13 ; n = 14
Vậy có 13 hạt proton, 13 hạt electron và 14 hạt notron
Sơ đồ cấu tạo của nguyên tử X
--------------------------------------
Tài liệu mong nhận đóng góp từ quý thầy cô và bạn đọc




