


Preview text:
MA TRẬN VÀ ĐẶC TẢ ĐỀ KIỂM TRA GIỮA KÌ I MÔN KHOA HỌC TỰ NHIÊN, LỚP 7 1. Khung ma trận
- Thời điểm kiểm tra: Kiểm tra giữa kì I, nội dung: Từ bài mở đầu đến bài 7 của chủ đề 2.
Tổng số tiết kiểm tra 33 tiết
- Thời gian làm bài: 60 phút thực hiện theo thông tư 22
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 60% trắc nghiệm, 40% tự luận) - Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao
+ Phần trắc nghiệm: 6,0 điểm gồm 24 câu hỏi: nhận biết( 12 câu), thông hiểu (12 câu), mỗi câu 0,25 điểm
+ Phần tự luận: 4,0 điểm (Biết: 1,0 điểm; Vận dụng thấp: 2,0 điểm; Vận dụng cao: 1,0 điểm) MỨC ĐỘ Tổng số câu TN/ Điểm số Chủ đề Tổng số ý TL Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL TN TL 1 2 3 4 5 6 7 8 9 10 11 12 Mở đầu (5 tiết) 2 1 2 1 1,5
Chủ đề 1 Nguyên tử, nguyên tố hoá
học- sơ lược về bảng tuần hoàn các 8 9 17 4.25
nguyên tố hoá học (15 tiết)
Chủ đề 2 Phân tử (13 tiết) 2 3 1 1 5 2 4.25 Số câu TN/ Số ý TL 12 1 12 1 1 24 3 (Số YCCĐ) Điểm số 3,0 1,0 3,0 2,0 1,0 6,0 4,0 Tổng số điểm 4,0 điểm 3,0 điểm 2,0 điểm 1,0 điểm 10 điểm 10 điểm
Ghi chú: Mỗi câu TN 1,5 phút ( 24*1,5) = 36 phút
1 Câu tự luận (TH) mỗi câu 4 phút: 4 phút
1 Câu tự luận (VDT) có 4 ý tính phân tử khối 12 phút
1 câu tự luận (VDC) mỗi câu 8 phút: 8 phút 2. Bảng đặc tả TN TL Nội dung Mức độ Yêu cầu cần đạt Số câu STT câu Số ý STT câu Mở đầu (5 tiết) Bài 1: Phương Nhận biết
Trình bày được một số phương pháp và kĩ năng trong học tập môn Khoa học tự 2 C1 C25 pháp và kỹ nhiên C2 năng học tập Thông hiểu
- Thực hiện được các kĩ năng tiến trình: quan sát, phân loại, liên kết, đo, dự báo. môn KHTN
- Sử dụng được một số dụng cụ đo (trong nội dung môn Khoa học tự nhiên 7). Vận dụng
Làm được báo cáo, thuyết trình.
Chủ đề 1: Nguyên tử, nguyên tố hoá học- sơ lược về bảng tuần hoàn các nguyên tố hoá học (15 tiết) Bài 2: Nguyên Nhận biết
- Trình bày được mô hình nguyên tử của Rutherford-Bohr(mô hình sắp xếp 3 C3 tử
electron trong các lớp electron ở vỏ nguyên tử) C4 Bài 3: Nguyên
- Nêu được khối lượng của một nguyên tử theo đơn vị quốc tế amu (đơn vị khối C5 tố hoá học lượng nguyên tử) Bài 4: Sơ lược
- Phát biểu được khái niệm về nguyên tố hoá học và kí hiệu nguyên tố hoá học 3 C6 bảng tuần
- Viết được kí hiệu hoá học và đọc được tên của 20 nguyên tố đầu tiên C7 hoàn các C8 nguyên tố hoa học
– Nêu được các nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học. 2 C9
– Mô tả được cấu tạo bảng tuần hoàn gồm: ô, nhóm, chu kì. C10 Thông hiểu
Sử dụng được bảng tuần hoàn để chỉ ra các nhóm nguyên tố/nguyên tố kim loại, các 9 C13
nhóm nguyên tố/nguyên tố phi kim, nhóm nguyên tố khí hiếm trong bảng tuần hoàn. C14 C15 C16 C17 C18 C19 C20 C21
Chủ đề 2: Phân tử (13 tiết) Bài 5: Phân tử -
Nêu được khái niệm phân tử, đơn chất, hợp chất. 1 C11
đơn chất – hợp Nhận biết chất
– Trình bày được khái niệm về hoá trị (cho chất cộng hoá trị). Cách viết công thức hoá 1 C12 TN TL Nội dung Mức độ Yêu cầu cần đạt Số câu STT câu Số ý STT câu học.
– Nêu được mối liên hệ giữa hoá trị của nguyên tố với công thức hoá học. Bài 6: Giới Thông hiểu
- Đưa ra được một số ví dụ về đơn chất và hợp chất. 1 C22 thiệu về liên
– Tính được khối lượng phân tử theo đơn vị amu theo mô hình kết hoá học
– *Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí 2 C23 Bài 7: Hoá trị
hiếm; sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để C24 và công thức
tạo ra lớp vỏ electron của nguyên tố khí hiếm (Áp dụng được cho các phân tử đơn ,… hoá học
giản như H2, Cl2, NH3, H2O, CO2, N2 .).
– *Nêu được được sự hình thành liên kết ion theo nguyên tắc cho và nhận electron
để tạo ra ion có lớp vỏ electron của nguyên tố khí hiếm (Áp dụng cho phân tử đơn giản như NaCl, MgO,…).
– Chỉ ra được sự khác nhau về một số tính chất của chất ion và chất cộng hoá trị.
– Viết được công thức hoá học của một số chất và hợp chất đơn giản thông dụng.
– Tính được phần trăm (%) nguyên tố trong hợp chất khi biết công thức hoá học của hợp chất. Vận dụng
– Từ hợp chất ion và hợp chất cộng hóa trị, ta xác định hóa trị của nguyên tố và ngược lại.
– Tính được khối lượng phân tử theo đơn vị amu theo CTHH Câu 26
– Xác định được công thức hoá học của hợp chất dựa vào phần trăm (%) nguyên tố
và khối lượng phân tử. (VDC cho CTHH có 2 hoặc 3 nguyên tố trở lên) Câu 27 (VDC) Đề bài
I. TRẮC NGHIỆM: (6.0 điểm) Chọn phương án trả lời đúng nhất và điền vào bảng sau: Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 Câu 9 Câu 10 Câu 11 Câu 12 Câu 13 Câu 14 Câu 15 Câu 16 Câu 17 Câu 18 Câu 19 Câu 20 Câu 21 Câu 22 Câu 23 Câu 24
Câu 1. “Trên cơ sở các số liệu và phân tích số liệu, con người có thể đưa ra các dự báo hay dự đoán
tính chất của sự vật, hiện tượng, nguyên nhân của hiện tượng!” Đó là kĩ năng nào?
A. Kĩ năng quan sát, phân loại.
B. Kĩ năng liên kết tri thức. C. Kĩ năng dự báo. D. Kĩ năng đo.
Câu 2. Con người có thể định lượng được các sự vật và hiện tượng tự nhiên dựa trên kĩ năng nào?
A. Kĩ năng quan sát, phân loại.
B. Kĩ năng liên kết tri thức. C. Kĩ năng dự báo. D. Kĩ năng đo.
Câu 3. Trong nguyên tử, các hạt mang điện là: A. electron và neutron
B. electron, proton và neutron C. electron và proton D. proton và neutron
Câu 4. Trong một nguyên tử…..
A. số proton = số neutron.
B. số electron = số neutron.
C. số proton = số electron.
D. số electron = số proton + số neutron.
Câu 5. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là: A. electron và neutron. B. proton và neutron. C. neutron và electron.
D. electron, proton và neutron
Câu 6. Các hạt cấu tạo nên trong hầu hết các nguyên tử là: A. electron và neutron
B. electron, proton và neutron C. electron và proton D. proton và neutron
Câu 7. Nguyên tố hóa học là tập hợp nguyên tử cùng loại có cùng
A. số neutron trong hạt nhân.
B. số proton trong hạt nhân.
C. số electron trong hạt nhân.
D. số proton và số neutron trong hạt nhân.
Câu 8. Nguyên tố hóa học nào dưới đây được kí hiệu bằng 2 chữ cái? A. Calcium B. Nitrogen C. Oxygen D. Phosphorus
Câu 9. Trong bảng tuần hoàn các nguyên tố hoá học có bao nhiêu chu kì? A. 1 chu kì. B. 3 chu kì. C. 5 chu kì. D. 7 chu kì.
Câu 10. Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết?
A. Số thứ tự của nguyên tố. B. Số hiệu nguyên tử.
C. Số electron lớp ngoài cùng. D. Số lớp electron.
Câu 11. Đơn chất là chất tạo nên từ
A. một chất. B. một nguyên tố hoá học. C. một nguyên tử. D. một phân tử.
Câu 12. Phát biểu nào sau đây đúng?
A. Tất các các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng.
B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron.
C. Nguyên tố khí hiếm rất khó hoặc không kết hợp với nguyên tố khác.
D. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí.
Câu 13. Cho các kí hiệu hoá học sau: Na, ZN, CA, Al, Ba, CU. Các kí hiệu hoá học nào viết sai: A. Na, ZN, CA. B. Al, Ba, CU. C. ZN, CA, Al. D. ZN, CA, CU.
Câu 14. Số hiệu nguyên tử của một nguyên tố hoá học có giá trị bằng…….
A. số hạt proton trong hạt nhân.
B. số hạt neutron trong hạt nhân.
C. số hạt nhân trong nguyên tử.
D. tổng số hạt mang điện trong nguyên tử.
Câu 15. Số electron trong nguyên tử Al là A. 10. B. 11. C. 12. D. 13.
Câu 16. Dãy nào sau đây gồm các nguyên tố đều là kim loại? A. F, O, Na, N. B. O, Cl, Br, H. C. H, N, O, K. D. K, Na, Mg, Al.
Câu 17. Số hiệu nguyên tử của Sodium là 11. Số hạt mang điện trong nguyên tử Sodium là? A. 11 B. 22 C. 36 D. 26
Câu 18. Nguyên tử X có số hạt proton là 15. Số electron ở lớp ngoài cùng của X là? A. 3 B. 4 C. 5 D. 6
Câu 19. Vàng và carbon có tính chất khác nhau vì vàng là nguyên tố kim loại còn carbon là nguyên tố: A. đơn chất. B. phi kim. C. hợp chất. D. khí hiếm.
Câu 20. Kí hiệu nào sau đây là kí hiệu hóa học của nguyên tố Potassium? A. P B. Pb. C. K D. Na
Câu 21. Nhóm kim loại kiềm gồm các nguyên tố kim loại thuộc nhóm? A. IA B. IIA. C. IIA. D. IVA Câu 22. Cho các chất sau:
(1) Khí nitrogen do nguyên tố N tạo nên;
(2) Khí carbon dioxide do 2 nguyên tố C và O tạo nên;
(3) Sodium hydroxide do 3 nguyên tố Na, O và H tạo nên;
(4) Sulfur do nguyên tố S tạo nên.
Trong những chất trên, chất nào là đơn chất? A. (1); (2). B. (2); (3). C. (3); (4). D. (1); (4).
Câu 23. Trong phân tử NaCl, nguyên tử Na và nguyên tử Cl liên kết với nhau bằng liên kết: A. cộng hóa trị . B. ion. C. kim loại. D. phi kim.
Câu 24. Trong phân tử O2, hai nguyên tử O đã liên kết với nhau bằng:
A. 1 cặp electron dùng chung.
B. 2 cặp electron dùng chung.
C. 3 cặp electron dùng chung.
D. 4 cặp electron dùng chung. II. TỰ LUẬN (4.0 điểm)
Câu 25. (1 điểm) Em hãy nêu các bước phương pháp tìm hiểu tự nhiên?
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
Câu 26. (2 điểm) Tính khối lượng phân tử các chất có công thức hóa học sau: O3, HCl, P2O5, Na2CO3
(Biết H=1; C=12; O=16; Na=23; P=31; Cl=35,5)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
Câu 27. (1 điểm) Một hợp chất có công thức là Fe
. Trong đó Fe chiếm 70% về khối lượng. xOy
Tìm công thức hoá học của hợp chất trên. (Biết Fe=56; O=16)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
………………………………………………………………………………………………………….. -------------HẾT ---------- HƯỚNG DẪN CHẤM
I. TRẮC NGHIỆM (6 điểm)
Mỗi câu chọn đúng đáp án đạt 0.25 điểm Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 C D C C B B B A Câu 9 Câu 10 Câu 11 Câu 12 Câu 13 Câu 14 Câu 15 Câu 16 D D B C D A D D Câu 17 Câu 18 Câu 19 Câu 20 Câu 21 Câu 22 Câu 23 Câu 24 B C B C A D B B II. TỰ LUẬN (4 điểm) Câu Đáp án chi tiết Điểm Ghi chú Câu 25
(1) Quan sát và đặt câu hỏi nghiên cứu Đúng
(2) Hình thành giả thuyết 2 ý - 0,25
(3) Lập kế hoạch kiểm tra giả thuyết 3 ý – 0,5
(4) Thực hiện kế hoạch 4 ý – 0,75 (5) Kết luận 5 ý – 1,0 điểm Câu 26 HS sắp chi tiết O3 = 3. 16 = 48 (amu) 0,5 đúng sai kết quả HCl = 1 + 35,5 = 36,5 (amu) 0,5 đạt 0,25.
P2O5 = 2. 31 + 5. 16 = 142 (amu) 0,5 Sắp sai kết quả
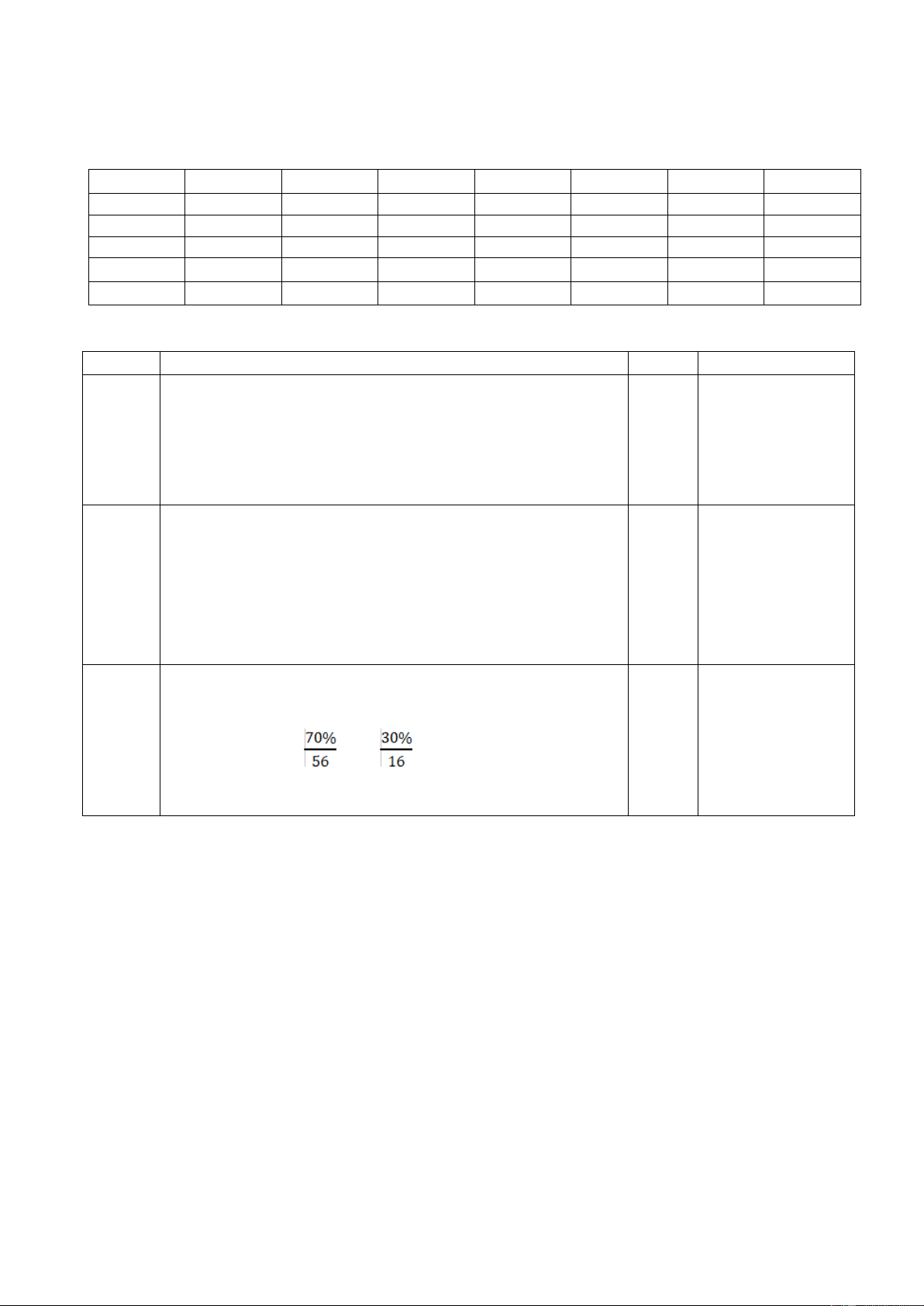
Na2CO3 = 2. 23 + 12 + 3. 16 = 106 (amu) 0,5 đúng không cho điểm Câu 27 % O = 100% - 70% = 30 % 0,25 HS giải cách khác
Từ công thức của hợp chất là FexOy, ta có: đúng cho điểm tối 56x : 16y = 70% : 30% 0,25 đa của câu. x : y = : = 2: 3 0,25
Vậy công thức của hợp chất cần tìm là: Fe2O3 0,25




