


Preview text:
MA TRẬN VÀ ĐẶC TẢ ĐỀ KIỂM TRA GIỮA KÌ 1 MÔN KHOA HỌC TỰ NHIÊN, LỚP 7 I. MA TRẬN
- Thời điểm kiểm tra: giữa học kì 1(tuần 9), khi kết thúc nội dung: chủ đề 3: Phân tử.
- Thời gian làm bài: 90 phút
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận ( tỉ lệ 40% trắc nghiệm, 60% tự luận ). - Cấu trúc:
- Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
- Phần trắc nghiệm: 4,0 điểm ( gồm 16 câu hỏi: nhận biết: 12 câu, thông hiểu: 4 câu), mỗi câu 0,25 điểm;
- Phần tự luận: 6,0 điểm ( Nhận biết: 1,0 điểm; Thông hiểu: 2,0 điểm; Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm ).
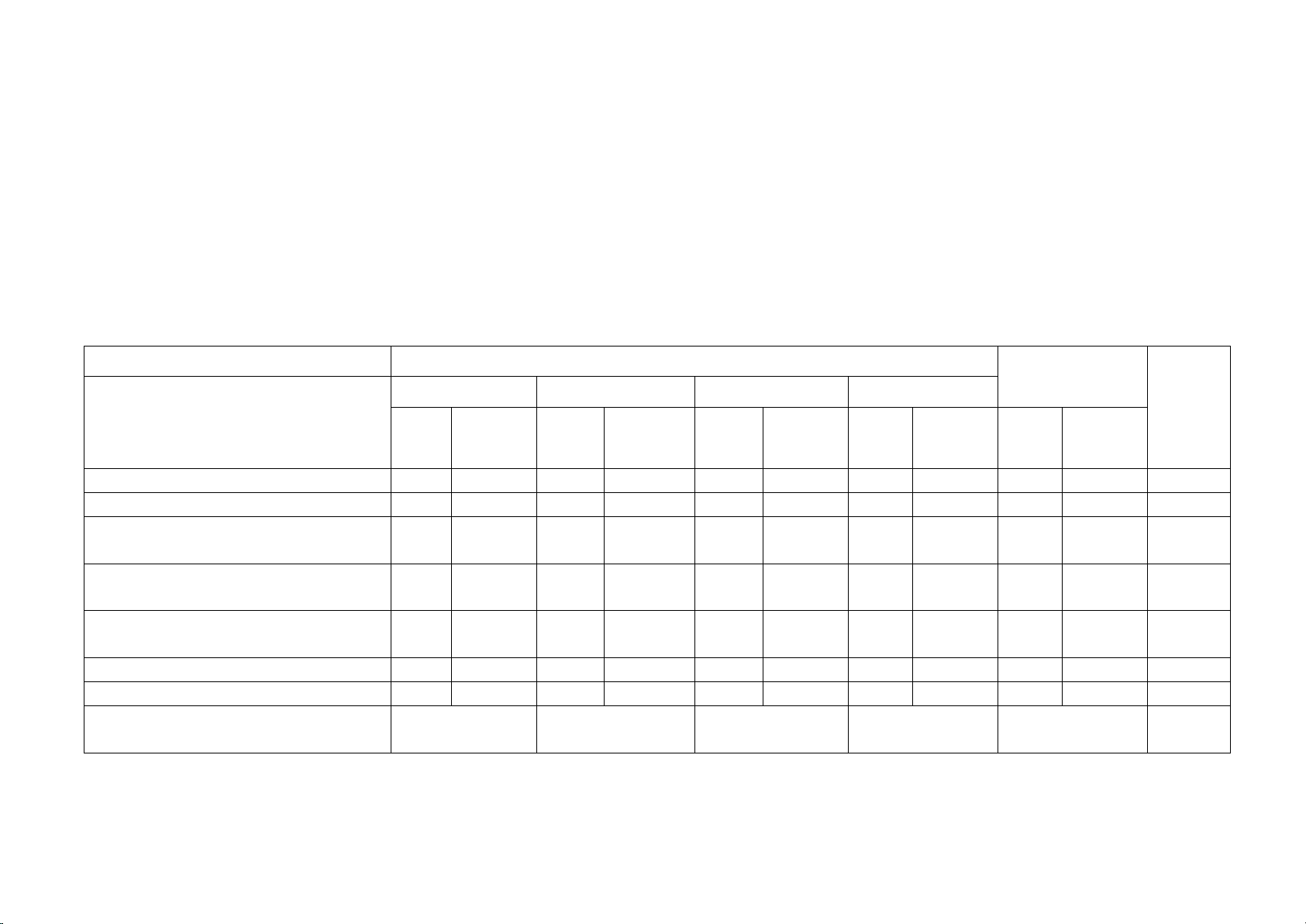
- Nội dung: 8 tuần đầu của HK1: 100% ( 10 điểm ) Chủ đề MỨC ĐỘ Tổng số câu/số Nhận biết Thông hiểu Vận dụng Vận dụng cao ý Điểm Tự Trắc Tự Trắc Tự Trắc Tự Trắc Tự Trắc số luận nghiệm luận nghiệm luận nghiệm luận nghiệm luận nghiệm 1 2 3 4 5 6 7 8 9 10 11 12 Mở đầu (5 tiết) 2 2 0,5
CĐ1. Nguyên tử. Nguyên tố hóa 4 1 1(4) 1 5 2,25 học (8 tiết)
CĐ 2. Sơ lược bảng tuần hoàn 4 1 5 1,15
các nguyên tố hóa học (7 tiết) CĐ3. Phân tử 1(2) 2 1(4) 2 1(8) 3 4 6 (13 tiết)
Số câu TN/ Số ý TL 1 12 1 4 2 1 4 16 Điểm số 1 3 2 1 2 1 6,0 4,0 10,0 Tổng số điểm 4,0 điểm 3,0 điểm 2,0 điểm 1,0 điểm 10,0 điểm điểm II. BẢN ĐẶC TẢ Số câu hỏi Câu hỏi TN Nội dung Mức độ
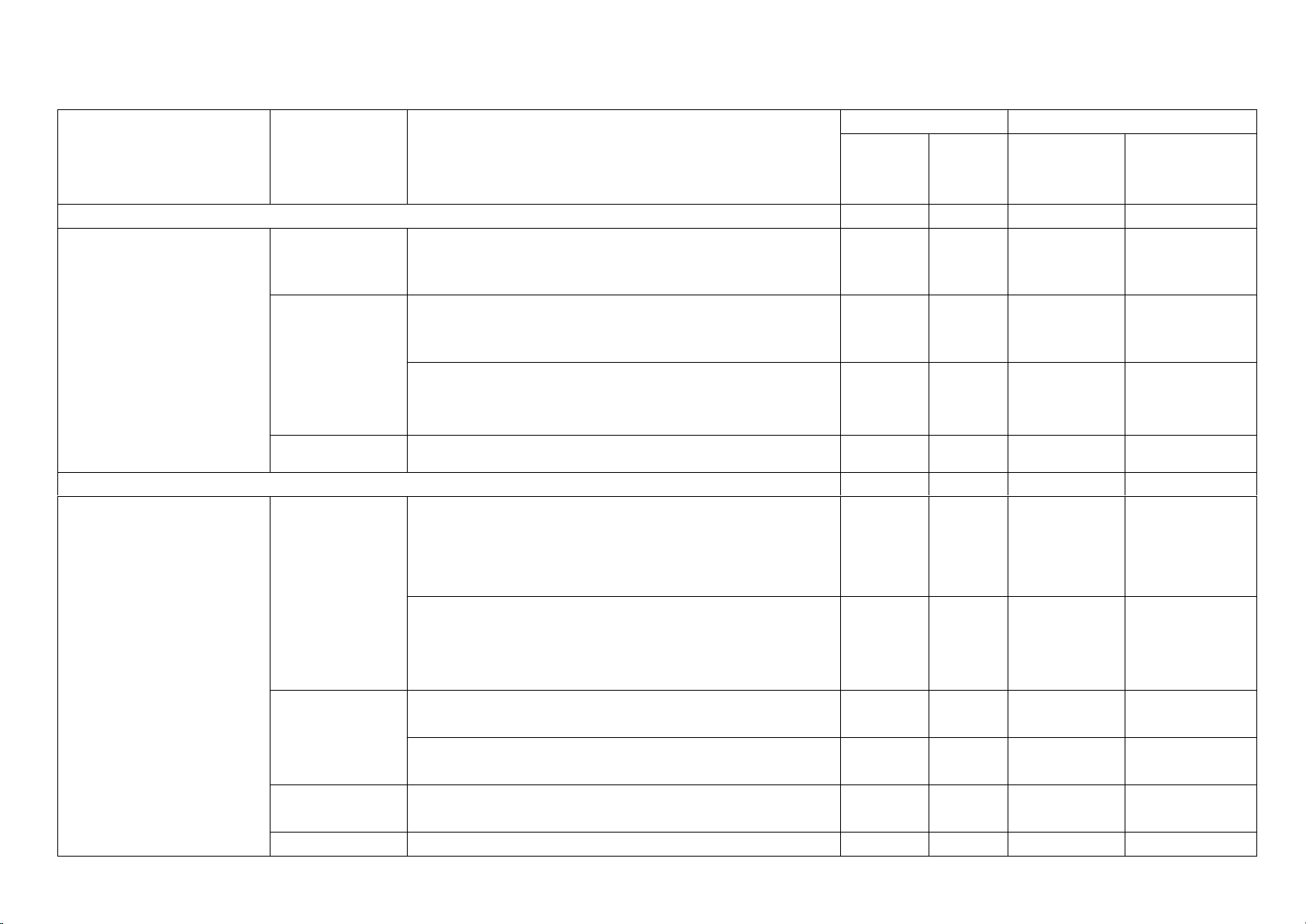
Yêu cầu cần đạt TL TL TN (Số (Số ý) (ý) (Câu) câu)
1. Chủ đề: Mở đầu (5 tiết) 2 C1,2
Trình bày được một số phương pháp và kĩ năng Nhận biết 2 C1,2
trong học tập môn Khoa học tự nhiên. Thông hiểu
- Thực hiện được các kĩ năng tiến trình: quan sát,
phân loại, liên kết, đo, dự báo. Bài mở đầu
- Sử dụng được một số dụng cụ đo (trong nội dung
môn Khoa học tự nhiên 7). Vận dụng
Làm được báo cáo, thuyết trình.
2. Nguyên tử. Nguyên tố hóa học (8 tiết) 1(4) 5 C4(4) C4,5,6,7
- Trình bày được mô hình nguyên tử Rutherfor - Bohr. 1 C3
- Nêu được khối lượng của nguyên tử theo đơn vị quốc tế amu Nhận biết
- Phát biểu được khái niệm về nguyên tố hóa học và kí hiệu nguyên tố 1 C7 hóa học. 1 C4
- Viết được kí hiệu hóa học của nguyên tố.. - Nguyên tử 1 C5
- Đọc được tên của 20 nguyên tố hóa học đầu tiên. - Nguyên tố hóa học
- Chỉ ra được số p, số e, số lớp e, số e lớp ngoài
cùng dựa vào sơ đồ nguyên tử. Thông hiểu
- Tính được khối lượng nguyên tử này dựa vào mối tương quan vớ 1 C6
i khối lượng nguyên tử khác
Vẽ được sơ đồ cấu tạo nguyên tử khi biết số p hoặc Vận dụng số e
Vận dụng cao - Tính được số hạt cơ bản mỗi loại (p, e, n) của 1(4) C4 nguyên tử
3. Chủ đề: Sơ lược bảng tuần hoàn các nguyên tố hóa học (7 tiết) 5 C8,9,10,11,12
– Nêu được các nguyên tắc xây dựng bảng tuần 1 C9
hoàn các nguyên tố hoá học. Nhận biết – - Sơ lược bảng tuần
Mô tả được cấu tạo bảng tuần hoàn gồm: ô, 3 C8,10,11 hoàn các nguyên tố hóa nhóm, chu kì. học.
Sử dụng được bảng tuần hoàn để chỉ ra các nhóm
nguyên tố/nguyên tố kim loại, các nhóm nguyên Thông hiểu 1 C12
tố/nguyên tố phi kim, nhóm nguyên tố khí hiếm trong bảng tuần hoàn.
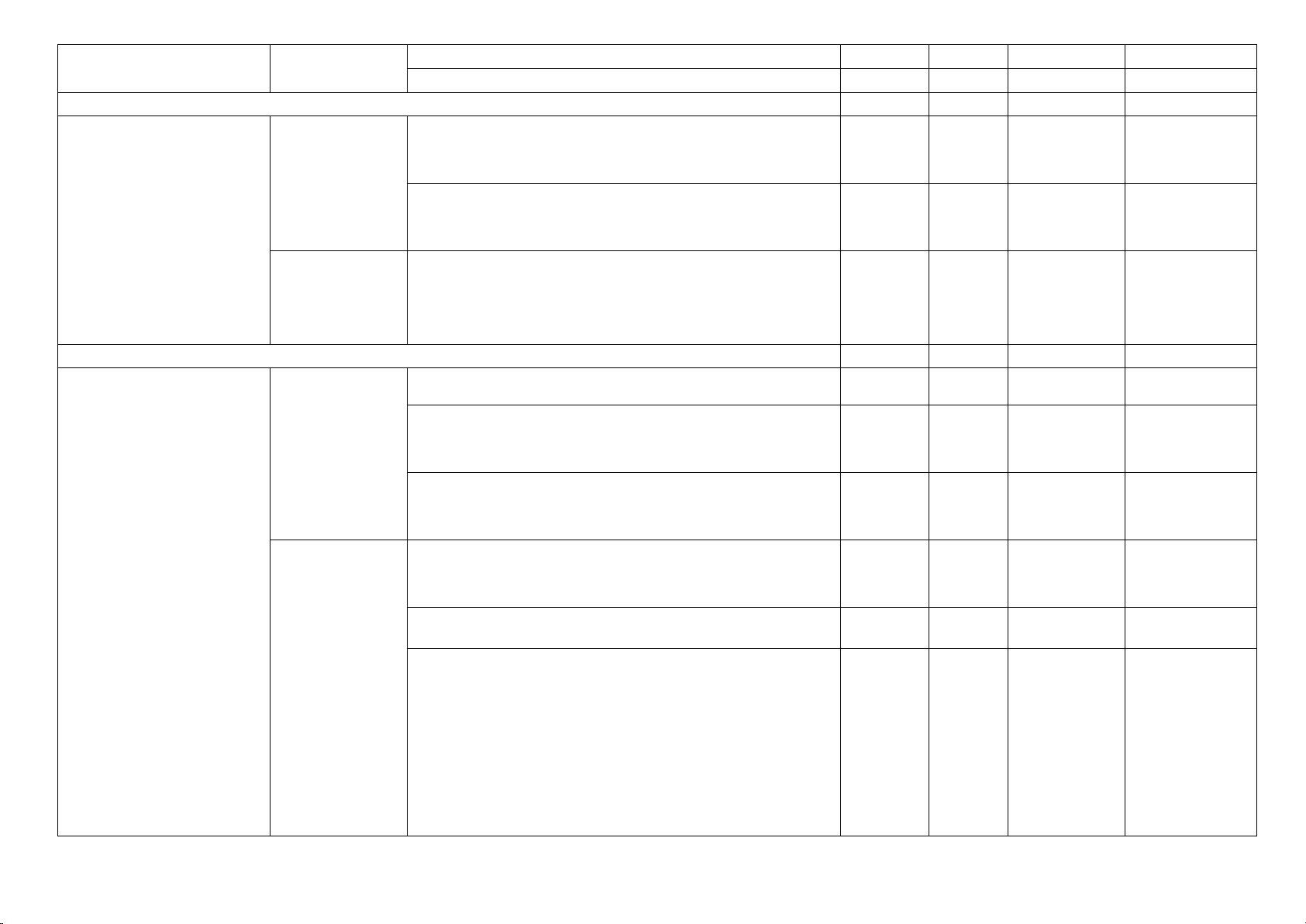
4. Phân tử (13 tiết) 3 (14) 4
C1,2,3 (14) C13,14,15,16
- Nêu được khái niệm phân tử, đơn chất, hợp chất. 1 C13
– Trình bày được khái niệm về hoá trị (cho chất cộng 1(2) 1 C1(2) C15 Nhận biết
hoá trị). Cách viết công thức hoá học.
– Nêu được mối liên hệ giữa hoá trị của nguyên tố
với công thức hoá học.
- Phân tử, đơn chất, hợp
- Đưa ra được một số ví dụ về đơn chất và hợp chất.
- Giới thiệu về liên kết chất. hóa học.
– Tính được khối lượng phân tử theo đơn vị amu. 1 C14
- Hóa trị, liên kết hóa Thông hiểu học.
– *Nêu được mô hình sắp xếp electron trong vỏ
nguyên tử của một số nguyên tố khí hiếm; sự hình
thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để
tạo ra lớp vỏ electron của
nguyên tố khí hiếm (Áp dụng được cho các phân tử đơn giản như H ,… 2, Cl2, NH3, H2O, CO2, N2 .).
– *Nêu được được sự hình thành liên kết ion theo
nguyên tắc cho và nhận electron để tạo ra ion có
lớp vỏ electron của nguyên tố khí hiếm (Áp dụng
cho phân tử đơn giản như NaCl, MgO,…).
– Chỉ ra được sự khác nhau về một số tính chất của
chất ion và chất cộng hoá trị.
– Viết được công thức hoá học của một số chất và 1(4) C2(4)
hợp chất đơn giản thông dụng.
– Tính được phần trăm (%) nguyên tố trong hợp chất
khi biết công thức hoá học của hợp chất. 1 C16
– Xác định được công thức hoá học của hợp chất Vận dụng
dựa vào phần trăm (%) nguyên tố và khối lượng 1(8) C3(8) phân tử.
Đề thi giữa kì 1 KHTN 7 Cánh diều
Trắc nghiệm: (4 điểm) Hãy chọn câu trả lời đúng nhất trong các câu sau:
Câu 1: Một báo cáo kết quả tìm hiểu, khám phá thế giới tự nhiên bao gồm:
A. tên báo cáo, tên người thực hiện, kết luận.
B. tên báo cáo, tên người thực hiện,kết quả và thảo luận.
C. tên báo cáo, tên người thực hiện; mục đích; mẫu vật, dụng cụ và phương pháp; kết quả và thảo luận; kết luận.
D. tên người báo cáo; mẫu vật, dụng cụ; kết luận.
Câu 2: Bước đầu tiên trong phương pháp tìm hiểu tự nhiên là:
A. quan sát đặt câu hỏi.
B. xây dựng giả thuyết . C. kiểm tra giả thuyết. D. phân tích kết quả.
Câu 3. Các hạt cấu tạo nên hạt nhân nguyên tử là: A. electron và neutron. B. proton và neutron.
C. electron, proton và neutron D. neutron và electron.
Câu 4. Cách biểu diễn 4H có nghĩa là: A. 4 nguyên tử helium. B. 4 nguyên tố hydrogen. C. 4 nguyên tử hydrogen. D. 4 nguyên tố helium.
Câu 5. Kí hiệu hóa học của sodium là: A. S. B. Si. C. Na. D. N.
Câu 6. Nguyên tử X nặng gấp đôi nguyên tử oxygen. X là: A. S B. Mg. C. Zn. D. Cu
Câu 7. Nguyên tố hóa học là tập hợp nguyên tử cùng loại có cùng:
A. số neutron trong hạt nhân.
B. số proton trong hạt nhân.
C. số electron trong hạt nhân.
D. số proton và số neutron trong hạt nhân.
Câu 8: Phát biểu nào sau đây không đúng?
A. Bảng tuần hoàn gồm 3 chu kì nhỏ và 4 chu kì lớn.
B. Số thứ tự của chu kì bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì đó.
C. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố thuộc chu kì đó.
D. Các nguyên tố trong cùng chu kì được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Câu 9. Bảng tuần hoàn các nguyên tố hoá học được sắp xếp theo nguyên tắc:
A. nguyên tử khối tăng dần.
B. tính kim loại tăng dần.
C. điện tích hạt nhân tăng dần D. tính phi kim tăng dần.
Câu 10. Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết:
A. số thứ tự của nguyên tố. B. số hiệu nguyên tử.
C. số electron lớp ngoài cùng.
D. số lớp electron.
Câu 11. Nguyên tố Mg có cùng số electron lớp ngoài cùng với nguyên tố nào sau đây? A. Calcium. B. Aluminium. C. Sodium. D. Potassium.
Câu 12. Dãy nào sau đây gồm các nguyên tố đều là kim loại? A. F, O, Na, N. B. O, CI, Br, H. C. H, N, O, K.
D. K, Na, Mg, Al.
Câu 13. Đơn chất là chất tạo nên từ: A. một chất.
B. một nguyên tố hoá học. C. một nguyên tử. D. một phân tử.
Câu 14. Khối lượng phân tử của phosphoric acid H3PO4 là: A. 48 amu. B. 86 amu. C. 98 amu. D. 96 amu
Câu 15. Liên kết ion được hình thành nhờ:
A. lực hút giữa các ion trái dấu.
B. lực hút tĩnh điện giữa các nguyên tử.
C. một hay nhiều cặp electron dùng chung.
D. một hay nhiều cặp neutron dùng chung.
Câu 16: Phần trăm khối lượng của S trong hợp chât CaSO3 là: A. 33,33% B. 26,67% C. 40% D. 66,67%
II. Tự luận: (6 điểm)
Câu 1. (1đ) Hóa trị là gì? Nêu quy tắc hóa trị?
Câu 2. (2đ) Viết công thức hóa học và tính khối lượng phân tử của các hợp chất có cấu tạo phân tử như sau: Hợp chất Cấu tạo phân tử Công thức hóa học Khối lượng phân tử Potassium oxide 2K, 1O Aluminium clorua 1A1, 3C1 Sulfuric acid 2H,1S, 4O Iron (II) phosphate 3Fe, 2 nhóm PO4
Câu 3. (2đ) Hợp chất được tạo thành từ nguyên tố Fe và oxygen có khối lượng phân tử là 160 amu. Trong đó, khối lượng của Fe chiếm 70%. Hãy xác định
công thức hóa học của hợp chất.
Câu 4. (1đ) Tổng số hạt proton, nơtron, electron của một nguyên tố X là 40, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định số p, số n, số e của X?
-------------------------Hết--------------------
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM
KIỂM TRA GIỮA HỌC KÌ 1 MÔN KHTN– LỚP 7
I. Trắc nghiệm: (4 điểm) Mỗi câu chọn đúng, học sinh được 0,25 điểm: Câu 1 2 3 4 5 6 7 8 Đáp án C A B C C A B B Câu 9 10 11 12 13 14 15 16 Đáp án C D A D B C A B
II. Tự luận: (6 điểm) Câu Nội dung Điểm
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử 0,5đ Câu 1 nguyên tố khác. (1 điể
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa
m) hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B. 0,5đ Hợp chất Cấu tạo phân tử Công thức hóa học Khối lượng phân tử 0,5đ Potassium oxide 2K, 1O K2O 94 (amu) Câu 2 0,5đ Aluminium clorua 1A1, 3C1 AlCl3 133,5 (amu) (2 điểm) Sulfuric acid 2H,1S, 4O H2SO4 98 (amu) Iron (II) phosphate 3Fe, 2 nhóm PO4 Fe3(PO4)2 358 (amu) 0,5 đ 0,5 đ 0,25đ Câu 3
- Đặt công thức hóa học của hợp chất là FexOy
- Khối lượng của nguyên tố Fe trong một phân tử hợp chất: 0,25đ (2 điểm) 160.70 0,25đ 112(amu) 100
- Khối lượng của nguyên tố O trong một phân tử hợp chất: 160 - 112 = 48 (amu) 0,25đ Ta có: 56.x = 112 x = 2 0,25đ 16.y = 48 y = 3 0,25đ
Vậy công thức hóa học của hợp chất là Fe2O3 0,25đ 0,25đ
Theo giả thiết, ta có: p + e+ n = 40 0,25đ Câu 4
Mà p = e => 2p + n = 40 (1) 0,25đ
(1 điểm) Mặt khác: 2p - n = 12 (2) 0,25đ
Từ (1) và (2): p = e = 13; n = 14 0,25đ




