

Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KIỂM TRA HỌC KỲ II NĂM HỌC 2019-2020 QUẢNG NAM
Môn: Hóa Học – Lớp 12
Thời gian: 45 phút (không kể thời gian giao đề) ĐỀ CHÍNH THỨC
(Đề gồm có 2 trang) MÃ ĐỀ: 324
Cho biết nguyên tử khối: Na = 23; K = 39; Mg = 24; Al = 27; Fe = 56; Cu = 64; H = 1, C =12; O = 16.
Câu 1: Dung dịch KOH tác dụng với chất nào sau đây tạo ra kết tủa Fe(OH)3? A. Fe(NO3)3. B. FeO. C. Fe2O3. D. Fe3O4.
Câu 2: Thành phần hóa học chính của quặng xiđêrit là A. Fe3O4. B. FeS2. C. FeCO3. D. Fe2O3.
Câu 3: Chất nào sau đây phản ứng với dung dịch KOH tạo kết tủa? A. MgSO4. B. NH4Cl. C. KNO3. D. BaCl2.
Câu 4: Natri clorua là thành phần chính của muối ăn. Công thức của natri clorua là A. NaI. B. NaOH. C. NaCl. D. KCl.
Câu 5: Ở nhiệt độ thường, kim loại Fe không phản ứng với dung dịch chất nào sau đây? A. CuSO4. B. K2SO4. C. HCl. D. AgNO3.
Câu 6: Nước cứng là nước có chứa nhiều ion A. K+, Ba2+. B. Na+, H+. C. Na+, K+. D. Ca2+, Mg2+.
Câu 7: Sắt có số oxi hóa +3 trong hợp chất nào sau đây? A. Fe2(SO4)3. B. Fe(OH)2. C. FeO. D. Fe(NO3)2.
Câu 8: Cấu hình electron của nguyên tử Na (Z =11) là
A. 1s2 2s2 2p6 3s2 3p1. B. 1s2 2s2 2p6 3s1. C. 1s2 2s2 2p6 3s2. D. 1s2 2s2 2p6.
Câu 9: Công thức của thạch cao khan là A. CaSO4.H2O. B. CaCO3. C. CaSO4. D. CaSO4.2H2O.
Câu 10: Phương pháp thích hợp để điều chế kim loại Na là
A. điện phân NaCl nóng chảy.
B. dùng K khử Na+ trong dung dịch NaCl.
C. điện phân dung dịch NaCl có màng ngăn.
D. điện phân dung dịch NaCl không màng ngăn.
Câu 11: Kim loại Fe tác dụng với dung dịch chất nào sau đây sinh ra khí H2?
A. HNO3 đặc, nóng. B. CuSO4. C. HCl.
D. H2SO4 đặc, nóng.
Câu 12: Công thức của sắt (III) sunfat là A. FeCl3. B. Fe2O3. C. FeS2. D. Fe2(SO4)3.
Câu 13: Hợp chất Mg(OH)2 có màu A. nâu đỏ. B. trắng xanh. C. trắng. D. vàng.
Câu 14: Kim loại nào sau đây thuộc nhóm IIIA? A. Ca. B. Na. C. Li. D. Al.
Câu 15: Chất nào sau đây có tính lưỡng tính? A. AlCl3. B. Mg(OH)2. C. Al2O3. D. Na2CO3.
Câu 16: Cho 0,01 mol BaCO3 tác dụng hết với dung dịch HCl dư, thu được V lít khí CO2 (đktc). Giá trị của V là A. 0,672. B. 0,448. C. 0,224. D. 0,336.
Câu 17: Phương trình hóa học nào sau đây sai?
A. Fe + CuSO4 → FeSO4 + Cu.
B. Ba + H2SO4 → BaSO4 + H2.
C. 2NaOH + MgCl2 → Mg(OH)2 + 2NaCl.
D. BaCO3 + 2NaOH → Ba(OH)2 + Na2CO3.
Câu 18: Cho dãy các kim loại: Na, Mg, Al, Fe, Cu. Số kim loại trong dãy phản ứng với lượng dư
dung dịch FeCl3 thu được kết tủa là A. 5. B. 3. C. 2. D. 1.
Câu 19: Phản ứng nào sau đây chứng minh sắt (II) có tính oxi hóa? Trang 1 0 A. 2FeCl t 2 + Cl2 2FeCl3. B. FeO + CO Fe + CO2.
C. Fe(OH)2 + H2SO4 FeSO4 + 2H2O.
D. FeCl2 + 2NaOH Fe(OH)2 + 2NaCl.
Câu 20: Dãy gồm tất cả các chất đều phản ứng với nước là
A. Na2O, K2O, BaSO4. B. Na2O, K2O, BaO. C. Na2O, Fe2O3, BaO. D. K2O, BaO, Al2O3.
Câu 21: Cho 3,6 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc,
thể tích khí H2 (lít) (ở đktc) thoát ra là A. 6,72. B. 3,36. C. 2,24. D. 4,48.
Câu 22: Cho 13,44 gam bột sắt tác dụng hết với dung dịch H2SO4 loãng (dư), thu được V lít khí H2
(đktc). Giá trị của V là A. 8,960. B. 5,376. C. 7,840. D. 13,440.
Câu 23: Dãy gồm tất cả các chất đều tác dụng với dung dịch NaHCO3 là A. NaOH, Na2CO3, KCl.
B. H2SO4, Ba(OH)2, NaOH.
C. BaCl2, K2CO3, Ba(OH)2.
D. H2SO4, Ba(OH)2, Na2CO3.
Câu 24: Có thể dùng dung dịch của chất nào sau đây để phân biệt hai dung dịch BaCl2 và K2SO4? A. MgSO4. B. NaNO3. C. quỳ tím. D. HCl.
Câu 25: Hòa tan hết m gam K vào 300 ml dung dịch Mg(NO3)2 1M, kết thúc phản ứng thu được
11,6 gam kết tủa. Giá trị của m là A. 23,40. B. 11,70. C. 5,85. D. 15,60.
Câu 26: Cho 16,0 gam hỗn hợp Fe và Mg tác dụng hoàn toàn với dung dịch HCl dư, thu được 8,96
lít khí H2 (đktc). Phần trăm khối lượng của Mg trong hỗn hợp là A. 30. B. 46. C. 70. D. 54.
Câu 27: Khử hoàn toàn 55,68 gam hỗn hợp rắn gồm FeO, Fe3O4 và Fe2O3 cần 0,96 mol khí CO, thu
được m gam Fe. Giá trị của m là A. 40,32. B. 42,30. C. 45,00. D. 47,04.
Câu 28: Nung m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí, thu được hỗn
hợp rắn (X). Cho toàn bộ X vào dung dịch NaOH dư, thu được 3,36 lít H2 (đktc) và còn lại 31,5
gam chất rắn không tan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 66,6. B. 73,8. C. 68,7. D. 59,7.
Câu 29: Muối Mohr là muối kép ngậm nước của (NH4)2SO4 và FeSO4. Để xác định hàm lượng sắt
(II) có trong một mẩu muối Mohr (đã được cất trữ trong phòng thí nghiệm một thời gian), một học
sinh đã cân chính xác 24,13 gam tinh thể muối Mohr, hòa vào nước thành 100 ml dung dịch X. Lấy
chính xác 5 ml dung dịch X đem cho phản ứng với dung dịch KMnO4 trong môi trường axit, thấy
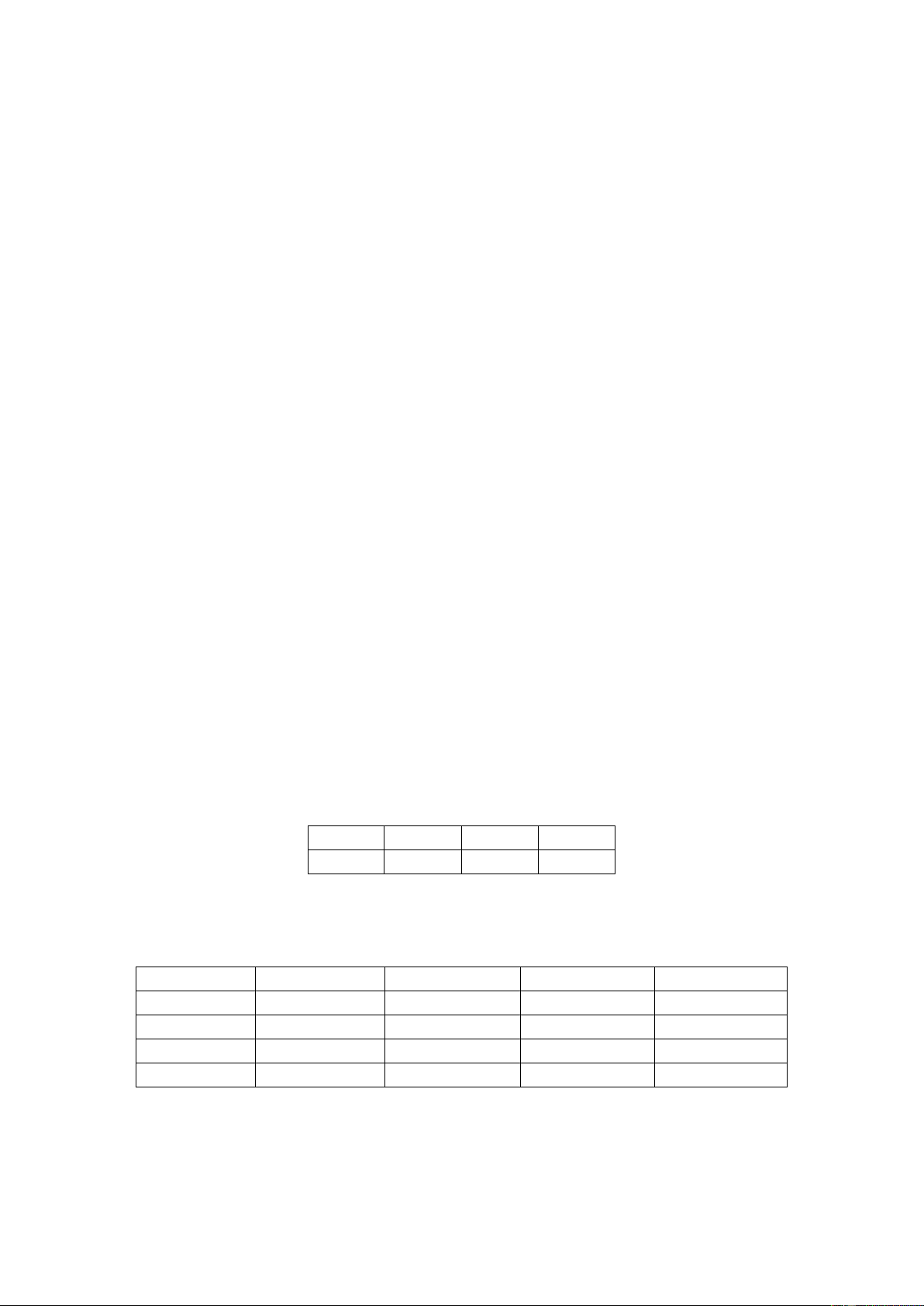
dùng vừa hết a ml dung dịch KMnO4 0,05 M. Lặp lại thí nghiệm 3 lần, thu được kết quả như sau: Lần 1 2 3 a (ml) 12,5 13,0 12,0
Phần trăm khối lượng của sắt (II) trong mẫu muối Mohr ở trên gần nhất với giá trị nào sau đây? A. 14,29. B. 14,50. C. 1,45. D. 1,43.
Câu 30: Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên
(1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau: Dung dịch (1) (2) (4) (5) (1) Khí thoát ra Có kết tủa (2) Khí thoát ra Có kết tủa Có kết tủa (4) Có kết tủa Có kết tủa (5) Có kết tủa
Các dung dịch (2), (3), (4) lần lượt là
A. H2SO4, MgCl2, BaCl2.
B. Na2CO3, BaCl2, H2SO4.
C. H2SO4, NaOH, BaCl2.
D. Na2CO3, NaOH, BaCl2.
------ HẾT ------
Học sinh được dùng bảng Hệ thống tuần hoàn các nguyên tố hóa học Trang 2 ĐÁP ÁN 1 A 6 D 11 C 16 C 21 D 26 A 2 C 7 A 12 D 17 D 22 B 27 A 3 A 8 B 13 C 18 D 23 B 28 D 4 C 9 C 14 D 19 B 24 A 29 B 5 B 10 A 15 C 20 B 25 D 30 D Trang 3




