


Preview text:
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG 2021-2022 Môn: Hóa Học 10
Thời gian làm bài: 180 phút Câu 1: (4 điểm)
a) Nêu phương pháp hóa học nhận biết các dung dịch không màu đựng trong các bình mất nhãn sau:
NaCl, H2SO4, NaOH và BaCl2, MgCl2.
b) Viết phương trình phản ứng và nêu hiện tượng trong thí nghiệm sau:
+ Thí nghiệm 1: Nhỏ dung dịch NaOH từ từ đến dư vào dung dịch AlCl3.
+ Thí nghiệm 2: Hòa tan hoàn toàn 1 mẩu Fe trong dung dịch H2SO4 loãng đủ thu được
dung dịch A. Sau đó cho NaOH dư vào dung dịch A. Câu 2: (4 điểm)
a) Nguyên tử của nguyên tố (A) là thành phần không thể thiếu trong thực vật. A tạo thành chuỗi
phản ứng sau. Xác định (A), (B), (C),… và viết các phương trình phản ứng. 0 (A) +O + + + 2 ⎯⎯⎯ → (B) NaOH ⎯⎯⎯→ (C) t C ⎯⎯⎯ → (D) (E ) ⎯⎯⎯ → (B)
b) Hòa tan hoàn toàn 12,6(g) hỗn hợp Mg và Al cần vừa đủ 400(g) dung dịch HCl 10,95 (%) thu
được dung dịch (A) và khí H2 thoát ra. Viết phương trình phản ứng xảy ra và xác định khối
lượng mỗi kim loại trong hỗn hợp. Câu 3: (4 điểm)
a) Lên men rượu từ m(g) glucozơ với hiệu suất 80%, lượng rượu thu được đem đốt cháy hoàn
toàn sau đó dẫn toàn bộ sản phẩm vào dung dịch Ca(OH)2 dư thu được 40(g) kết tủa. Viết các
phương trình phản ứng xảy ra và tính giá trị m.
b) Viết phương trình phản ứng sau: CH = CH + Br → 2 2 2 CH − COOH + NaOH → 3 C H OH + Na → 2 5 0 t C CH + O ⎯⎯→ 4 2 Câu 4: (4 điểm)
a) Khối lượng nguyên tử trung bình của Bo là 10,18(u). Bo trong tự nhiên có 2 đồng vị 10 11 B; B . 5 5
Hỏi có bao nhiêu phần trăm khối lượng đồng vị 11B trong phân tử H 5 3BO3.
b) Hợp chất tạo từ ion M+ và ion X2- cho biết:
- Trong phân tử M2X có tổng các loại hạt là 140, trong đó số hạt mang điện nhiều hơn số
hạt không mang điện là 44.
- Số khối của ion M+ lớn hơn số khối của ion X2- là 23.
- Tổng số hạt trong M+ lớn hơn trong X2- là 31.
Xác định Z, A của nguyên tử M và X. Câu 5: (4 điểm)
a) Nguyên tử của nguyên tố X có tổng các hạt là 52, trong đó tổng số hạt mang điện nhiều hơn
số hạt không mang điện là 16. Xác định số lượng mỗi loại hạt trong nguyên tử X và bộ số lượng
tử của electron cuối cùng trong nguyên tử X.
b) Tính bán kính gần đúng của Cu ở 200C biết ở nhiệt độ đó khối lượng riêng của Cu là
8,93 g/cm3 với giả thiết trong tinh thể các nguyên tử Cu là những hình cầu chiếm 74% thể tích
tinh thể, phần còn lại là khe trống. Cho khối lượng của Cu là 63,5u. -------Hết--------
Cho biết khối lượng mol: Ba=137; Zn=65; Fe = 56; Ca=40; Cl=35,5; S=32; Al=27;
Mg =24; K=19; O=16; N=14; C=12; H=1. ĐÁP ÁN Câu 1( 4 điểm):
a). NaCl, H2SO4, NaOH và BaCl2, MgCl2. - Trích 5 mẩu thử. 0,25
- Cho quỳ tím vào 5 mẩu: 0,25
+ Quỳ tím chuyển sang màu đỏ là H2SO4. 0,25
+ Quỳ tím chuyển sang màu xanh là NaOH. 0,25
+ Quỳ tím không chuyển màu là NaCl BaCl2 và MgCl2. 0,25
- Cho tác dụng Na2SO4 nếu có kết tủa trắng là BaCl2.
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓ 0,25 Câu 1
- Cho tác dụng NaOH nếu có kết tủa trắng là MgCl2.
MgCl2 + 2NaOH → 2NaCl + Mg(OH)2↓ 0,25 - Còn lại là NaCl 0,25
b). + Thí nghiệm 1: AlCl3 + 3NaOH →Al(OH)3↓ +3NaCl 0,25
NaOH dư: NaOH + AlCl3 → NaAlO2 + 2H2O 0,25
Hiện tượng: có kết tủa trắng xuất hiện. 0,50
+ Thí nghiệm 2: Fe + H2SO4(l) → FeSO4 + H2. 0,25
2NaOH + FeCl2 → Fe(OH)2↓ + 2NaCl 0,25
Hiện tượng: có khí thoát ra và dung dịch có kết tủa trắng xanh 0,50 Câu 2( 4 điểm): a).
- A là cacbon(C), xác định (B), (C), (D),… 0,50 C+ O2 → CO2 (B) Câu 2 CO2 + NaOH→NaHCO3 (C) 0 2NaHCO +t C ⎯⎯⎯ → 1,50 3 Na2CO3 + CO2 + H2O (D)
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O (B)
(E) có thể là H2SO4 hoặc HNO3,,,… b). Phương trình: Mg + 2HCl →MgCl2 +H2 (1) 0,50 x mol 2xmol
2Al + 6HCl →2AlCl3 +3H2 (2) 0,50 y mol 2y mol m = 24x + 27y =12,6 hh = 10, 95(%)x400 x 0, 3 0,50 n = 2x + 3y = =1,2 y = 0, 2 HCl 36, 5 m = 0,3x24 = 7,2(g) Mg 0,50 m = 0,2x27 = 5,4(g) Al Câu 3( 4 điểm): a). men C H O ⎯⎯⎯ →2CO + 2C H OH (1) 0,50 6 12 6 2 2 5 0,1 ← 0,2(mol) 0 t C
C H OH + 3O ⎯⎯→ 2CO + 3H O (2) 2 5 2 2 2 0,50 0,2 ← 0,4(mol) CO + Ca(OH) ⎯⎯ →CaCO +H O (3) 2 2 3 2 0,50 0,4 ← 0,4(mol) CaCO3: 0,4(mol)
Từ (1), (2),(3) n(C6H12O6)=0,1(mol) Câu 3 100 0,50 Vậy: m = m = 0,1x180x = 22,5(g) C H O 6 12 6 80 b). Phương trình: 0,50
CH = CH + Br → CH Br − CH Br 2 2 2 2 2
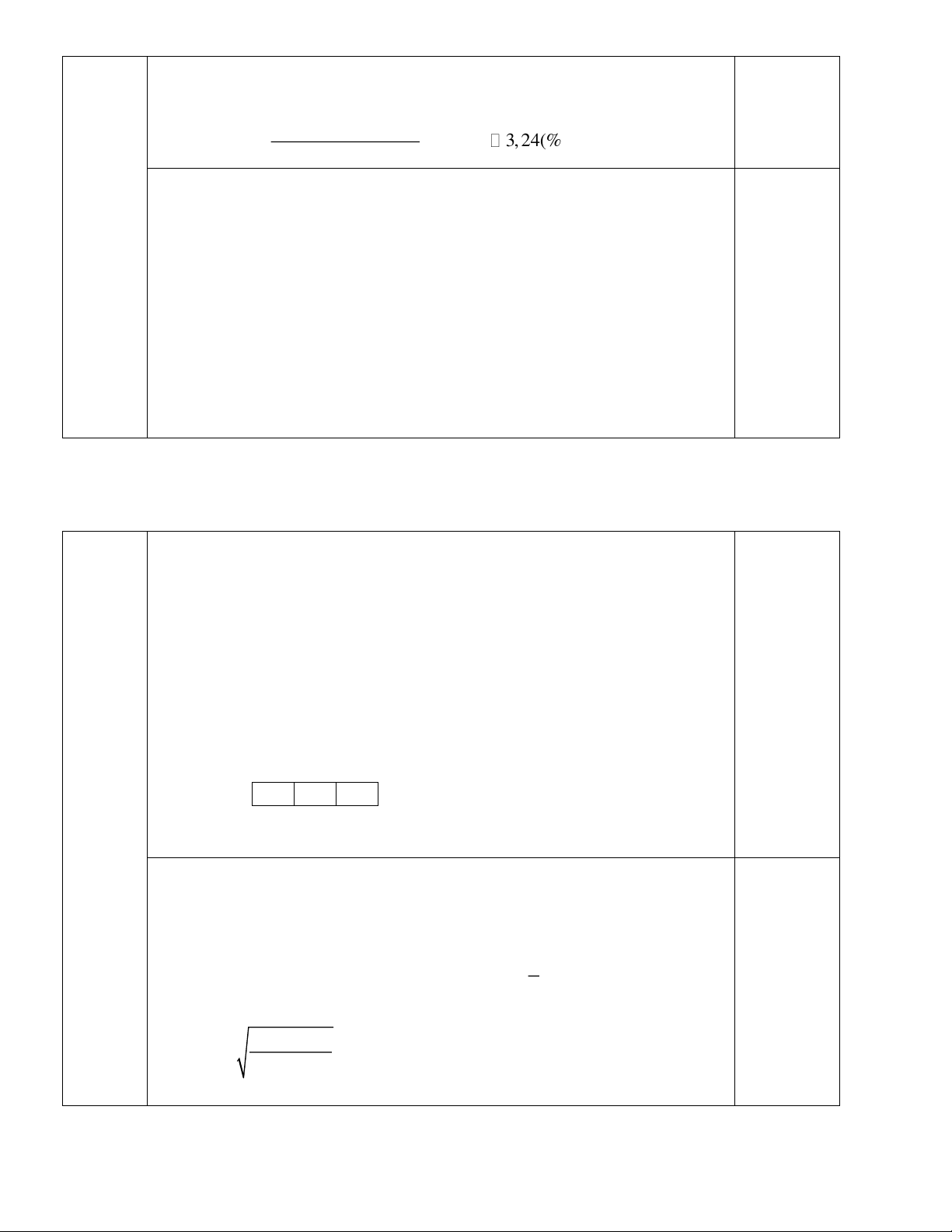
CH − COOH + NaOH → CH − COONa+H O 0,50 3 3 2 C H OH + Na → C H ONa+1/2H 2 5 2 5 2 0,50 0 t C CH + O ⎯⎯→ CO + H O 4 2 2 2 0,50 Câu 4( 4 điểm): a). Gọi x% nguyên tử 11B 0,50 5 (100-x) % của 10 B Câu 4 5 11x +10(100 − x) Từ A =
=10,18 x =18(%) đồng vị 11B 0,50 B 100 5 11 0,18 mol B 0,50 Trong 1 mol H BO có 1 mol B 5 3 3 10 0,82 mol B 5 0,50 0,18x11 Vậy: %m = x100(%) 3, 24(%) 11 5 B 1x(3 +10,18 +16x3) Z = P = E Z = P = E 0,25 b). Gọi 1 1 1 M và 2 2 2 X N N 1 2 0,25
từ GT ta có: 2(N1 + P1+ E1)+ (P2+E2+N2)=140(1) 0,25
[2(P1+E1)+(P2+E2)]-(2N1+N2)=44(2) 0,25 (N1+P1)-(N2+P2)=23(3) 0,25
(N1+P1+E1-1)-((N2+P2+E2+2)=31(4) 0,25 P1=E1(5) và P2 = E2(6) 0,25
Giải hệ ta có: Z1 = P1=E1 =19 và N1 = 20 AM = 39 Z2 = P2=E2 =8 và N2 = 8 0,25 AX = 16 Câu 5( 4 điểm): a). Z = P = E Gọi X N GT: P+N+E=52(1) 0,50 (P+E)-N=16 (2) P=E(3) 0,50 P=E=Z =17 N= 18 0,50 37 2 2 6 2 5 X :1s 2s 2p 3s 3p 17 Ô lượng tử: 3p5 ↑↓ ↑↓ ↑ Câu 5
Electron cuối cùng là electron thứ 5 của phân lớp 3p Ta có: n=3, l=1, m=0,s=-1/2 0,50 b).
- Thể tích 1 mol nguyên tử Cu là V1mol =M/D 0,50
- Thể tích 1 nguyên tử Cu là 4 0,50
V1ngtu=(V1mol/NA) x74% = 0,74xM/NA.D= 3 r 3 với NA = 6,023.1023. 0 3x0, 74xM r = 8 − 3 =1,28x10 (cm) =1,28(A) 1,0 4 x DxNA -------Hết--------



