










Preview text:
SỞ GD&ĐT THANH HÓA
ĐỀ KHẢO SÁT CÁC MÔN THI TỐT NGHIỆP CỤM TRƯỜNG THPT
LỚP 12 NĂM HỌC 2024 - 2025 -------------------- MÔN: Hóa học
(Đề thi có 5 trang)
Thời gian làm bài: 50 phút
(không kể thời gian phát đề)
Cho: H = 1; N = 14; O = 16; Na = 23; Mg = 24; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Ba = 137.
Họ và tên: ............................................................................ Số báo danh: ....... Mã đề 101
PHẦN I.Câu trắc nghiệm nhiều phương án lựa chọn.Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn 1 phương án.
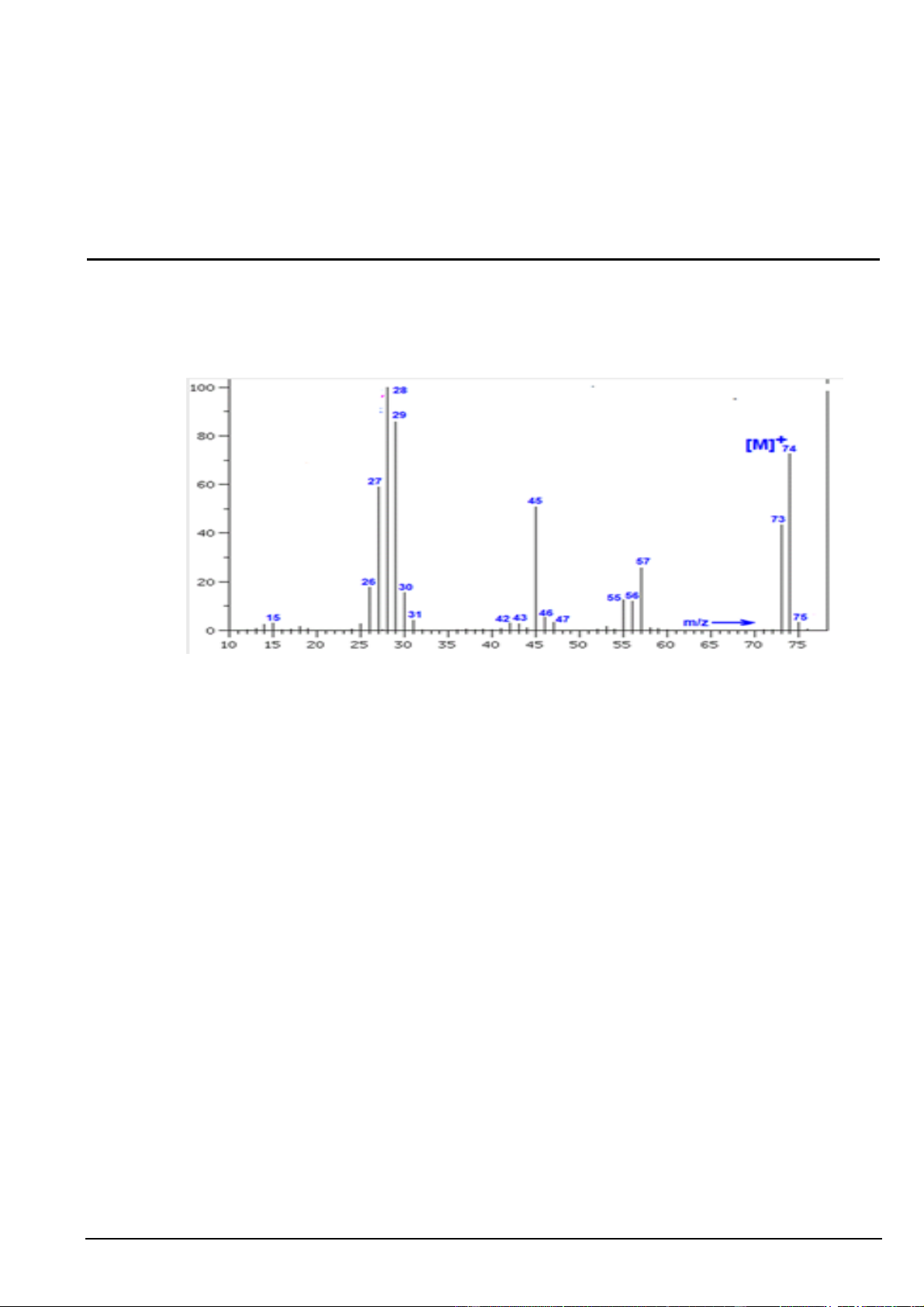
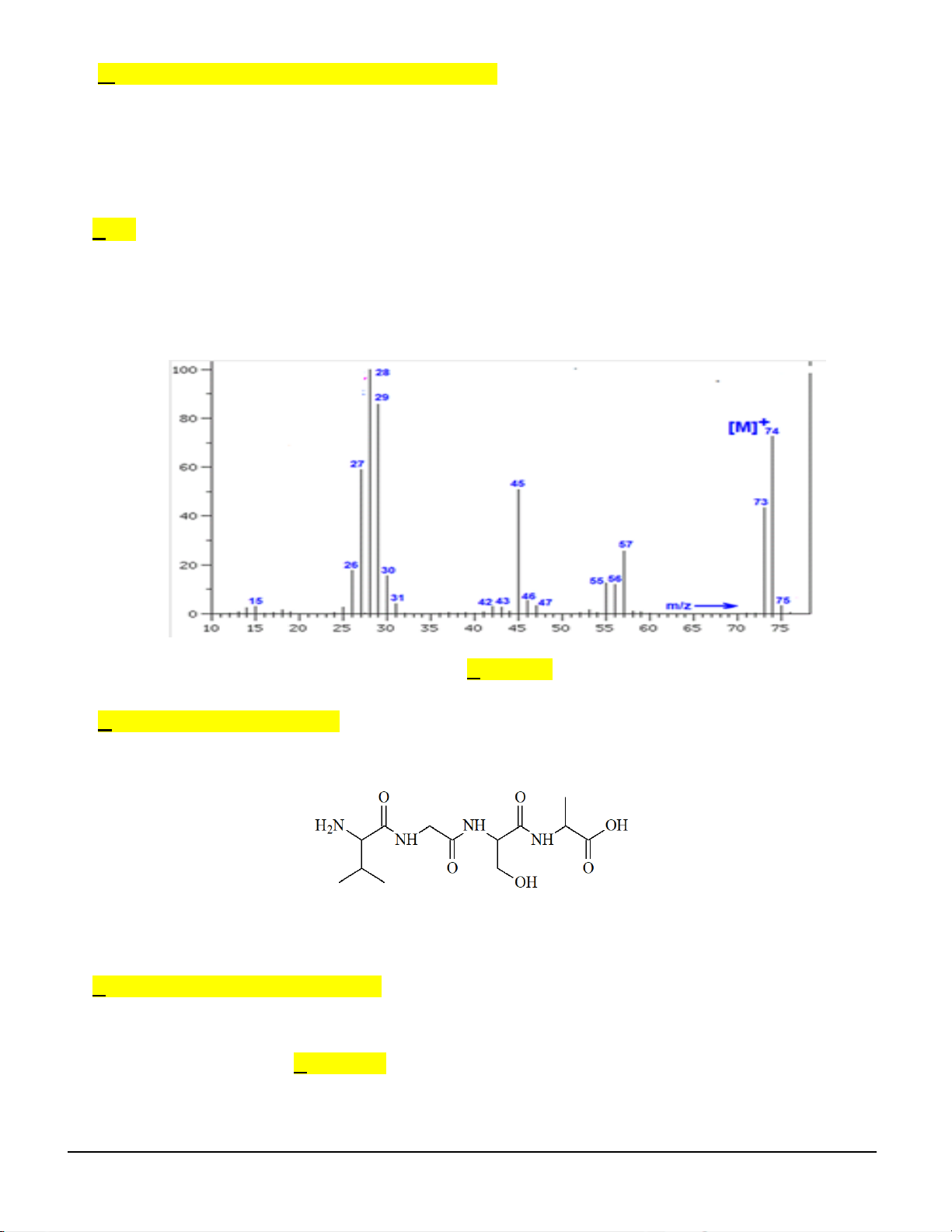
Câu 1. Kết quả phân tích nguyên tố hợp chất hữu cơ X cho thấy thành phần phần trăm về khối lượng của
các nguyên tố carbon, hydrogen trong X lần lượt là 48,64%, 8,11% còn lại là oxygen. Dựa trên thông tin
đã cho và phổ khối lượng của X ở hình dưới, lập được công thức phân tử của hợp chất hữu cơ X là A. C3H8O. B. C3H6O2. C. C2H6O. D. C2H4O.
Câu 2. Thực hiện các thí nghiệm sau:
(1) Ngâm lá đồng trong dung dịch AgNO3.
(2) Ngâm lá kẽm tron g dung dịch HCl loãng.
(3) Ngâm lá sắt được cuộn dây đồng trong dung dịch HCl.
(4) Đặt một vật làm bằng gang ngoài không khí ẩm trong nhiều ngày.
(5) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn điện hoá là A. 3. B. 2. C. 4. D. 1.
Câu 3. Hang Sơn Đoòng tại tỉnh Quảng Bình, Việt Nam là hang động tự nhiên lớn nhất và có thạch nhũ
đẹp nhất thế giới. Thạch nhũ tăng kích thước với tốc độ 0,13 – 3 mm mỗi năm. Thạch nhũ trong hang
động được tạo thành bởi phản ứng nào sau đây? A. Ca(OH) 2 + CO2 CaCO3 + H2O.
B. CaCO3 + CO2 + H2O ↔ Ca(HCO3)2. C. Ca(HCO
3)2 ↔ CaCO3 + CO2 + H2O. D. CaCl2 + Na2CO3 CaCO3 + 2NaCl.
Câu 4. Benzyl acetate có mùi thơm của loại hoa nhài. Công thức cấu tạo của benzyl acetate là
A. CH3COOCH2C6H5. B. C6H5COOCH3. C. CH3COOC6H5. D. CH3COOC6H4CH3.
Câu 5. Nhúng thanh aluminium (Al) và thanh copper (Cu) vào dung dịch H2SO4 1 M. Nối hai thanh với
nhau bằng dây dẫn. Phát biểu nào sau đây không đúng?
A. Tại thanh aluminium xảy ra quá trình oxi hoá Al thành Al3+.
B. Tại thanh copper xảy ra quá trình khử ion Cu2+thành Cu.
C. Tại thanh copper và thanh aluminium đều sinh ra khí hydrogen.
D. Trên dây dẫn xuất hiện dòng electron chuyển từ thanh aluminium sang thanh copper.
Câu 6. Cho các chất sau: H2NCH2COOH (X), HCOONH3CH3(Y), C2H5NH2(Z), H2NCH(CH3)COOC2H5
(T). Dãy gồm các chất đều tác dụng được với dung dịch NaOH và dung dịch HCl là A. Y, Z, T. B. X, Y, Z. C. X, Y, Z, T. D. X, Y, T.
Câu 7. Ứng dụng phổ biến của các kim loại chuyển tiếp là tạo các hợp kim có các tính chất đáp ứng nhiều
mục đích sử dụng khác nhau. X là kim loại chuyển tiếp dãy thứ nhất. Hợp kim X-Ti không bị gỉ và chịu
được nhiệt độ cao; hợp kim X-Cr không bị gỉ và rất cứng; hợp kim X-C được sử dụng phổ biến trong xây
dựng nhà cửa. X là kim loại nào sau đây? A. Ni. B. Fe. C. Cr. D. Mn.
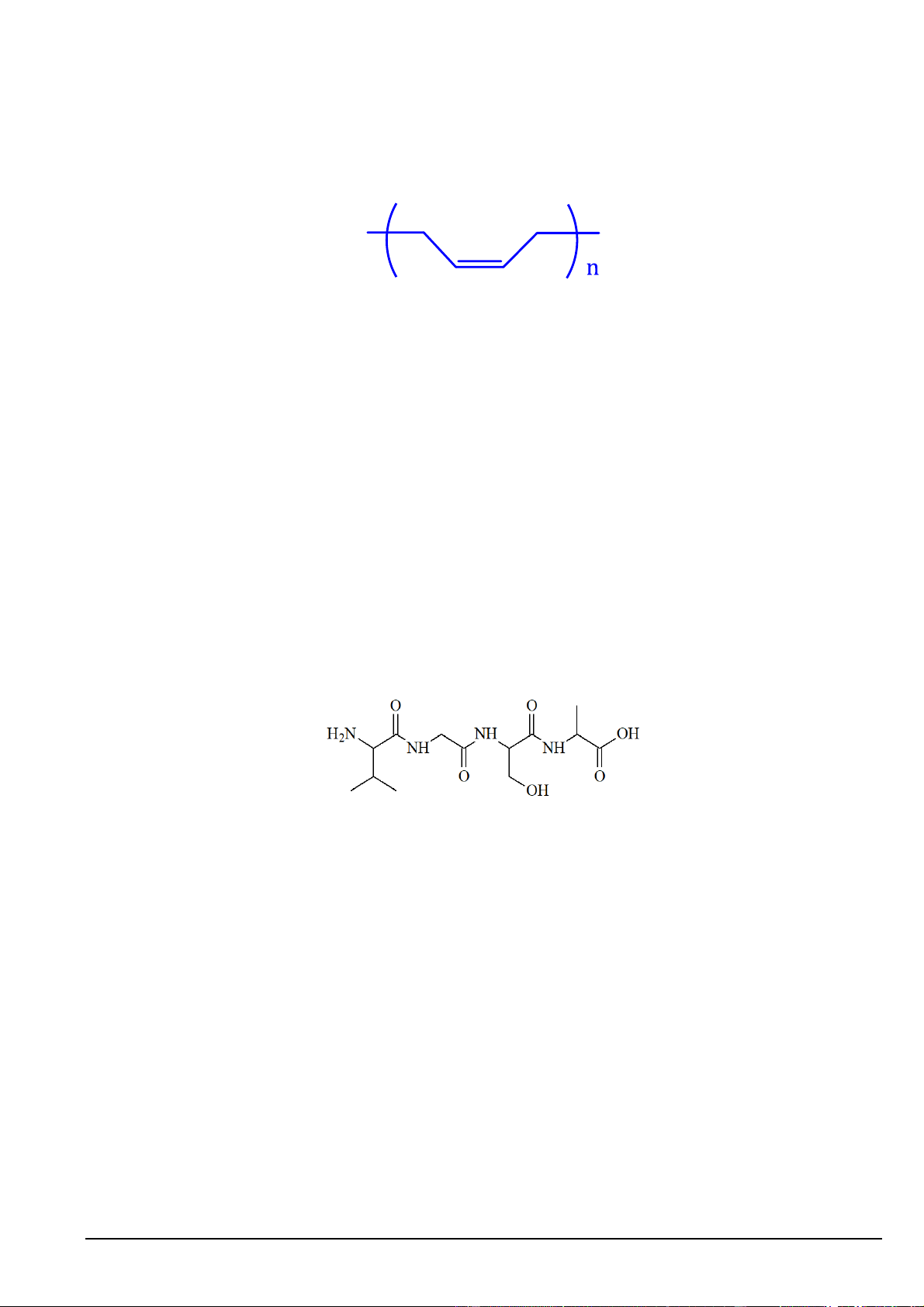
Câu 8. Tên gọi của polymer có công thức cho dưới đâylà
A. Polybuta-1,3-diene (cao su buna). B. Cao su lưu hóa.
C. Polychloroprene (cao su chloroprene).
D. Polyisoprene (cao su isoprene).
Câu 9. Phương pháp nào sau đây dùng để sản xuất ethanol sinh học?
A. Thủy phân dẫn xuất C2H5Br trong môi trường kiềm.
B. Cho hỗn hợp khí ethylene và hơi nước đi qua tháp chứa H3PO4.
C. Cộng nước vào ethylene với xúc tác là H2SO4.
D. Lên men tinh bột.
Câu 10. Phát biểu nào sau đây là đúng khi nói về tính điện di của amino acid?
A. Trong dung dịch, dạng tồn tại chủ yếu của amino acid chỉ phụ thuộc vào pH của dung dịch.
B. Tính điện di của amino acid là khả năng di chuyển khác nhau trong điện trường tùy thuộc vào pH của môi trường.
C. Ở pH cao, amino acid tồn tại chủ yếu ở dạng cation (tích điện dương), di chuyển về điện cực âm trong điện trường.
D. Ở pH thấp, amino acid tồn tại chủ yếu ở dạng anion (tích điện âm), di chuyển về điện cực dương trong điện trường.
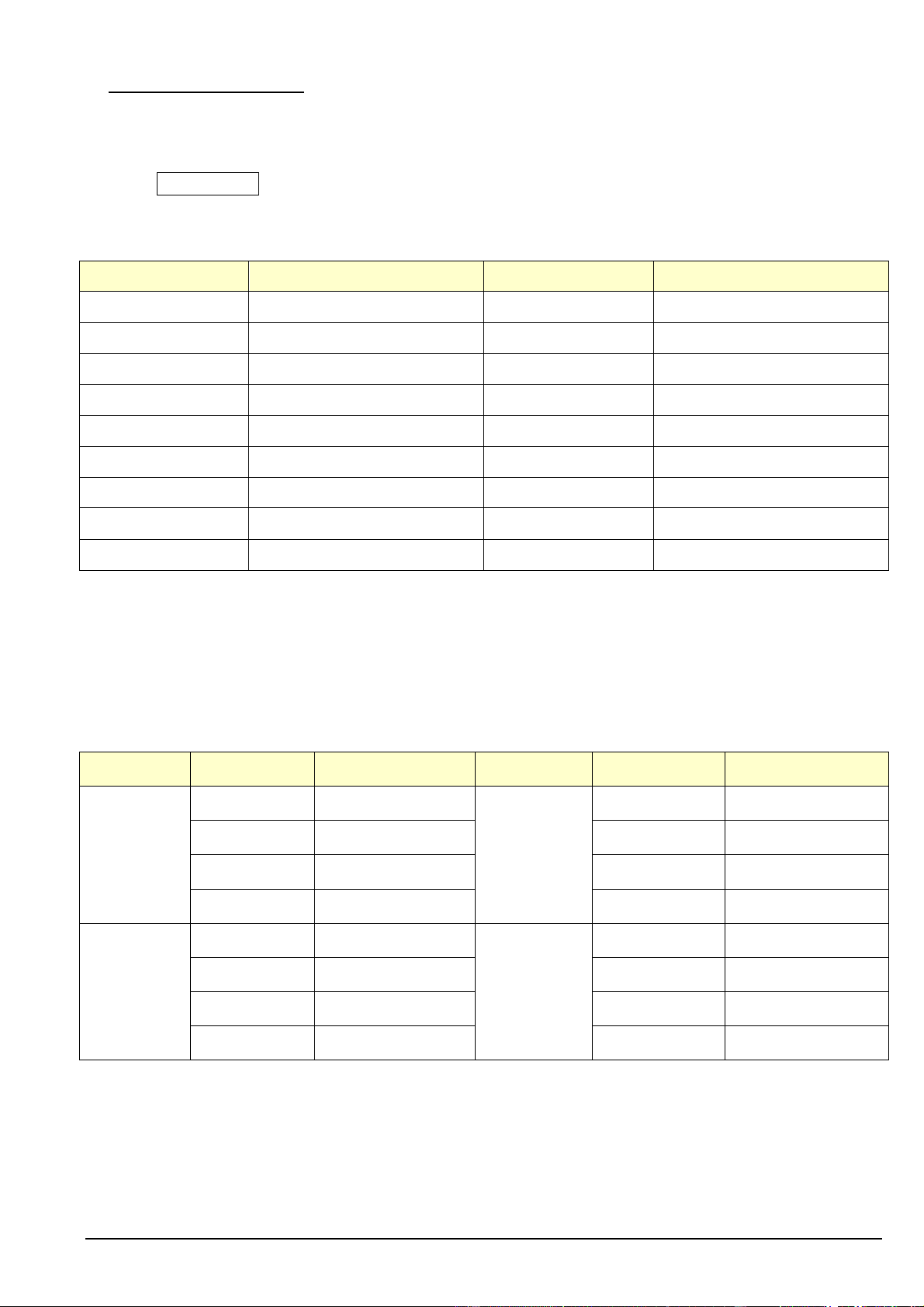
Câu 11. Cho một peptide X có cấu tạo như hình bên:
Phát biểu nào sau đây đúng?
A. Dung dịch X không có phản ứng màu biuret.
B. Amino acid đầu C của X là alanine.
C. Thủy phân X thu được tối đa 4 dipeptide.
D. Peptide X thuộc loại tripeptide. 0
Câu 12. Một pin Galvani Mg-Cu có sức điện động chuẩn bằng 2,696 V. Biết E 2 0,340 V, Cu /Cu 0 E 2 là Mg / Mg A. 2,300 V. B. -2,356 V. C. -3,260 V. D. 3,260 V.
Câu 13. Carbohydrate nào sau đây thuộc loại polysaccharide? A. Glucose. B. Cellulose. C. Saccharose. D. Fructose.
Câu 14. Dãy nào sau đây chỉ gồm các polymer tổng hợp?
A. Polypropylene, polybutadiene, nylon-7, nylon-6,6.
B. Tinh bột, cellulose, cao su thiên nhiên, polybutadiene.
C. Polypropylene, tinh bột, nylon-7, cao su thiên nhiên.
D. Polypropylene, cellulose, nylon-7, nylon-6,6.
Câu 15. Cho các phát biểu sau:
(a) Tất cả các kim loại kiềm thổ (nhóm IIA) đều tan trong nước.
(b) Các kim loại kiềm có thể đẩy được kim loại yếu hơn ra khỏi dung dịch muối của chúng.
(c) Các ion Na+, Mg2+, Al3+có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu.
(d) Các kim loại kiềm K, Rb, Cs tự bốc cháy khi tiếp xúc với nước.
(e) Kim loại magnesium có cấu trúc mạng tinh thể lục phương.
Trong các phát biểu trên số phát biểu đúng là A. 3. B. 2. C. 4. D. 5.
Câu 16. Triolein không tác dụng với chất (hoặc dung dịch) nào sau đây?
A. Cu(OH)2 (ở điều kiện thường).
B. Dung dịch NaOH (đun nóng).
C. H2O (xúc tác H2SO4 loãng, đun nóng).
D. H2 (xúc tác Ni, đun nóng).
Câu 17. Xét các cặp oxi hoá – khử sau: Cặp oxi hoá – khử Mg2+/Mg A13+/Al Fe2+/Fe 2H+/H2 Cu2+/Cu Ag+/Ag
Thế điện cực chuẩn (V) -2,356 -1,676 -0,44 0 0,340 +0,799 Có các nhận định sau:
(1) Kim loại có tính khử mạnh nhất là Mg.
(2) Ion kim loại có tính oxi hoá mạnh nhất là Ag+.
(3) Có tất cả 2 kim loại có thể khử ion Ag+ thành Ag ở điều kiện chuẩn.
(4) Có 3 kim loại có thể khử ion H+ thành H2 ở điều kiện chuẩn.
Số nhận định đúng là: A. 1. B. 3. C. 4. D. 2.
Câu 18. Sodium hydrogencarbonate được sử dụng làm thuốc để hỗ trợ điều trị bệnh
A. thoái hoá cột sống.
B. đau dạ dày do dư acid. C. viêm cơ.
D. đau dạ dày do thiếu acid.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Isoamyl acetate (d=0,876 g/mL) có mùi chuối nên được dùng làm hương liệu nhân tạo. Trong
ngành sơn, isoamyl acetate được dùng làm dung môi vecni, dung môi sơn mài. Isoamyl acetate được điều chế theo các bước sau:
Bước 1. Cho vào bình cầu 15 mL isoamyl alcohol (d=0,810 g/mL), 10 mL acetic acid (d = 1,049
g/mL) và 7,0 mL H2SO4 đậm đặc, cho thêm vào bình vài viên đá bọt. Lắp ống sinh hàn hồi lưu thẳng
đứng vào miệng bình cầu. Sau đó đun nóng bình cầu trong khoảng 1 giờ.
Bước 2. Sau khi đun, để nguội rồi rót sản phẩm vào phễu chiết, lắc đều rồi để yên khoảng 5 phút, chất
lỏng tách thành hai lớp, loại bỏ phần chất lỏng phía dưới, lấy phần chất lỏng phía trên.
Bước 3. Cho từ từ dung dịch Na2CO3 10% vào phần chất lỏng thu lấy ở bước 2 và lắc đều cho đến khi
không còn khí thoát ra, thêm tiếp 20 mL dung dịch NaCl bão hoà rồi để yên khi đó chất lỏng tách thành
hai lớp. Chiết lấy phần chất lòng phía trên, làm khan, ta thu được isoamyl acetate.
a) Có thể dùng phương pháp phổ IR để phân biệt isoamyl alcohol, acetic acid và isoamyl acetate.
b) Nếu hiệu suất phản ứng ester hoá là 60% và lượng isoamyl acetate bị hao hụt mất 6% thì thể tích
isoamyl acetate thu được là 11,6 mL. (Làm tròn kết quả đến hàng phần mười)
c) Ở bước 1, xảy ra phản ứng thế nguyên tử H trong nhóm –OH của alcohol bằng gốc CH3COO-.
d) Isoamyl acetate rất ít tan trong nước và nhẹ hơn nước nên nổi lên trên.
Câu 2. Hiện nay, trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại
ngày càng tăng và lượng phế thải kim loại tạo ra ngày càng nhiều. Do đó, tái chế kim loại là công việc
cần thiết, vừa đảm bảo nguồn cung, vừa gia tăng giá trị kinh tế, bảo vệ môi trường và thực hiện mục tiêu
phát triển bền vững.
a) Tái chế kim loại là quá trình thu kim loại từ các phế liệu kim loại.
b) Quy trình tái chế kim loại thường gồm các giai đoạn: thu gom, phân loại; xử lí sơ bộ, phối trộn phế
liệu, nấu chảy, đúc, chế tạo, gia công, tinh chế.
c) Kim loại là vật liệu có thể được tái chế nhiều lần nhưng sẽ làm thay đổi tính chất cũng như làm giảm
chất lượng của chúng. Còn phế liệu kim loại là các kim loại, hợp kim có trong thiết bị, máy móc, vật dụng
hỏng, cũ, không còn sử dụng được nữa.
d) Tái chế là quá trình xử lí để tái sử dụng rác thải hoặc vật liệu không cần thiết (phế liệu) thành vật
liệu mới mang lại lợi ích cho đời sống và sản xuất.
Câu 3. Điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước là công đoạn chính của quy trình
Sodium chloride được dùng trong chế biến và bảo quản thực phẩm, làm nguyên liệu chính của quy trình
công nghiệp chlorine – kiềm. Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch
sodium chloride bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của phản ứng điện
phân dung dịch NaCl bão hòa trong bể điện phân có màng ngăn như sau: đpdd 2NaCl (aq) + 2H 2O (l)
2NaOH (aq) + H2(g) + Cl2(g) m c n
a) Nếu bỏ màng ngăn xốp thì thu được sản phẩm là nước Javel và khí H2.
b) Sản phẩm cơ bản của công nghiệp chlorine – kiềm là sodium hydroxide, chlorine và hydrogen.
c) Trong trường hợp không có màng ngăn, khi điện phân hoàn toàn 300 kg dung dịchNaCl bão hòa ở
250C thì thu được dung dịch chứaNaClO 30% (làm tròn đến hàng đơn vị).(Biết độ tan của NaCl ở nhiệt độ này là 36,2 gam).
d) Khí thoát ra ở anode là H2. Khí thoát ra ở cathode là Cl2.
Câu 4. Tiến hành thí nghiệm theo các bước sau:
+ Bước 1: Cho vào ống nghiệm (1) một nhúm nhỏ bông và khoảng 2 mL dung dịch H2SO4 70%.
+ Bước 2: Khuấy đều rồi đặt ống nghiệm vào cốc nước nóng, thỉnh thoảng dùng đũa thuỷ tinh khuấy nhẹ,
cho đến khi thu được dung dịch đồng nhất.
+ Bước 3: Để nguội, lấy 1 mL dung dịch trong ống (1) cho vào ống (2).
+ Bước 4: Cho từ từ dung dịch NaOH 10 % vào ống nghiệm (2) đến khi môi trường có tính kiềm.
+ Bước 5: Cho tiếp 5 giọt dung dịch CuSO4 5%. Lắc đều và đun nóng nhẹ dung dịch trong ống nghiệm.
Hãy cho biết những phát biểu sau đây là đúng hay sai?
a) Ở bước 4, mục đích duy nhất thêm dung dịch NaOH để trung hòa lượng acid còn dư.
b) Ở bước 2 xảy ra phản ứng thủy phân cellulose trong môi trường acid tạo thành glucose và fructose.
c) Ở bước 1, có thể thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98%.
d) Ở bước 5, hiện tượng thu được ban đầu tạo kết tủa xanh, sau đó kết tủa tan dần và thu được dung
dịch xanh lam, cuối cùng thì kết tủa đỏ gạch xuất hiện sau khi đun nóng.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Poly(vinyl chloride) được điều chế từ khí ethylene và chlorine theo sơ đồ sau: Cl 0 500 C 0 xt,t ,p CH 2 2=CH2 ClCH2–CH2Cl CH2=CHCl PVC
Biết hiệu suất của quá trình điều chế đạt 80%. Tính khối lượng PVC (theo tấn) thu được từ 5,6 tấn
ethylene ban đầu. (Làm tròn kết quả đến hàng đơn vị)
Câu 2. Xăng sinh học E5 (chứa 5% ethanol về thể tích, còn lại là xăng, giả thiết chỉ là octane). Khi được
đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1365,0 kJ và 1 mol octane tỏa ra lượng nhiệt là
5928,7 kJ. Trung bình, một chiếc xe máy di chuyển được 1km thì cần một nhiệt lượng chuyển thành công
cơ học có độ lớn là 211,8 kJ. Nếu xe máy đó đã sử dụng 4,6 lít xăng E5 ở trên thì quãng đường di chuyển
được là bao nhiêu km, biết hiệu suất sử dụng nhiên liệu của đông cơ là 25%; khối lượng riêng của ethanol
là 0,8 g/mL, của octane là 0,7 g/mL (đáp án làm tròn đến số nguyên)
Câu 3. Để mạ đồng (Cu) một vật dụng kim loại có tổng diện tích bề mặt là 10 cm2, người ta tiến hành
điện phân dung dịch CuSO4 với cực âm là vật dụng cần mạ và cực dương là lá đồng thô. Biết cường độ
dòng điện không đổi là 2 A, hiệu suất điện phân là 80%, khối lượng riêng của tinh thể Cu là 8,94 g/cm3 và
lượng đồng tạo ra được tính theo công thức Faraday là AIt m
(với A là nguyên tử khối của Cu = 64; I là nF
cường độ dòng điện, F là hằng số Faraday = 96485 C/mol, n làsố electron mà 1 ion Cu2+nhận, t là thời
gian điện phân tính bằng giây). Thời gian điện phân để lớp mạ có độ dày đồng nhất 0,1 mm là bao nhiêu
phút? (làm tròn kết quả đến phần mười)
Câu 4. Trong công nghiệp, một lượng lớn NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay
bằng cách cho khí CO2 (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hoà và ammonia (NH3) bão hoà.
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) ↔ NH4Cl(aq) + NaHCO3(s) (1) 0 t NaHCO
3 tách ra đem nhiệt phân thu được soda: 2NaHCO3 Na2CO3 + CO2 + H2O (2)
và NH4Cl được sử dụng để tái tạo NH3 bằng cách tác dụng với Ca(OH)2 tạo ra từ CaO. Cho các phát biểu sau
1) Phản ứng (1) xảy ra được là do khi làm lạnh, NaHCO3 có độ tan kém hơn nên bị kết tinh trước.
2) Trong thực tế sản xuất, người ta đun nóng hỗn hợp các chất tham gia phản ứng (1) để thu được Na2CO3 ngay.
3) Nguyên liệu chính của quá trình sản xuất soda bằng phương pháp Solvay là đá vôi, muối ăn, amonia và nước.
4) NaHCO3 được ứng dụng làm bột nở là do phản ứng (2).
Sắp xếp các phát biểu đúng theo thứ tự tăng dần
Câu 5. Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối
Mohr (Cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến
hành các thí nghiệm sau: Cân chính xác 9,81 gam muối Mohr, pha thành 200 mL dung dịch X. Lấy chính
xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y
bằng dung dịch chuẩn KMnO4 0,02M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau: Lần chuẩn độ 1 2 3
V dung dịch KMnO4 (ml) 12,5 12,0 12,2
Theo kết quả chuẩn độ ở trên, hãy tính độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối
Mohr? (Làm tròn kết quả đến hàng phần mười)
Câu 6. Quy trình sản xuất Copper (Cu) từ quặng chứa Cu2S được thực hiện như sau:
Giai đoạn 1.Đốt Cu2S bằng khí oxygen theo phản ứng: 2Cu 2S + 3O2 2Cu2O + 2SO2
Giai đoạn 2. Copper(I) oxide sẽ phản ứng với phần còn lại của Cu2S theo phản ứng: 2Cu2O + Cu2S 6Cu + 2SO2
Quặng Copper ban đầu chứa khoảng 40% Cu2S theo khối lượng. Tính khối lượng quặng Copper (theo
tấn) cần lấy để điều chế được 1 tấn Cu. Biết hiệu suất của quá trình đạt 90%. (Làm tròn kết quả đến hàng phần trăm)
------ HẾT ------ SỞ GD&ĐT THANH HÓA
ĐÁP ÁN ĐỀ KHẢO SÁT CHẤT LƯỢNG HỌC SINH
TRƯỜNG THPT YÊN ĐỊNH 2
NĂM HỌC 2024 – 2025 MÔN: HÓA HỌC 12 (ĐỀ CHÍNH THỨC)
Thời gian làm bài: 50 phút
(Đề gồm có 28 câu; 5 trang) MÃ ĐỀ: 121 Phần I.
(Mỗi câu trả lời đúng, thí sinh được 0,25 điểm) Câu Đáp án Câu Đáp án 1 A 10 B 2 B 11 C 3 B 12 D 4 C 13 B 5 B 14 D 6 A 15 B 7 C 16 B 8 A 17 C 9 C 18 D Phần II.
Điểm tối đa của một câu hỏi là 1 điểm.
- Thí sinh chỉ lựa chọn chính xác 1 ý trong 1 câu hỏi được 0,1 điểm.
- Thí sinh chỉ lựa chọn chính xác 2 ý trong 1 câu hỏi được 0,25 điểm.
- Thí sinh chỉ lựa chọn chính xác 3 ý trong 1 câu hỏi được 0,5 điểm.
- Thí sinh lựa chọn chính xác cả 4 ý trong 1 câu hỏi được 1 điểm. Câu Lệnh hỏi Đáp án (Đ/S) Câu Lệnh hỏi Đáp án (Đ/S) a S a Đ b S b Đ 1 3 c S c S d Đ d S a Đ a S b Đ b Đ 2 4 c Đ c Đ d S d S Phần III.
(Mỗi câu trả lời đúng, thí sinh được 0,25 điểm) Câu Đáp án Câu Đáp án 1 134 4 194 2 10 5 28,1 3 3,47 6 97,8 SỞ GD&ĐT THANH HÓA
ĐÁP ÁN ĐỀ KHẢO SÁT CHẤT LƯỢNG HỌC SINH
TRƯỜNG THPT YÊN ĐỊNH 2
NĂM HỌC 2024 – 2025 MÔN: HÓA HỌC 12 (ĐỀ CHÍNH THỨC)
Thời gian làm bài: 50 phút
(Đề gồm có 28 câu; 5 trang) MÃ ĐỀ: 000 Phần I.
(Mỗi câu trả lời đúng, thí sinh được 0,25 điểm) Câu Đáp án Câu Đáp án 1 A 10 B 2 B 11 C 3 B 12 D 4 C 13 B 5 B 14 D 6 A 15 B 7 C 16 B 8 A 17 C 9 C 18 D Phần II.
Điểm tối đa của một câu hỏi là 1 điểm.
- Thí sinh chỉ lựa chọn chính xác 1 ý trong 1 câu hỏi được 0,1 điểm.
- Thí sinh chỉ lựa chọn chính xác 2 ý trong 1 câu hỏi được 0,25 điểm.
- Thí sinh chỉ lựa chọn chính xác 3 ý trong 1 câu hỏi được 0,5 điểm.
- Thí sinh lựa chọn chính xác cả 4 ý trong 1 câu hỏi được 1 điểm. Câu Lệnh hỏi Đáp án (Đ/S) Câu Lệnh hỏi Đáp án (Đ/S) a S a Đ b S b Đ 1 3 c S c S d Đ d S a Đ a S 2 4 b Đ b Đ c Đ c Đ d S d S Phần III.
(Mỗi câu trả lời đúng, thí sinh được 0,25 điểm) Câu Đáp án Câu Đáp án 1 134 4 194 2 10 5 28,1 3 3,47 6 97,8 ĐÁP ÁN CHI TIẾT
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn 1 phương án.
Câu 1. Sodium hydrogencarbonate được sử dụng làm thuốc để hỗ trợ điều trị bệnh
A. đau dạ dày do dư acid.
B. đau dạ dày do thiếu acid.
C. thoái hoá cột sống. D. viêm cơ.
Câu 2. Tên gọi của polymer có công thức cho dưới đây là
A. Polyisoprene (cao su isoprene).
B. Polybuta-1,3-diene (cao su buna). C. Cao su lưu hóa.
C. Polychloroprene (cao su chloroprene).
Câu 3. Cho các phát biểu sau:
(a) Tất cả các kim loại kiềm thổ (nhóm IIA) đều tan trong nước.
(b) Các kim loại kiềm có thể đẩy được kim loại yếu hơn ra khỏi dung dịch muối của chúng.
(c) Các ion Na+, Mg2+, Al3+ có cùng cấu hình electron ở trạng thái cơ bản và đều có tính oxi hóa yếu.
(d) Các kim loại kiềm K, Rb, Cs tự bốc cháy khi tiếp xúc với nước.
(e) Kim loại magnesium có cấu trúc mạng tinh thể lục phương.
Trong các phát biểu trên số phát biểu đúng là A. 2. B. 3. C. 4. D. 5.
Câu 4. Ứng dụng phổ biến của các kim loại chuyển tiếp là tạo các hợp kim có các tính chất đáp ứng nhiều
mục đích sử dụng khác nhau. X là kim loại chuyển tiếp dãy thứ nhất. Hợp kim X-Ti không bị gỉ và chịu
được nhiệt độ cao; hợp kim X-Cr không bị gỉ và rất cứng; hợp kim X-C được sử dụng phổ trong xây dựng
nhà cửa. X là kim loại nào sau đây? A. Ni. B. Cr. C. Fe. D. Mn.
Câu 5. Dãy nào sau đây chỉ gồm các polymer tổng hợp?
A. Polypropylene, cellulose, nylon-7, nylon-6,6.
B. Polypropylene, polybutadiene, nylon-7, nylon-6,6.
C. Polypropylene, tinh bột, nylon-7, cao su thiên nhiên.
D. Tinh bột, cellulose, cao su thiên nhiên, polybutadiene.
Câu 6. Hang Sơn Đoòng tại tỉnh Quảng Bình, Việt Nam là hang động tự nhiên lớn nhất và có thạch nhũ
đẹp nhất thế giới. Thạch nhũ tăng kích thước với tốc độ 0,13 – 3 mm mỗi năm. Thạch nhũ trong hang động
được tạo thành bởi phản ứng nào sau đây?
A. Ca(HCO3)2 ↔ CaCO3 + CO2 + H2O.
B. Ca(OH)2 + CO2 CaCO3 + H2O.
C. CaCO3 + CO2 + H2O ↔ Ca(HCO3)2.
D. CaCl2 + Na2CO3 CaCO3 + 2NaCl.
Câu 7: Kết quả phân tích nguyên tố hợp chất hữu cơ X cho thấy thành phần phần trăm về khối lượng của
các nguyên tố carbon, hydrogen trong X lần lượt là 48,64%, 8,11% còn lại là oxygen. Dựa trên thông tin đã
cho và phổ khối lượng của X ở hình dưới, lập được công thức phân tử của hợp chất hữu cơ X là A. C2H6O. B. C3H8O. C. C3H6O2. D. C2H4O.
Câu 8. Triolein không tác dụng với chất (hoặc dung dịch) nào sau đây?
A. Cu(OH)2 (ở điều kiện thường).
B. Dung dịch NaOH (đun nóng).
C. H2O (xúc tác H2SO4 loãng, đun nóng).
D. H2 (xúc tác Ni, đun nóng).
Câu 9. Cho một peptide X có cấu tạo như hình bên:
Phát biểu nào sau đây đúng?
A. Dung dịch X không có phản ứng màu biuret.
B. Peptide X thuộc loại tripeptide.
C. Amino acid đầu C của X là alanine.
D. Thủy phân X thu được tối đa 4 dipeptide.
Câu 10. Carbohydrate nào sau đây thuộc loại polysaccharide? A. Saccharose. B. Cellulose. C. Fructose. D. Glucose.
Câu 11. Phương pháp nào sau đây dùng để sản xuất ethanol sinh học?
A. Cho hỗn hợp khí ethylene và hơi nước đi qua tháp chứa H3PO4.
B. Cộng nước vào ethylene với xúc tác là H2SO4.
C. Lên men tinh bột.
D. Thủy phân dẫn xuất C2H5Br trong môi trường kiềm.
Câu 12. Benzyl acetate có mùi thơm của loại hoa nhài. Công thức cấu tạo của benzyl acetate là A. CH3COOC6H5. B. CH3COOC6H4CH3. C. C6H5COOCH3. D. CH3COOCH2C6H5.
Câu 13. Cho các chất sau: H2NCH2COOH (X), HCOONH3CH3 (Y), C2H5NH2 (Z),
H2NCH(CH3)COOC2H5 (T). Dãy gồm các chất đều tác dụng được với dung dịch NaOH và dung dịch HCl là A. X, Y, Z, T. B. X, Y, T. C. X, Y, Z. D. Y, Z, T.
Câu 14. Phát biểu nào sau đây là đúng khi nói về tính điện di của amino acid?
A. Trong dung dịch, dạng tồn tại chủ yếu của amino acid chỉ phụ thuộc vào pH của dung dịch.
B. Ở pH thấp, amino acid tồn tại chủ yếu ở dạng anion (tích điện âm), di chuyển về điện cực dương trong điện trường.
C. Ở pH cao, amino acid tồn tại chủ yếu ở dạng cation (tích điện dương), di chuyển về điện cực âm trong điện trường.
D. Tính điện di của amino acid là khả năng di chuyển khác nhau trong điện trường tùy thuộc vào pH của môi trường. 0
Câu 15. Một pin Galvani Mg-Cu có sức điện động chuẩn bằng 2,696 V. Biết E 0,340 V, 2 Cu /Cu 0 E 2 là Mg / Mg A. 2,300 V. B. -2,356 V. C. 3,260 V. D. -3,260 V.
Câu 16. Nhúng thanh aluminium (Al) và thanh copper (Cu) vào dung dịch H2SO4 1 M. Nối hai thanh với
nhau bằng dây dẫn. Phát biểu nào sau đây không đúng?
A. Tại thanh aluminium xảy ra quá trình oxi hoá Al thành Al3+.
B. Tại thanh copper xảy ra quá trình khử ion Cu2+ thành Cu.
C. Tại thanh copper và thanh aluminium đều sinh ra khí hydrogen.
D. Trên dây dẫn xuất hiện dòng electron chuyển từ thanh aluminium sang thanh copper.
Câu 17. Thực hiện các thí nghiệm sau:
(1) Ngâm lá đồng trong dung dịch AgNO3.
(2) Ngâm lá kẽm trong dung dịch HCl loãng.
(3) Ngâm lá sắt được cuộn dây đồng trong dung dịch HCl.
(4) Đặt một vật làm bằng gang ngoài không khí ẩm trong nhiều ngày.
(5) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn điện hoá là A. 1. B. 2. C. 3. D. 4.
Câu 18: Xét các cặp oxi hoá – khử sau: Cặp oxi hoá – khử Mg2+/Mg A13+/Al Fe2+/Fe 2H+/H2 Cu2+/Cu Ag+/Ag
Thế điện cực chuẩn (V) -2,356 -1,676 -0,44 0 0,340 +0,799 Có các nhận định sau:
(1) Kim loại có tính khử mạnh nhất là Mg.
(2) Ion kim loại có tính oxi hoá mạnh nhất là Ag+.
(3) Có tất cả 2 kim loại có thể khử ion Ag+ thành Ag ở điều kiện chuẩn.
(4) Có 3 kim loại có thể khử ion H+ thành H2 ở điều kiện chuẩn.
Số nhận định đúng là: A. 1. B. 2. C. 4. D. 3.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Tiến hành thí nghiệm theo các bước sau:
+ Bước 1: Cho vào ống nghiệm (1) một nhúm nhỏ bông và khoảng 2 mL dung dịch H2SO4 70%.
+ Bước 2: Khuấy đều rồi đặt ống nghiệm vào cốc nước nóng, thỉnh thoảng dùng đũa thuỷ tinh khuấy nhẹ,
cho đến khi thu được dung dịch đồng nhất.
+ Bước 3: Để nguội, lấy 1 mL dung dịch trong ống (1) cho vào ống (2).
+ Bước 4: Cho từ từ dung dịch NaOH 10% vào ống nghiệm (2) đến khi môi trường có tính kiềm.
+ Bước 5: Cho tiếp 5 giọt dung dịch CuSO4 5%. Lắc đều và đun nóng nhẹ dung dịch trong ống nghiệm.
Hãy cho biết những phát biểu sau đây là đúng hay sai?
a) Ở bước 1, có thể thay dung dịch H2SO4 70% bằng dung dịch H2SO4 98%.
b) Ở bước 2 xảy ra phản ứng thủy phân cellulose trong môi trường acid tạo thành glucose và fructose.
c) Ở bước 4, mục đích duy nhất thêm dung dịch NaOH để trung hòa lượng acid còn dư.
d) Ở bước 5, hiện tượng thu được ban đầu tạo kết tủa xanh, sau đó kết tủa tan dần và thu được dung dịch
xanh lam, cuối cùng thì kết tủa đỏ gạch xuất hiện sau khi đun nóng. Lời giải.
a) Sai vì H2SO4 98% sẽ làm bông hóa than
b) Sai vì phản ứng thủy phân cellulose trong môi trường acid tạo thành glucose
c) Sai vì ngoài mục đích trung hòa còn phải tạo môi trường base d) Đúng
Câu 2. Isoamyl acetate (d=0,876 g/mL) có mùi chuối nên được dùng làm hương liệu nhân tạo. Trong
ngành sơn, isoamyl acetate được dùng làm dung môi vecni, dung môi sơn mài. Isoamyl acetate được điều chế theo các bước sau:
Bước 1. Cho vào bình cầu 15 mL isoamyl alcohol (d=0,810 g/mL), 10 mL acetic acid (d = 1,049 g/mL)
và 7,0 mL H2SO4 đậm đặc, cho thêm vào bình vài viên đá bọt. Lắp ống sinh hàn hồi lưu thẳng đứng vào
miệng bình cầu. Sau đó đun nóng bình cầu trong khoảng 1 giờ.
Bước 2. Sau khi đun, để nguội rồi rót sản phẩm vào phễu chiết, lắc đều rồi để yên khoảng 5 phút, chất
lỏng tách thành hai lớp, loại bỏ phần chất lỏng phía dưới, lấy phần chất lỏng phía trên.
Bước 3. Cho từ từ dung dịch Na2CO3 10% vào phần chất lỏng thu lấy ở bước 2 và lắc đều cho đến khi
không còn khí thoát ra, thêm tiếp 20 mL dung dịch NaCl bão hoà rồi để yên khi đó chất lỏng tách thành hai
lớp. Chiết lấy phần chất lòng phía trên, làm khan, ta thu được isoamyl acetate.
a) Isoamyl acetate rất ít tan trong nước và nhẹ hơn nước nên nổi lên trên.
b) Nếu hiệu suất phản ứng ester hoá là 60% và lượng isoamyl acetate bị hao hụt mất 6% thì thể tích
isoamyl acetate thu được là 11,6 mL. (Làm tròn kết quả đến hàng phần mười)
c) Có thể dùng phương pháp phổ IR để phân biệt isoamyl alcohol, acetic acid và isoamyl acetate.
d) Ở bước 1, xảy ra phản ứng thế nguyên tử H trong nhóm –OH của alcohol bằng gốc CH3COO-. Lời giải. a) Đúng b) Đúng
nC5H11OH = 243/1760 (mol) , nCH3COOH = 1049/6000 (mol)
Thể tích isoamyl acetate thu được V = c) Đúng d) Sai
OH trong acid CH3COOH bị thay thế bởi (CH3)2CHCH2CH2O- trong alcohol
Câu 3. Hiện nay, trữ lượng các mỏ quặng kim loại ngày càng cạn kiệt, trong khi nhu cầu sử dụng kim loại
ngày càng tăng và lượng phế thải kim loại tạo ra ngày càng nhiều. Do đó, tái chế kim loại là công việc cần
thiết, vừa đảm bảo nguồn cung, vừa gia tăng giá trị kinh tế, bảo vệ môi trường và thực hiện mục tiêu phát triển bền vững.
a) Tái chế là quá trình xử lí để tái sử dụng rác thải hoặc vật liệu không cần thiết (phế liệu) thành vật
liệu mới mang lại lợi ích cho đời sống và sản xuất.
b) Tái chế kim loại là quá trình thu kim loại từ các phế liệu kim loại.
c) Kim loại là vật liệu có thể được tái chế nhiều lần nhưng sẽ làm thay đổi tính chất cũng như làm giảm
chất lượng của chúng. Còn phế liệu kim loại là các kim loại, hợp kim có trong thiết bị, máy móc, vật dụng
hỏng, cũ, không còn sử dụng được nữa.
d) Quy trình tái chế kim loại thường gồm các giai đoạn: thu gom, phân loại; xử lí sơ bộ, phối trộn phế
liệu, nấu chảy, đúc, chế tạo, gia công, tinh chế. Lời giải a) Đúng b) Đúng
c) Sai vì kim loại sau tái chế không bị thay đổi tính chất d) Sai
Quy trình: thu gom, phân loại; xử lí sơ bộ; phối trộn phế liệu; nấu chảy;tinh chế, đúc, chế tạo, gia công.
Câu 4 . Điện phân có màng ngăn dung dịch muối ăn bão hoà trong nước là công đoạn chính của quy trình
Sodium chloride được dùng trong chế biến và bảo quản thực phẩm, làm nguyên liệu chính của quy trình
công nghiệp chlorine – kiềm. Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch
sodium chloride bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của phản ứng điện
phân dung dịch NaCl bão hòa trong bể điện phân có màng ngăn như sau: đpdd 2NaCl (aq) + 2H 2O (l)
2NaOH (aq) + H2 (g) + Cl2 (g) m c n
a) Khí thoát ra ở anode là H2. Khí thoát ra ở cathode là Cl2.
b) Sản phẩm cơ bản của công nghiệp chlorine – kiềm là sodium hydroxide, chlorine và hydrogen.
c) Nếu bỏ màng ngăn xốp thì thu được sản phẩm là nước Javel và khí H2.
d) Trong trường hợp không có màng ngăn, khi điện phân hoàn toàn 300 kg dung dịch NaCl bão hòa ở 250C
thì thu được dung dịch chứa NaClO 30% (làm tròn đến hàng đơn vị).(Biết độ tan của NaCl ở nhiệt độ này là 36,2 gam). Lời giải a.Sai
Anode: Khí thoát ra là Cl₂.
Cathode : Khí thoát ra là H₂. b.Đúng c.Đúng d.Sai
Trong 300g dung dịch NaCl có mNaCl = 18100/227 (Kg)
Số mol NaCl = 1,363 mol Số mol NaClO = 1,363
Khối lượng NaClO = 101,5435 gam
Khối lượng H2 bay lên = 1,363 gam
Nồng độ dung dịch NaClO =
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Trong công nghiệp, một lượng lớn NaHCO3 và Na2CO3 được sản xuất theo phương pháp Solvay
bằng cách cho khí CO2 (lấy từ nhiệt phân đá vôi) vào dung dịch chứa sodium chloride (NaCl) bão hoà và ammonia (NH3) bão hoà.
CO2(aq) + H2O(l) + NH3(aq) + NaCl(aq) ↔ NH4Cl(aq) + NaHCO3(s) (1) 0 t NaHCO
3 tách ra đem nhiệt phân thu được soda: 2NaHCO3 Na2CO3 + CO2 + H2O (2)
và NH4Cl được sử dụng để tái tạo NH3 bằng cách tác dụng với Ca(OH)2 tạo ra từ CaO. Cho các phát biểu sau
1) Phản ứng (1) xảy ra được là do khi làm lạnh, NaHCO3 có độ tan kém hơn nên bị kết tinh trước.
2) Trong thực tế sản xuất, người ta đun nóng hỗn hợp các chất tham gia phản ứng (1) để thu được Na2CO3 ngay.
3) Nguyên liệu chính của quá trình sản xuất soda bằng phương pháp Solvay là đá vôi, muối ăn, amonia và nước.
4) NaHCO3 được ứng dụng làm bột nở là do phản ứng (2).
Sắp xếp các phát biểu đúng theo thứ tự tăng dần Lời giải: 134
Câu 2. Poly(vinyl chloride) được điều chế từ khí ethylene và chlorine theo sơ đồ sau: Cl 0 500 C 0 xt,t ,p CH 2=CH2 2 ClCH2–CH2Cl CH2=CHCl PVC
Biết hiệu suất của quá trình điều chế đạt 80%. Tính khối lượng PVC (theo tấn) thu được từ 5,6 tấn ethylene
ban đầu. (Làm tròn kết quả đến hàng đơn vị) Lời giải Đs: 10
Khối lượng PVC thu được = tấn
Câu 3. Quy trình sản xuất Copper (Cu) từ quặng chứa Cu2S được thực hiện như sau:
Giai đoạn 1. Đốt Cu2S bằng khí oxygen theo phản ứng: 2Cu2S + 3O2 2Cu2O + 2SO2
Giai đoạn 2. Copper(I) oxide sẽ phản ứng với phần còn lại của Cu2S theo phản ứng: 2Cu2O + Cu2S 6Cu + 2SO2
Quặng Copper ban đầu chứa khoảng 40% Cu2S theo khối lượng. Tính khối lượng quặng Copper (theo tấn)
cần lấy để điều chế được 1 tấn Cu. Biết hiệu suất của quá trình đạt 90%. (Làm tròn kết quả đến hàng phần trăm) Lời giải Đs: 3,47
Khối lượng quặng =
Câu 4: Xăng sinh học E5 (chứa 5% ethanol về thể tích, còn lại là xăng, giả thiết chỉ là octane). Khi được
đốt cháy hoàn toàn, 1 mol ethanol tỏa ra lượng nhiệt là 1365,0 kJ và 1 mol octane tỏa ra lượng nhiệt là
5928,7 kJ. Trung bình, một chiếc xe máy di chuyển được 1km thì cần một nhiệt lượng chuyển thành công
cơ học có độ lớn là 211,8 kJ. Nếu xe máy đó đã sử dụng 4,6 lít xăng E5 ở trên thì quãng đường di chuyển
được là bao nhiêu km, biết hiệu suất sử dụng nhiên liệu của đông cơ là 25%; khối lượng riêng của ethanol
là 0,8 g/mL, của octane là 0,7 g/mL (đáp án làm tròn đến số nguyên) Lời giải Đs: 194
Số mol ethanol = (4,6.0,05.1000.0,8):46 = 4 mol
Số mol octane = (4,37.0,7.1000): 114 = 161/6 mol
Quãng đường đi được: [(4. 1365 + 161/6. 5928,7). 0,25]:211,8 = 194,2
Câu 5. Để mạ đồng (Cu) một vật dụng kim loại có tổng diện tích bề mặt là 10 cm2, người ta tiến hành điện
phân dung dịch CuSO4 với cực âm là vật dụng cần mạ và cực dương là lá đồng thô. Biết cường độ dòng
điện không đổi là 2 A, hiệu suất điện phân là 80%, khối lượng riêng của tinh thể Cu là 8,94 g/cm3 và lượng
đồng tạo ra được tính theo công thức Faraday là AIt m
(với A là nguyên tử khối của Cu = 64; I là cường nF
độ dòng điện, F là hằng số Faraday = 96485 C/mol, n là số electron mà 1 ion Cu2+ nhận, t là thời gian điện
phân tính bằng giây). Thời gian điện phân để lớp mạ có độ dày đồng nhất 0,1 mm là bao nhiêu phút? (làm
tròn kết quả đến phần mười) Lời giải Đs: 28,1
Khối lượng Cu = 10.0,01.8,94 = 0,894 gam
Thời gian điện phân: t = phút
Câu 6. Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr
(Cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành
các thí nghiệm sau: Cân chính xác 9,81 gam muối Mohr, pha thành 200 mL dung dịch X. Lấy chính xác 10
mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung
dịch chuẩn KMnO4 0,02M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau: Lần chuẩn độ 1 2 3
V dung dịch KMnO4 (ml) 12,5 12,0 12,2
Theo kết quả chuẩn độ ở trên, hãy tính độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối
Mohr? (Làm tròn kết quả đến hàng phần mười) Lời giải ĐS: 97,8
Số mol Fe trong muối ban đầu = 20.5.nKMnO4 =10.5. Khối lượng muối mohr =
Độ tinh khiết của muối = .100= 97,8%




