






Preview text:
ĐỀ THI THỬ THPT MÔN HÓA 2023 PHÁT TRIỂN TỪ ĐỀ MINH HỌA-ĐỀ 5
* Cho biết nguyên tử khối của các nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al =
27; S = 32; Cl = 35,5; K = 39, Fe = 56; Cu = 64; Ba = 137.
* Các thể tích khí đều đo ở (đktc), các khí sinh ra đều không tan trong nước.
Câu 41: Canxi phản ứng với clo sinh ra sản phẩm nào sau đây? A. CaCl.
B. CaCl2. C. Ca(OH)2. D. NaOH.
Câu 42: Dung dịch chất nào sau đây không hòa tan được Al(OH)3? A. H2SO4. B. NaOH. C. HCl. D. KCl.
Câu 43: Dung dịch amin nào sau đây tạo kết tủa trắng với dung dịch Br2?
A. Đimetylamin. B. Anilin. C. Metylamin. D. Etylamin.
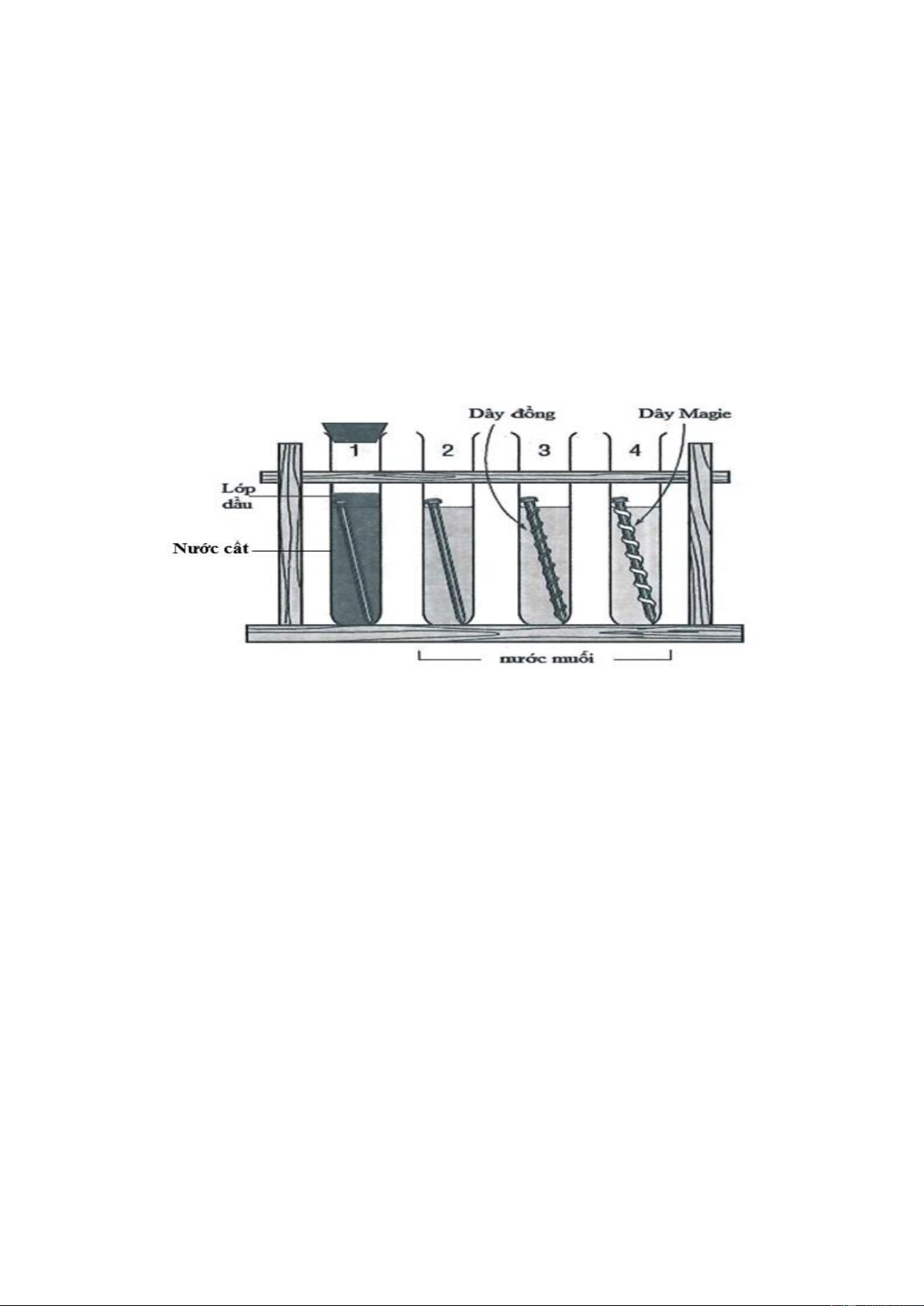
Câu 44: Cho 4 thí nghiệm như hình vẽ (biết đinh làm bằng thép):
Số thí nghiệm Fe bị ăn mòn điện hóa trước là A. 1. B. 2. C. 4. D. 3.
Câu 45: Chất nào sau đây làm mất tính cứng của nước cứng vĩnh cửu? A. NaCl. B. NaNO3. C. HCl.
D. Na2CO3.
Câu 46: Trong điều kiện không có oxi, sắt không phản ứng với dung dịch nào sau đây?
A. H2SO4 đặc, nóng.
B. HNO3 đặc, nguội.
C. HNO3 đặc, nóng.
D. H2SO4 loãng.
Câu 47: Trong hợp chất, số oxi hóa của kim loại kiềm la bao nhiêu? A. +1. B. +2. C. +3. D. -4.
Câu 48: Vinyl axetat có công thức là A. CH3COOCH3. B. C2H5COOCH3. C. HCOOC2H5.
D. CH3COOCH=CH2.
Câu 49: Khi điện phân CaCl2 nóng chảy (điện cực trơ), tại cực dương xảy ra
A. sự khử ion.
B. sự khử ion Ca2+.
C. sự oxi hoá ion Ca2+.
D. sự oxi hoá ion.
Câu 50: Polime dùng để chế tạo thuỷ tinh hữu cơ (plexiglas) được điều chế bằng phản ứng trùng hợp
A. CH2=C(CH3)COOCH3.
B. CH2 =CHCOOCH3. C. C6H5CH=CH2.
D. CH3COOCH=CH2.
Câu 51: Chất nào sau đây là muối axit? A. CuSO4. B. Na2CO3. C. NaH2PO4. D. NaNO3.
Câu 52: Quặng boxit là nguyên liệu dùng để điều chế nhôm trong công nghiệp bằng phương pháp
điện phân nóng chảy. Công thức quặng boxit là A. Al2O3.
B. K2SO4.Al2(SO4)3.24H2O. C. Al2O3.2H2O. D. Al(OH)3.
Câu 53: Người hút thuốc là nhiều thường mắc các bệnh nguy hiểm về đường hô hấp. Chất gây hại
chủ yếu có trong thuốc lá là A. Becberin. B. Mocphin. C. Nicotin.
D. Axit nicotinie.
Câu 54: Tripanmitin là một loại chất béo có trong mỡ động vật và dầu cọ. Công thức của tripanmitin là
A. (C15H31COO)3C3H5.
B. (C17H35COO)3C3H5.
C. (C17H33COO)3C3H5. D. (C17H31COO)3C3H5.
Câu 55: Kim loại cứng nhất là A. Cr. B. Os. C. Pb. D. W.
Câu 56: Etanol là chất tác động đến thần kinh trung ương. Khi hàm lượng etanol trong máu tăng
thì sẽ có hiện tượng nôn, mất tỉnh táo và có thể tử vong.
Tên gọi khác của etanol là A. phenol.
B. ancol etylic. C. etanal. D. axit fomic.
Câu 57: Amin nào sau đây là amin bậc 3? A. C2H5NH2.
B. (CH3)3N. C. C6H5NH2. D. (CH3)2NH.
Câu 58: Màu của CrO3 là A. Xanh lục. B. Vàng. C. Da cam.
D. Đỏ thẫm.
Câu 59: Ở nhiệt độ cao, Al khử được ion kim loại trong oxit? A. K2O. B. Fe2O3. C. MgO. D. BaO.
Câu 60: Chất nào sau đây còn có tên gọi là đường nho A. Glucozơ. B. Saccarozơ. C. Fructozơ. D. Tinh bột.
Câu 61: Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên
(1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau: Dung dịch (1) (2) (4) (5) (1) khí thoát ra có kết tủa (2) khí thoát ra có kết tủa có kết tủa (4) có kết tủa có kết tủa (5) có kết tủa
Các dung dịch (1), (3), (5) lần lượt là A. H2SO4, NaOH, MgCl2.
B. Na2CO3, NaOH, BaCl2.
C. H2SO4, MgCl2, BaCl2.
D. Na2CO3, BaCl2, NaOH.
Câu 62: Phát biểu nào sau đây đúng?
A. Các polime đều được tổng hợp bằng phản ứng trùng hợp.
B. Ở điều kiện thích hợp, triolein tham gia phản ứng cộng H2.
C. Lực bazơ của các amin đều mạnh hơn amoniac.
D. Tơ xenlulozơ axetat và tơ visco đều là tơ tổng hợp.
Câu 63: Thực hiện các thí nghiệm sau thí nghiệm thu được muối sắt (II) là
A. Đốt dây Fe trong khí Cl2 dư.
B. Cho bột Fe3O4 vào dung dịch H2SO4 đặc, nóng, dư.
C. Cho bột Fe vào dung dịch AgNO3 dư.
D. Cho bột Fe dư vào dung dịch HNO3 loãng.
Câu 64: Để có 29,7 kg xenlulozơtrinitrat cần dùng dung dịch chứa m kg axit HNO3 đặc pư với
xenlulozơ (H= 90%) giá trị của m là A. 42 kg. B. 10 kg. C. 30 kg. D. 21 kg.
Câu 65: Cho 4,5 gam amin X (no, đơn chức, mạch hở) tác dụng với HCl dư, thu được 8,15 gam
muối. Số nguyên tử hiđro trong phân tử X A. 9. B. 5. C. 7. D. 11..
Câu 66: Poliscacrit X chất rắn dạng bột, vô định hình màu trắng, được tạo thành ở cây xanh trong
quá trình quang hợp. Thủy phân X sinh ra monosaccarit Y. Phát biểu nào sau đây là đúng?
A. Phân tử khối của Y là 162.
B. X có pư tráng bạc.
C. X dễ tan trong nước lạnh.
D. Y tác dụng với H2 sinh ra sobitol.
Câu 67: Cho một lượng tinh thể Cu(NO3)2.3H2O vào 400 ml dung dịch HCl 0,4M thu được dung dịch
X. Điện phân dung dịch X trong thời gian t giây với cường độ 5A không đổi đến khi khối lượng dung
dịch giảm 17,49 gam thì dừng lại. Nhúng thanh Fe vào dung dịch sau điện phân, kết thúc phản ứng
thoát ra 0,07 mol NO, đồng thời khối lượng thanh Fe giảm 5,88 gam. Giá trị gần nhất của t là A. 9455. B. 9264. C. 9611. D. 9750.
Câu 68: Chất X có công thức phân tử C4H6O2. Khi X tác dụng với dung dịch NaOH sinh ra chất Y có
công thức phân tử C3H3O2Na. Chất X có tên gọi là
A. metyl acrylat.
B. metyl metacrylat.
C. metyl axetat.
D. etyl acrylat.
Câu 69: Cho các kim loại Fe, Cu, Zn, Ag. Có bao nhiêu kim loại tác dụng được với ion Fe + 3 ? A. 1. B. 2. C. 3. D. 4.
Câu 70: Thí nghiệm điều chế và thử tính chất của etilen được tiến hành theo các bước sau:
Bước 1: Cho 2 ml ancol etylic khan vào ống nghiệm khô đã có sẵn vài viên đá bọt (ống số 1) rồi
thêm từ từ 4 ml dung dịch H2SO4 đặc và lắc đều. Nút ống số 1 bằng nút cao su có ống dẫn khí
rồi lắp lên giá thí nghiệm.
Bước 2: Lắp lên giá thí nghiệm khác một ống hình trụ được đặt nằm ngang (ống số 2) rồi nhồi
một nhúm bông tẩm dung dịch NaOH đặc vào phần giữa ống. Cắm ống dẫn khí của ống số 1
xuyên qua nút cao su rồi nút vào một đầu của ống số 2. Nút đầu còn lại của ống số 2 bằng nút
cao su có ống dẫn khí, Nhúng ống dẫn khí của ống số 2 vào dung dịch KMnO4 đựng trong ống nghiệm (ống số 3).
Bước 3: Dùng đèn cồn đun nóng hỗn hợp trong ống số 1. Cho các phát biểu sau:
(a) Đá bọt có vai trò làm cho chất lỏng sôi đều và không trào lên khi đun nóng.
(b) Ở bước 1, nếu thay H2SO4 đặc bằng H2SO4 loãng thì trong thí nghiệm vẫn thu được lượng khí etilen không đổi.
(c) Bông tẩm dung dịch NaOH đặc có tác dụng loại bớt khí SO2, CO2 sinh kèm theo.
(d) Phản ứng trong ống số 3 thuộc phản ứng oxi hóa - khử.
(e) Nếu thu khí etilen đi ra từ ống dẫn khí của ống số 2 thì dùng phương pháp dời nước.
Số phát biểu đúng là A. 4. B. 3. C. 5. D. 2.
Câu 71: Cho các phát biểu sau:
(a) Glucozơ bị oxi hóa bởi dung dịch AgNO3 trong NH3 đun nóng.
(b) Đồng trùng hợp buta-1,3-đien với lưu huỳnh thu được cao su buna-S.
(c) Giấm ăn có thể khử được mùi tanh của cá do các amin gây ra.
(d) Đun nóng tristearin với dung dịch NaOH sẽ xảy ra phản ứng thủy phân.
(e) Nhỏ vài giọt nước brom vào dung dịch phenol (C6H5OH) xuất hiện kết tủa trắng.
Số phát biểu đúng là A. 2. B. 4. C. 5. D. 3.
Câu 72: Thực hiện các thí nghiệm sau:
(1) Cho dung dịch Ca(OH)2 dư vào dung dịch Mg(HCO3)2.
(2) Cho dung dịch FeCl2 vào dung dịch AgNO3 (dư).
(3) Cho 2x mol Ba vào dung dịch chứa x mol Al2(SO4)3.
(4) Cho từ từ đến dư dung dịch NaOH vào dung dịch chứa AlCl3 và CuCl2.
(5) Cho dung dịch chưa 4a mol Ba(OH)2 vào dung dịch chưa 3a mol H3PO4 và đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa gồm hai chất là A. 5. B. 3. C. 2. D. 4.
Câu 73: Một loại phân lân có thành phần chính Ca(H2PO4)2.2CaSO4 và 10% tạp chất không chứa
Photpho. Hàm lượng dinh dưỡng trong loại phân lân đó là A. 36,42%. B. 28,40%. C. 25,26%. D. 31,00%
Câu 74: Đun nóng m gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 300 ml dung dịch
KOH 1M (vừa đủ), thu được glixerol và hỗn hợp Y chứa các muối có công thức chung C17HyCOOK.
Đốt cháy 0,14 mol E, thu được 3,69 mol CO2. Mặt khác, m gam E tác dụng vừa đủ với 0,25 mol Br2.
Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là A. 86,71. B. 86,91. C. 86,41. D. 86,61.
Câu 75: Theo TCVN 5502: 2003, dựa vào độ cứng của nước (được xác định bằng tổng hàm lượng
Ca2+ và Mg2+ quy đổi về khối lượng CaCO3, có trong 1 lít nước), người ta có thể phân nước thành 4 loại: Phân loại nước Mềm Hơi cứng Cứng Rất cứng Độ cứng (mg CaCO3/lít) 0 - dưới 50 50 - dưới 150 150 - 300 > 300
Từ một mẫu nước có chứa các ion (Mg2+, Ca2+, SO 2- -
4 0,0004M, HCO3 0,00042M, Cl- 0,0003M),
người ta có thể tính được giá trị độ cứng của mẫu nước. Hãy chọn nhận định đúng trong các nhận định sau
A. Độ cứng của nước là 76 mg/l. Mẫu nước thuộc loại nước hơi cứng.
B. Độ cứng của nước là 152 mg/l. Mẫu nước thuộc loại nước cứng.
C. Độ cứng của nước là 40 mg/l. Mẫu nước thuộc loại nước mềm.
D. Độ cứng của nước là 400 mg/l. Mẫu nước thuộc loại nước rất cứng.
Câu 76: Nung m gam hỗn hợp A gồm Mg, FeCO3, FeS và Cu(NO3)2 (trong đó phần trăm khối lượng
oxi chiếm 47,818%) một thời gian, thu được chất rắn B (không chứa muối nitrat) và 22,288 lít hỗn
hợp khí gồm CO2, NO2, O2, SO2. Hoà tan hết B với dung dịch HNO3 đặc nóng, dư, thấy có 1,34 mol 321
HNO3 phản ứng, thu được dung dịch C và 6,272 lít hỗn hợp X gồm NO2 và CO2 ( d = X ). Đem H 2 14
C tác dụng hoàn toàn với dung dịch BaCl2 dư, thu được 4,66 gam kết tủa. Biết các khí đo ở đktc.
Giá trị của m gần nhất với giá trị nào sau đây? A. 86,6. B. 84,4. C. 78,5. D. 88,6.
Câu 77: Hỗn hợp E gồm ba este X, Y, Z đều đa chức, no, mạch hở (MX < MY < MZ). Đốt cháy hoàn
toàn 8,55 gam E cần vừa đủ 8,232 lít khí O2, thu được 5,13 gam H2O. Mặt khác, đun nóng 8,55 gam
E với dung dịch NaOH (vừa đủ), cô cạn dung dịch sau phản ứng, thu được muối T (có mạch cacbon
không phân nhánh) và hỗn hợp hai ancol (đơn chức, kế tiếp trong dãy đồng đẳng). Đốt cháy hoàn
toàn T, thu được Na2CO3, CO2 và 1,08 gam H2O. Khối lượng của 0,12 mol Y là A. 14,16. B. 19.20. C. 17,52. D. 15,84.
Câu 78: Giấm được sử dụng nhiều trong chế biến thực phẩm.
Thành phần chính của giấm là axit axetic có vị cay nồng. Một mẫu giấm có nồng độ axit axetic là
4%. Khối lượng riêng của dung dịch axit axetic đó là 1,05 g.ml-1.Độ pH của mẫu giấm ở trên, cho
biết Ka (axit axetic) = 1,8.10-5. A. 2,45. B. 3,125. C. 0,7. D. 3,54.
Câu 79: Thực hiện các sơ đồ phản ứng sau:
(a) X1 + X2 dư → X3 + X4↓ + H2O. (b) X1 + X3 → X5 + H2O. (c) X2 + X5 → X4 + 2X3.
(d) X4 + X6 → BaSO4 + CO2 + H2O.
Biết các chất phản ứng theo đúng tỉ lệ mol. Các chất X2 và X6 thỏa mãn sơ đồ trên lần lượt là
A. KOH và H2SO4.
B. Ba(HCO3)2 và H2SO4.
C. Ca(HCO3)2 và Na2SO4. D. Ba(OH)2 và HCl.
Câu 80: Chất hữu cơ X mạch hở có công thức phân tử C7H8O4. Thủy phân hoàn toàn X trong dung
dịch NaOH, thu được muối Y và hỗn hợp hai chất hữu cơ đơn chức là Z và T có cùng số nguyên tử
hiđro (MZ < MT). Axit hóa Y thu được hợp chất hữu cơ E đa chức. Cho các phát biểu sau đây:
a) Đề hiđrat hóa Z (xúc tác H2SO4 đặc, 170°C), thu được anken.
b) Nhiệt độ sôi của chất T cao hơn nhiệt độ sôi của etanol.
c) Phân tử chất E có số nguyên tử hiđro bằng số nguyên tử oxi.
d) X có hai công thức cấu tạo thoả mãn.
e) Từ Z có thể tạo ra T bằng một phản ứng.
Số phát biểu đúng là A. 1. B. 3. C. 4. D. 2. ĐÁP ÁN 41.B 42.D 43.B 44.B 45.D 46.B 47.A 48.D 49.D 50.A 51.C 52.C.A 53.C 54.A 55.A.C 56.B 57.B.C 58.D 59.B 60.A 61.A 62.B 63.D.C 64.D 65.C 66.D 67.A 68.A 69.C.C 70.A 71.B 72.D 73.C 74.C 75.A 76.B 77.C 78.A 79.B 80.A
LỜI GIẢI CHI TIẾT VD – VDC
Câu 44: Chọn B.
Có 2 thí nghiệm, trong đó sắt bị ăn mòn điện hóa là: Thí nghiệm số 2 và thí nghiệm 3, Fe bị ăn
mòn điện hóa. Còn thí nghiệm 4 thì Mg bị ăn mòn điện hóa, thí nghiệm 1 thì không có dung dịch điện li.
Câu 61: Chọn A.
Theo bảng ta tìm được (1) là H2SO4; (2) là Na2CO3; (3) là NaOH; (4) là BaCl2; (5) là MgCl2. Câu 67: Chọn A.
- Nếu không có Cu2+ dư thì nFe (phản ứng) = 0,105 mol, trong khi nNO = 0,07 mol.
Bt mol e: 0,105x2 = 0,07x3 thỏa mãn, vậy điều giả sử là đúng, Cu2+ phản ứng hết. Ta có: = 4nNO = 0,28 mol. Ptđp: Cu(NO3)2 + 2HCl Cu + Cl2 + 2HNO3 0,08 0,16 0,08 0,08 0,16
Kết thúc phản ứng dung dịch mới có: 0,16 mol H+. Vậy cần thêm ( 0,28 – 0,16) = 0,12 mol H+ nữa. Ptđp: 2Cu(NO3)2 + 2H2O 2Cu + O2 + 4HNO3 0,06 0,03 0,12
Sau hai phản ứng m (giảm) = 15,6 gam < 17,49 gam
Ta có: H2O bị điện phân 2 H2O 2H2 + O2 mol: a a 0,5a
=> m (giảm) = 15,6 + 18a = 17,49 => a = 0,105 mol =>
= (0,08x2 + 4x0,0825) =0,49 mol t =9457s 9455
Câu 70: ChọnA.
Phát biểu đúng là (a); (c); (d); (e).
(a) Đúng: trọng lượng của đã bọt cản chở sự trào lên của nước khi sôi
(b) Sai: Vì H2SO4 loãng không có tính háo nước như H2SO4 đặc
(c) Đúng: vì trong thí nghiệm H2SO4 đặc có tính oxi hóa mạnh dẫn đến ancol có thể oxi hóa một
phần thành SO2; CO2. Hai khí bị hấp thụ trong bông tẩm NaOH.
(d) Đúng: có sự thay đổi số oxi hóa
(e) Đúng: vì etilen không tan trong nước nên thu bằng phương pháp đẩy nước)
Câu 71: Chọn B
(a) Đúng, Ag+ là chất oxi hóa (số oxi hóa giảm từ +1 xuống 0).
(b) Sai, đồng trùng hợp buta-1,3-đien với stiren thu được cao su buna-S.
(c) Đúng, giấm ăn chứa CH3COOH kết hợp với amin tạo muối tan, dễ bị rửa trôi.
(d) Đúng, chất béo bị thủy phân trong môi trường kiềm.
(e) Đúng, do xảy ra phản ứng thế 3Br vào vòng benzen, sản phẩm thế là chất kết tủa trắng.
Câu 72: Chọn D
(1) 2Ca(OH)2 + Mg(HCO3)2 → CaCO3 + Mg(OH)2 + 2H2O
(2) FeCl2 + 3AgNO3 → Fe(NO3)3 + 2AgCl + Ag
(3) Ba + 2H2O → Ba(OH)2 + H2
3Ba(OH)2 + Al2(SO4)3 → 3BaSO4 + 2Al(OH)3 Al2(SO4)3 còn dư.
(4) AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
(5) Tỉ lệ nH+/nOH- = 9a/8a → Tạo Ba3(PO4)2 và BaHPO4.
Câu 73: Chọn C
Độ dinh dưỡng phân lân được đánh giá qua hàm lượng P2O5
Giả sử có 100 gam phân lân Ca(H PO ) .2CaSO : 90(g) 2 4 2 4 → n = 0,1779 Ca(H2PO4 )2 .2CaSO4 Tap chat :10(g) . → n = 0,3538 → n = 0,1779 → % P O = 25, 26% P 2 P O5 2 5
Câu 74: Chọn C Số C = nCO2/nE = 369/14
Đặt nX = x và n axit béo tổng = y → nC = 57x + 18y = 369(x + y)/14
nKOH = 3x + y = 0,3 → x = 0,045; y = 0,165
Quy đổi E thành (C17H35COO)3C3H5 (0,045), C17H35COOH (0,165) và H2 (-0,25) → mE = 86,41 gam.
Câu 75: Chọn A
Bảo toàn điện tích (mỗi Mg2+ được thay bằng 1Ca2+):
CM (Ca2+) = (0,0004.2 + 0,00042 + 0,0003)/2 = 7,6.10^-4 mol/l = 0,76 mmol/l
Độ cứng = mCaCO3/lít = 0,76.100 = 76 mg/l
Câu 76: Chọn B.
Hỗn hợp khí X gồm CO2 (0,02 mol) và NO2 (0,26 mol) n
Khi cho B tác dụng với HNO BT:H HNO3 3 thì: ⎯ ⎯ ⎯ →n = = 67 , 0 mol H O 2 2 BT:N ⎯ ⎯ ⎯ →n n − = n = − = n − n = , 1 08mol mà 2 , 0 02 HNO NO ( X NO ) BaSO 3 2 SO 3 4 4 ⎯ ⎯ ⎯ BT:O→ n = 4n 3n ( 2 n n ) n 3n 0,53mol 2− + − + + + − = O( B) CO SO NO 2 NO2 H 2O HN 3 O 4 3 BT:O ⎯ ⎯ ⎯ →n = n + ( 2 n + n
+ n + n ) = 2,52mol O( A) O( B) CO2 NO2 2 O 2 SO 16n với %m O( A) O(A) = 100 . → mA = 84,32g mA
Câu 77: Chọn C
Muối T không nhánh nên tối đa 2 chức, mặt khác các ancol đều đơn chức nên T và E đều 2 chức. nO2 = 0,3675; nH2O = 0,285
Bảo toàn khối lượng → nCO2 = 0,345
→ nT = nE = nCO2 – nH2O = 0,06 Đốt T → nH2O = 0,06
→ Số H của T = 2nH2O/nT = 2 → T là CH2(COONa)2
nAncol = 2nE = 0,12 và nC(ancol) = nC(E) – nC(T) = 0,165
→ Số C = nCO2/nAncol = 1,375 → CH3OH và C2H5OH X là CH2(COOCH3)2 Y là CH2(COOCH3)(COOC2H5) Z là CH2(COOC2H5)2
Khi nY = 0,12 thì mY = 17,52.
Câu 78: Chọn A
Nồng độ mol của axit axetic = 10.1,05.4/60 = 0,7 M
Từ Ka => [H+] = 3,54.10-3M => pH = 2,45
Câu 79: Chọn B
(d) => X4 là BaCO3 và X6 là H2SO4 (do X4 không tan, theo phản ứng (a)).
(a) X1 + X2 dư → X3 + X4↓ + H2O.
KOH + Ba(HCO3)2 dư → KHCO3 + BaCO3 + H2O (b) X1 + X3 → X5 + H2O. KOH + KHCO3 → K2CO3 + H2O (c) X2 + X5 → X4 + 2X3.
Ba(HCO3)2 + K2CO3 → BaCO3 + 2KHCO3
(d) X4 + X6 → BaSO4 + CO2 + H2O.
BaCO3 + H2SO4 → BaSO4 + CO2 + H2O
=> X2 là Ba(HCO3)2 và X6 là H2SO4.
Câu 80: Chọn A
X + NaOH → Y + Z + T với Y là muối và Z, T cùng H nên:
TH1: X là CH3 - OOC - CH2 – COO - CH2 – C ≡ CH
=> Y là CH2(COONa)2; Z là CH3OH; T là C3H3OH; E là CH2(COOH)2
TH2: X là CH3 – OOC - C2H2 – COO – CH = CH2
=> Y là C2H2(COONa)2; Z là CH3OH; T là CH3CHO; E là C2H2(COOH)2
Trong đó -C2H2- là -CH=CH- hoặc -C(=CH2)-
(a) Sai, Z có 1C nên không tạo anken.
(b) Sai, tùy theo cấu tạo của T, CH3CHO sôi thấp hơn C2H5OH, C3H3OH sôi cao hơn C2H5OH.
(c) Đúng, E có 4H và 4 oxi.
(d) Sai, X có 3 cấu tạo thỏa mãn. (e) Sai




