


Preview text:
PHÁT TRIỂN TỪ ĐỀ MINH HỌA
ĐỀ ÔN THI TỐT NGHIỆP THPT 2025 ĐỀ 36 MÔN: HÓA Thời gian: 50 phút
PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án
Câu 1. Ester ethyl formate có mùi thơm của đào và có thành phần trong hương vị của quả mâm xôi, đôi khi
nó còn được tìm thấy trong táo, ester này công thức là A. CH3COOCH3. B. HCOOC2H5. C. HCOOCH=CH2. D. HCOOCH3.
Câu 2. Phản ứng giữa C2H5OH với CH3COOH (xúc tác H2SO4 đặc, đun nóng) là phản ứng A. Xà phòng hóa. B. ester hóa. C. Trùng hợp. D. Trùng ngưng
Câu 3. Chất thuộc loại disaccharide là A. glucose. B. saccharose. C. cellulose. D. fructose.
Câu 4. Tên gọi và bậc của amine có công thức cấu tạo CH3-CH2-NH2
A. methylamine, bậc I. B. ethylamine, bậc I.
C. ethylamine, bậc II. D. ethaneamine, bậc II.
Câu 5. Amino acid là hợp chất hữu cơ trong phân tử
A. chứa nhóm carboxyl và nhóm amino.
B. chỉ chứa nhóm amino.
C. chỉ chứa nhóm carboxyl.
D. chỉ chứa nitrogen hoặc carbon.
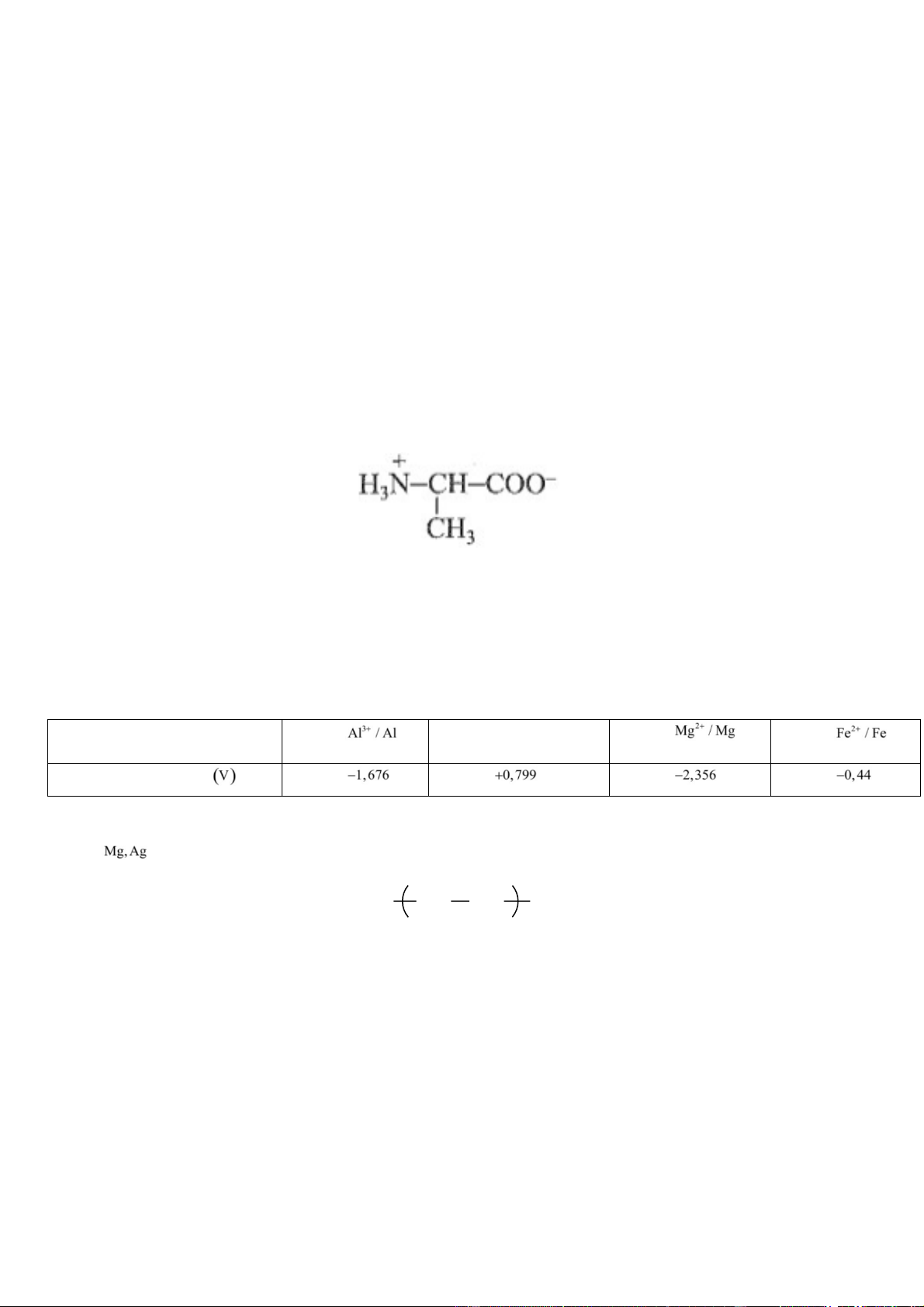
Câu 6. Cho dung dịch chứa amino acid X tồn tại ở dạng ion lưỡng cực:
Đặt dung dịch này trong một điện trường. Khi đó:
A. Chất X sẽ di chuyển về phía cực âm của điện trường.
B. Chất X sẽ di chuyển về phía cực dương của điện trường.
C. Chất X không di chuyển dưới tác dụng của điện trường.
D. Chất X chuyển hoàn toàn về dạng H2NCH(R)COOH.
Câu 7. So sánh, phân loại, lựa chọn được các đối tượng, khái niệm hoặc quá trình hoá học theo các tiêu chí khác nhau.
Xét các cặp oxi hoá - khử sau: Cặp oxi hoá - khử Ag / Ag Thế điện cực chuẩn
Kim loại có tính khử mạnh nhất, yếu nhất lần lượt là A. . B. Al, Ag. C.Al, Fe D. Mg, Fe
Câu 8. Tên gọi của polymer có công thức cho dưới đây là CH2 CH2 n A. Cao su buna. B. Cao su buna-S. C. Polyethylene. D. Cao su isoprene .
Câu 9. Cho các chất sau:
CH2=CHCl; CH2 = CH – CH3, CH2=CH-CH=CH2; H2N[CH2]5COOH.
Số chất có khả năng tham gia phản ứng trùng hợp là A. 3. B. 1. C. 4. D. 2
Câu 10. Một học sinh tiến hành thí nghiệm: Nhúng một thanh đồng vào dung dịch AgNO3, sau một lúc
nhúng tiếp một thanh sắt vào dung dịch này đến phản ứng hoàn toàn. Sau khi thí nghiệm kết thúc, học sinh
đó rút ra các kết luận sau :
(1) Dung dịch thu được sau phản ứng có màu xanh nhạt.
(2) Khối lượng thanh đồng bị giảm sau phản ứng.
(3) Khối lượng thanh sắt tăng lên sau phản ứng.
Số kết luận không đúng là A. 0. B. 1. C. 2. D. 3.
Câu 11. Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là A. 1s22s22p63s1. B. 1s22s22p63s2. C. 1s22s32p63s2. D. 1s22s22p73s1.
Câu 12. Liên kết kim loại là liên kết được hình thành do:
A. Các electron tự do chuyển động quanh vị trí cân bằng giữa nguyên tử kim loại và ion dương kim loại.
B. Sự cho và nhận electron giữa các nguyên tử kim loại.
C. Sự góp chung electron giữa các nguyên tử kim loại.
D. Lực hút tĩnh điện của ion dương kim loại này với nguyên tử kim loại.
Câu 13. Nhiệt tạo thành của một số chất được cho trong bảng sau: Chất Na2CO3(s) NaHCO3(s) Na2O(s) CO2(g) H2O(l) 0 H (kJ.mol – 1) -1130,70 -950,81 -414,20 -393,51 -285,83 f 298
Phát biểu sau đây là sai?
A. Quá trình hình thành muối NaHCO3 từ các đơn chất thuận lợi về năng lượng hơn so với quá trình hình
thành muối Na2CO3 từ các đơn chất.
B. Giá trị biến thiên enthalpy chuẩn bị của phản ứng 2NaHCO3(s)
Na2CO3(s) + H2O(l) + CO2(g) là -91,28kJ.
C. Phản ứng Na2CO3(s)
Na2O(s) + CO2(g) không diễn ra ở điều kiện thường, phù hợp với giá trị
biến thiên enthalpy chuẩn của phản ứng khá dương.
D. Na2CO3 bền với nhiệt hơn NaHCO3.
Câu 14. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là A. Ti B. Fe C. Cr D. Cu
Câu 15. Dãy nào sau đây sắp xếp các kim loại nhóm IA theo mức độ phản ứng với nước tăng dần? A. K, Na, Li. B. Na, K, Li. C. Li, Na, K. D. K, Li, Na.
Câu 16. Cho pin điện hoá Al-Pb. Biết o E = -1,66 V và o E = - 0,13 V. 3+ Al /Al 2+ Pb /Pb
Sức điện động chuẩn của pin điện hoá Al - Pb là A. 1,79 V. B. -1,79V. C. -1,53V. D. 1,53 V.
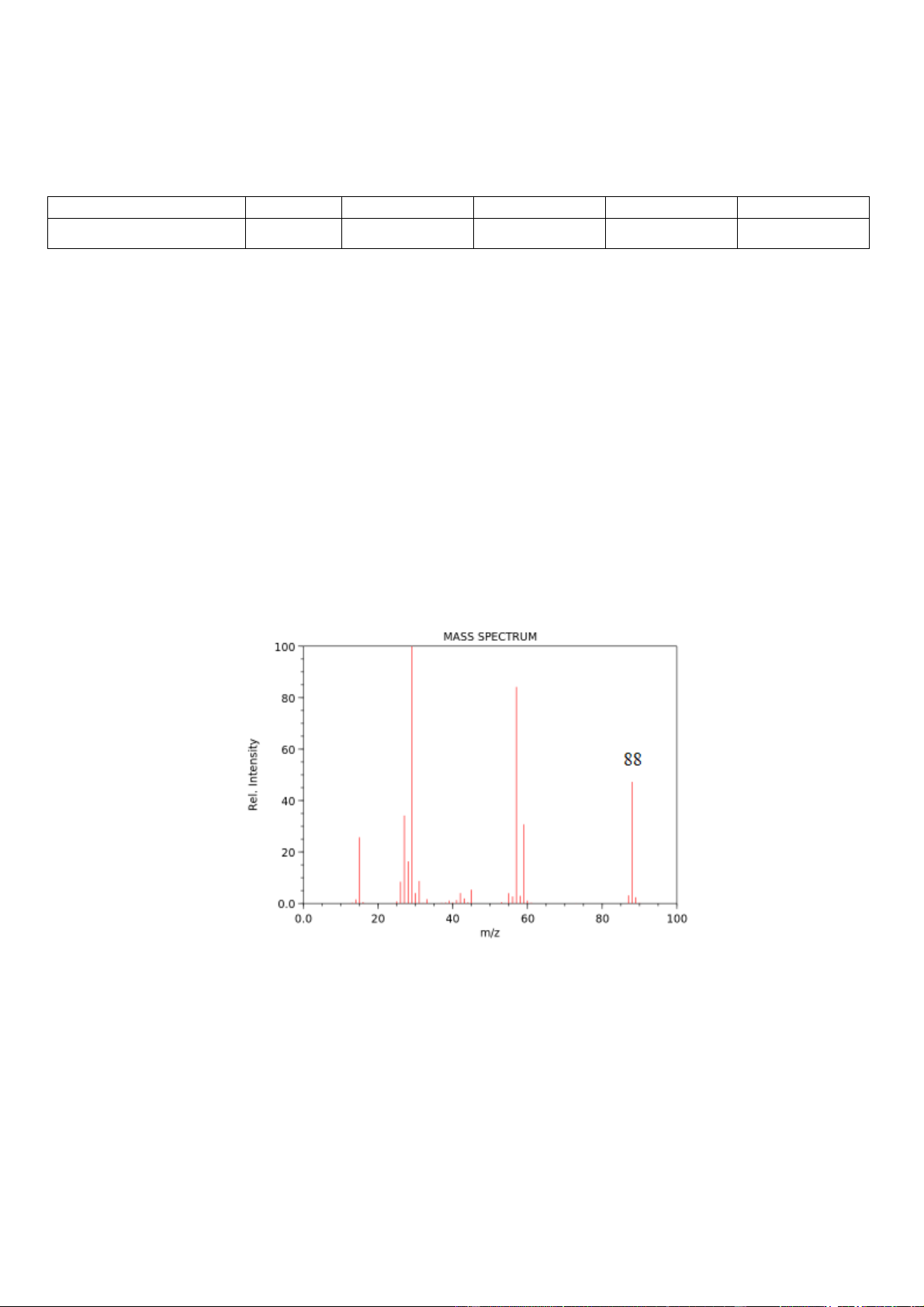
Câu 17. Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ:
Công thức phân tử của X có thể là: A. C4H10O. B. C5H10O. C. C4H10O2. D. C4H8O2.
Câu 18. Cho các chất sau: H2O, Cl2, K2O, NaF, N2, HCl, MgO. Số chất chứa liên kết ion trong phân tử là A. 2. B. 3. C. 4. D. 5.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới khi phản ứng hoàn toàn, thu được chất
rắn X và dung dịch Y. Biết E°Fe2+/Fe = -0,44V; E°Cu2+/Cu = +0,34V; E°Fe3+/Fe2+ = +0,771V. Phát
biểu dưới đây là đúng hay sai?
a. Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
b. Trong điều kiện Fe2(SO4)3 dư thì Y gồm ba muối.
c. Y gồm hai chất tan là CuSO4 và FeSO4. d. X gồm hai kim loại.
Câu 2. X là một peptide mạch hở có công thức phân tử C13H24N4O6. Thực hiện các phản ứng sau (theo
đúng tỉ lệ mol các chất):
(1) X + 4NaOH → X1 + H2NCH2COONa + X2 + 2H2O.
(2) X1 + 3HCl → C5H10NO4Cl + 2NaCl.
a. X là một tetrapeptide.
b. X1 được ứng dụng làm mì chính (bột ngọt).
c. Trong dung dịch, X1 làm quỳ tím hóa đỏ.
d. X2 tác dụng với dung dịch HCl theo tỉ lệ mol tương ứng 1 : 3.
Câu 3. Hoà tan 0,422g mẫu khoáng vật của sắt trong dung dịch sulfuric acid dư, sao cho tất cả lượng sắt có
trong quặng đều chuyển thành Fe2+, thu được dung dịch A. Chuẩn độ Fe2+ trong dung dịch A bằng chất
chuẩn là dung dịch thuốc tím KMnO4 0,040M. Khi đã sử dụng 23,50mL thì phản ứng vừa qua điểm tương đương. 5Fe2+ (aq) + MnO −
4 (aq) +8H+ (aq) → 5Fe3+ (aq) + Mn2+ (aq) + 4H2 O(l)
Mỗi phát biểu dưới đây là đúng hay sai?
a. Nếu chỉ có Fe2+ trong dung dịch A tác dụng được với thuốc tím thì việc chuẩn độ dung dịch A sẽ giúp
xác định được lượng nguyên tố sắt trong mẫu khoáng vật. Từ đó tính được % (theo khối lượng) của nguyên
tố sắt có trong mẫu khoáng vật là 60,26 %.
b. Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từ burette vào bình tam giác chứa dung dịch A.
c. Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch A để xác định được thời điểm kết
thúc quá trình chuẩn độ.
d. Cần lặp lại thí nghiệm chuẩn độ 2 lần để bảo đảm tính chính xác của kết quả.
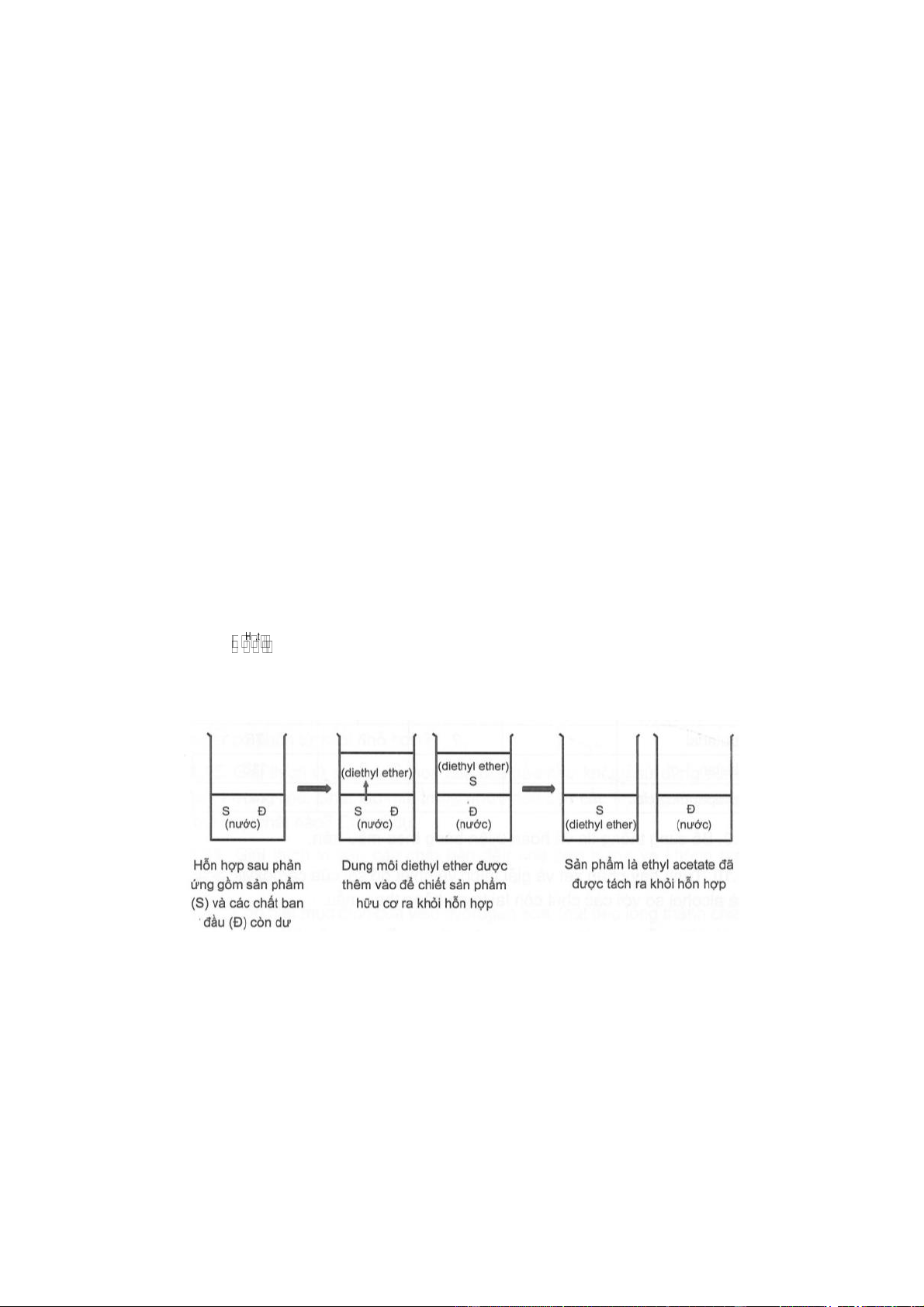
Câu 4. Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu là acetic
acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm
ethyl acetate và acetic acid, ethanol còn dư theo phương trình hoá học: o H ,t CH3COOH + C2H5OH CH3COOC2H5 + H2O
Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm đã dùng dung môi hữu
cơ không phân cực diethyl ether (C2H5OC2H5) đề chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng theo sơ đồ sau:
Chọn tính đúng sai cho các phát biểu sau về thí nghiệm của nhóm:
a) Diethyl ether là dung môi chiết lí tưởng trong thí nghiệm trên vì ethyl acetate tan tốt trong dung môi
này, còn acetic acid và ethanol lại tan tốt trong nước.
b) Bằng phương pháp chưng cất đơn giản, ta có thể tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
c) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6°C so với 77,1°C) nên có thể
thu được ethyl acetate sau khi chiết bằng cách dùng đèn cồn đun nhẹ cho dung môi diethyl ether bay hơi.
d) Để an toàn, ta có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản
để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6
Câu 1. Cho dãy các dung dịch: glucose, saccharose, ethanol, glycerol. Số dung dịch trong dãy phản ứng
được với Cu(OH)2 ở nhiệt độ thường tạo thành dung dịch có màu xanh lam là
Câu 2. Amine đơn chức X có chứa vòng benzene. Cho X tác dụng với HCl dư thu được muối Y có công
thức RNH3Cl. Cho a gam Y tác dụng với AgNO3 dư thu được a gam kết tủa. Hãy cho biết X có bao nhiêu đồng phân? ?
Câu 3. Xác định nhiệt đốt cháy tiêu chuẩn ở 25oC của khí methane theo phản ứng: CH4 + 2O2
CO2 + 2H2O. Nếu biết hiệu ứng nhiệt tạo thành tiêu chuẩn của các chất CH4, CO2 và
H2O lần lượt bằng: -74.85; -393.51; -285.84 (kJ/mol) (làm tròn đến hàng đơn vị).
Câu 4. Dầu gió xanh Thiên Thảo là sản phẩm của Công ty Cổ phần Đông
Nam Dược Trường Sơn, dùng để chủ trị: Cảm, ho, sổ mũi, nhức đầu, say nắng,
trúng gió, say tàu xe, buồn nôn, đau bụng, sưng viêm, nhức mỏi, muỗi chích, kiến
cắn, tê thấp tay chân.Thành phần một chai dầu 12 mL gồm: tinh dầu bạc hà:
0,36ml, Menthol: 2,52g, Methyl salicylate: 2,16g, Eucalyptol: 0,72ml, tinh dầu
Đinh hương: 0,24ml, Long não: 0,36g. Methyl salicylate điều chế theo phản ứng sau: o H SO , t 2 4 HOC H COOH CH OH HOC H COOCH H O 6 4 3 6 4 3 2
Để sản xuất một triệu hộp 12 chai dầu trên cần tối thiểu m tấn salicylic acid, với
hiệu suất cả quá trình là 80%. Giá trị của m là (kết làm tròn đến hàng phần mười).
Câu 5. Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn
kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hyđrogen, carbon
monooxide, methanol, ethanol, propane,…) bằng oxygen không khí. Trong pin propane - oxygen, phản ứng
tổng cộng xảy ra khi pin hoạt động như sau: C3H8 (khí) + 5O2 (khí) + 6OH– (dung dịch) → 3 2 CO (dung 3 dịch) + 7H2O (lỏng)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propan theo phản ứng trên thì sinh ra một lượng
năng lượng là 2500,00 kJ. Một bóng đèn công suất 10W được thắp sáng bằng pin nhiên liệu propan -
oxygen. Biết hiệu suất quá trình oxi hóa propan là 80,0%; hiệu suất sử dụng năng lượng là 100%. Khi sử
dụng 220 gam propan làm nhiên liệu ở điều kiện chuẩn, thì thời gian (giờ) bóng đèn được thắp sáng liên tục
là (làm tròn đến số hàng đơn vị)
Câu 6. Trong số các chất sau: Ca(OH)2, Na2CO3, Na3PO4, KCl có bao nhiêu chất có thể làm mềm nước có tính cứng tạm thời? Đáp án Mã đề Câu hỏi thi Phần I 001 1 B 2 B 3 B 4 C 5 A 6 C 7 A 8 C 9 A 10 B 11 B 12 A 13 B 14 C 15 C 16 D 17 D 18 B Phần 1 ĐĐĐS II 2 ĐĐĐS 3 ĐĐSĐ 4 ĐĐSĐ Phần 1 3 III 2 4 3 -890 4 29,4 5 278 6 3 Phần III. Hướng dẫn giải CÂU 2: Đáp số 4 4 đồng phân
X + HCl → RNH3Cl chứng tỏ X là amin bậc 1
RNH3Cl + AgNO3 → AgCl + RNH3NO3 a gam a gam
Khối lượng RNH2 = 108 -1 = 107 → CT amine là C7H9N X là amine bậc 1: C6H5-CH2-NH2; o-CH3-C6H4-NH2;
m-CH3-C6H4-NH2; p-CH3-C6H4-NH2;
Câu 4: Hướng dẫn giải
mmethyl salicylate = 1.106.12.2,16 = 25 920 000 gam = 25,92 tấn. o H SO , t 2 4 HOC H COOH CH OH HOC H COOCH H O 6 4 3 6 4 3 2 138 g → 152 g m tấn H 80 % 25,92 tấn 25,92.138 100 msalicylic acid = m = . 29,4 tấn 152 80 Câu 5 10W = 10 J/s = 36 kJ/h
nC3H8 = 5, thời gian đèn sáng là x giờ. Bảo toàn năng lượng: 2500.5.80% = 36x → x = 278 giờ.




