

Preview text:
TRƯỜNG THPT HẢI LĂNG
KỲ THI KHẢO SÁT CHẤT LƯỢNG LẦN 2 ĐỀ CHÍNH THỨC NĂM HỌC 2024-2025
(Đề thi có 06 trang)
BÀI KHẢO SÁT MÔN: HÓA HỌC
Thời gian: 50 phút (Không kể thời gian phát đề)
Họ và tên thí sinh: ………………………………………………………; SBD:……………… Mã đề: 0001
Cho nguyên tử khối của một số nguyên tố: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31;
S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
Giả thiết các khí sinh ra không tan trong nước.
PHẦN I. Câu hỏi trắc nghiệm nhiều phương án lựa chọn: Thí sinh trả lời từ câu 1 đến câu 18. Mỗi
câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Công thức phân tử của dimethylamine là A. C2H6N2. B. C2H8N2. C. C4H11N. D. C2H7N.
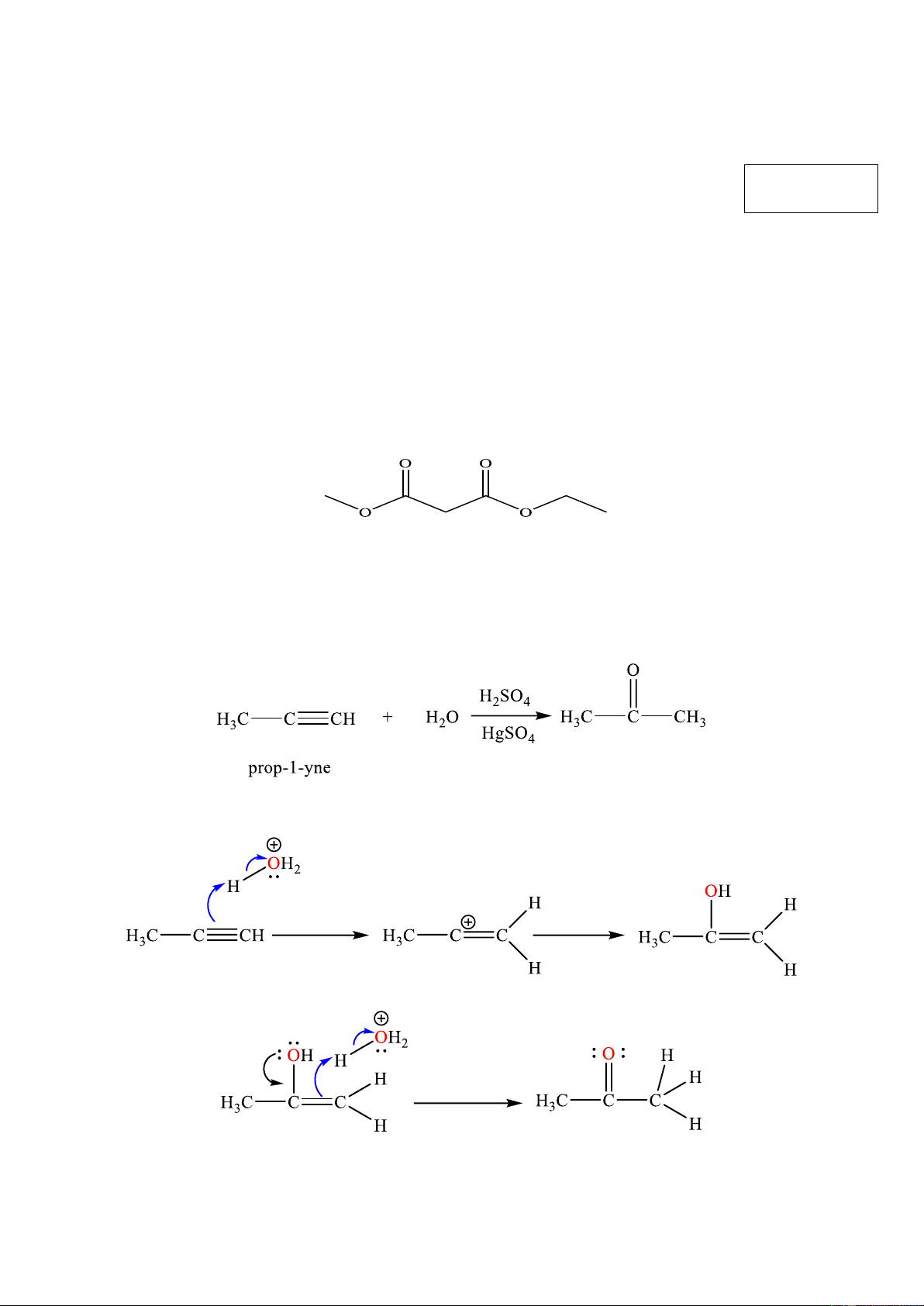
Câu 2: Cho sơ đồ chuyển hóa sau: X (l) +2NaOH(aq)
CH₂(COONa)2(aq) + CH3OH(aq) + C2H5OH(aq)
Nhận xét nào sau đây sai về chất (X)?
A. Công thức cấu tạo của (X) là:
B. (X) là ester no có hai nhóm chức có công thức phân tử C6H10O4
C. Tên của X là ethyl methyl malonate.
D. (X) có nhiệt độ sôi cao vì có liên kết hydrogen giữa các phân tử.
Câu 3: Thành phần chính của phân urea là hợp chất nào sau đây? A. (NH2)2CO. B. NH3. C. (NH4)2SO4. D. (NH4)2HPO4.
Câu 4: Phương trình hoá học cộng nước theo tỷ lệ 1: 1 của prop-1-yne có xúc tác là
Phản ứng trên diễn ra theo 2 giai đoạn được mô tả như sau: Giai đoạn 1. Giai đoạn 2.
Nhận định nào sau đây đúng?
A. Giai đoạn 2 là giai đoạn chuyển liên kết C=C thành liên kết C=O.
B. Trong giai đoạn (1) sẽ hình thành liên kết π giữa C và O.
C. Trong giai đoạn (1) sẽ bẻ gãy 2 liên kết π trong phân tử propyne. Trang 1/7 - Mã đề 0001
D. Trong giai đoạn (2) có sự hình thành liên kết σ giữa C với oxygen và hydrogen.
Câu 5: Cho biết số thứ tự của Mg trong bảng tuần hoàn là 12. Vị trí của Mg trong bảng tuần hoàn là
A. chu kì 3, nhóm IIA.
B. chu kì 3, nhóm IIIA.
C. chu kì 3, nhóm IIIB.
D. chu kì 2, nhóm IIB.
Câu 6: Leucine là một amino acid thiết yếu (tức là cơ thể người không tổng hợp được mà phải lấy từ thức
ăn). Leucine là loại amino acid duy nhất có khả năng điều hòa sự tổng hợp protein của cơ, là amino acid
quan trọng nhất trong việc rèn luyện cơ bắp, leucine còn được biết đến là thành phần cơ bản trong các thực
phẩm bổ xung chế độ ăn kiêng. Leucine có CTCT như sau: (CH3)2CHCH2CH(NH2)COOH
Chọn phát biểu sai về Leucine trong các phát biểu sau?
A. Leucine có CTPT C6H13O2N.
B. Leucine là một loại amino acid mà cơ thể người không tự tổng hợp được, đóng vai trò quan trọng trong
việc phát triển cơ bắp ở người.
C. Ở pH = 3, Leucine tồn tại ở dạng anion và sẽ di chuyển về cực dương trong điện trường.
D. Leucine là một loại amino acid.
Câu 7: Xà phòng hóa ester X có công thức phân tử C4H8O2 bằng dung dịch NaOH dư thu được muối Y và
alcohol Z (bậc II). Công thức cấu tạo thu gọn của X là A. CH3CH2COOCH3. B. HCOOCH2CH2CH3.
C. CH3COOC2H5. D. HCOOCH(CH3)2. 1
Câu 8: Cho phương trình nhiệt hóa học: CO (g) + O2(g) CO2(g) o H 283, 0 kJ 2 r 298
Biết nhiệt tạo thành chuẩn của CO 2(g) là o H
393,5 kJ / mol . Nhiệt tạo thành chuẩn của CO f 298 (g) là A. +110,5 kJ/mol. B. -141,5 kJ/mol. C. -221,0 kJ/mol. D. -110,5 kJ/mol.
Câu 9: Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:
Cặp oxi hóa – khử + 2H /H 2+ Cu /Cu 2 2+ Fe /Fe + Ag /Ag
Thế điện cực chuẩn (V) 0,00 +0,34 -0,44 +0,799
Khi điện phân dung dịch chứa đồng thời bốn loại cation ở trên với nồng độ mol bằng nhau, cation đầu tiên bị
điện phân đầu tiên ở cathode là A. Cu2+. B. Fe2+. C. Ag+. D. H+.
Câu 10: Kí hiệu cặp oxi hoá - khử ứng với quá trình khử: Fe3+ + le → Fe2+ là A. Fe3+/Fe2+. B. Fe2+/Fe3+. C. Fe2+/Fe. D. Fe3+/Fe.
Câu 11: Poly(methyl methacrylate) cho ánh sáng truyền qua trên 90%, được sử dụng làm thuỷ tinh hữu cơ.
Thực hiện phản ứng trùng hợp monomer nào sau đây thu được poly(methyl methacrylate)?
A. CH2=CHCOOCH3. B. CH2=C(CH3)COOCH3. C. CH2=CHCl. D. CH2=CHC6H5.
Câu 12: Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện? A. Al. B. Fe. C. Na. D. Mg.
Câu 13: Nước cứng gây nhiều trở ngại cho đời sống thường ngày. Các nguồn nước ngầm hoặc nước ở các
ao hồ, sông suối thường có độ cứng cao bởi quá trình hòa tan các ion Ca2+, Mg2+ có trong thành phần của
lớp trầm tích đá vôi. Cho các phát biểu sau:
(a) Nước tự nhiên có chứa ion Ca2+, Mg2+, Cl-, SO 2-
4 gọi là nước có tính cứng toàn phần.
(b) Nước không chứa hoặc chứa ít các ion Ca2+ và Mg2+ được gọi là nước mềm.
(c) Có thể dùng Na3PO4 để làm mềm nước có tính cứng vĩnh cửu.
(d) Phương pháp trao đổi ion có thể làm mềm tất cả các loại nước cứng. Số phát biểu đúng là A. 3. B. 2. C. 1. D. 4.
Câu 14: Công thức nào sau đây không phải là chất béo? A. (C17H33COO)3C3H5. B. (C17H35COO)3C3H5. C. (C15H31COO)3C3H5.
D. (CH3COO)3C3H5. Trang 2/7 - Mã đề 0001
Câu 15: Cho các dung dịch: (1) mật ong, (2) nước mía, (3) nước ép quả nho chín, (4) nước ép củ cải đường.
Số dung dịch có khả năng hòa tan Cu(OH)2 là A. 1. B. 4. C. 2. D. 3.
Câu 16: Biết độ tan trong nước của monosodium glutamate (mì chính hay bột ngọt) ở 60 oC là 112 g/100 g
nước; ở 25 oC là 74 g/ 100 g nước. Có bao nhiêu gam monosodium glutamate kết tinh khi làm nguội 2000 g
dung dịch monosodium glutamate bão hoà ở 60 oC xuống 25 oC? (giả thiết lượng nước bay hơi không đáng kể) A. 38 gam. B. 179,24 gam. C. 358,49 gam. D. 145,67 gam.
Câu 17: Sodium chloride là hợp chất có sẵn trong tự nhiên và có nhiều ứng dụng quan trong trong cuộc
sống như làm gia vị thức ăn và trong công nghiệp như sản xuất sodium hydoxyde, chlorine,. Công thức của sodium chloride là A. NaOH. B. NaClO. C. NaCl. D. KCl.
Câu 18: Thực tế, một số biện pháp để hạn chế sự ăn mòn điện hóa tác động đến các vật dụng bằng kim loại như sau:
(a) Máy bay hết hạn sử dụng được bảo quản ở sa mạc.
(b) Quét sơn kín bề mặt hàng rào bằng thép.
(c) Hàn khối kẽm lên mặt ngoài của vỏ tàu biển (phần chìm dưới nước).
(d) Rửa sạch và lau khô dao bằng thép sau khi thái, cắt hoa quả.
(e) Tráng kẽm lên vật liệu thép để sản xuất tấm tôn lợp nhà.
Trong số các biện pháp trên, những trường hợp nào có mục đích hạn chế (hoặc ngăn cản) sự tiếp xúc của
kim loại với dung dịch điện ly?
A. (a), (b), (d) và (e). B. (b) và (e).
C. (b), (c), (d) và (e).
D. (b), (c) và (d).
PHẦN II. Câu hỏi trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở
mỗi câu thí sinh chọn đúng hoặc sai.
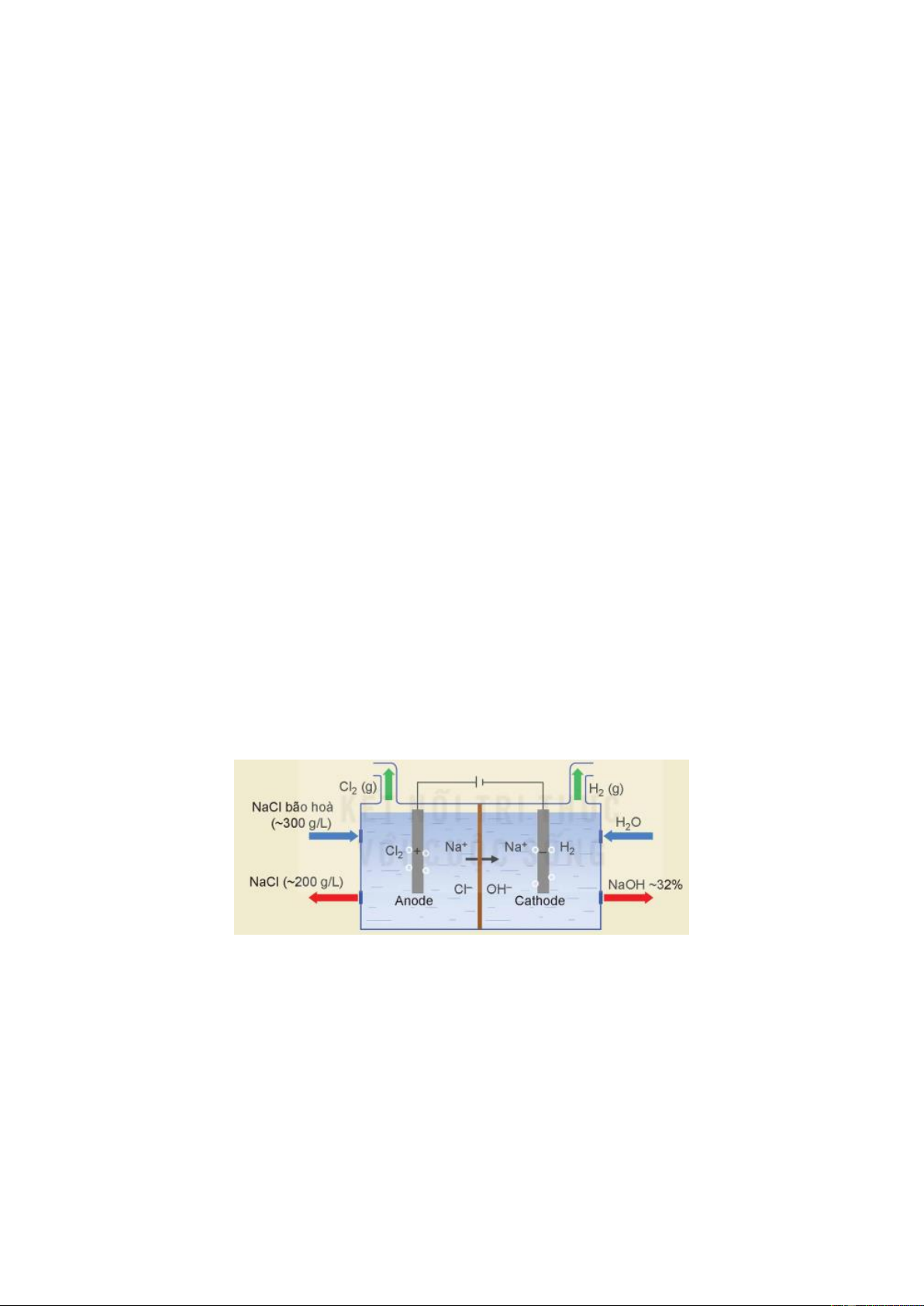
Câu 1. Trong công nghiệp, quá trình điện phân dung dịch NaCl thường được tiến hành trong thùng điện
phân có anode bằng than chì và cathode bằng Iron (giữa hai điện cực có màng ngăn xốp) dùng để sản xuất
NaOH, khí Cl2. Sơ đồ quá trình điện phân dung dịch NaCl trong công nghiệp như hình vẽ sau:
Dung dịch NaCl bão hòa có nồng độ 300 g L-1 bơm vào chỉ được điện phân một phần thành dung dịch NaCl
có nồng độ 200 g L-1, dung dịch này sau đó được dẫn ra khỏi thùng điện phân, trong khi nước muối mới
được bơm vào. Việc làm này giúp hạn chế sự tạo thành sản phẩm không mong muốn. Dung dịch NaOH thu
được ở cathode có nồng độ 32% được chuyển sang thiết bị cô đặc để sản xuất dung dịch NaOH có nồng độ theo ý muốn.
a) Khí Cl2 thoát ra ở anode, khí H2 thoát ra ở cathode.
b) Màng ngăn xốp có tác dụng ngăn không cho khí Cl2 chuyển sang cathode phản ứng với OH-.
c) Tại cathode xảy ra sự oxi hóa H2O thành khí H2 và OH-, tại anode xảy ra sự khử ion Cl- thành khí Cl2.
d) Giả sử NaOH không bị thất thoát trong quá trình cô đặc, thể tích dung dịch NaCl không thay đổi trong
quá trình điện phân. Để sản xuất được một thùng 20 lít dung dịch NaOH 45% thương phẩm có khối lượng Trang 3/7 - Mã đề 0001
riêng 1,48 g mL-1, cần ít nhất 194,8 lít ( làm tròn đến hàng phần mười) dung dịch NaCl bão hòa nồng độ 300
g L-1 bơm vào thùng điện phân.
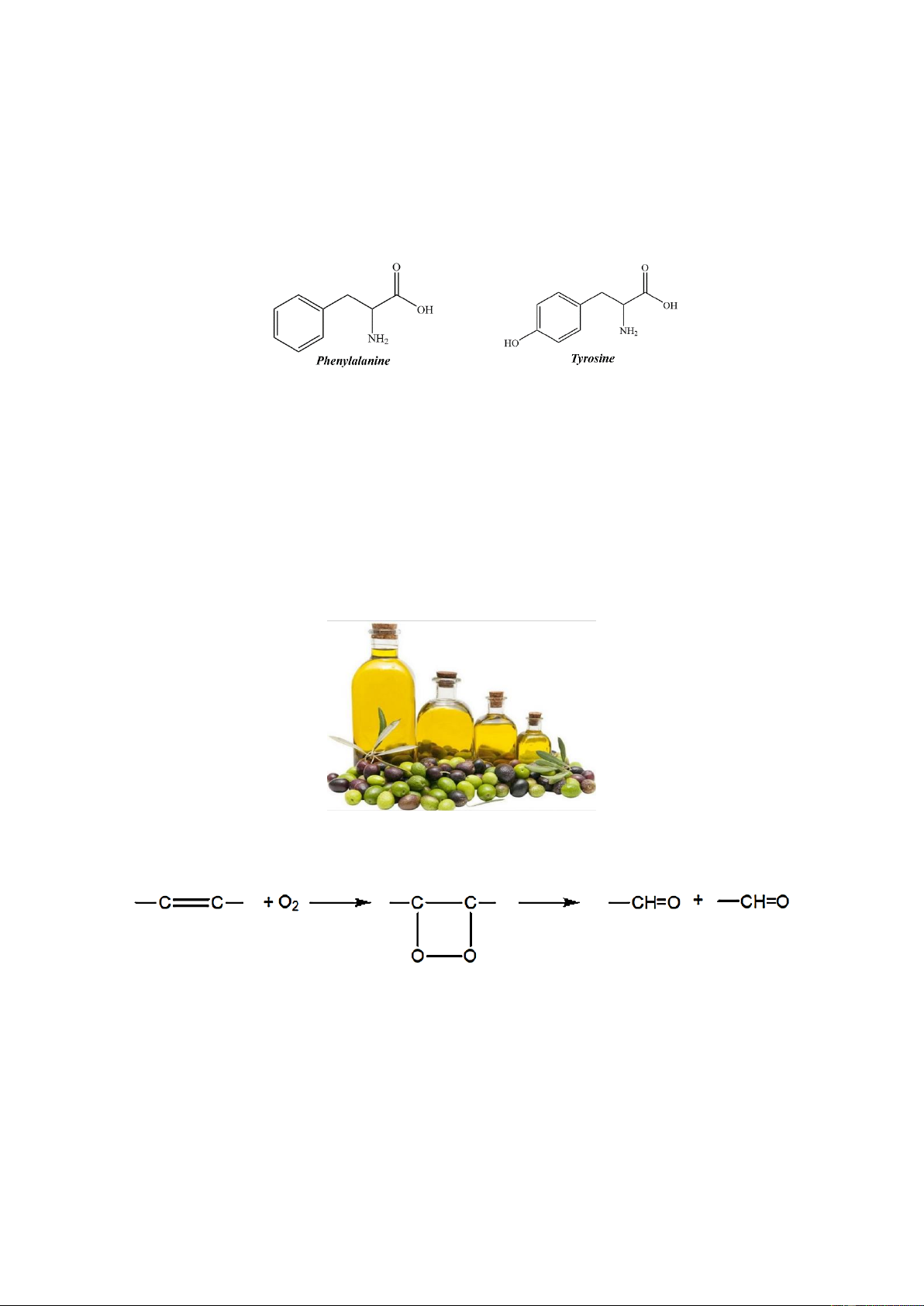
Câu 2. Tyrosine là một trong 20 amino acid tiêu chuẩn được sử dụng bởi các tế bào để tổng hợp protein.
Đây là một amino acid không thiết yếu. Trong cơ thể người, tyrosine được chuyển hóa từ Phenylalanine.
Phenylalanine là một amino acid thiết yếu, phenylalanine được tìm thấy trong sữa của động vật có vú. Nó
được cho thêm vào thức ăn, đồ uống và thực phẩm bổ sung do nó có tính giảm đau và chống trầm cảm. Nó
là tiền chất của chất điều biến thần kinh (neuromodulator) phenylethylamin, một chất thường được cho vào
thực phẩm bổ sung. Công thức cấu tạo của Phenylalanine và tyrosine như hình dưới
a) Phenylalanine và tyrosine đều tác dụng tối đa với dung dịch HCl theo tỉ lệ mol 1:1.
b) Phenylalanine và tyrosine là đồng đẳng của nhau.
c) Tyrosine có khả năng tạo kết tủa với dung dịch bromine.
d) Khi tác dụng với lượng dư dung dịch KOH, tyrosine tạo ra muối có công thức C9H10O3NK.
Câu 3. Chất béo là triester của glycerol và acid béo. Ở điều kiện thường, chất béo no ở trạng thái rắn còn
chất béo không no ở trạng thái lỏng. Mặc dù các từ “dầu”, “mỡ” và “lipid” đều dùng để chỉ chất béo, “dầu”
thường được dùng để chỉ chất béo ở dạng lỏng (chứa nhiều chất béo không no) trong điều kiện phòng bình
thường, trong khi “mỡ” là chỉ chất béo ở dạng rắn (chứa nhiều chất béo no) trong điều kiện phòng bình
thường. “Lipid” được dùng để chỉ cả chất béo ở thể lỏng và rắn, cùng với những chất liên quan khác, thường
dùng trong ngữ cảnh y học hoặc hóa sinh.
Dầu mỡ để lâu ngày sẽ có mùi khó chịu, đó là sự ôi mỡ. Có nhiều nguyên nhân gây ôi mỡ, nhưng chủ yếu
nhất là do oxi không khí cộng vào nối đôi ở gốc acid không no tạo ra peoxit, chất này bị phân hủy thành các
aldehyde có mùi khó chịu. Có thể biểu diễn bằng sơ đồ sau:
a) Bơ thực vật là một thuật ngữ chỉ chung về các loại bơ có nguồn gốc từ thực vật và là loại bơ được
chế biến từ dầu thực vật. Phương pháp chế biến bơ từ dầu thực vật là hydrogen hóa acid béo
b) Khi cho chất béo vào nước, khuấy mạnh rồi dùng máy đo pH để thử thì thấy giá trị pH nhỏ hơn 7. Vì
khi khuấy mạnh, phân tử chất béo bị bẻ gãy, sinh ra acid béo.
c) Dầu thực vật dễ bị ôi hơn dầu động vật
d) Ống dẫn nước thải từ các chậu rửa bát thường rất hay bị tắc do dầu mỡ nấu ăn dư thừa làm tắc.
Người ta thường đổ xút rắn hoặc dung dịch xút đặc vào và 1 thời gian sẽ hết tắc. Câu 4. Cation 2
Cu có cấu hình electron 9
[Ar]3 d có thể tạo phức được với nhiều phối tử bằng liên kết cho-
nhận giữa phối tử với các orbital trống của cation 2
Cu . Một thí nghiệm về sự tạo thành hợp chất phức được thực hiện như sau: Trang 4/7 - Mã đề 0001
(1) Hoà tan một lượng muối CuSO khan màu trắng vào nước, thu được dung dịch X có màu xanh 4
(2) Thêm tiếp dung dịch NH vào dung dịch X, thu được kết tủa màu xanh nhạt 3
(3) Tiếp tục thêm dung dịch NH đặc đến dư vào đến khi kết tủa bị hoà tan, thu được dung dịch Y có 3 màu xanh lam.
Chuỗi thí nghiệm trên được biểu diễn qua sơ đồ sau:
CuSO4(s) [Cu(OH2)6]2+(aq) [Cu(OH)2(OH2)4](s) [Cu(NH3)4(OH2)2]2+(aq).
(màu trắng) (màu xanh) (màu xanh nhạt) (màu xanh lam)
a) Màu sắc của phức chất phụ thuộc vào bản chất của nguyên tử trung tâm và phối tử.
b) Phức chất Cu OH 2 2 6
có dạng hình học là tứ diện.
c) Hai phức chất Cu NH OH 2 Cu OH 3 2 4 2 và 2 2 6 có cùng số phối tử.
d) Khi xảy ra phản ứng giữa dung dịch ammonia dư với phức kết tủa màu xanh nhạt tạo dung dịch đồng
nhất màu xanh lam, có sự thay thế 4 phối tử nước trong phức kết tủa bằng 4 phối tử ammonia.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Cho dãy các chất: phenyl acetate, allyl acetate, methyl acetate, ethyl formate, tripalmitin. Số chất
trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra alcohol là bao nhiêu?
Câu 2. Số nguyên tử oxygen có trong peptide Gly-Ala-Val-Glu-Ala là bao nhiêu?
Câu 3. Glucose là một loại monosaccarit với công thức phân tử C6H12O6 được tạo ra bởi thực vật và hầu hết
các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Dung dịch
glucose 5% (D = 1,1 g/mL) là dung dịch đường tiêm tĩnh mạch, là loại thuốc thiết yếu, quan trọng của Tổ
chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản.
Phương trình nhiệt hóa học của phản ứng oxi hóa glucose:
C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(l) rH0298 = -2803 kJ.
Tính năng lượng tối đa (kJ) thu được từ glucose khi một người bệnh được truyền dịch trong 2 ngày, mỗi
ngày 1 chai 250mL dung dịch glucose 5%. (Kết quả được lấy đến hàng đơn vị).
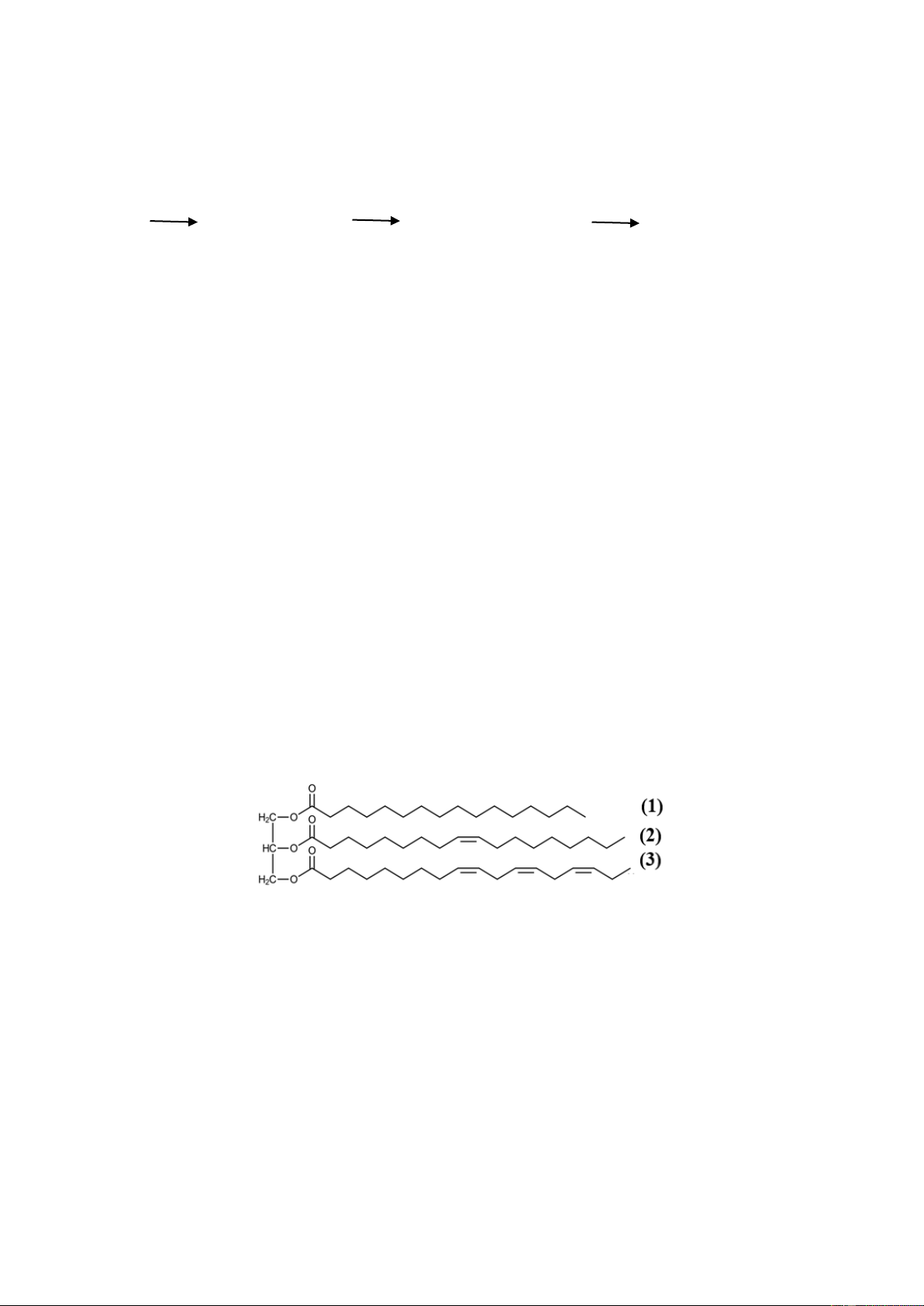
Câu 4. Triglyceride là thành phần đóng một vai trò là nguồn cung cấp năng lượng và chuyên chở các chất
béo trong quá trình trao đổi chất. Cho triglyceride X có công thức cấu tạo như hình sau:
Thực hiện phản ứng hydrogen hóa hoàn toàn 427 kg triglyceride X bằng lượng dư H2 (điều kiện áp suất
cao, xúc tác, t0 có đủ) thu được a kg triglyceride Y . Giá trị của a là bao nhiêu? ( giả sử hiệu suất phản ứng là 100%)
Câu 5. Pin kẽm-mangan Zn MnO là loại pin phổ biến trong các thiết bị điện từ do giá thành thấp và an 2
toàn. Tuy nhiên, loại pin này thường có tuổi thọ ngắn do phản ứng phụ làm giảm hiệu suất hoạt động. Một
nhóm học sinh nghiên cứu ảnh hưởng của nồng độ KOH đến hiệu suất và tuổi thọ của pin Zn MnO . Thí 2
nghiệm được tiến hành như sau:
Bước 1: Pha các dung dịch KOH với nồng độ 2M,6M,10M .
Bước 2: Lắp ráp pin Zn MnO 2
- Điện cực cực âm (anode): Dùng tấm kẽm (Zn).
- Điện cực cực dương (cathode): Dùng MnO trộn với than hoạt tính và chất kết dính để tạo thành điện cực. 2 Trang 5/7 - Mã đề 0001
- Nhúng điện cực vào dung dịch KOH tương ứng. Bước 3:
- Đo dung lượng ban đầu, ghi nhận các giá trị vào bảng số liệu.
- Sử dụng máy đo dung lượng pin để tiến hành sạc-xả 50 chu kỳ. Ghi lại dung lượng sau mỗi 10 chu kỳ.
- So sánh dung lượng ban đầu và dung lượng sau 50 chu kỳ.
- Xác định hiệu suất Coulombic (%) của từng mẫu.
- Kiểm tra sự suy giảm hiệu suất do ăn mòn kẽm hoặc hòa tan MnO2. Nồng độ
Dung lượng ban Dung lượng sau 50 Hiệu suất KOH (M) đầu (mAh / g) chu kỳ (mAh / g) Coulombic (%) 2 M 180 120 85% 6 M 210 170 92% 10 M 190 100 80%
1) Giả thuyết phù hợp với mục đích và quá trình tiến hành thí nghiệm trên là "nếu sử dụng chất điện ly
kiềm (KOH) có nồng đọ tối ưu, thì hiệu suất và tuổi thọ của pin Zn MnO sẽ được cải thiện". 2
2) Khi nồng độ KOH quá cao thúc đẩy quá trình tiêu thụ zinc, làm giảm tuổi thọ của pin.
3) Cực âm xảy ra quá trình khử kẽm và cực dương xảy ra quá trình oxi hóa MnO . 2
4) Trong thí nghiệm, pin với KOH 6M có hiệu suất cao nhất, dung lượng duy trì tốt sau 50 chu kỳ.
Hãy sắp xếp các ý kiến đúng từ nhỏ đến lớn.
Câu 6. Tất cả các huy chương Olympics London 2012 đều có đường kính 85 mm và độ dày 7 mm. Các huy
chương Đồng được làm bằng hợp kim chứa copper. Tiến hành quy trình phân tích định lượng sau để xác
định thành phần hợp kim: Hòa tan 0,800 g mẫu huy chương Đồng vào dung dịch nitric acid đậm đặc, nóng.
Sau khi làm nguội và pha loãng, thêm một lượng dư dung dịch potassium iodide vào rồi tiếp tục pha loãng
dung dịch đến 250,0 cm³. Biết 25,00 cm³ mẫu dung dịch này phản ứng vừa đủ với 12,20 cm³ dung dịch sodium thiosulfate 0.100 Μ.
Cho các phản ứng xảy ra theo sơ đồ sau:
Cu2+(aq) + I-(aq) → CuI (s) + I2 (aq) I 2- 2- 2 (aq) + S2O3 (aq) → I- (aq) + S4O6 (aq)
Tính hàm lượng đồng trong chiếc huy chương đồng? ( (Kết quả được lấy đến hàng phần mười).
------------------- Hết -------------------
Thí sinh không được sử dụng tài liệu. Cán bộ coi thi không giải thích gì thêm!
Chữ kí giám thị số 1:…………………………………………………….
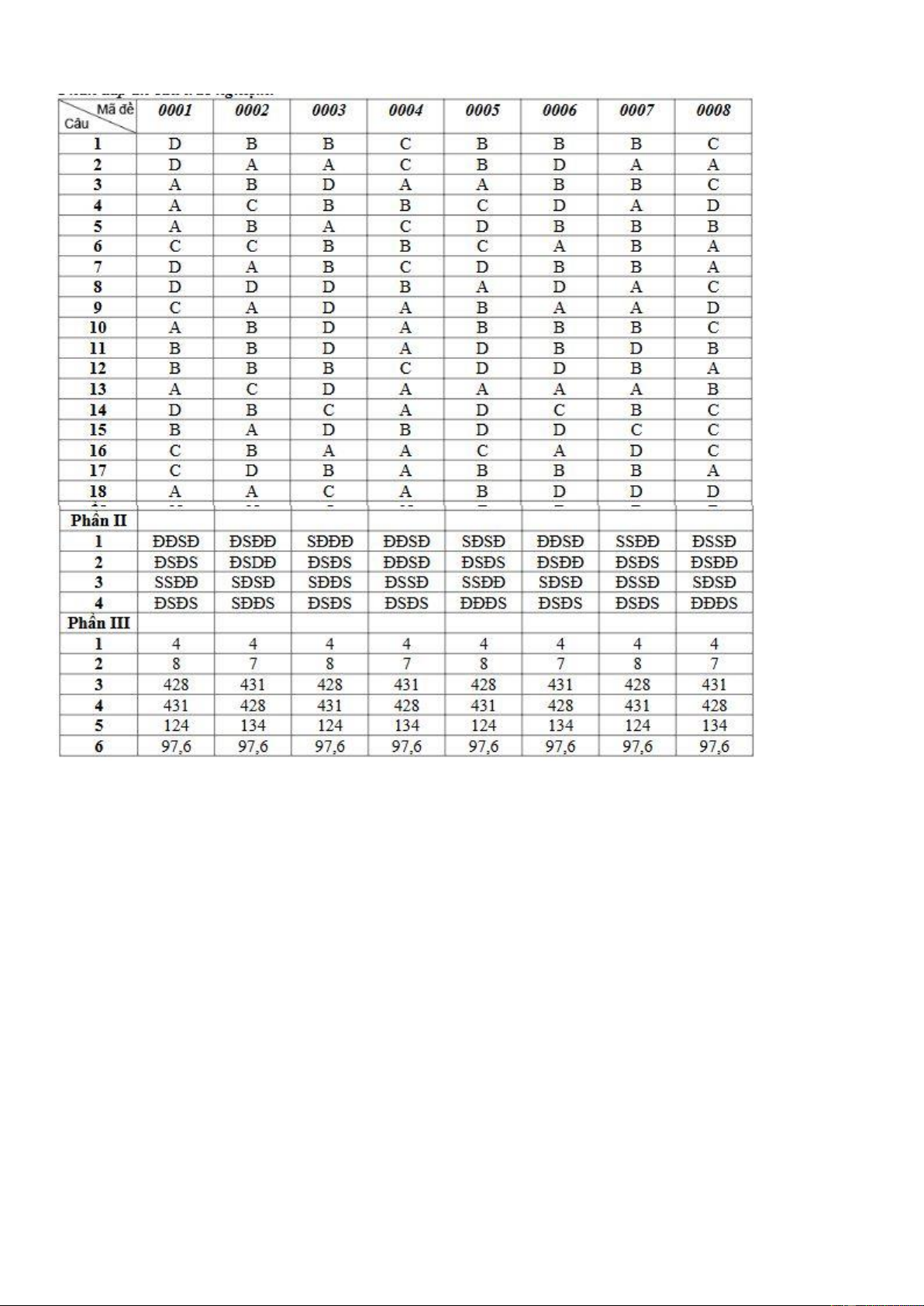
Chữ kí giám thị số 2: ………………………………………………….. Trang 6/7 - Mã đề 0001 ĐÁP ÁN ĐỀ THI Trang 7/7 - Mã đề 0001
Document Outline
- Câu 15: Cho các dung dịch: (1) mật ong, (2) nước mía, (3) nước ép quả nho chín, (4) nước ép củ cải đường. Số dung dịch có khả năng hòa tan Cu(OH)2 là




