







Preview text:
SỞ GD&ĐT HÀ TĨNH
KỲ THI THỬ TỐT NGHIỆP THPT NĂM 2025 ĐỀ CHÍNH THỨC MÔN: HÓA HỌC
(Đề thi gồm 04 trang)
Thời gian làm bài:50 phút, không kể thời gian phát đề
Họ và tên: ………………………………………………………….. Mã đề
Số báo danh: ……………………………………………………….. 0401
Cho biết: 9F = 19; 12Mg = 24; 17Cl = 35,5; 20Ca = 40; H = 1; O = 16; C = 12; N = 14; Na = 23; Fe = 56.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Cation X2+ và Y- lần lượt có cấu hình e ở phân lớp ngoài cùng là 2p6 và 3p6. Hợp chất được tạo ra
giữa X và Y có công thức là A. MgCl2. B. CaCl2. C. CaF2. D. MgF2.
Câu 2. Người mắc bệnh tiểu đường nên ưu tiên ăn nhiều loại thực phẩm nào sau đây?
A. Các loại trái cây chín như nho, chuối,...
B. Thực phẩm chứa nhiều đường như kẹo, nước ngọt, nước mía,...
C. Rau xanh, ngũ cốc nguyên hạt và thực phẩm giàu chất xơ.
D. Thực phẩm giàu tinh bột như cơm trắng, bánh mì,...
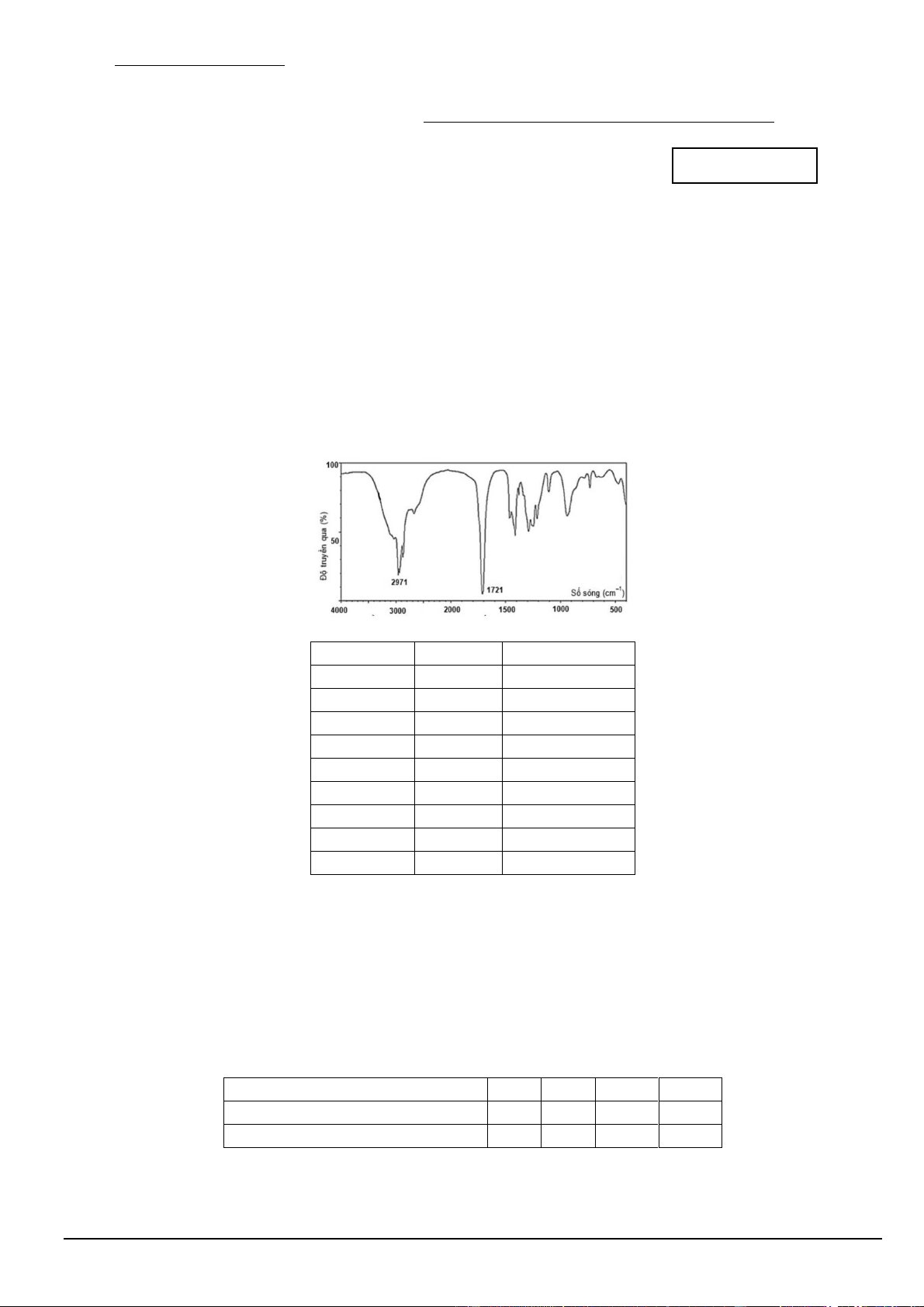
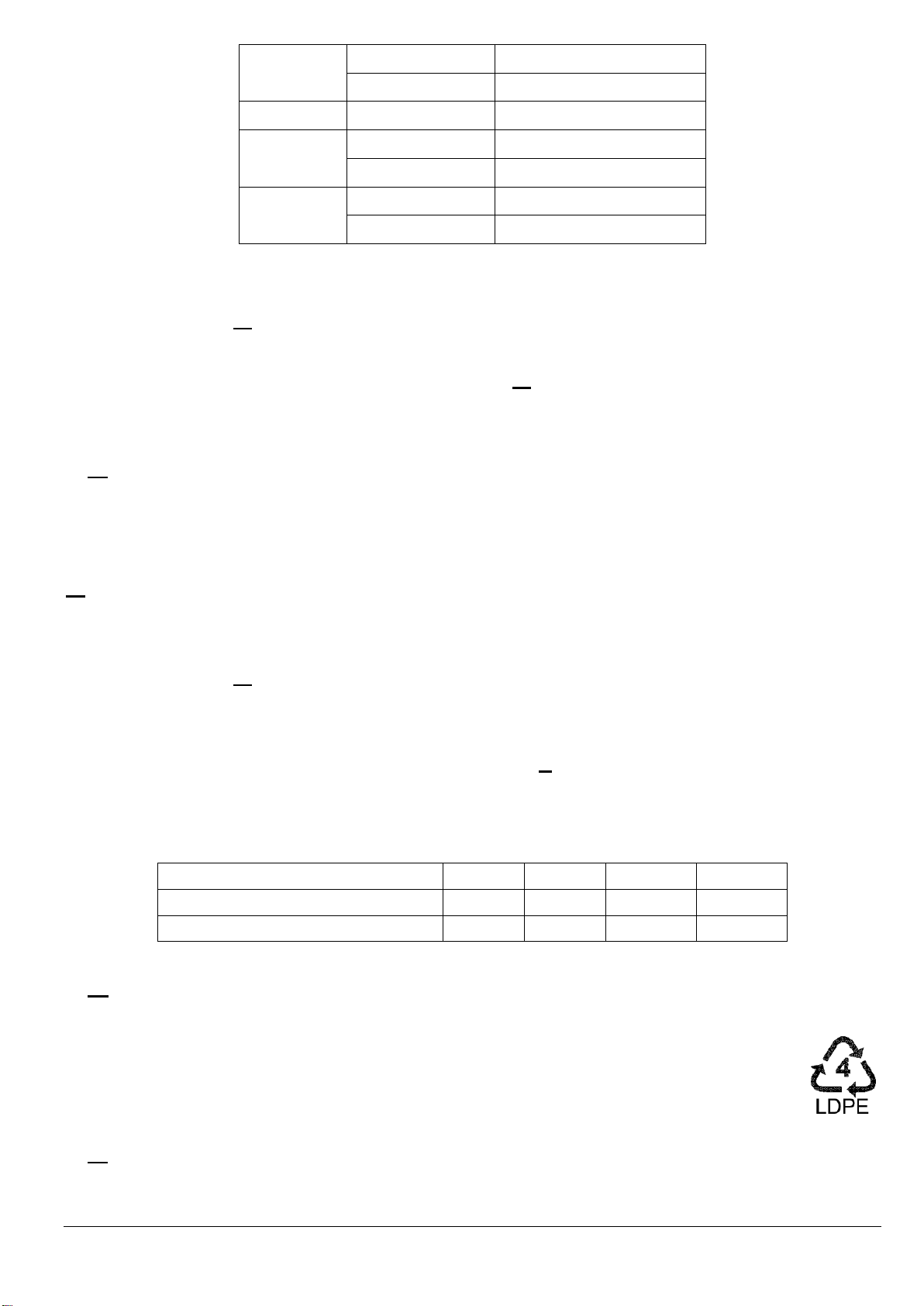
Câu 3. Cho sơ đồ phổ khối IR của chất X như sau:
Cho biết số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức cơ bản như sau:
Hợp chất Liên kết Số sóng (cm-1) Alcohol O – H 3650 – 3200 Amine N – H 3500 – 3200 Aldehyde C – H 2850 – 2700 C = O 1740 – 1670 Ketone C = O 1740 – 1670 Carboxylic C = O 1750 – 1680 O – H 3000 – 2500 Ester C = O 1750 – 1715 C – O 1300 – 1000
Nhóm chức có mặt trong X là A. carboxylic. B. aldehyde. C. ester. D. alcohol.
Câu 4. Kim loại nào dưới đây dẻo nhất (có thể được dùng để dát lên các công trình kiến trúc cổ)? A. Cu. B. Ag. C. Al. D. Au.
Câu 5. Diêm tiêu kali được dùng để chế tạo thuốc nổ đen (làm mìn phá đá), làm phân bón (cung cấp nguyên
tố N và K cho cây trồng) có công thức hóa học là A. K2SO4. B. KNO3. C. K2CO3. D. KCl.
Câu 6. Cho X, Y, Z, T là các chất khác nhau trong số bốn chất: methylamine, ammonia, phenol và aniline có
các tính chất được ghi trong bảng sau: Chất X Y Z T Nhiệt độ sôi (oC) 182 184 -6,7 -33,4
pH (dung dịch nồng độ 0,001M) 6,48 7,82 10,81 10,12
Nhận xét nào sau đây đúng?
A. Chất Y là phenol.
B. Chất X là ammonia.
C. Chất T là aniline.
D. Chất Z là methylamine.
Câu 7. Dầu ăn và mỡ động vật có thể được sử dụng để sản xuất sản phẩm nào sau đây? Trang 1/16 A. Xi măng B. Thủy tinh C. Xà phòng
D. Chất giặt rửa tổng hợp
Câu 8. Dãy gồm các kim loại có thể điều chế được bằng phương pháp nhiệt luyện là: A. Al, Na, Ba. B. Ca, Ni, Zn. C. Mg, Fe, Cu. D. Fe, Cu, Zn.
Câu 9. Pin quả chanh được thiết lập gồm một dây Cu và dây Zn ghim vào một quả chanh và nối với bóng
điện như hình sau. Bóng điện sáng đồng nghĩa với sự xuất hiện dòng điện. Bán phản ứng nào sau đây xảy ra ở cực dương?
A. Cu(s) → Cu²+(aq) + 2e.
B. Zn(s) → Zn2+(aq) + 2e.
C. 2H+(aq) + 2e → H2(g).
D. Cu2+(aq) + 2e → Cu(s).
Câu 10. Sử dụng phân bón nào sau đây làm tăng độ chua của đất? A. KCl. B. K2SO4. C. (NH2)2CO. D. NH4Cl.
Câu 11. Benzyl acetate là ester tạo nên mùi thơm của hoa nhài có công thức cấu tạo thu gọn là
A. CH3COOCH2C6H5. B. CH3COOC6H5.
C. CH3COOC6H4CH3. D. C6H5COOCH3.
Câu 12. Cho phản ứng của methane với bromine (ánh sáng, tỉ lệ 1 : 1) có cơ chế như sau: Giai đoạn 1: Giai đoạn 2: Giai đoạn 3:
Phát biểu nào sau đây sai ?
A. Giai đoạn 3 là giai đoạn tạo ra các gốc tự do từ các phân tử.
B. Phản ứng trên diễn ra theo cơ chế thế gốc (SR).
C. Giai đoạn 1 là giai đoạn khơi mào của phản ứng.
D. Sản phẩm CH3Br chủ yếu được sinh ra ở giai đoạn 2.
Câu 13. Ngày 04 tháng 8 năm 2020 đã xảy ra một vụ nổ kinh hoàng ở nhà kho tại cảng Beirut của Lebanon.
Đây là nhà kho chứa khoảng 2700 tấn NH4NO3, một loại hoá chất vừa được sử dụng làm phân bón, vừa
được dùng làm thuốc nổ do có khả năng phân huỷ thành khí và hơi, kèm theo toả nhiệt mạnh: Cho biết
của NH4NO3(s) và của H2O(g) lần lượt là và .
Nhiệt lượng tối đa giải phóng ra từ vụ nổ khi toàn bộ lượng NH4NO3 bị phân hủy là A. 148.104 kJ. B. 79,92.108 kJ. C. 3996.106 kJ. D. 296.104 kJ.
Câu 14. Dung dịch chất nào sau đây làm quỳ tím hóa xanh? A. Valine. B. Glycine. C. Alanine. D. Lysine.
Câu 15. Khi nấu món canh từ thịt, cua, tôm tép, có nhiều mảng thịt đóng rắn lại. Hiện tượng trên gây ra bởi tính chất nào sau đây?
A. Sự đông tụ protein bởi sự thay đổi pH.
B. Sự thủy phân protein bởi nhiệt độ.
C. Sự đông tụ protein bởi nhiệt độ.
D. Kết tủa carbonate của các chất khoáng có trong vỏ.
Câu 16. LDPE là một chất dẻo dễ tạo màng, có tính dai bền nên được sử dụng làm túi nylon, màng bọc, bao
gói thực phẩm. Trên các bao bì làm từ LDPE thường được in kí kiệu như hình sau. Polymer dùng để sản
xuất LDPE được tổng hợp từ monomer nào sau đây? A. CH2=CHCH3. B. CH2=CH2. C. CH2=CHCl. D. C6H5CH=CH2. Trang 2/16
Câu 17. Dãy gồm các kim loại nào sau đây đều tan được hoàn toàn trong dung dịch hydrochloric acid dư? A. Fe, Cr, Ag. B. Ba, Zn, Au. C. Na, Fe, Cu. D. Zn, Fe, Al.
Câu 18. Phản ứng giải thích sự hình thành thạch nhũ trong các hang động núi đá vôi là A. CaCO3 + 2HCl CaCl2 + CO2 + H2O. B. CaCO3 CaO + CO2. C. CaCO3 + CO2 + H2O Ca(HCO3)2.
D. Ca(HCO3)2 CaCO3 + CO2 + H2O.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
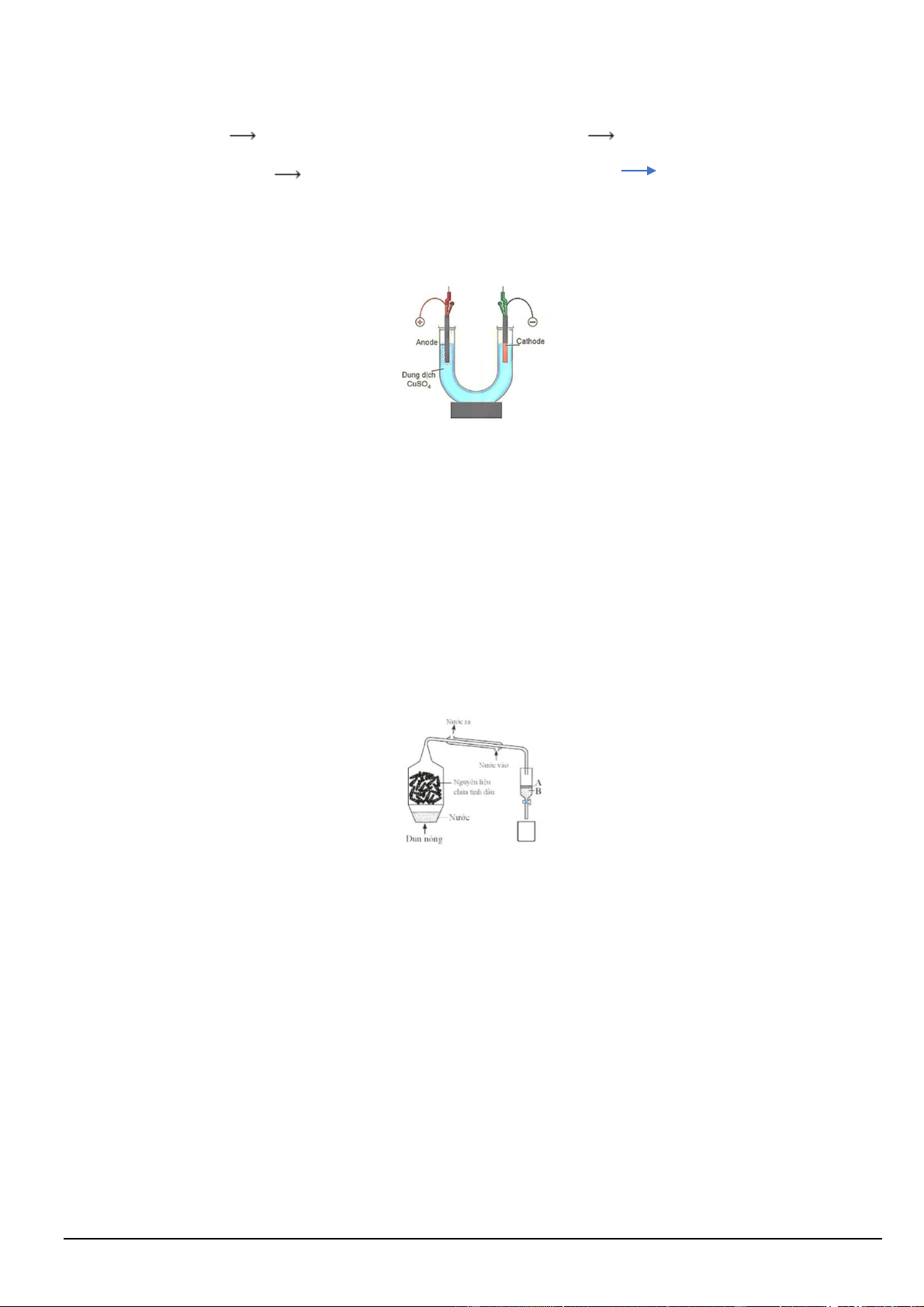
Câu 1. Tiến hành thí nghiệm điện phân dung dịch CuSO4 theo các bước sau:
Bước 1: Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như hình bên dưới:
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ
Bước 2: Rót dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
Bước 3: Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân.
Bước 4: Khi có khí thoát ra ở cả hai điện cực thì dừng điện phân, ngắt nguồn điện.
a) Trong quá trình điện phân, pH dung dịch tăng dần.
b) Ở cathode, ion Cu2+ bị khử tạo thành kim loại Cu.
c) Ở anode, có khí H2 thoát.
d) Sau bước 4, nhúng thanh Mg vào dung dịch sau điện phân thấy có khí không màu thoát ra.
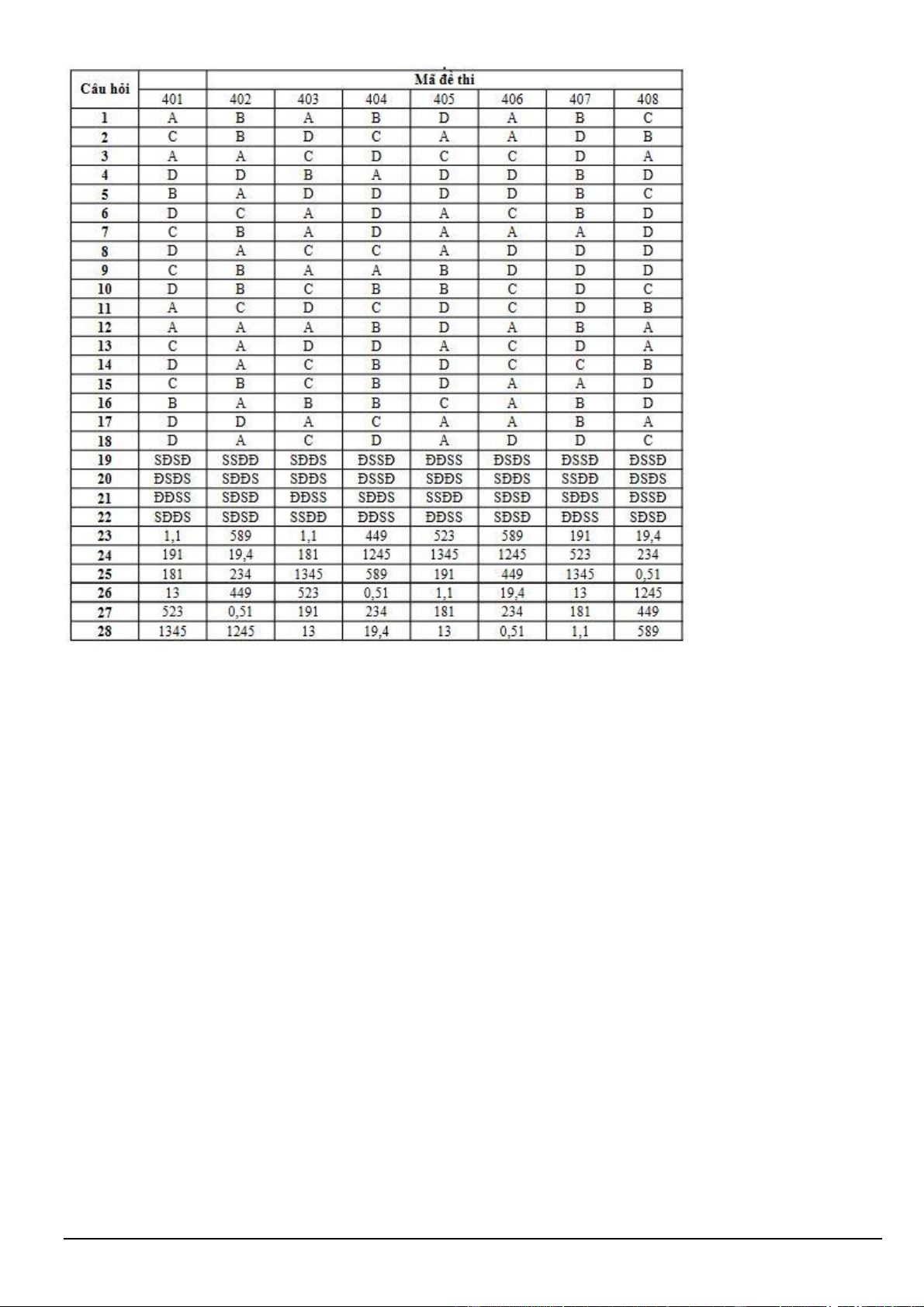
Câu 2. Nhiều chất hữu cơ có nhiệt độ sôi cao và không tan trong nước có thể tách ra khỏi hỗn hợp ở nhiệt độ
sôi xấp xỉ nhiệt độ sôi của nước bằng phương pháp chưng cất lôi cuốn hơi nước. Hình sau mô phỏng thiết bị
dùng để chưng cất tinh dầu bằng phương pháp chưng cất lôi cuốn hơi nước. Biết rằng tinh dầu có khối lượng riêng nhỏ hơn 1 g.mL-1.
a) Quá trình bay hơi của nước sẽ kéo theo các hợp chất hữu cơ cần tách.
b) Để tăng hiệu suất ngưng tụ của ống sinh hàn, có thể đổi chiều nước vào ở trên và ra ở dưới.
c) Có thể dùng phương pháp chiết để tách tinh dầu ra khỏi hỗn hợp sau ngưng tụ.
d) Lớp A là nước, lớp B là tinh dầu cần tách ra.
Câu 3. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho khoảng 5 ml dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL dung dịch HCl 1M vào, lắc đều.
Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
Bước 3: Thêm từ từ NaHCO3 vào ống nghiệm đến khi ngừng sủi bọt khí.
Bước 4: Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng cách cho
0,5 ml dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%), lắc nhẹ.
a) Trong bước 2, đã xảy ra phản ứng thủy phân tinh bột tạo thành glucose.
b) Sau bước 4, thu được dung dịch màu xanh lam.
c) Sau bước 1, thu được dung dịch đồng nhất.
d) Trong bước 3, NaHCO3 được thêm vào để làm tăng tốc độ phản ứng thủy phân ở bước 2. Trang 3/16
Câu 4. Chuẩn độ V1 mL dung dịch chứa muối Fe2+, nồng độ C1 (M) và dung dịch H2SO4 loãng, đựng trong
bình tam giác bằng dung dịch KMnO4 nồng độ C2 (M) để ở burette và để ở vạch 0. Khi vạch thể tích dung
dịch KMnO4 trên burete là V2 mL thì trong bình tam giác xuất hiện màu hồng tồn tại bền trong khoảng 20 giây.
a) Dung dịch H2SO4 được thêm vào để tạo môi trường acid, không tham gia phản ứng.
b) Khi kết thúc chuẩn độ, dung dịch trong bình tam giác có màu hồng tồn tại bền trong khoảng 20 giây là
của lượng rất nhỏ KMnO4 dư.
c) Phản ứng ion chuẩn độ là: MnO –
4 (aq) + 5Fe2+(aq) + 8H+(aq) → Mn2+(aq) + 5Fe3+(aq) + 4H2O(l).
d) Dung dịch muối Fe2+ được cho vào burette khi chuẩn độ.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Lắp ráp pin điện hóa Zn-Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: và
. Sức điện động chuẩn của pin điện hóa trên là bao nhiêu? (Kết
quả được làm tròn đến một chữ số thập phân).
Câu 2. Tại Việt Nam, Quy chuẩn quốc gia về chất lượng nước ăn uống sinh hoạt QCVN 01-1:2018/BYT
quy định hàm lượng sắt không được vượt quá 0,3mg/L. Một mẫu nước nhiễm phèn sắt với lượng iron cao
gấp 44,8 lần ngưỡng cho phép. Giả thiết sắt trong mẫu nước tồn tại ở dạng muối sulfate FeSO4 và Fe2(SO4)3
với tỉ lệ số mol tương ứng là 8:1. Tính khối lượng (theo gam) vôi tôi ít nhất cần dùng để xử lí lượng iron
trong 10m3 mẫu nước trên về giới hạn cho phép. Giả sử vôi tôi chỉ chứa Ca(OH)2 và sắt được tách ra dưới
dạng Fe(OH)3. (Kết quả làm tròn đến hàng đơn vị).
Câu 3. Một loại chất béo có chứa 75% tristearin về khối lượng. Để sản xuất 2 nghìn bánh xà phòng cần dùng
tối thiểu x kg loại chất béo trên cho phản ứng với dung dịch NaOH, đun nóng. Biết rằng trong mỗi bánh xà
phòng có chứa 70 gam sodium stearate. Giá trị của x là bao nhiêu? (Kết quả được làm tròn đến hàng đơn vị)
Câu 4. Cho các nhận định sau:
1. Dịch truyền glucose 5% được dùng để truyền tĩnh mạch cho bệnh nhân suy nhược cơ thể.
2. Ở điều kiện thường, cellulose là chất rắn màu trắng, tan tốt trong nước.
3. Tinh bột và cellulose là những polymer tự nhiên.
4. Amylose là polymer dạng mạch dài, không nhánh, xoắn lại, được tạo thành từ các đơn vị α-glucose liên
kết với nhau bằng liên kết α-1,4-glycoside và liên kết α-1,6-glycoside .
5. Cellulose và tinh bột đều có thể cung cấp năng lượng cho con người vì chúng đều có thể thủy phân tạo glucose.
Các nhận định đúng có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 12; 134; 1345;…).
Câu 5. Một chiếc ô tô chạy bằng xăng RON 95-III có mức tiêu thụ nhiên liệu trung bình là 7 lít/100 km.
Năng lượng tỏa ra khi đốt cháy 1 lít xăng RON 95-III là 33 MJ. Ông An muốn sử dụng ô tô đó để đi quãng
đường 350 km, nhưng thay vì dùng xăng RON 95-III ông lại muốn sử dụng xăng E5. Giá xăng E5 hiện tại là
20430 VNĐ/lít. Xăng E5 là hỗn hợp chứa 5% ethanol và 95% xăng truyền thống theo thể tích. Khối lượng
riêng của ethanol là 0,785 g/mL. Năng lượng tỏa ra khi đốt cháy 1 mol ethanol là 1364 kJ và 1 lít xăng
truyền thống là 32 MJ. Hiệu suất sử dụng năng lượng của xe với các loại nhiên liệu là như nhau. Hỏi ông An
sẽ phải chi trả bao nhiêu nghìn đồng tiền xăng nếu sử dụng xăng E5 cho quãng đường 350 km đó? (Kết quả
được làm tròn đến hàng đơn vị)
Câu 6. Trong các tính chất sau:
1. Có tính chất lưỡng tính;
2. Làm đổi màu quỳ tím ẩm;
3. Tham gia phản ứng ester hóa khi có acid vô cơ mạnh xúc tác;
4. Thuộc loại α-amino acid;
5. Là chất rắn ở điều kiện thường.
Các tính chất của glycine có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 13; 134; 2345; …). ----HẾT--- Trang 4/16
SỞ GD&ĐT HÀ TĨNH
KỲ THI THỬ TỐT NGHIỆP THPT NĂM 2025 ĐỀ CHÍNH THỨC MÔN: HÓA HỌC
(Đề thi gồm 04 trang)
Thời gian làm bài:50 phút, không kể thời gian phát đề
Họ và tên: …………………………………………………………..
Số báo danh: ……………………………………………………….. Mã đề 0402
Cho biết: H = 1; C = 12; N = 14; O = 16; S = 32; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1. Để tẩy dầu mỡ đóng cặn trong dụng cụ, thiết bị và đường ống nhà bếp người ta thường dùng
Na2CO3. Tên thường gọi của Na2CO3 là tên nào sau đây? A. Baking soda. B. Soda. C. Xút ăn da. D. Muối ăn.
Câu 2. Ester có công thức phân tử là C2H4O2 được tạo thành từ methyl alcohol và carboxylic acid nào sau đây? A. Oxalic acid. B. Formic acid. C. Propionic acid. D. Acetic acid.
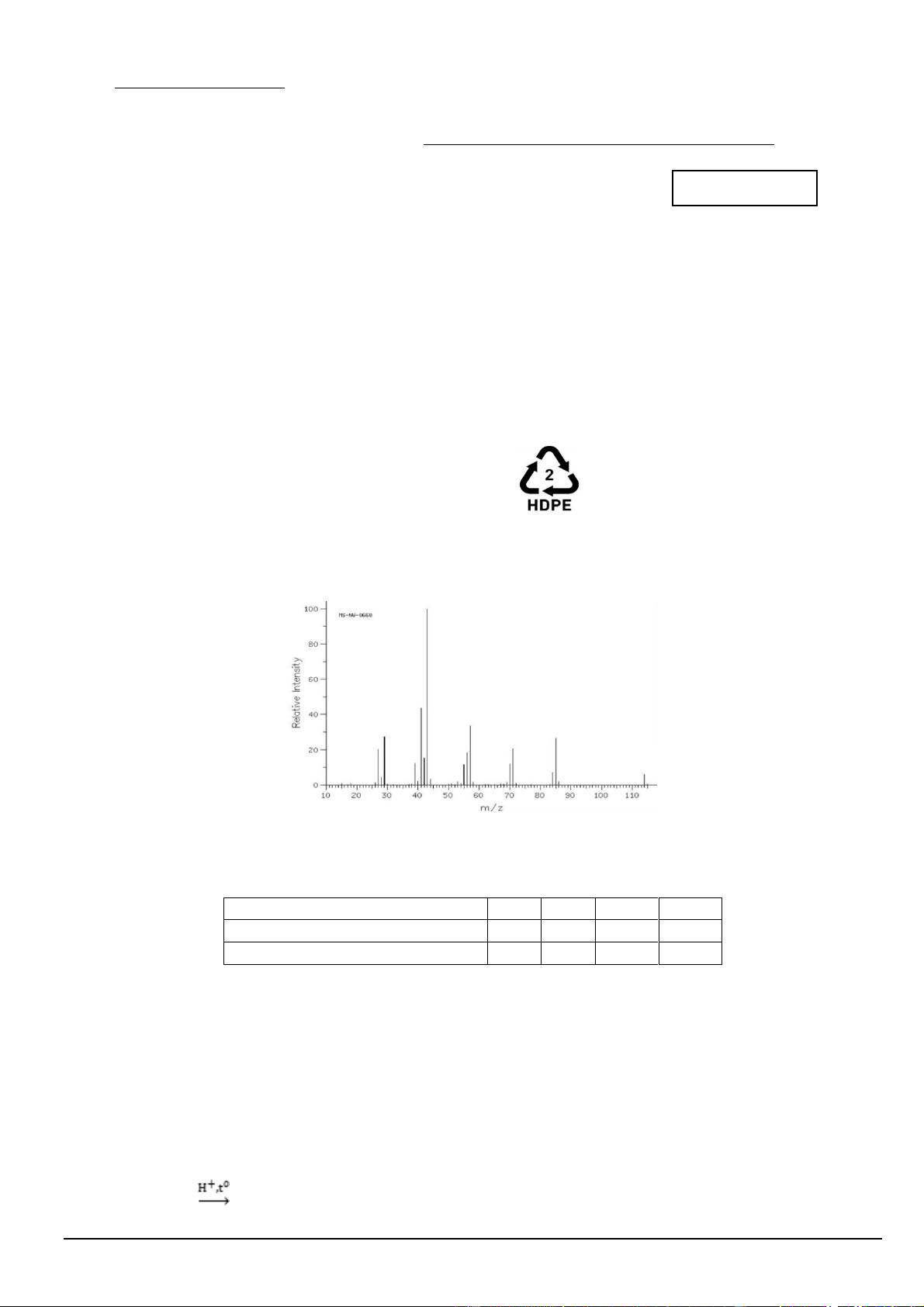
Câu 3. Nhựa HDPE (kí hiệu ở hình bên dưới) là loại nhựa nhiệt dẻo có đặc điểm cứng, chống chịu va đập,
kéo căng tốt hơn so với nhựa thông thường. Đây là nhựa tổng hợp dùng phổ biến nhất trong sản xuất hiện
nay. Nhựa HDPE được sản xuất từ polymer nào sau đây? A. Polyethylene. B. Polystyrene. C. Polypropylene. D. Polyisoprene.
Câu 4. Phân tích thành phần nguyên tố của hợp chất hữu cơ X thu được kết quả %C và %H (theo khối
lượng) lần lượt là 84,21% và 15,79%. Phân tử khối của hợp chất X này được xác định thông qua kết quả phổ
khối lượng như hình bên dưới với peak ion phân tử có giá trị m/z lớn nhất. 114
Công thức phân tử của X là A. C7H14O. B. C4H9. C. C9H6. D. C8H18.
Câu 5. Cho X, Y, Z, T là các chất khác nhau trong số bốn chất: CH3NH2, NH3, C6H5OH (phenol) và
C6H5NH2 (aniline) có các tính chất được ghi trong bảng sau: Chất X Y Z T Nhiệt độ sôi (oC) 182 184 -6,7 -33,4
pH (dung dịch nồng độ 0,001M) 6,48 7,82 10,81 10,12
Nhận xét nào sau đây đúng?
A. Chất T có tỉ khối hơi so với không khí nhỏ hơn 1.
B. Chất Z làm dung dịch quỳ tím hóa đỏ.
C. Chất X không tác dụng được với dung dịch NaOH.
D. Chất Y không tác dụng được với dung dịch HCl.
Câu 6. Để vôi sống (CaO) lâu ngày trong không khí, vôi sống sẽ cứng lại và giảm chất lượng. Hiện tượng
này được giải thích bằng phản ứng nào dưới đây? A. 2CaO → 2Ca + O2.
C. CaO + CO2 → CaCO3.
B. CaCO3 + CO2 + H2O → Ca(HCO3)2.
D. CaO + SO2 → CaSO3.
Câu 7. Phản ứng của ethylene với H2O (có xúc tác acid) tạo thành ethanol như sau: CH2=CH2 + H2O CH3–CH2–OH.
Giai đoạn 1: Quá trình proton hoá liên kết đôi C=C của ethylene tạo thành carbocation. Trang 5/16
Giai đoạn 2: Quá trình nước cộng hợp vào carbocation.
Giai đoạn 3: Quá trình tách proton để tạo ra alcohol.
Phát biểu nào sau đây sai?
A. Phản ứng trên diễn ra theo cơ chế cộng electrophile (AE).
B. Trong giai đoạn 3, có sự kết hợp proton tạo thành alcohol.
C. Trong giai đoạn 1, có sự phá vỡ liên kết π.
D. Trong giai đoạn 2, có sự hình thành liên kết σ.
Câu 8. Phát biểu nào sau đây không đúng về peptide?
A. Trong phân tử tripeptide (mạch hở) có ba liên kết peptide.
B. Dipeptide (mạch hở) là chất mà phân tử gồm 2 đơn vị α-amino acid.
C. Khi đun nóng peptide với dung dịch kiềm sẽ xảy ra phản ứng thuỷ phân.
D. Phân tử peptide gồm các đơn vị α-amino acid liên kết với nhau bằng liên kết peptide.
Câu 9. Polymer X chỉ được tạo thành từ các đơn vị β-glucose là một loại chất xơ không hòa tan, được tìm
thấy nhiều trong thành phần cấu tạo của tế bào thực vật. Nó đóng vai trò quan trọng trong việc tạo khung cho
tế bào thực vật, giúp duy trì hình dạng và độ cứng cáp của chúng. Polymer X là A. amylose. B. cellulose. C. saccharose. D. amylopectin.
Câu 10. Tính chất nào sau đây không phải của triolein?
A. Thuỷ phân hoàn toàn trong dung dịch NaOH (đun nóng), thu được sodium oleate.
B. Tác dụng với Cu(OH)2 ở điều kiện thường, tạo ra dung dịch xanh lam.
C. Là chất lỏng ở điều kiện thường.
D. Tác dụng với H2 dư (xúc tác Ni, đun nóng) tạo ra tristearin.
Câu 11. Sự phân loại bậc amine nào dưới đây là đúng? A. . B. . C. . D. .
Câu 12. Khi đốt nóng kim loại nào sau đây với khí oxygen sẽ không xảy ra phản ứng hóa học? A. Ag. B. Na. C. Al. D. Ca.
Câu 13. Ammonium nitrate là một hợp chất hóa học có công thức hóa học NH4NO3, là một chất bột màu
trắng tại nhiệt độ phòng và áp suất tiêu chuẩn. Chất này thường được dùng trong nông nghiệp làm phân bón
và cũng được sử dụng làm chất oxy hóa trong thuốc nổ, đặc biệt là các thiết bị nổ tự tạo do có khả năng phân
huỷ thành khí và hơi, kèm theo toả nhiệt mạnh. Phản ứng phân hủy Ammonium nitrate xảy ra như sau: 2NH NO s o t 2N g + O g + 4H O g 4 3 2 2 2 Biết 0 Δ H của NH f 298
4NO3(s) và của H2O(g) lần lượt là –365,6 kJ/mol và –242 kJ/mol .
Nhiệt lượng tỏa ra khi thực hiện phản ứng phân hủy 1 tấn NH4NO3 là bao nhiêu? A. 148.104 kJ. B. 3996.106 kJ . C. 79,92.108 kJ. D. 296.104 kJ.
Câu 14. Anion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. Tổng số electron ở lớp vỏ của nguyên tử X A. 8. B. 16. C. 10. D. 12.
Câu 15. Cho dãy gồm các kim loại: Na, Ca, K, Cu, Ag. Số kim loại trong dãy điều chế được bằng phương pháp thủy luyện là A. 4. B. 2. C. 1. D. 3.
Câu 16. Cho các pin điện hóa với các giá trị sức điện động chuẩn tương ứng như bảng sau : Pin điện hóa Cu - X Y - Cu Z - Cu
Sức điện động chuẩn (V) 0,46 1,1 1,47 Trang 6/16
Biết rằng X, Y, Z là các kim loại. Dãy các kim loại được sắp xếp theo chiều tăng dần tính khử từ trái sang phải là: A. X, Cu, Y, Z. B. Z, Y, Cu, X. C. X, Cu, Z, Y. D. Y, Z, Cu, X.
Câu 17. Kim loại nào sau đây có độ cứng cao nhất trong các kim loại và thường được dùng chế tạo hợp kim không gỉ? A. Aluminium. B. Copper. C. Iron. D. Chromium.
Câu 18. Bón loại phân bón hóa học nào sau đây ít làm ảnh hưởng tới độ pH của đất trồng nhất? A. (NH2)2CO. B. NH4NO3. C. NH4Cl. D. K2CO3.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi
câu, thí sinh chọn đúng hoặc sai.
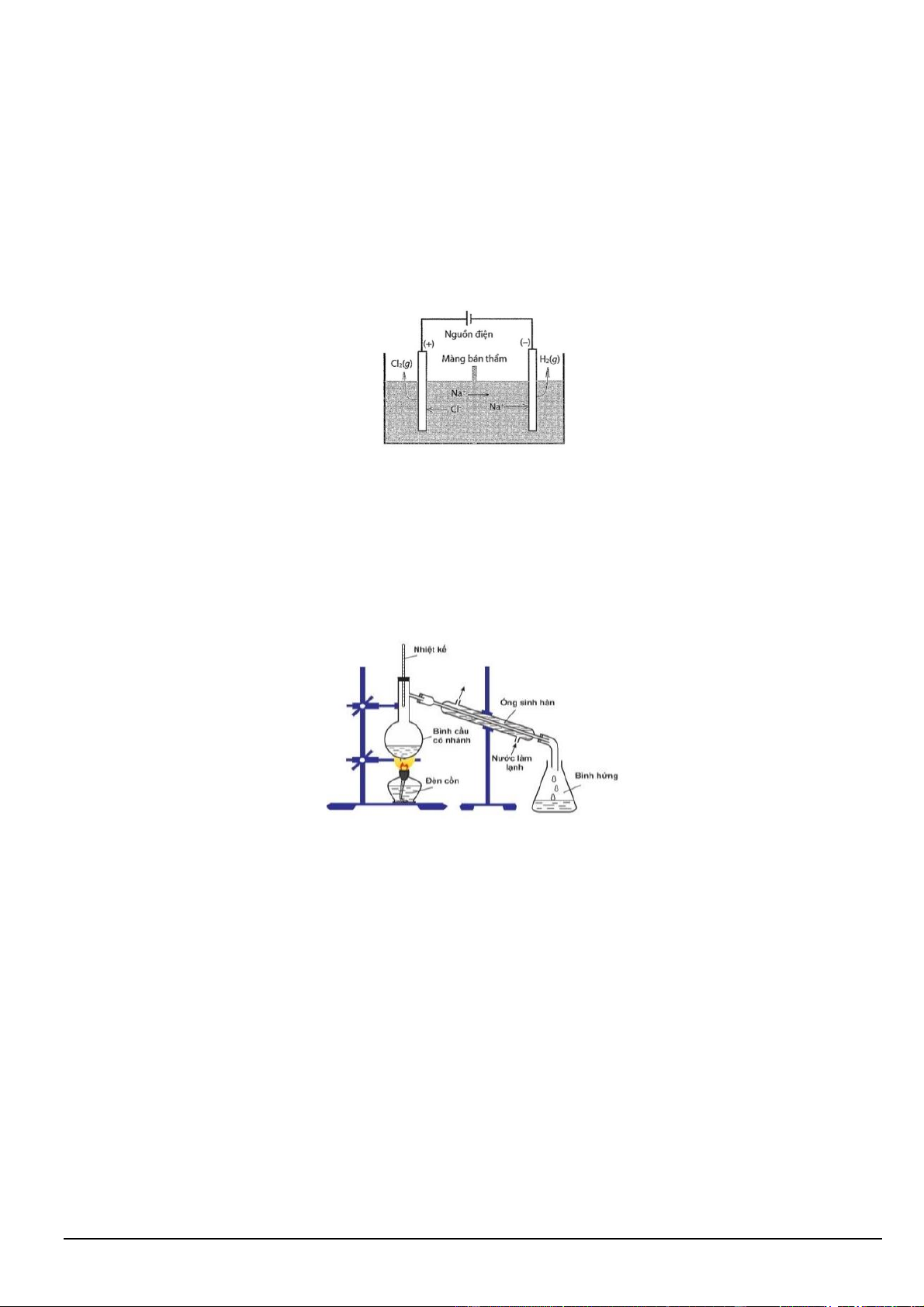
Câu 1. Điện phân dung dịch NaCl có màng bán thẩm ngăn giữa anode với cathode (các điện cực đều là các
điện cực trơ). Màng bán thẩm chỉ cho ion Na+ đi qua. Sơ đồ bình điện phân như hình sau:
a) Phản ứng chính xảy ra trong bình điện phân là NaCl (aq) + H2O (l) → NaClO (aq) + H2 (g).
b) Tại anode xảy ra sự khử ion Cl (aq) thành Cl2 (g).
c) Số mol Na+ trong dung dịch không đổi trong quá trình điện phân.
d) Tại cathode xảy ra sự khử H2O (l) thành H2 (g) và OH (aq).
Câu 2. Chưng cất là phương pháp tách chất dựa vào sự khác nhau về nhiệt độ sôi của các chất trong hỗn hợp
ở một áp suất nhất định. Chất lỏng cần tách được chuyển sang pha hơi, rồi làm lạnh cho hơi ngưng tụ, thu
lấy chất lỏng ở khoảng nhiệt độ thích hợp. Để tách các chất lỏng có nhiệt độ sôi khác nhau nhiều người ta
dùng phương pháp chưng cất thường như mô tả hình sau.
a) Chất lỏng thu được ở bình hứng là chất có nhiệt sôi cao nhất trong hỗn hợp.
b) Khi lắp ống sinh hàn thì nước phải được đi vào từ đầu thấp phía dưới và đi ra từ đầu phía trên mà
không được lắp ngược lại vì sẽ gây ra hiện tượng thiếu nước cho ống sinh hàn, khiến ống bị nóng và có thể
gây vết nứt và làm giảm hiệu quả của sự ngưng tụ.
c) Dùng nhiệt kế để đo nhiệt độ sôi của chất đang chưng cất, phát hiện thời điểm thích hợp để thu chất,
đồng thời kiểm tra độ tinh khiết của chất thu được.
d) Nếu hỗn hợp các chất lỏng có nhiệt độ sôi càng gần nhau thì chất thu được ở bình hứng có độ tinh khiết càng cao.
Câu 3. Tiến hành các bước làm thí nghiệm thử tính tan của cellulose trong nước Schweizer như sau:
Bước 1: Cho khoảng 50 mL dung dịch CuSO4 1M vào cốc 250 mL. Thêm 20 mL dung dịch NaOH 20% vào, khuấy đều.
Bước 2: Lọc tách kết tủa, cho vào cốc thuỷ tinh 250 mL. Thêm khoảng 50 mL dung dịch NH3 đặc, khuấy
đều đến khi kết tủa tan hết thu được nước Schweizer.
Bước 3: Thêm một lượng nhỏ bông vào khoảng 30 mL nước Schweizer và khuấy đều trong khoảng 3 phút.
a) Thí nghiệm trên có thể dùng để chứng minh trong cellulose có nhiều nhóm OH liền kề.
b) Ở bước 2 xảy ra phương trình tạo nước schweizer như sau: Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
c) Sau bước 3, dung dịch thu được gồm các chất lỏng có sự phân lớp.
d) Sau khi kết thúc bước 1, kết tủa tạo ra trong sản phẩm là Cu(OH)2 có màu xanh. Trang 7/16
Câu 4. Chuẩn độ V1 mL dung dịch chứa muối Fe2+ nồng độ C1 (M) và dung dịch H2SO4 (loãng, dư) đựng
trong bình tam giác bằng dung dịch KMnO4 nồng độ C2 (M) để ở burette và để ở vạch 0. Khi trong bình tam
giác xuất hiện màu hồng bền trong khoảng 20 giây thì đóng khóa burette, ghi giá trị thể tích dung dịch
KMnO4 đã dùng. Lặp lại thí nghiệm đến lần thứ 3 lấy giá trị trung bình của thể tích dung dịch KMnO4 đã
phản ứng của 3 lần được giá trị V2 mL.
a) Trong phép chuẩn độ trên nếu chỉ thay dung dịch H2SO4 bằng dung dịch HNO3 thì vẫn thu được kết quả đúng như vậy.
b) Phản ứng hóa học xảy ra khi chuẩn độ là:
MnO (aq) + 5Fe2+(aq) + 8H+(aq) → Mn2+(aq) + 5Fe3+(aq) + 4H 4 2O.
c) Mối quan hệ giữa V1, C1, V2 và C2 được biểu diễn qua biểu thức: V1.C1 = V2.C2.
d) Trong phép chuẩn độ trên, KMnO4 vừa đóng vai trò là chất chuẩn vừa đóng vai trò là chất chỉ thị.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Tại Việt Nam, Quy chuẩn quốc gia về chất lượng nước ăn uống sinh hoạt QCVN 01-1:2018/BYT
quy định hàm lượng sắt không được vượt quá 0,3mg/L. Một mẫu nước nhiễm phèn sắt với lượng iron cao
gấp 28 lần ngưỡng cho phép. Giả thiết sắt trong mẫu nước tồn tại ở dạng muối sulfate FeSO4 và Fe2(SO4)3
với tỉ lệ số mol tương ứng là 8 : 1. Tính số gam Ca(OH)2 tối thiểu cần dùng để xử lí lượng sắt (được tách ra
dưới dạng Fe(OH)3) trong 50 m3 mẫu nước trên về giới hạn cho phép. (Kết quả được làm tròn đến hàng đơn vị).
Câu 2. Chất béo X có công thức: (C H COO)(C H COO)(C H COO)C H . Tính khối lượng X cần lấy 17 35 17 33 17 31 3 5
(theo đơn vị kilogam) để khi tác dụng hoàn toàn với lượng vừa đủ dung dịch NaOH, thu được 20 kg xà
phòng (Kết quả được làm tròn đến một chữ số thập phân).
Câu 3. Cho các nhận định sau:
1. Protein có dạng hình sợi tan tốt trong nước.
2. Một trong những tính chất hoá học của peptide là phản ứng thuỷ phân.
3. Phản ứng của aniline với nước bromine cho sản phẩm là kết tủa màu trắng.
4. Khi đun nóng lòng trắng trứng sẽ xảy ra hiện tượng đông tụ.
5. Dung dịch glycine làm quỳ tím đổi thành màu đỏ.
Các nhận định đúng có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 13; 134; 1345;…).
Câu 4. Một phương tiện vận chuyển chạy bằng xăng RON 95-V có mức tiêu thụ nhiên liệu trung bình là 7
lít/100 km. Năng lượng tỏa ra khi đốt cháy 1 lít xăng RON 95-V là 33 MJ. Tuy nhiên xăng RON 95-V
thường sẽ thải ra một trường một lượng khí lớn gây ô nhiễm môi trường, còn xăng E5 giúp đảm bảo về mặt
an ninh năng lượng, giảm thiểu việc thải các khí độc hại và giúp bảo vệ môi trường. Ông An muốn sử dụng
phương tiện vận chuyển này để đi quãng đường 300 km tại thời điểm đó, nhưng thay vì dùng xăng RON 95-
V, ông lại muốn sử dụng xăng E5. Giá xăng E5 tại thời điểm hiện tại là 20430 VNĐ/lít. Biết: Xăng E5 là
hỗn hợp chứa 5% ethanol và 95% xăng truyền thống theo thể tích; Khối lượng riêng của ethanol là 0,785
g/mL; Năng lượng tỏa ra khi đốt cháy 1 mol ethanol là 1364 kJ và 1 lít xăng truyền thống là 32 MJ; Hiệu
suất sử dụng năng lượng của xe với các loại nhiên liệu là như nhau. Em hãy tính toán xem ông An sẽ phải
chi trả bao nhiêu ngàn tiền xăng khi sử dụng xăng E5? (Kết quả được làm tròn đến hàng đơn vị).
Câu 5. Lắp ráp pin điện hóa Zn-Ni ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: o E = -0,763 V và o E
= -0,257 V . Sức điện động chuẩn của pin điện hóa trên là bao nhiêu? 2+ Zn /Zn 2+ Ni /Ni
(Kết quả được làm tròn đến hai chữ số thập phân).
Câu 6. Trong các tính chất sau đây: 1. Có vị ngọt;
2. Dễ tan trong nước nóng;
3. Có phản ứng tráng bạc;
4. Bị thủy phân trong môi trường acid;
5. Hòa tan Cu(OH)2 thành dung dịch màu xanh lam;
6. Tác dụng với I2 tạo thành hợp chất có màu xanh lục.
Các tính chất của saccharose có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 13; 134; 2345; …). ----HẾT--- Trang 8/16 ĐÁP ÁN ĐỀ THI Trang 9/16
SỞ GD&ĐT HÀ TĨNH
KỲ THI THỬ TỐT NGHIỆP THPT NĂM 2025 MÔN: HÓA HỌC
Thời gian làm bài 50 phút, không kể thời gian phát đề
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi
thí sinh chỉ chọn một phương án.
Câu 1: Cation X2+ và Y- lần lượt có cấu hình e ở phân lớp ngoài cùng là 2p6 và 3p6. Hợp chất được
tạo ra giữa X và Y có công thức là A. MgCl2. B. CaCl2. C. CaF2. D. MgF2.
Câu 2: Kim loại nào dưới đây dẻo nhất (có thể được dùng để dát lên các công trình kiến trúc cổ)? A. Ag. B. Au. C. Al. D. Cu.
Câu 3: Dãy gồm các kim loại nào sau đây đều tan hoàn toàn được trong dung dịch hydrochloric acid dư? A. Na, Fe, Cu. B. Fe, Cr, Ag. C. Zn, Fe, Al. D. Ba, Zn, Au.
Câu 4: Dãy gồm các kim loại có thể điều chế được bằng phương pháp nhiệt luyện là: A. Al, Na, Ba. B. Ca, Ni, Zn. C. Mg, Fe, Cu. D. Fe, Cu, Zn.
Câu 5: Pin quả chanh được thiết lập gồm một dây Cu và dây Zn ghim vào một quả
chanh và nối với bóng điện như hình bên. Bóng điện sáng đồng nghĩa với sự xuất
hiện dòng điện. Bán phản ứng nào sau đây xảy ra ở cực dương?
A. Cu2+(aq) + 2e → Cu(s).
B. Zn(s) → Zn2+(aq) + 2e.
C. 2H+(aq) + 2e → H2(g).
D. Cu(s) → Cu²+(aq) + 2e.
Câu 6: Diêm tiêu kali được dùng để chế tạo thuốc nổ đen (làm mìn phá đá), làm phân bón (cung cấp
nguyên tố N và K cho cây trồng) có công thức hóa học là A. KNO3. B. K2CO3. C. KCl. D. K2SO4.
Câu 7: Phản ứng giải thích sự hình thành thạch nhũ trong các hang động núi đá vôi là
A. CaCO3 + CO2 + H2O
Ca(HCO3)2. B. CaCO3 + 2HCl CaCl2 + CO2 + H2O. C. CaCO3 CaO + CO2. D. Ca(HCO3)2 CaCO3 + CO2 + H2O.
Câu 8: Cho sơ đồ phổ khối IR của chất X như sau:
Cho biết số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số nhóm chức cở bản như sau: Hợp chất Liên kết Số sóng (cm-1) Alcohol O – H 3650 – 3200 Amine N – H 3500 – 3200 Trang 10/16 C – H 2850 – 2700 Aldehyde C = O 1740 – 1670 Ketone C = O 1740 – 1670 C = O 1750 – 1680 Carboxylic O – H 3000 – 2500 C = O 1750 – 1715 Ester C – O 1300 – 1000
Nhóm chức có mặt trong X là A. alcohol. B. carboxylic. C. aldehyde. D. ester.
Câu 9: Benzyl acetate là ester tạo nên mùi thơm của hoa nhài có công thức cấu tạo thu gọn là A. CH3COOC6H5.
B. CH3COOCH2C6H5. C. C6H5COOCH3. D. CH3COOC6H4CH3.
Câu 10: Dầu ăn và mỡ động vật có thể được sử dụng để sản xuất sản phẩm nào sau đây? A. Xà phòng B. Thủy tinh C. Xi măng
D. Chất giặt rửa tổng hợp
Câu 11: Người mắc bệnh tiểu đường nên ưu tiên ăn nhiều loại thực phẩm nào sau đây?
A. Thực phẩm giàu tinh bột như cơm trắng, bánh mì,...
B. Thực phẩm chứa nhiều đường như kẹo, nước ngọt, nước mía,...
C. Rau xanh, ngũ cốc nguyên hạt và thực phẩm giàu chất xơ.
D. Các loại trái cây chín như nho, chuối,...
Câu 12: Dung dịch chất nào sau đây làm quỳ tím hóa xanh? A. Glycine . B. Lysine. C. Alanine. D. Valine.
Câu 13: Khi nấu món canh từ thịt, cua, tôm tép, có nhiều mảng thịt đóng rắn lại. Hiện tượng trên
gây ra bởi tính chất nào sau đây?
A. Sự đông tụ protein bởi sự thay đổi pH.
B. Sự đông tụ protein bởi nhiệt độ.
C. Kết tủa carbonate của các chất khoáng có trong vỏ. D. Sự thủy phân protein bởi nhiệt độ.
Câu 14: Cho X, Y, Z, T là các chất khác nhau trong số bốn chất: methylamine, ammonia, phenol
và aniline có các tính chất được ghi trong bảng sau: Chất X Y Z T Nhiệt độ sôi (oC) 182 184 -6,7 -33,4
pH (dung dịch nồng độ 0,001M) 6,48 7,82 10,81 10,12
Nhận xét nào sau đây đúng?
A. Chất Z là methylamine.
B. Chất T là aniline.
C. Chất Y là phenol.
D. Chất X là ammonia.
Câu 15: LDPE là một chất dẻo dễ tạo màng, có tính dai bền nên được sử dụng làm túi
nylon, màng bọc, bao gói thực phẩm. Trên các bao bì làm từ LDPE thường được in kí
kiệu như hình bên. Polymer dùng để sản xuất LDPE được tổng hợp từ monomer nào sau đây? A. CH2=CH2. B. CH2=CHCl. C. CH2=CHCH3. D. C6H5CH=CH2.
Câu 16: Ngày 04 tháng 8 năm 2020 đã xảy ra một vụ nổ kinh hoàng ở nhà kho tại cảng Beirut của
Lebanon. Đây là nhà kho chứa khoảng 2700 tấn NH4NO3, một loại hoá chất vừa được sử dụng làm Trang 11/16
phân bón, vừa được dùng làm thuốc nổ do có khả năng phân huỷ thành khí và hơi, kèm theo toả nhiệt mạnh: 2NH NO s o t 2N g + O g + 4H O g 4 3 2 2 2 Cho biết 0 Δ H của NH f 298
4NO3(s) và của H2O(g) lần lượt là –365,6 kJ/mol và –242 kJ/mol .
Nhiệt lượng tối đa giải phóng ra từ vụ nổ khi toàn bộ lượng NH4NO3 bị phân hủy là A. 148.104 kJ. B. 296.104 kJ. C. 3996.106 kJ. D. 79,92.108 kJ. HD: 0 Δ H
của phản ứng = (-242).4 - (-365,6.2) = (-968)- (-731,2) = -236,8 kJ r 298
1 tấn NH4NO3 có số mol là 106/80 = 125. 102 (mol)
2700 tấn NH4NO3phân hủy tỏa ra lượng nhiệt là: 2700.(236,8/2).125. 102 = 3996.106 kJ
Câu 17: Sử dụng phân bón nào sau đây làm tăng độ chua của đất? A. KCl. B. (NH2)2CO. C. K2SO4. D. NH4Cl.
Câu 18: Cho phản ứng của methane với bromine (ánh sáng, tỉ lệ 1 : 1) có cơ chế như sau: Giai đoạn 1: a s Br Br Br 2
Giai đoạn 2: Br CH HBr C H 4 3 C H Br CH Br Br 3 2 3 Giai đoạn 3: 2Br Br2 Br C H CH Br 3 3 C H C H C H 3 3 2 6
Phát biểu nào sau đây sai ?
A. Phản ứng trên diễn ra theo cơ chế thế gốc (SR).
B. Giai đoạn 1 là giai đoạn khơi mào của phản ứng.
C. Sản phẩm CH3Br chủ yếu được sinh ra ở giai đoạn 2.
D. Giai đoạn 3 là giai đoạn tạo ra các gốc tự do từ các phân tử.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d)
ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Tiến hành thí nghiệm điện phân dung dịch CuSO4 theo các bước sau:
Bước 1: Lắp thiết bị thí nghiệm điện phân dung dịch CuSO4 như hình bên dưới:
Sơ đồ thí nghiệm điện phân dung dịch CuSO4 với điện cực trơ Trang 12/16
Bước 2: Rót dung dịch CuSO4 0,5 M vào ống thuỷ tinh hình chữ U rồi nhúng hai điện cực than chì vào dung dịch.
Bước 3: Nối hai điện cực than chì với hai cực của nguồn điện và tiến hành điện phân.
Bước 4: Khi có khí thoát ra ở cả hai điện cực thì dừng điện phân, ngắt nguồn điện.
a. Ở cathode, ion Cu2+ bị khử tạo thành kim loại Cu.
b. Ở anode, có khí H2 thoát.
c. Trong quá trình điện phân, pH dung dịch tăng dần.
d. Sau bước 4, nhúng thanh Mg vào dung dịch sau điện phân thấy có khí không màu thoát ra. Đáp án: a. Đúng b. Sai. c. Sai. d. Đúng.
Câu 2: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho khoảng 5 ml dung dịch hồ tinh bột 1% vào ống nghiệm. Sau đó thêm khoảng 1 mL
dung dịch HCl 1M vào, lắc đều.
Bước 2: Đặt ống nghiệm trong một cốc thuỷ tinh chứa nước nóng, đun cách thuỷ trong 10 phút. Sau đó để nguội.
Bước 3: Thêm từ từ NaHCO3 vào ống nghiệm đến khi ngừng sủi bọt khí.
Bước 4: Cho khoảng 2 mL dung dịch thu được vào ống nghiệm chứa Cu(OH)2 (được điều chế bằng
cách cho 0,5 ml dung dịch CuSO4 5% vào 2 mL dung dịch NaOH 10%), lắc nhẹ.
a. Sau bước 1, thu được dung dịch đồng nhất.
b. Trong bước 2, đã xảy ra phản ứng thủy phân tinh bột tạo thành glucose.
c. Trong bước 3, NaHCO3 được thêm vào để làm tăng tốc độ phản ứng thủy phân ở bước 2.
d. Sau bước 4, thu được dung dịch màu xanh lam. Đáp án: a. Sai. b. Đúng. c. Sai. d. Đúng.
Câu 3: Nhiều chất hữu cơ có nhiệt độ sôi cao và không tan trong
nước có thể tách ra khỏi hỗn hợp ở nhiệt độ sôi xấp xỉ nhiệt độ sôi
của nước bằng phương pháp chưng cất lôi cuốn hơi nước. Hình bên
mô phỏng thiết bị dùng để chưng cất tinh dầu bằng phương pháp
chưng cất lôi cuốn hơi nước. Biết rằng tinh dầu có khối lượng riêng nhỏ hơn 1 g.mL-1.
a. Quá trình bay hơi của nước sẽ kéo theo các hợp chất hữu cơ cần tách.
b. Lớp A là nước, lớp B là tinh dầu cần tách ra.
c. Có thể dùng phương pháp chiết để tách tinh dầu ra khỏi hỗn hợp sau ngưng tụ.
d. Để tăng hiệu suất ngưng tụ của ống sinh hàn, có thể đổi chiều nước vào ở trên và ra ở dưới. Trang 13/16 Đáp án: a. Đúng b. Sai. c. Đúng. d. Sai.
Câu 4: Chuẩn độ V1 mL dung dịch chứa muối Fe2+, nồng độ C1 (M) và dung dịch H2SO4 loãng,
đựng trong bình tam giác bằng dung dịch KMnO4 nồng độ C2 (M) để ở burette và để ở vạch 0. Khi
vạch thể tích dung dịch KMnO4 trên burete là V2 mL thì trong bình tam giác xuất hiện màu hồng
tồn tại bền trong khoảng 20 giây.
a. Dung dịch muối Fe2+ được cho vào burette khi chuẩn độ.
b. Dung dịch H2SO4 được thêm vào để tạo môi trường acid, không tham gia phản ứng.
c. Phản ứng ion chuẩn độ là: MnO –
4 (aq) + 5Fe2+(aq) + 8H+(aq) Mn2+(aq) + 5Fe3+(aq) + 4H2O(l).
d. Khi kết thúc chuẩn độ, dung dịch trong bình tam giác có màu hồng tồn tại bền trong khoảng 20
giây là của lượng rất nhỏ KMnO4 dư. Đáp án: a. Sai. b. Sai. c. Đúng. d. Đúng.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Lắp ráp pin điện hóa Zn-Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: o E = -0,763 V và o E
= +0,340V . Sức điện động chuẩn của pin điện hóa trên là bao nhiêu? 2+ Zn /Zn 2+ Cu /Cu
(Kết quả được làm tròn đến một chữ số thập phân).
Đáp số: 1,1 HD: o E = 0,340V - (-0,763V) = 1,103V Pin
. Kết quả được làm tròn đến một chữ số thập phân nên lấy 1,1
Câu 2: Một loại chất béo có chứa 75% tristearin về khối lượng. Để sản xuất 2 nghìn bánh xà
phòng cần dùng tối thiểu x kg loại chất béo trên cho phản ứng với dung dịch NaOH, đun nóng.
Biết rằng trong mỗi bánh xà phòng có chứa 70 gam sodium stearate. Giá trị của x là bao nhiêu?
(Kết quả được làm tròn đến hàng đơn vị)
Đáp số: 181 HD:
msodium stearate = 2.103.70 = 140.103 gam = 140 kg.
PTHH: (C17H35COO)3C3H5 + 3NaOH ⟶3C17H35COONa + C3H5(OH)3 890 g → 918 g 140.890 m 135,73 kg tristearin 918
⟹ mchất béo = 135,73:75% = 181kg
Câu 3: Cho các nhận định sau:
1. Dịch truyền glucose 5% được dùng để truyền tĩnh mạch cho bệnh nhân suy nhược cơ thể.
2. Ở điều kiện thường, cellulose là chất rắn màu trắng, tan tốt trong nước. Trang 14/16
3. Tinh bột và cellulose là những polymer tự nhiên.
4. Amylose là polymer dạng mạch dài, không nhánh, xoắn lại, được tạo thành từ các đơn vị α-
glucose liên kết với nhau bằng liên kết α-1,4-glycoside và liên kết α-1,6-glycoside .
5. Cellulose và tinh bột đều có thể cung cấp năng lượng cho con người vì chúng đều có thể thủy phân tạo glucose.
Các nhận định đúng có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 12; 134; 1345;…).
Đáp số: 13
HD: Các nhận định đúng xếp theo chiều số thứ tự tăng dần là: 1; 3.
Câu 4: Trong các tính chất sau:
1. Có tính chất lưỡng tính;
2. Làm đổi màu quỳ tím ẩm;
3. Tham gia phản ứng ester hóa khi có acid vô cơ mạnh xúc tác;
4. Thuộc loại α-amino acid;
5. Là chất rắn ở điều kiện thường.
Các tính chất của glycine có số thứ tự xếp theo chiều tăng dần tạo ra con số là (ví dụ 13; 134; 2345; …).
Đáp số: 1345
HD: Các tính chất của sacchrose xếp theo chiều số thứ tự tăng dần là: 1; 3; 4; 5.
Câu 5: Một chiếc ô tô chạy bằng xăng RON 95-III có mức tiêu thụ nhiên liệu trung bình là 7 lít/100
km. Năng lượng tỏa ra khi đốt cháy 1 lít xăng RON 95-III là 33 MJ. Ông An muốn sử dụng ô tô đó
để đi quãng đường 350 km, nhưng thay vì dùng xăng RON 95-III ông lại muốn sử dụng xăng E5.
Giá xăng E5 hiện tại là 20430 VNĐ/lít. Xăng E5 là hỗn hợp chứa 5% ethanol và 95% xăng truyền
thống theo thể tích. Khối lượng riêng của ethanol là 0,785 g/mL. Năng lượng tỏa ra khi đốt cháy 1
mol ethanol là 1364 kJ và 1 lít xăng truyền thống là 32 MJ. Hiệu suất sử dụng năng lượng của xe với
các loại nhiên liệu là như nhau. Hỏi ông An sẽ phải chi trả bao nhiêu nghìn đồng tiền xăng nếu sử
dụng xăng E5 cho quãng đường 350 km đó? (Kết quả được làm tròn đến hàng đơn vị)
Đáp án: 523 HD:
Năng lượng cần cung cấp cho xe chạy quãng đường 350 km là 7.350 Q = .33 = 808,5 (MJ) 100
Nếu thay xăng RON 95-III bằng x lít xăng E5. Vì hiệu suất sử dụng các loại năng lượng là như nhau
nên khi xe chạy hết quãng đường 350 km thì năng lượng cần cung cấp cho xe là 3 x.5%.0, 785.10 3 Q =
.1364.10 + x.95%.32= 808,5 (MJ) 46 x = 25,615 (lít)
Số tiền ông An cần chi trả mua xăng E5 là: 25,615.20,430 = 523,31445 nghìn đồng.
Kết quả được làm tròn đến hàng đơn vị nên lấy 523.
Câu 6: Tại Việt Nam, Quy chuẩn quốc gia về chất lượng nước ăn uống sinh hoạt QCVN 01-
1:2018/BYT quy định hàm lượng sắt không được vượt quá 0,3mg/L. Một mẫu nước nhiễm phèn sắt
với lượng iron cao gấp 44,8 lần ngưỡng cho phép. Giả thiết sắt trong mẫu nước tồn tại ở dạng muối
sulfate FeSO4 và Fe2(SO4)3 với tỉ lệ số mol tương ứng là 8 : 1. Tính khối lượng (theo gam) vôi tôi ít Trang 15/16
nhất cần dùng để xử lí lượng iron trong 10m3 mẫu nước trên về giới hạn cho phép. Giả sử vôi tôi chỉ
chứa Ca(OH)2 và sắt được tách ra dưới dạng Fe(OH)3. (Kết quả làm tròn đến hàng đơn vị).
Đáp án: 191 HD:
Gọi số mol FeSO4 và Fe2(SO4)3 lần lượt là 8x và x
4FeSO4 + 4Ca(OH)2 + O2 + 2H2O → 4Fe(OH)3 + 4CaSO4 8x 8x
Fe2(SO4)3 + 3Ca(OH)2 → 2Fe(OH)3 + 3CaSO4 x 3x
mFe = (8x + 2x).56.103 = (44,8-1).0,3.10.103 => x =0,2346 mol.
Theo phản ứng số mol Ca(OH)2 = 8.x +3.x = 11.x = 2,581 mol => m 2,581.74 190,994 (gam) Ca (OH)2
Kết quả làm tròn đến hàng đơn vị nên lấy 191. ---HẾT--- Trang 16/16




