



Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH LỚP 10 THPT CHUYÊN QUẢNG NAM NĂM HỌC 2021-2022 ĐỀ CHÍNH THỨC
Môn thi: HÓA HỌC
(Đề thi gồm có 02 trang)
Thời gian: 150 phút (không kể thời gian giao đề)
Khóa thi ngày: 03-05/6/2021
Cho nguyên tử khối: H= 1; C= 12; O= 16; Al= 27; Zn= 65; Mg= 24; Cl=35,5; Br= 80; Ba= 137; S= 32; Na= 23. Câu 1. (2,0 điểm)
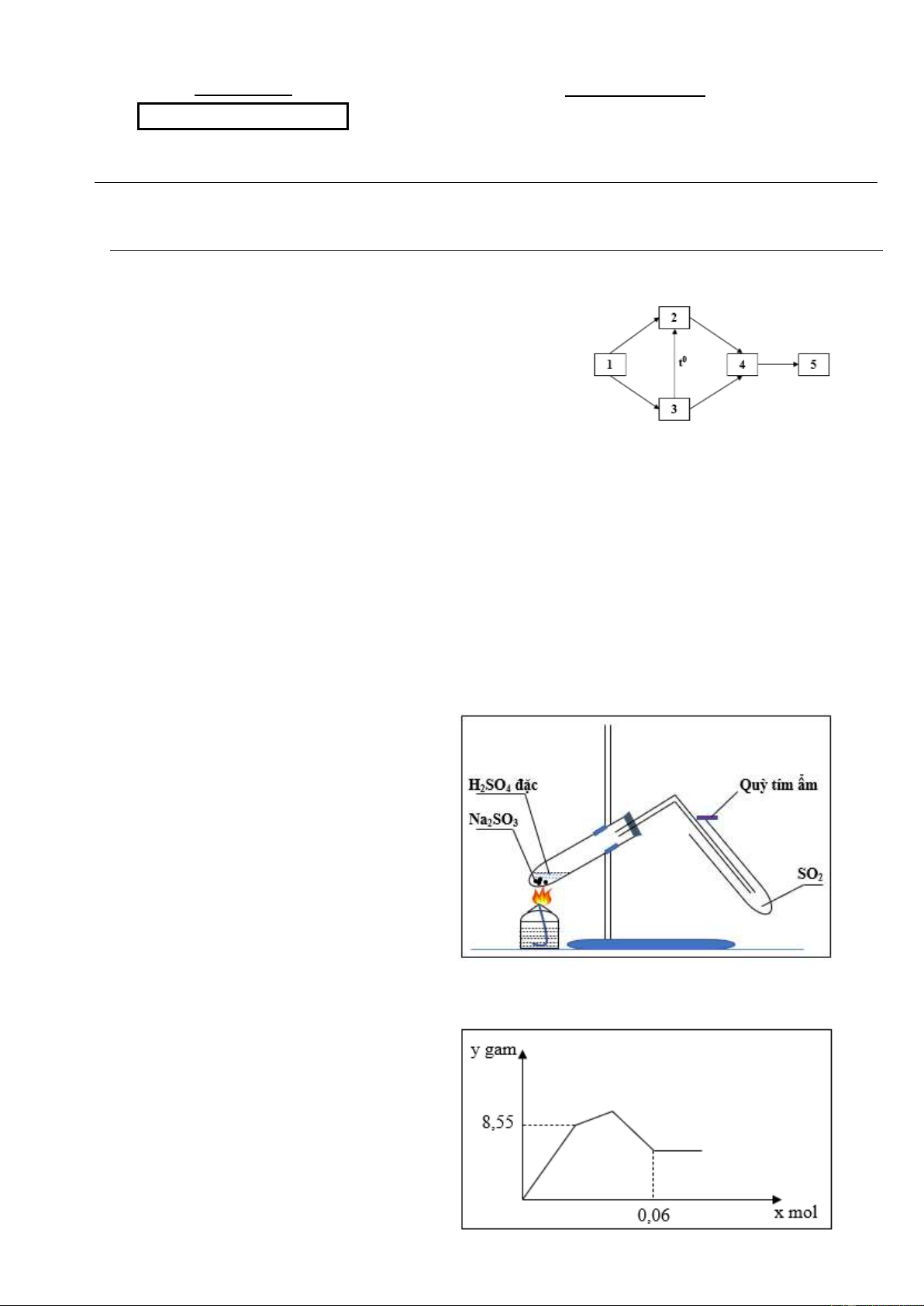
1.1. (1,0 điểm) Cho các chất: Ca(OH)2, CaO, CO2,
CaCO3, Ca(HCO3)2. Tìm vị trí tương ứng của các chất trên trong sơ đồ bên.
Viết các phương trình phản ứng hoàn thành dãy
chuyển hóa trên, ghi rõ điều kiện (nếu có).
1.2. (1,0 điểm) Cho các dung dịch: Na2CO3, NH4Cl, NaOH, BaCl2 và H2SO4 được
đánh số ngẫu nhiên từ 1 đến 5. Dung dịch 5 đều cho kết tủa trắng với dung dịch 3 và
dung dịch 4, nhưng không phản ứng với dung dịch 1 hoặc dung dịch 2.
a. Xác định dung dịch 5. Giải thích.
b. Nêu hiện tượng và viết phương trình phản ứng xảy ra (nếu có) khi:
- Trộn dung dịch 3 với dung dịch 4.
- Trộn dung dịch 1 với dung dịch 2. Câu 2. (2,0 điểm)
Trong phòng thí nghiệm, một học sinh điều chế và thu khí SO2 như hình vẽ sau:
a. Viết phương trình hóa học điều chế
SO2 và cho biết tác dụng của quỳ tím ẩm.
b. Hãy chỉ ra các chi tiết chưa chính
xác trong hình vẽ bên. Giải thích. Vẽ lại hình cho chính xác.
c. Để nhận biết SO2 tạo thành có thể
sục khí này vào dung dịch nào? Hãy đề
xuất 2 dung dịch phù hợp, nêu hiện
tượng và viết phương trình hóa học.
d. Có nên thay dung dịch H2SO4 đặc
bằng dung dịch HCl đặc không? Vì sao? Câu 3. (2,0 điểm)
3. 1. (1,0 điểm) Cho từ từ đến dư
dung dịch Ba(OH)2 vào dung dịch X
chứa hỗn hợp Al2(SO4)3 và AlCl3. Sự
phụ thuộc của khối lượng kết tủa (y gam)
với số mol Ba(OH)2 (x mol) được biểu
diễn bằng đồ thị như hình bên. Tính khối
lượng muối trong dung dịch X. Trang 1
3.2. (1,0 điểm) Đun nóng 20,5 gam hỗn hợp X gồm Al, Zn, Mg trong không khí thu
được a gam hỗn hợp Y gồm các kim loại và các oxit. Hoà tan hoàn toàn lượng hỗn hợp Y
trên trong dung dịch HCl dư, thu được 5,04 lít khí H2 (đktc) và dung dịch Z. Cô cạn Z
được 59,55 gam muối khan. Xác định giá trị của a. Câu 4. (2,0 điểm)
4.1. (1,5 điểm) Cho bảng thông tin sau: Chất A B C D Thuốc thử Quỳ tím Hóa đỏ 0 0 0 Dung dịch Br2/CCl4 0 0 Mất màu da cam 0 Dung dịch AgNO3/NH3, t0 0 0 ? Xuất hiện kết tủa
a. A, B, C, D có thể là những chất nào? Biết rằng: A, B, C, D là những hợp chất hữu
cơ, mạch hở có dạng CxHyOz hoặc CxHy và đều chứa 2 nguyên tử cacbon.
b. Điền thông tin còn thiếu ở ô có dấu “?”. Giải thích.
Chú thích: 0: không hiện tượng.
4.2. (0,5 điểm) Hiđrocacbon CnH2n-2 (chất X) có tính chất hóa học giống axetilen. Cho
X vào bình đựng dung dịch brom dư, sau phản ứng thấy có 0,09 mol brom phản ứng, thu
được 2 hợp chất hữu cơ và thấy khối lượng bình tăng 2,4 gam. Xác định công thức phân
tử và công thức cấu tạo của X. Câu 5. (2,0 điểm)
5.1. (1,0 điểm) Chất X là trieste của glixerol với các axit cacboxylic đơn chức, mạch
hở. Đốt cháy hoàn toàn a mol X thu được b mol CO2 và c mol H2O. Biết rằng: b – c = 4a.
Hiđro hóa hoàn toàn m1 gam X cần 8,96 lít H2 (đktc), thu được 52 gam este Y. Đun nóng
m1 gam X với dung dịch chứa 0,8 mol NaOH đến khi phản ứng xảy ra hoàn toàn, cô cạn
dung dịch sau phản ứng, thu được m2 gam chất rắn. Tính giá trị của m2.
5.2. (1,0 điểm) Xăng E5 được sản xuất bằng cách phối trộn xăng khoáng RON 92 với
etanol (d = 0,8 gam/ml) theo tỉ lệ thể tích tương ứng là 95: 5. Etanol được sản xuất từ tinh
bột bằng phương pháp lên men. Tinh bột có nhiều trong sắn, ngô. Cho bảng thông tin sau: Nguyên liệu Sắn tươi Ngô khô (bắp khô) Thông tin Hàm lượng tinh bột 30% 75%
Giá 1 kg dao động trong khoảng 1200-1700 đồng 5400- 6500 đồng
a. Tính khối lượng sắn tươi cần dùng để điều chế 50000 lít xăng E5. Biết hiệu suất của
toàn bộ quá trình sản xuất đạt 80%.
b. Nếu em là nhà sản xuất xăng E5 em sẽ chọn sắn tươi hay ngô khô để làm nguyên
liệu? Vì sao? Biết hiệu suất của toàn bộ quá trình sản xuất khi dùng sắn tươi và ngô khô lần lượt là 80%; 85%.
--------------- HẾT ---------------
Học sinh không được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học.
Họ và tên thí sinh:......................................................................Số báo danh: ............................. Trang 2
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI LỚP 10 THPT CHUYÊN TỈNH QUẢNG NAM Năm học 2021 - 2022
HƯỚNG DẪN CHẤM VÀ ĐÁP ÁN Môn: HÓA HỌC
(Hướng dẫn chấm này có 05 trang) CÂU 1. (2,0 điểm)
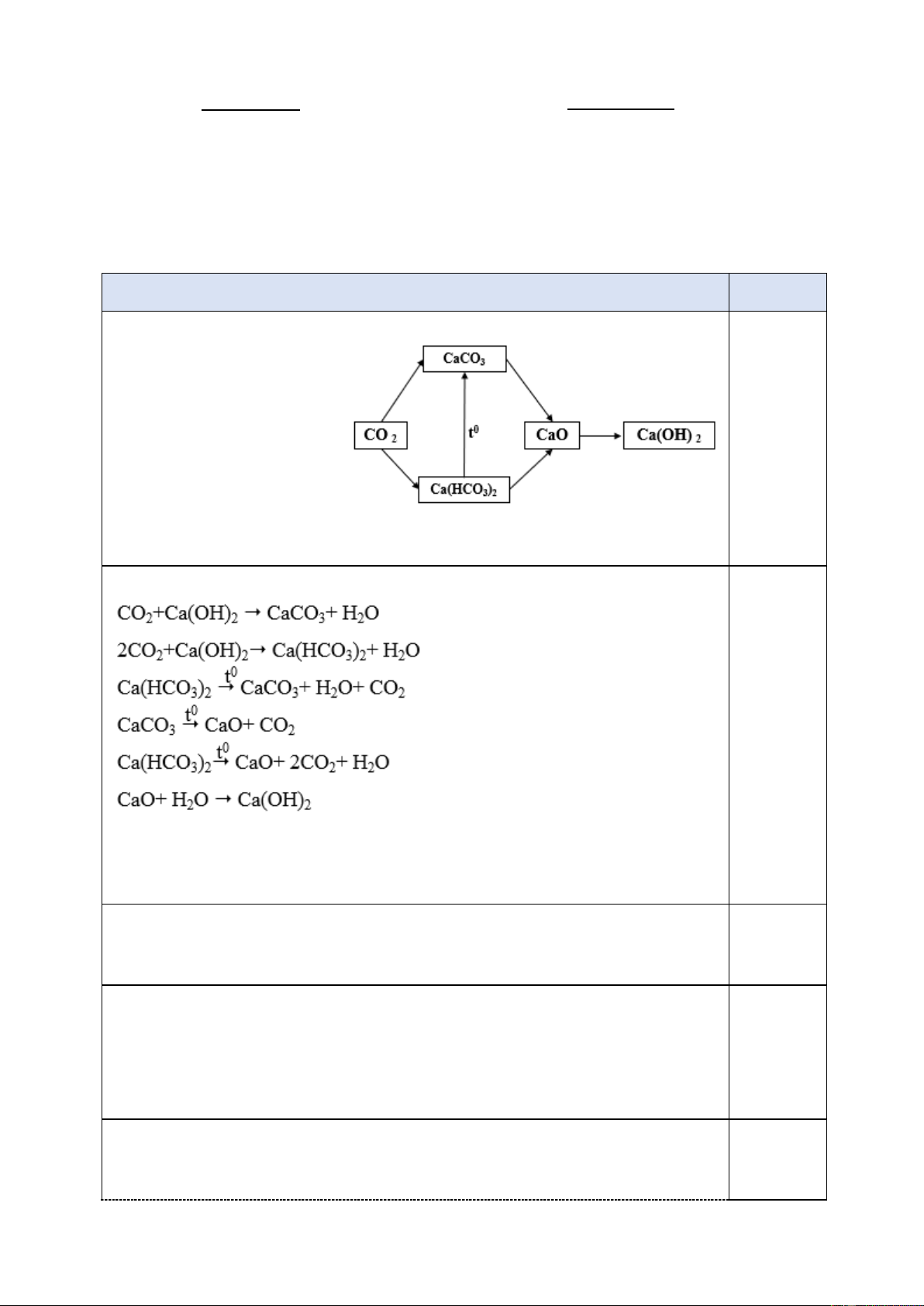
Nội dung Điểm 1.1. (1,0 điểm) 1- CO2 2- CaCO3 3- Ca(HCO3)2 0,1đ/1 hoặc chất 4- CaO 5- Ca(OH)2 Ptpư: 0,5đ Lưu ý:
- Đúng 1 pt được 0,1 đ. Đúng từ 5 pt được 0,5 đ.
- Không cân bằng 2 pt trừ 0,1 đ, thiếu điều kiện từ 2 pt trừ 0,1 đ. 1.2. (1,0 điểm) 0,3đ
Dung dịch 5 là BaCl2 Giải thích:
Na2CO3 + BaCl2 → 2NaCl + BaCO3
0,3đ/2pt
H2SO4 + BaCl2 → 2HCl + BaSO4 Lưu
ý: ghi đủ 2 pt mới được điểm.
Trộn dung dịch 3 với dung dịch 4: sủi bọt khí 0,2đ
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O Trang 3
Trộn dung dịch 1 với dung dịch 2: khí mùi khai bay lên
NH4Cl + NaOH → NaCl + NH3(mùi khai) + H2O 0,2đ Trang 4 CÂU 2. (2,0 điểm)
Nội dung Điểm a. Ptpư 0,1đ
Tác dụng của quỳ tím: Nhận biết khí SO2 (quỳ hóa đỏ sau đó mất màu) từ đó biết khi nào 0,2đ SO2 đầy ống.
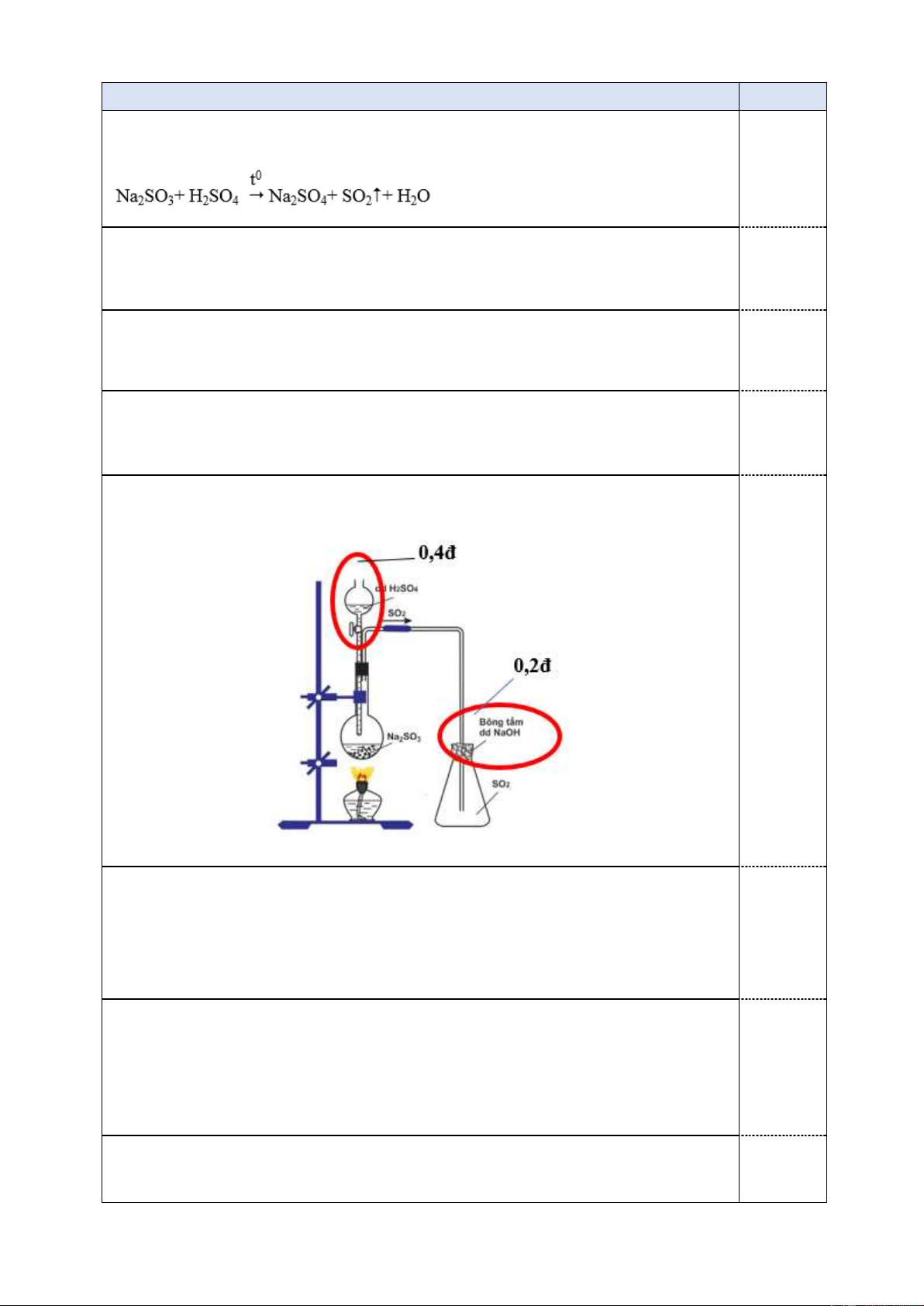
b. Chi tiết chưa chính xác:
- Không có bông tẩm xút ở miệng ống nghiệm khí SO2 bay ra môi trường 0,2đ (SO2 là 1 khí độc).
- Cho Na2SO3 và H2SO4 cùng 1 lúc vào ống nghiệm thì khi lắp xong hệ 0,3đ
thống gần như không còn SO 2 để thu nữa. Hình vẽ chính xác 0,6đ c. - Dung dịch Br2:
Hiện tượng: Nhạt màu hoặc mất màu của dung dịch Br 0,2đ 2. Ptpư: SO
2+ H2O+ Br2 H2SO4+ 2HBr - Dung dịch KMnO4
Hiện tượng: Nhạt màu hoặc mất màu của dung dịch KMnO4. Ptpư: 5SO 0,2đ
2+ 2H2O+ 2KMnO4 K2SO4+ 2MnSO4+ 2H2SO4
Lưu ý: Có thể dùng lượng dư dung dịch Ca(OH) 2 / Ba(OH)2 tạo kết tủa trắng. ptpư: SO 2+ Ca(OH)2
CaSO3 + H2O
d. Không nên thay H2SO4 đặc bằng HCl đặc vì HCl dễ bay hơi SO2 thu 0,2đ
được có độ tinh khiết thấp. CÂU 3. (2,0 điểm) Trang 5
Nội dung Điểm
3.1. (1,0 điểm) Al 0,1đ
2(SO4)3+ 3Ba(OH)2
3BaSO4 + 2Al(OH)3
a 3a 3a 2a (mol) 2AlCl 3+ 3Ba(OH)2
3BaCl2+ 2Al(OH)3 0,1đ b 1,5b b (mol) 2Al(OH) 3+ Ba(OH)2
Ba(AlO2)2+4H2O 0,1đ
2a+b a+0,5b (mol)
Ta có: 0,06= 3a+1,5b+a+0,5b 0,2đ
8,55= 233.3a+78.2a 0,2đ
a= b= 0,01 0,1đ
mmuối= mAl2(SO4)3+ mAlCl3= 4,755 gam. 0,2đ
3.2. (1,0 điểm) nH2 = 0,225 mol 0,2
mCl = m muối - mKL=59,55-20,5 = 39,05 gam
nCl = 1,1 mol = nHCl
BTH: nH2O= (nHCl-nH2.2)/2 = 0,325 mol 0,3
BTKL: mKL+ mO2+ mHCl= mmuối+ mH2O+ mH2
20,5+ mO2+1,1.36,5=59,55+0,325.18+0,225.2 0,3
mO2 = 5,2 gam
a = mKL + mO2 = 20,5 + 5,2 = 25,7 gam. 0,2
Lưu ý: Học sinh giải cách khác, logic, cho kết quả đúng vẫn được điểm tối đa. Trang 6 CÂU 4. (2,0 điểm)
Nội dung Điểm 4.1. (1,5 điểm)
A: CH3-COOH / (COOH)2 / HO-CH2-COOH.
B: C2H6 / C2H5OH / C2H4(OH)2 / CH3OCH3. 1,2đ C: C2H4 / C2H2.
D: CH3CHO / (CHO)2 / HO-CH2-CHO / HCOOCH3.
Lưu ý: 0,1 điểm/1 chất. Đúng từ 12 chất được 1,2 điểm.
- Thông tin ở ô “?”: không hiện tượng hoặc xuất hiện kết tủa. 0,2đ
Lưu ý: 0,1đ/cụm từ tô đậm. - Giải thích: + Nếu C là C 2H4
“?”: không hiện tượng. 0,1đ + Nếu C là C 2H2
“?”: xuất hiện kết tủa.
4.2. (0,5 điểm) C nH2n-2 + Br2 CnH2n-2Br2 C nH2n-2 + 2Br2 CnH2n-2Br4
nBr2=0,09 0,045 < nX < 0,09 0,2đ
Lưu ý: Học sinh chỉ viết được 2 pt thì được 0,1 điểm.
2,4/0,09 < MX < 2,4/0,045
2,4/0,09 < 14n-2< 2,4/0,045 0,1 2,05 n=3
CTPT của X: C3H4 0,1đ
CTCT của X: CH3 − C ≡ CH 0,1đ
Lưu ý: HS giải cách khác, logic, cho kết quả đúng vẫn được điểm tối đa. Trang 7 CÂU 5. (2,0 điểm)
Nội dung Điểm
5.1. (1,0 điểm) 0,2đ
Vì b – c = 4a nên suy ra X có độ bất bão hòa k = 5 X có 5 liên kết pi gồm 3 liên kết pi
trong 3 nhóm -COO- và 2 liên kết pi ở gốc H-C.
1 mol X sẽ phản ứng với 2 mol H2. 0,2đ
nH2= 0,4 molnX = 0,2 mol.
m1 = mY - mH2= 52 - 0,4.2 = 51,2 gam. 0,2đ
BTKL: m1 + mNaOH = m2 + mglixerol 51,2 + 0,8.40 = m2 + 0,2.92
m 0,4đ
2 = 64,8 gam.
Lưu ý: Nếu HS giải cách khác, logic, cho kết quả đúng vẫn được điểm tối đa. 5.2. (1,0 điểm) a. 0,2đ
Khối lượng sắn tươi lí thuyết = 50000.0,05.1000.0,8.162/(46.2.0,3) = 1173913 (g)
Khối lượng sắn tươi thực tế = 50000.0,05.1000.0,8.162/(46.2.0,3.0,8) 0,3đ
= 14673913 (g) = 14673,913 (kg) b.
Số tiền mua nguyên liệu 0,2đ
+ Số tiền mua nguyên liệu nếu dùng sắn tươi: 17608696 đến 24945652 đồng.
+ Khối lượng ngô khô cần = 50000.0,05.1000.0,8.162/(46.2.0,75.0,85) =5524297 (g) = 5524,297 (kg) 0,2đ
+ Số tiền mua nguyên liệu nếu dùng ngô khô: 29831204 đến 35907931 đồng.
Vậy dùng sắn tươi sẽ hợp lí hơn vì chi phí mua nguyên liệu ít hơn.
Lưu ý: Nếu HS giải cách khác, logic, cho kết quả đúng vẫn được điểm tối 0,1đ đa.
------------------------------------------------HẾT------------------------------------------------ Trang 8