

Preview text:
SỞ GIÁO DỤC VÀ ĐÀO TẠO
KỲ THI TUYỂN SINH VÀO LỚP 10 THPT CHUYÊN QUẢNG TRỊ Năm học 2016-2017 Môn thi: HÓA HỌC ĐỀ CHÍNH THỨC
Thời gian: 150 phút (không kể thời gian giao đề) (Đề thi gồm có 2 trang)
Câu 1. (2,0 điểm)
1. Hãy chọn 1 đơn chất, 1 oxit, 1 hidroxit và 2 muối khác loại nhau đều tác dụng được với
cả dung dịch HCl và dung dịch NaOH. Viết các phương trình phản ứng.
2. Hãy nêu phương pháp loại bỏ khí có lẫn trong khí khác và viết các phương trình hóa học a). CO2 có lẫn trong CO. b). SO2 có lẫn trong C2H4. c). SO3 có lẫn trong SO2. d). SO2 có lẫn trong CO2.
3. Có 5 ống nghiệm đựng 5 chất bột riêng biệt gồm: Mg(OH)2, Al(OH)3, BaCl2, Na2CO3,
NaOH. Chỉ được dùng thêm H2O và CO2 hãy trình bày cách nhận biết các chất đó.
Câu 2. (2,0 điểm) 1. Cho sơ đồ: +G B E t0 AH SO đđ xt 2 4 A A 1700C +M D F
Xác định A, B, D, E, F, G, M (là ký hiệu các chất hữu cơ, vô cơ khác nhau), viết các phương
trình phản ứng. Biết: A có thể điều chế từ tinh bột và được dùng để pha chế xăng sinh học E5.
2. Tìm các chất vô cơ thích hợp, hoàn thành các phương trình phản ứng sau: a). (A) + (B)
ot→ (C) rắn, đen
b). (C) + HCl → (D) + (E)↑
c). (A) + HCl → (D) + (F)↑ d). (F) + (B) ot→ (E)↑
e). (G) + (E) → (I) + H2O f). (I) + FeSO4 → (C)↓ + (J)
3. Có các chất lỏng A, B, D, E, F không theo thứ tự gồm: Benzen, ancol etylic, axit axetic,
dung dịch glucozơ, nước. Biết kết quả của những thí nghiệm như sau:
- Cho tác dụng với Na thì E không phản ứng.
- Cho tác dụng với CaCO3 thì chỉ có D phản ứng, có khí thoát ra.
- Cho tác dụng với dung dịch AgNO3/NH3 (hay Ag2O/ NH3) thì B phản ứng tạo ra bạc.
- Khi đốt trong không khí thì A không cháy.
Xác định A, B, D, E, F (không cần viết các phương trình phản ứng).
Câu 3. (2,0 điểm)
1. Có hỗn hợp Na, Ba, Fe, Cu. Bằng phương pháp hóa học hãy tách riêng mỗi kim loại ra
khỏi hỗn hợp (khối lượng mỗi kim loại không thay đổi).
2. A, B, D là các nguyên tố rất phổ biến trong tự nhiên. Hợp chất tạo bởi A và D khi hoà tan
trong nước cho một dung dịch có tính kiềm. Hợp chất của A và B khi hoà tan vào nước có khí
thoát ra. Hợp chất của B và D khi hoà tan trong nước cho dung dịch E có tính axit rất yếu. Hợp
chất của A, B, D không tan trong nước nhưng tan trong dung dịch E. Xác định hợp chất tạo bởi A
với D; A với B, B với D và A, B, D. Viết phương trình phản ứng.
3. Cho các chất Al2O3, Al(NO3)3, NaAlO2, Al2(SO4)3, Al(OH)3, AlCl3, Al. Hãy lựa chọn và
sắp xếp các chất trên thành một dãy chuyển hoá (theo sơ đồ thẳng X → Y →Z → ….T).
Viết phương trình phản ứng minh họa (ghi rõ điều kiện nếu có).
Câu 4. (2,0 điểm) 1/2
1. Hỗn hợp X gồm M và R2O, trong đó M là kim loại thuộc nhóm IIA và R là kim loại
kiềm. Cho m gam hỗn hợp X tan hết vào 400 ml dung dịch HCl 2M (dư), thu được dung dịch Y
chứa 38 gam các chất tan có cùng nồng độ mol.
a. Viết các phương trình phản ứng.
b. Xác định kim loại M và R.
2. Cho m gam Al2O3 tác dụng với dung dịch HCl dư thu được dung dịch X chứa 2 chất tan
có cùng nồng độ mol. Rót từ từ dung dịch NaOH vào dung dịch X, đồ thị biến thiên số mol kết tủa theo số mol NaOH như sau: Số mol Al(OH)3 (a-0,09) Số mol NaOH a 4,25a
Viết các phương trình phản ứng, tính giá trị của m.
Câu 5. (2,0 điểm)
1. Hỗn hợp A gồm ankin X, anken Y và hidrocacbon Z, đốt cháy hoàn toàn m gam A thu
được 20,16 lít CO2 (đktc) và 16,2 gam H2O. Dẫn m gam A đi qua bình đựng dung dịch brom dư
thấy có 0,4 mol Br2 phản ứng. Khí thoát ra khỏi bình brom đem đốt cháy hoàn toàn thu được 13,2
gam CO2 và 7,2 gam H2O. Xác định công thức phân tử của X, Y, Z, tính % thể tích của mỗi chất trong A.
2. Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4, Cu vào dung dịch HCl dư thấy có 2 mol axit
phản ứng, còn lại 0,264a gam chất rắn không tan. Mặt khác khử hoàn toàn a gam hỗn hợp A bằng
H2 dư nung nóng, thu được 84 gam chất rắn.
a. Viết các phương trình phản ứng.
b. Tính % khối lượng Cu trong hỗn hợp A.
H=1, Li=7, C=12, O=16, Na=23, Mg= 24, Al=27, K=39, Ca= 40, Fe=56, Cu=64
-------------HẾT-------------
Thí sinh không được sử dụng tài liệu. Cán bộ coi thi không giải thích gì thêm.
Họ và tên thí sinh..………………………………..; Số báo danh……………………..
HƯỚNG DẪN CHẤM THI VÀO LỚP 10 CHUYÊN NĂM HỌC 2016-2017 2/2 Môn : HOÁ HỌC Câu 1 Ý Nội dung Điểm (2đ) 1.
Hãy chọn 1 đơn chất, 1 oxit, 1 hidroxit và 2 loại muối khác loại nhau đều tác (0,875đ)
dụng được với cả dung dịch HCl và dung dịch NaOH. Viết phương trình phản ứng Hướng dẫn chấm.
Đơn chất: Al hoặc Zn – Oxit Al2O3 hoặc ZnO- Hidroxit Al(OH)3 hoặc 0,175*5
Zn(OH)2. Muối: NaHCO3, Pb(NO3)2 hoặc KHS, (CH3COO)2Mg, AgNO3..... =
Học sinh chọn và viết đúng mỗi trường hợp được 0,125 điểm 0,875 2.
Hãy nêu phương pháp loại bỏ khí có lẫn trong khí khác và viết các phương trình (0,5 đ) hóa học.
a. Loại bỏ khí CO2 có lẫn trong CO
b. Loại bỏ SO2 có lẫn trong C2H4.
c. Loại bỏ SO3 có lẫn trong SO2.
d. Loại bỏ SO2 có lẫn trong CO2 Hướng dẫn chấm.
a. Cho hỗn hợp đi qua dung dịch NaOH dư (hoặc KOH, Ca(OH)2,
Ba(OH)2...dư) thu khí thoát ra. CO2 + 2NaOH→ Na2CO3 + H2O.
b. Cho hỗn hợp đi qua dung dịch Ca(OH)2 dư (hoặc KOH, NaOH ,
Ba(OH)2...dư) thu khí thoát ra. SO2 + Ca(OH)2 → CaSO3 + H2O.
c. Cho hỗn hợp đi qua dung dịch Ba(NO3)2 dư (hoặc BaCl2). SO 0,125*4
3+ H2O+ Ba(NO3)2 → BaSO4+ 2HNO3
d. Cho hỗn hợp đi qua dung dịch nước brom dư = SO 0,5 2+ 2H2O+ Br2→ H2SO4+ 2HBr 3.
Có 5 ống nghiệm đựng 5 chất bột riêng biệt gồm: Mg(OH)2, Al(OH)3, BaCl2, (0,625đ)
Na2CO3, NaOH. Chỉ được dùng thêm H2O, CO2 trình bày cách nhận biết các chất đó. Hướng dẫn chấm.
Hoà tan mỗi chất vào nước, 2 chất không tan là Mg(OH)2, Al(OH)3.
Lấy 3 dung dịch trộn với nhau từng đôi một 2 chất tạo kết tủa là BaCl2, 0,125 Na2CO3
BaCl2 + Na2CO3→BaCO3+ 2NaCl (1) 0,125
Lấy dung dịch NaOH đã biết cho vào 2 chất không tan, chất tan là Al(OH)3. NaOH + Al(OH) 0,125 3→ NaAlO2 +2H2O(2)
Lọc lấy kết tủa ở (1) cho vào nước rồi thổi CO2 dư BaCO 0,125
3 + CO2 +H2O→Ba(HCO3)2 (3)
Lấy dd Ba(HCO3)2 thu được ở (3) cho vào 2 dung dịch là BaCl2, Na2CO3, dd có kết tủa là Na2CO3 Ba(HCO 0,125
3)2 + Na2CO3→BaCO3+ 2NaHCO3
Hoặc thổi CO2 dư vào một trong 2 dung dịch BaCl2 hoặc Na2CO3 rồi rót vào
dung dịch còn lại. Nếu không có kết tủa thì dd đã thổi CO2 vào là Na2CO3 Na2CO3 + CO2 +H2O→2NaHCO3
Nếu có kết tủa thì dung dịch đã thổi CO2 là BaCl2. Câu 2 Nội dung chấm Điểm (2đ) 1. +G 0,125*5 (0,625đ) 1. Cho sơ đồ: B E = t0 0,625 A H SO đđ xt 2 4 A A 1700C +M D F 3/2
Xác định A, B, D, E, F, G, M (là ký hiệu các chất hữu cơ, vô cơ khác nhau ),
viết các phương trình phản ứng. Biết: A có thể điều chế từ tinh bột và được
dùng để pha chế xăng sinh học E5. Hướng dẫn chấm.
C2H5OH→ C2H4 +H2O C2H4 +H2O → C2H5OH (A) (B) (D) (B) (D) (A)
C2H4 +HCl → C2H5Cl 2H2O + 2Na → 2NaOH + H2 (B) (G) (E) (D) (M) (F)
C2H5Cl + NaOH → C2H5OH+ NaCl (E) (F)
Mỗi phương trình 0,125 2.
2. Tìm các chất thích hợp và hoàn thành các phương trình phản ứng sa: 0,125*6 (0,75đ) (a). (A) + (B)
ot→ (C) rắn,đen (b). (C) + HCl → (D) + (E)↑ = 0,75
(c). (A) + HCl → (D) + (F)↑ (d). (F) + (B) ot→ (E)↑
(e). (G) + (E) → (I) + H2O (f). (I) + FeSO4 → (C)↓ + (J) Hướng dẫn chấm. (a). Fe + S
ot→ FeS (b) FeS + 2HCl → FeCl2 + H2S↑
(c). Fe + 2HCl→FeCl2 + H2↑ (d) H2+S → H2S↑
(e).NaOH + H2S→Na2S + H2O (f). Na2S+ FeSO4 →FeS↓+ Na2SO4
Mỗi phương trình 0,125 3.
3Có các chất lỏng A, B, D, E, F không theo thứ tự gồm: Benzen, ancol etylic,
(0,625 đ) axit axetic, dung dịch glucozơ, nước. Biết kết quả của những thí nghiệm như sau:
- Cho tác dụng với Na thì E không phản ứng
- Cho tác dụng với CaCO3 thì chỉ có D phản ứng, có khí thoát ra.
- Cho tác dụng với dung dịch AgNO3/NH3 (hay Ag2O/ NH3 ) thì B có bạc xuất hiện
- Khi đốt trong không khí thì A không cháy.
Xác định A, B, D, E ,F (không cần viết các phương trình phản ứng). Hướng dẫn chấm.
E: C6H6 D: CH3COOH. B: C6H12O6 A. H2O. F: C2H5OH
Mỗi chất đúng 0,125 Câu 3 Ý Nội dung chấm Điểm (2đ) 1.
1. Có hỗn hợp Na, Ba, Fe, Cu. Bằng phương pháp hóa học hãy tách riêng các (0,5 đ)
kim loại ra khỏi hỗn hợp (khối lượng mỗi kim loại vẫn được bảo toàn Hướng dẫn chấm.
Hoà hỗn hợp vào nước dư, lọc lấy riêng phần dd và kết tủa Cu, Fe
NaOH + H2O→ NaOH + 1/2H2; Ba +2H2O → Ba(OH)2 +H2
Thổi CO2 vào dd thu được rồi đun sôi dung dịch, lọc lấy riêng kết tủa và dd
NaOH+CO2→ NaHCO3; Ba(OH)2+ 2CO2 →Ba(HCO3)2 Ba(HCO3)2 ot→ BaCO3+CO2+H2O
Cho riêng kết tủa và dung dịch tác dụng với dd HCl dư, cô cạn 2 dd rồi điện
phân nóng chảy thu được Na, Ba riêng biệt BaCl đpnc đpnc
2 → Ba + Cl2; 2NaCl → 2Na + Cl2
Hoà tan Cu, Fe bằng dd HCl, lọc kết tủa thu được Cu. Điện phân dd FeCl2 thu 4/2 được Fe Fe + 2HCl→FeCl đpdd 2+ H2; FeCl2 → Fe + Cl2
(Hoặc FeCl2 →Fe(OH)2 → Fe(OH)3 →Fe2O3→Fe)
Tách được 1 kim loại 0,125 điểm 2.
2. A, B, D là các nguyên tố rất phổ biến trong tự nhiên . Hợp chất tạo bởi A và . (0,5điểm
D khi hoà tan trong nước cho một dung dịch có tính kiềm. Hợp chất của A và )
B hoà tan vào nước có khí thoát ra. Hợp chất của B và D khi hoà tan trong
nước cho dung dịch E có tính axit rất yếu . Hợp chất A, B, D không tan trong
nước nhưng tan trong dung dịch E. Xác định hợp chất tạo bởi A và D; B và D;
A, B, D. Viết các phương trình phản ứng. Hướng dẫn chấm. 0,125*4 A.Canxi. B. Cacbon. D: Oxi 0,5
CaO + H2O → Ca(OH)2 CaC2 + 2H2O → Ca(OH)2 + C2H2 điểm
CO2+ H2O → H2CO3 CaCO3+CO2+H2O → Ca(HCO3)2 3(1
3. Cho các chất Al2O3, Al(NO3)3, NaAlO2, Al2(SO4)3, Al(OH)3, AlCl3, Al. Hãy . điểm)
lựa chọn chất thích hợp sắp xếp thành một dãy chuyển hoá và viết phương
trình phản ứng minh họa (ghi rõ điều kiện nếu có). Hướng dẫn chấm. Al → Al →
2O3 → NaAlO2 → Al(OH)3 → Al2(SO4)3 AlCl3 → 0,25 Al(NO t 3)3 4Al + 3O2 0→ 2 Al2O3 Al 0,125*6 2O3 + 2NaOH → NaAlO2 + H2O =0,75 NaAlO2 + 2H2O + CO2 → Al(OH)3 + NaHCO3 2Al(OH)3 + 3 H2SO4 → Al2(SO4)3 + 6H2O Al2(SO4)3 + 3 BaCl2 → 2 AlCl3 + 3BaSO4 AlCl3 + 3 Ag NO3 → Al(NO3)3 + 3AgCl 1 điểm Câu 4 Ý Nội dung chấm Điểm (2đ) 1.(1
Hỗn hợp X gồm M và R2O, trong đó M là kim loại thuộc nhóm IIA và R là điểm)
kim loại kiềm. Cho m gam hỗn hợp X tan hết vào 400 ml dung dịch HCl 2M
(dư), thu được dung dịch Y chứa 38 gam các chất tan có cùng nồng độ mol/l.
Viết các phương trình phản ứng, xác định kim loại M và R Hướng dẫn chấm. M + 2HCl → MCl 0,125*2 2+H2 (1) R2O + 2HCl → 2RCl + H2O (2) x 2x x x/2. x x
CM băng nhau thì số mol bằng nhau=> Số mol HCl dư = x
n(HCl)= 2x+ x+ x = 0,8=> x= 0,2 mol. 0,25
0,2.(M +71) + 0,2.(R+ 35,5) + 0,2.36,5= 38 => M + R = 47 0,25
Vậy M là Mg, R là Na hoặc M là Ca, R là Li 0,25 1 điểm 2.(1
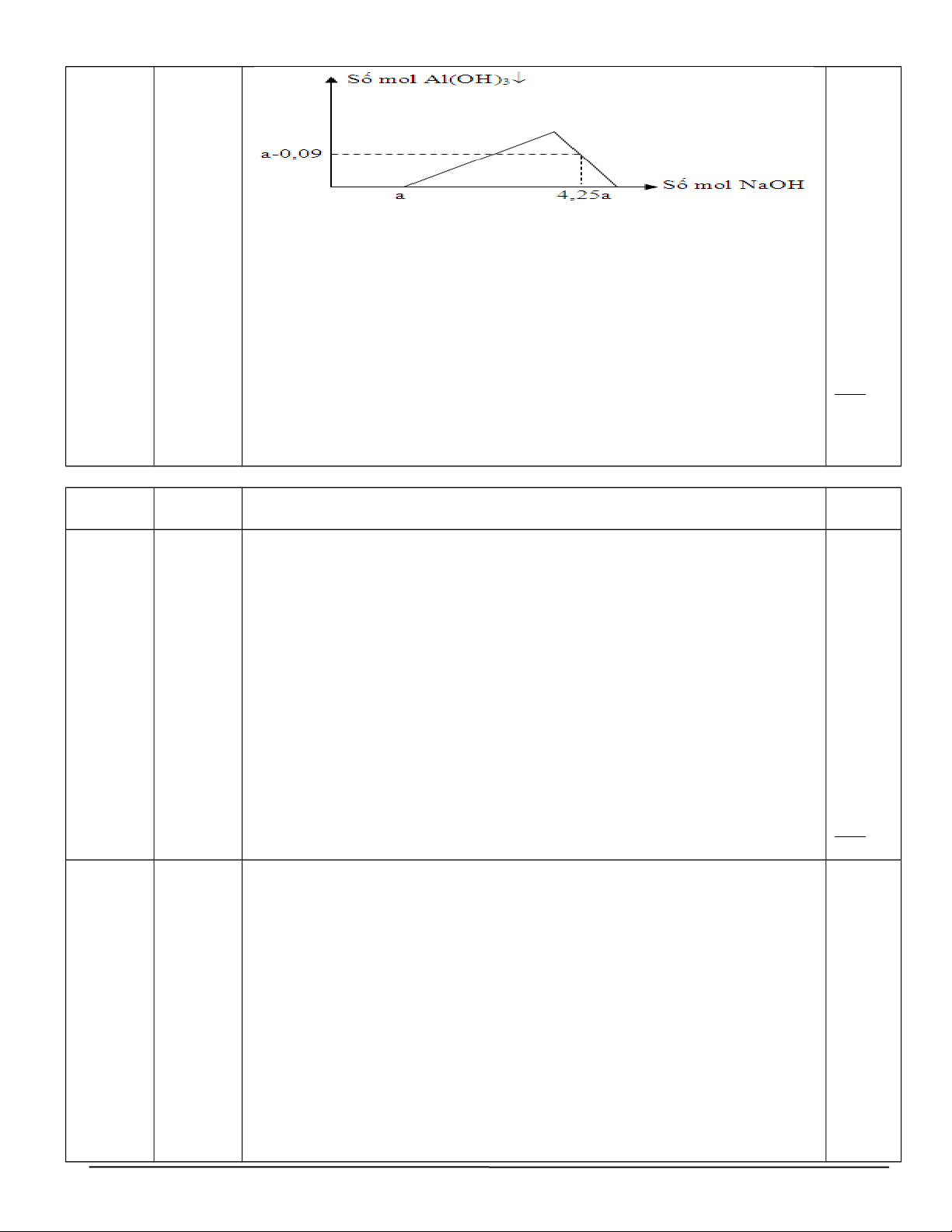
Cho m gam Al2O3 tác dụng với dung dịch HCl dư thu được dung dịch X chứa điểm)
2 chất tan có cùng nồng độ mol. Rót từ từ dung dịch NaOH vào dung dịch X,
ta có đồ thị biến thiên số mol kết tủa theo số mol NaOH như sau: 5/2
Viết các phương trình phản ứng, tính m gam Al2O3 Hướng dẫn chấm. Al2O3 +6HCl
→ 2AlCl3 + 3H2O (1) Dung dịch X chứa n(AlCl3)= n(HCl)= a a/2 a 4pt*0,1 HCl + NaOH
→ NaCl + H2O (2) AlCl3 + 3NaOH → Al(OH)3+ 25= 3NaCl (3) 0,5 a a a 3a a 0,25 Al(OH) 0,25 3+ NaOH → NaAlO2+ 2H2O (4) 0,09 0,09 1 điểm
Theo (2), (3), (4) và đồ thị n(NaOH)= a + 3a + 0,09 = 4,25a => a= 0,36
m(Al2O3)= 0,36*102/2= 18,36 gam Câu 5 Ý Nội dung chấm Điểm (2đ) 1.
Hỗn hợp A gồm ankin X, ankenY và hidrocacbon Z cháy hoàn toàn m gam A (1đ)
thu được 20,16 lít CO2 (đktc) và 16,2 gam H2O . Dẫn m gam A đi qua bình
đựng dung dịch brom dư thấy có 0,4 mol Br2 phản ứng. Khí thoát ra khỏi bình
brom đem đốt cháy hoàn toàn thu được 13,2 gam CO2 và 7,2 gam H2O. Xác
định công thức phân tử của X, Y, Z và tính % V của mỗi chất trong A. Hướng dẫn chấm.
Z là ankan. Khi A cháy n(H2O)=0,9 =n(CO2)=> n(ankin)=n(ankan) Z cháy n(H 0,25
2O)=0,4 ; n(CO2)= 0,3=> Số C của Z= 0,3:(0,4-0,3)= 3 => C3H8 n(CnH2n-2)=0,1 C 5pt*0,1 nH2n-2 + 2Br2
→ CnH2n-2Br4 (1) CmH2m + Br2 → CmH2mBr2 (2) 0,1 0,2 0,2. 0,2 = 0,5 C3H8 → 3CO2 (3) CnH2n-2 → n CO2 (4) CmH2m → m CO2 (5) 0,1 0,3 0,1 0,1n 0,2 0,2m 0,25
n(CO2) = 0,3 + 0,1n + 0,2m = 0,9 => n+ 2m = 6; n=2; m=2 C2H2, C2H4 1đ 2.
Cho a gam hỗn hợp A gồm Fe2O3, Fe3O4 ; Cu vào dung dịch HCl dư thấy có 2 (1đ)
mol axit phản ứng và còn lại 0,264a gam chất rắn không tan. Mặt khác khử
hoàn toàn a gam hỗn hợp A bằng H2 dư nung nóng, thu được 84g chất rắn.
a.Viết các phương trình phản ứng.
b.Tính % khối lượng Cu trong hỗn hợp A. Hướng dẫn chấm.
a. Đặt hỗn hợp là FeO, Fe2O3 số mol x,y FeO + 2HCl → FeCl 5pt*0,1 2 + H2O (1) Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2) x 2x y 6y 2y 25=0,6 Cu + 2FeCl 25 3 → 2FeCl2 + CuCl2 (3) y 2y FeO + H2
→ Fe + H2O (4) Fe2O3 + 3H2 → 2Fe + 3H2O (5) x x x x y 3y 2y 3y
b. Theo (1), (2) và (4), (5) n(H2) =n(HCl)/2= 1mol= n(H2O ở 4,5) 6/2
Áp dụng định luật bảo toàn khối lượng với (4), (5)=> a + 2= 84 + 18 => a= 100 gam. m(Cu dư)= 0,264*100=26,4 gam Theo (1), (2), (3) 0,125 2x + 6y = 2 (6)
72x + 160y + 64y = 100-26,4 => 72x + 224y = 73,6 (7)
Giải (6), (7) => x=0,4 y= 0,2
%m(Cu)= (0,2*64 +26,4)100/100= 39,2% 0,125 0,125 0,125 0,125 1 điểm 7/2



