





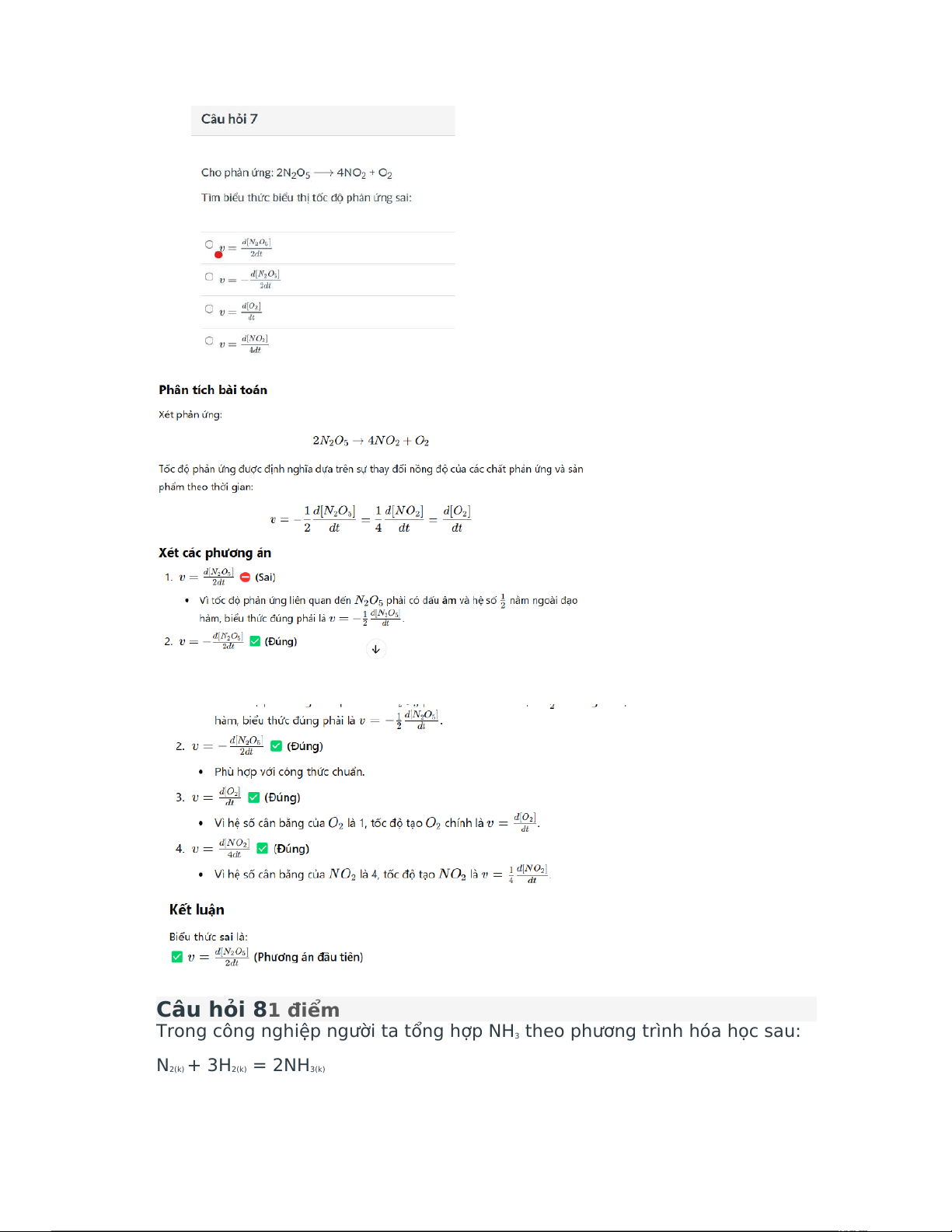





Preview text:
Tính ΔGo 0
298trong sự hình thành 1 mol nước lỏng biết S của H2, O2và H2O(l)
lần lượt là 130,684 J/K.mol; 205,133 J/K.mol; 69,901 J/K.mol và D(H2O lỏng)= - 285,83 (KJ/mol)
Nhóm lựa chọn câu trả lời -213,548 kJ -206,587 kJ 213,584 kJ -237,155 kJ
Một phản ứng có năng lượng hoạt hóa 30.000 cal/mol. Tốc độ phản ứng sẽ
tăng lên bao nhiêu lần khi tăng nhiệt độ từ 20oC lên 30oC.
Nhóm lựa chọn câu trả lời 60,1 0,41 5,47 251,6
Một phản ứng bậc 1, ở nhiệt độ 27oC nồng độ ban đầu giảm ½ sau 5000
giây, còn ở nhiệt độ 37oC nồng độ ban đầu giảm ½ sau 1000 giây. Tính
năng lượng hoạt hóa của phản ứng.
Nhóm lựa chọn câu trả lời 1336,7 kJ/mol 319,5 kJ/mol 29740,9 kJ/mol 124,4 kJ/mol Câu hỏi 41điểm
Ở 1000K hằng số cân bằng Kpcủa phản ứng: 2SO + O -1
2= 2SO3 K = 3,50 (atm p ) 2
Nếu áp suất chung của hệ bằng 1atm và áp suất cân bằng của O2là 0,1
(atm) thì áp suất riêng lúc cân bằng của SO2và O2lần lượt là:
Nhóm lựa chọn câu trả lời 0,63 (atm); 0,33 (atm) 0,1 (atm); 0,15 (atm) 0,57 (atm); 0,33 (atm) 0,24 (atm); 0,12 (atm) Câu hỏi 51điểm
Đối với phản ứng: 2NOCl = 2NO + Cl2
Năng lượng hoạt hóa bằng 100Kj/mol. Ở 350K hằng số tốc độ bằng 8.10- 6 -1 -1
mol .1.s . Hằng số tốc độ ở 400K là:
Nhóm lựa chọn câu trả lời 5,9.10-4mol-1.1.s-1 3,74.10-6 mol-1.1.s-1 1,49.10-7 mol-1.1.s-1 2,6.10-5mol-1.1.s-1 Câu hỏi 61điểm
Xét sự thủy phân este trong môi trường kiềm: RCOOR' + NaOH = RCOONa + R'OH
Khi tăng nồng độ kiềm gấp đôi thì tốc độ phản ứng tăng lên 2 lần. Nhận
xét này cũng đúng khi tăng nồng độ kiêm gấp 2 lần. Bậc của phản ứng là:
Nhóm lựa chọn câu trả lời Bậc 3 Bậc 2 Bậc 1 Bậc 4 Câu hỏi 81điểm
Trong công nghiệp người ta tổng hợp NH3theo phương trình hóa học sau: N + 3H2(k)= 2NH 2(k) 3(k)
Khi tăng nồng độ H2lên 2 lần (giữ nguyên nồng độ của khí N2và nhiệt độ
của phản ứng) thì tốc độ phản ứng tăng lên bao nhiêu lần?
Nhóm lựa chọn câu trả lời 8 lần 4 lần 16 lần 2 lần
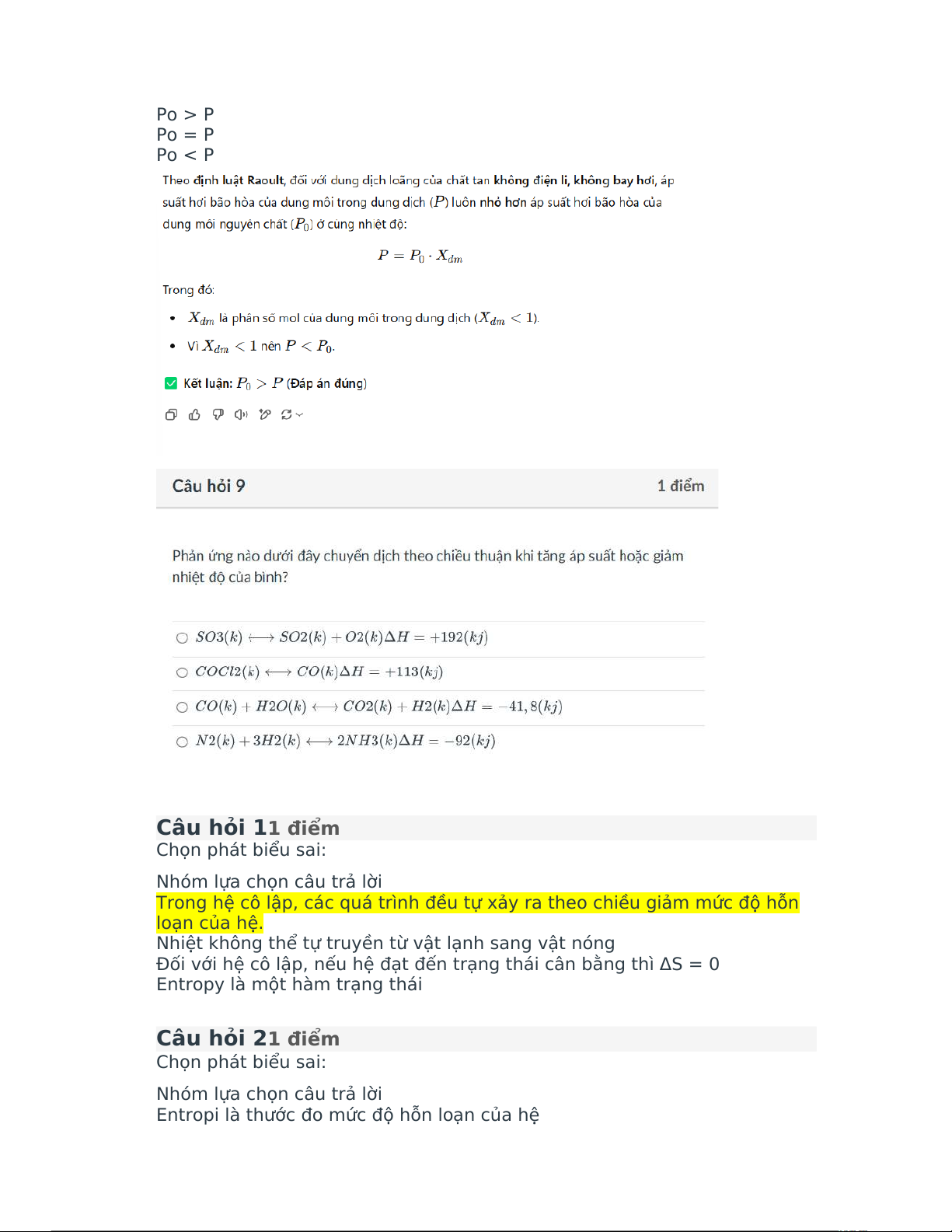
Trong dung dịch loãng của chất tan không điện li, không bay hơi, nếu kí
hiệu P là áp suất của dung môi trong dung dịch và Polà áp suất của dung
môi nguyên chất ở cùng nhiệt độ, ta luôn có:
Nhóm lựa chọn câu trả lời
Po có thể > P hoặc Po < P tùy từng trường hợp Po > P Po = P Po < P Câu hỏi 11điểm Chọn phát biểu sai:
Nhóm lựa chọn câu trả lời
Trong hệ cô lập, các quá trình đều tự xảy ra theo chiều giảm mức độ hỗn loạn của hệ.
Nhiệt không thể tự truyền từ vật lạnh sang vật nóng
Đối với hệ cô lập, nếu hệ đạt đến trạng thái cân bằng thì ΔS = 0
Entropy là một hàm trạng thái Câu hỏi 21điểm Chọn phát biểu sai:
Nhóm lựa chọn câu trả lời
Entropi là thước đo mức độ hỗn loạn của hệ
Entropi của hệ ở trạng thái khí lớn hơn entropi của hệ ở trạng thái lỏng
Entropi của hệ tăng khí áp suất tăng
Entropi của hệ tăng khi nhiệt độ tăng Câu hỏi 31điểm
Chọn phát biểu đúng:
Nhóm lựa chọn câu trả lời
Biến thiên của hàm trạng thái chỉ phụ thuộc vào cách tiến hành quá trình
Biến thiên của hàm trạng thái chỉ phụ thuộc vào trạng thái đầu và trạng
thái cuối của hệ mà không phụ thuộc vào cách tiến hành quá trình
Biến thiên của hàm trạng thái chỉ phụ thuộc vào trạng thái đầu
Biến thiên của hàm trạng thái chỉ phụ thuộc vào trạng thái cuối Câu hỏi 41điểm
Xét hệ phản ứng: N2(k) + O2(k) = 2 NO (k) có ΔH < 0. Phản ứng được thực
hiện trong bình kín có thể tích không đổi, sau phản ứng hệ được đưa về
nhiệt độ ban đầu. Hệ như thế là :
Nhóm lựa chọn câu trả lời Hệ mở và đồng thể Hệ kín và dị thể Hệ kín và đồng thể
Hệ cô lập và đồng thể Câu hỏi 51điểm
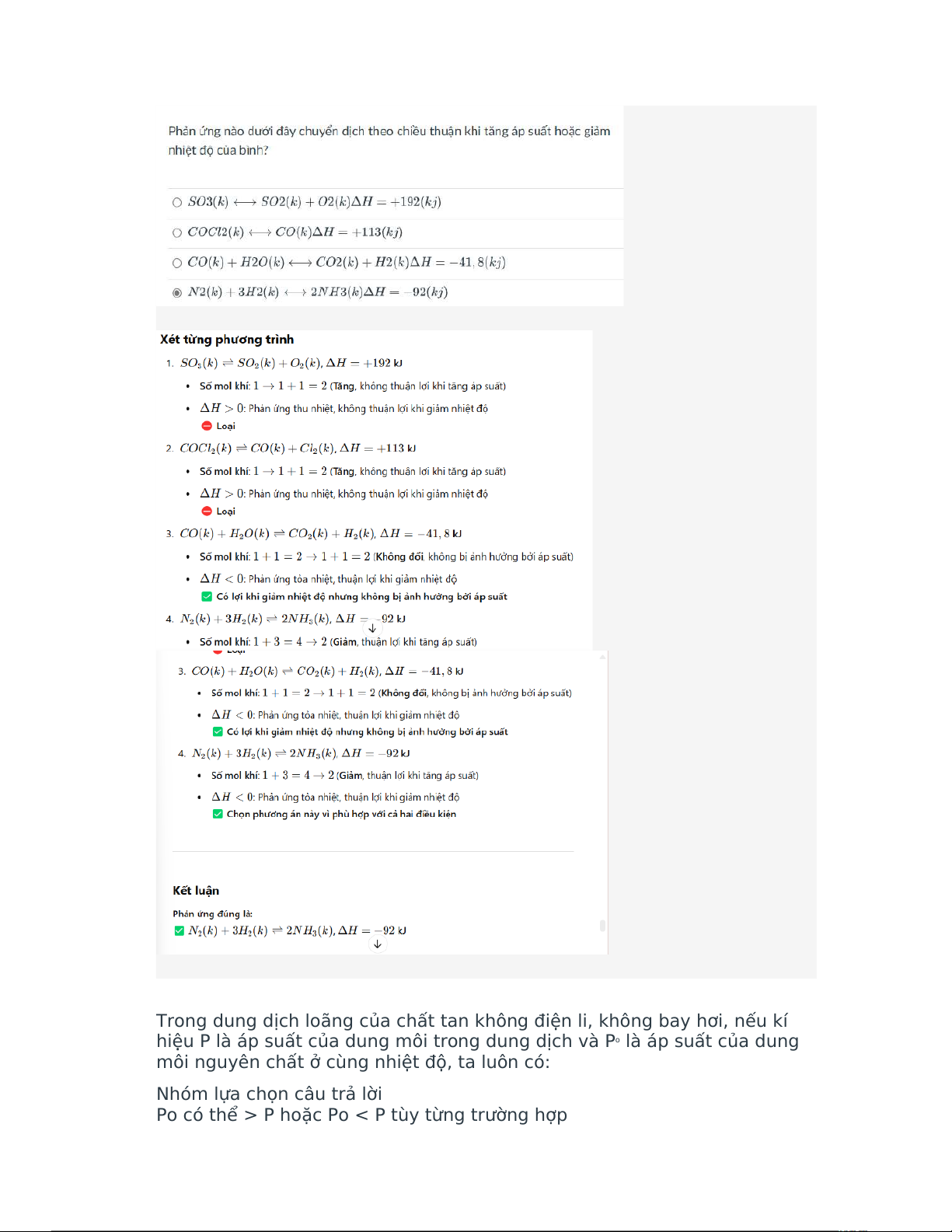
Cho phản ứng hóa học sau:
2SO2(k)+O2(k) SO3(k)ΔH=−198(Kj) ⟷
Ở nhiệt độ thường phản ứng xảy ra rất chậm. Để thu được nhiều sản
phẩm SO3, ta cần tiến hành biện pháp nào dưới đây:
Nhóm lựa chọn câu trả lời
Giảm nhiệt độ, tăng áp suất bình Tăng nhiệt độ Tăng nồng độ oxi
Giảm áp suất bình phản ứng Câu hỏi 61điểm
Xét sự thủy phân este trong môi trường kiềm: RCOOR′+NaOH RCOONa+R′OH ⟷
Khi tăng nồng độ kiềm hoặc nồng độ este gấp đôi thì tốc độ phản ứng tăng lên mấy lần:
Nhóm lựa chọn câu trả lời 2 lần 4 lần 1 lần 3 lần Câu hỏi 71điểm
Cặp nào sau đây không phải là axit-bazơ liên hợp?
Nhóm lựa chọn câu trả lời HCO -, CO 2- 3 3 H O+, H2O 3 NH +, NH 4 3 H O+, OH- 3 Câu hỏi 81điểm
Tính nhiệt đốt cháy của C H 2
2(k), biết nhiệt tạo thành tiêu chuẩn (Kcal/mol) của C H 2
2(k), CO2(k) và H2O (l) tương ứng là 54,3; -94,1 và -68,3 C H + 2O 2 2CO ⟶ 2 + H2O 2 2
Nhóm lựa chọn câu trả lời 216,7 kcal/mol -310,82 kcal/mol -216,7 kcal/mol 310,82 kcal/mol Câu hỏi 91điểm
Tính hiệu ứng nhiệt của phản ứng C(r) + H O(k) (k) 2 CO(k) + H ⟶ 2 Biết C(r) + 1/2O (k) 2 CO(k) ΔH ⟶ 1= -26,42 kcal H (k) H 2(k) + 1/2O2 ⟶
2O(k) ΔH2= -57,8 kcal
Nhóm lựa chọn câu trả lời -84,22 kcal 84,22 kcal 31.38 kcal -31.38 kcal Câu hỏi 101điểm
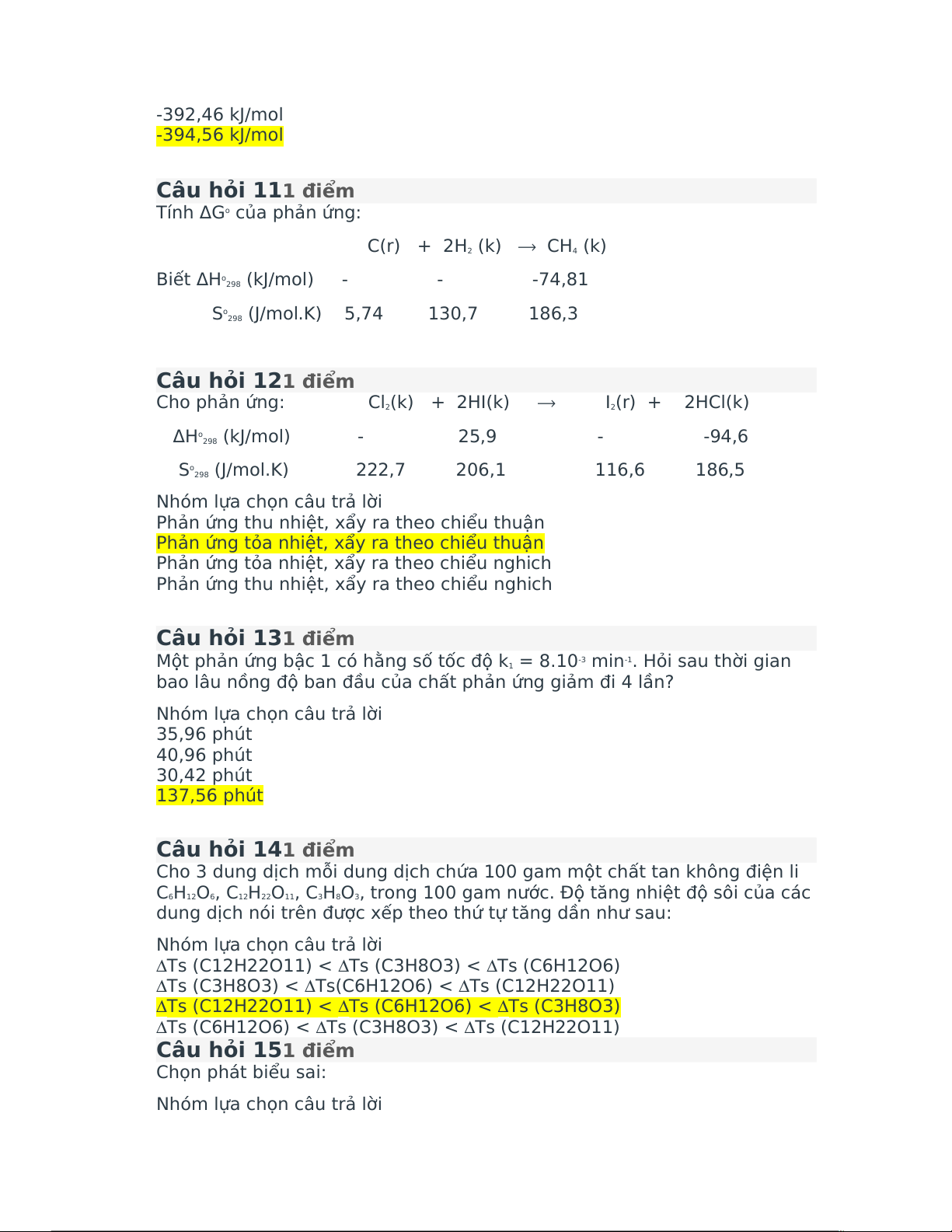
Tính ΔHocủa phản ứng ở 1500 K:
C (graphit) + O (k) 2(k) CO ⟶ 2
ΔHo (kJ/mol) 0 0 -393,51 298
Co (J/mol.K) 8,64 29,36 37,13 p
Nhóm lựa chọn câu trả lời 392,46 kJ/mol 394,56 kJ/mol -392,46 kJ/mol -394,56 kJ/mol Câu hỏi 111điểm
Tính ΔGocủa phản ứng:
C(r) + 2H2(k) ⟶CH4(k)
Biết ΔHo298(kJ/mol) - - -74,81
So298(J/mol.K) 5,74 130,7 186,3 Câu hỏi 121điểm
Cho phản ứng: Cl2(k) + 2HI(k) I ⟶ 2(r) + 2HCl(k)
ΔHo298(kJ/mol) - 25,9 - -94,6
So298(J/mol.K) 222,7 206,1 116,6 186,5
Nhóm lựa chọn câu trả lời
Phản ứng thu nhiệt, xẩy ra theo chiểu thuận
Phản ứng tỏa nhiệt, xẩy ra theo chiểu thuận
Phản ứng tỏa nhiệt, xẩy ra theo chiểu nghich
Phản ứng thu nhiệt, xẩy ra theo chiểu nghich Câu hỏi 131điểm
Một phản ứng bậc 1 có hằng số tốc độ k -3min-1 1= 8.10 . Hỏi sau thời gian
bao lâu nồng độ ban đầu của chất phản ứng giảm đi 4 lần?
Nhóm lựa chọn câu trả lời 35,96 phút 40,96 phút 30,42 phút 137,56 phút Câu hỏi 141điểm
Cho 3 dung dịch mỗi dung dịch chứa 100 gam một chất tan không điện li C H O , C O , C
O , trong 100 gam nước. Độ tăng nhiệt độ sôi của các 12 6 12H22 11 3H 6 8 3
dung dịch nói trên được xếp theo thứ tự tăng dần như sau:
Nhóm lựa chọn câu trả lời ∆Ts (C12H22O11) < ∆ ∆ Ts (C3H8O3) < Ts (C6H12O6) ∆Ts (C3H8O3) < ∆ ∆
Ts(C6H12O6) < Ts (C12H22O11)
∆Ts (C12H22O11) < ∆Ts (C6H12O6) < ∆Ts (C3H8O3)
∆Ts (C6H12O6) < ∆Ts (C3H8O3) < ∆Ts (C12H22O11) Câu hỏi 151điểm Chọn phát biểu sai:
Nhóm lựa chọn câu trả lời
Độ giảm nhiệt độ đông đặc của dung dịch tỷ lệ thuận với nồng độ molan
của chất tan trong dung dịch
Nồng độ dung dịch càng lớn, độ hạ áp suất hơi tương đối càng lớn, nhiệt độ sôi càng cao
Độ tăng nhiệt độ sôi của dung dịch tỷ lệ thuận với nồng độ molan của chất tan trong dung dịch
Độ giảm tương đối áp suất hơi bão hòa của dung dịch bằng nồng độ phần
mol của dung môi trong dung dịch Câu hỏi 161điểm
Một phản ứng có hệ số nhiệt độ γ=3,1. Hỏi khi tăng nhiệt độ thêm 40oC
tốc độ phản ứng tăng lên bao nhiêu lần.
Nhóm lựa chọn câu trả lời 30,13 lần 83,49 lần 26,44 lần 92,35 lần Câu hỏi 171điểm
Tính nhiệt hình thành tiêu chuẩn của CH3OH(l), biết rằng: C(r) + O o
2(k) = CO2(k) có ΔH 1= -94 kcal/mol. H (k) + 0,5O o
2(k) = H2O(l) có ΔH 2= -68,5 kcal/mol. 2 CH OH(l) + 1,5O o
2(k) = CO2(k) + 2H2O (l) có ΔH 3= -171 kcal/mol. 3
Nhóm lựa chọn câu trả lời 60 kcal/mol 402 kcal/mol -402 kcal/mol -60 kcal/mol Câu hỏi 181điểm
Đối với phản ứng: 2NOCl = 2NO + Cl2
Năng lượng hoạt hóa bằng 100Kj/mol. Ở 350K hằng số tốc độ bằng 8.10- 6 -1 -1
mol .1.s . Hằng số tốc độ ở 400K là:
Nhóm lựa chọn câu trả lời 1,49.10-7 mol-1.1.s-1 3,74.10-6 mol-1.1.s-1 2,6.10-5mol-1.1.s-1 5,9.10-4mol-1.1.s-1
Câu hỏi 191điểm
Khối lượng NaOH cần dùng để pha chế 300ml dung dịch NaOH có pH = 10 là:
Nhóm lựa chọn câu trả lời 18.10-4 gam 6.10-4 gam 8.10-4 gam 12.10-4 gam Câu hỏi 201điểm Chọn phát biểu sai.
Nhóm lựa chọn câu trả lời
Các chất có cấu tạo phân tử giống nhau thì tan tốt vào nhau.
Khi tăng nhiệt độ thì độ tan của chất khí vào chất lỏng tăng lên.
Ở nhiệt độ không đổi, độ tan của chất khí tỷ lệ thuận với áp suất riêng
phần của nó trên chất lỏng.
Dung dịch quá bão hòa là dung dịch chứa lượng chất tan nhiều hơn so với
của dung dịch bão hòa trong cùng điều kiện.



