Preview text:
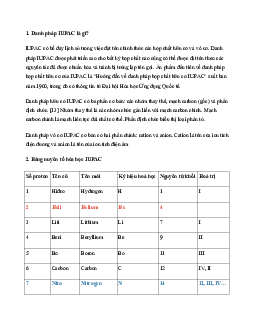
Giải Hóa 10 Cánh Diều
Bài 4: Mô hình nguyên tử và Orbital nguyên tử
Mở đầu trang 21 Hóa 10 Cánh diều
Trong lịch sử các thuyết về mô hình nguyên tử, có mô hình hành tinh nguyên tử và mô hình
hiện đại nguyên tử. Theo em, trong hai hình bên, hình nào thể hiện mô hình hành tinh
nguyên tử, hình nào thể hiện mô hình hiện đại của nguyên tử?
Hướng dẫn trả lời câu hỏi
Hình a) thể hiện mô hình hiện đại của nguyên tử. Trong mô hình hiện đại của nguyên tử các
electron chuyển động không theo quỹ đạo cố định. Electron chuyển động rất nhanh trong cả
khu vực không gian xung quanh hạt nhân với xác xuất tìm thấy là khác nhau, sự chuyển
động này tạo nên một hình ảnh giống như một đám mây electron.
Hình b) thể hiện mô hình hành tinh nguyên tử. Trong mô hình này các electron chuyển động
theo quỹ đạo giống như các hành tinh quay xung quanh mặt trời.
A. Trả lời câu hỏi và thảo luận
Câu 1 trang 21 SGK Hóa 10 Cánh diều
Electron chuyển từ lớp gần hạt nhân ra lớp xa hạt nhân thì phải thu hay giải phóng năng lượng? Giải thích.
Hướng dẫn trả lời câu hỏi
Electron ở càng xa hạt nhân thì năng lượng càng cao
=> Electron ở gần hạt nhân có mức năng lượng thấp hơn electron ở xa hạt nhân
=> Electron cần phải thu năng lượng để có thể chuyển từ lớp gần ra lớp xa hạt nhân
Câu 2 trang 23 SGK Hóa 10 Cánh diều
Theo em, xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là
khoảng bao nhiêu phần trăm.
Hướng dẫn trả lời câu hỏi
Xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây là khoảng 10%
Câu 3 trang 23 SGK Hóa 10 Cánh diều
Khái niệm AO xuất phát từ mô hình Rutherford – Bohr hay mô hình hiện đại về nguyên tử?
Hướng dẫn trả lời câu hỏi
Khái niệm AO xuất phát từ mô hình hiện đại nguyên tử.
Câu 4 trang 23 SGK Hóa 10 Cánh diều
Chọn phát biểu đúng về electron s.
A. Là electron chuyển động chủ yếu trong khu vực không gian hình cầu.
B. Là electron chỉ chuyển động trên một mặt cầu.
C. Là electron chỉ chuyển động trên một đường tròn.
Hướng dẫn trả lời câu hỏi
Electron s hay gọi là AO s là Là electron chuyển động chủ yếu trong khu vực không gian hình cầu Đáp án A
B. Trả lời câu hỏi luyện tập
Dựa theo mô hình nguyên tử của Rutherford – Bohr, hãy vẽ mô hình nguyên tử các nguyên tố có Z từ 1 đến 11.
Hướng dẫn trả lời câu hỏi
C. Giải bài tập trang 25 SGK Hóa 10 Cánh diều
Bài 1 trang 25 SGK Hóa 10 Cánh diều
Những phát biểu nào sau đây là đúng khi nói về mô hình Rutherford – Bohr?
(a). Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
(b). Electron không chuyển động theo quỹ đạo cố định mà trong cả khu vực không gian xung quanh hạt nhân.
(c). Electron không bị hút vào hạt nhân do còn chịu tác dụng của lực quán tính li tâm.
Hướng dẫn giải bài tập
(a) Đúng vì theo mô hình Rutherford – Bohr thì electron quay xung quanh hạt nhân theo
những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
(b) Sai vì theo mô hình hiện đại thì electron chuyển động xung quanh hạt nhân không theo
những quỹ đạo cố định.
(c) Đúng vì theo mô hình Rutherford – Bohr, các electron mang điện tích âm nhưng không
bị hút vào hạt nhân bởi lực hút này cân bằng với lực quán tính li tâm.
>> Thảo luận thêm đáp án tại: Những phát biểu nào sau đây là ....
Bài 2 trang 25 SGK Hóa 10 Cánh diều
Nguyên tử Li (Z = 3) có 2 electron ở lớp K và 1 electron ở lớp L. So sánh năng lượng của
electron giữa hai lớp theo mô hình Rutherford – Bohr.
Hướng dẫn trả lời câu hỏi
Năng lượng của electron của lớp K thấp hơn năng lượng của electron ở lớp L.
Bài 3 trang 25 SGK Hóa 10 Cánh diều
Sử dụng mô hình Rutherford – Bohr, hãy cho biết khi electron của nguyên tử H hấp thụ một
năng lượng phù hợp, electron đó sẽ chuyển ra xa hay tiến gần vào hạt nhân hơn. Giải thích.
Hướng dẫn trả lời câu hỏi
Electron của nguyên tử H hấp thụ một năng lượng phù hợp, electron đó sẽ chuyển ra xa hạt
nhân hơn do năng lượng càng cao thì electron ở càng xa hạt nhân
Bài 4 trang 25 SGK Hóa 10 Cánh diều
Từ khái niệm: Orbital nguyên tử là khu vực không gian xung quanh hạt nhân nguyên tử mà
xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%). Phát biểu sau đây có
đúng không: Xác suất tìm thấy electron tại mỗi điểm trong không gian của AO là 90%.
Hướng dẫn trả lời câu hỏi
Đúng vì xác suất tìm thấy electron trong khu vực không gian của AO là lớn nhất (khoảng 90%).
Bài 5 trang 25 SGK Hóa 10 Cánh diều
Trả lời những câu hỏi sau đây liên quan đến mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
a) Vì sao còn gọi mô hình Rutherford – Bohr là mô hình hành tinh nguyên tử?
b) Theo mô hình hiện đại, orbital p có hình số tám nổi với hai phần (còn gọi là hai thùy)
giống hệt nhau. Xác suất tìm thấy electron ở mỗi thùy là khoảng bao nhiêu phần trăm?
c) So sánh sự giống và khác nhau giữa mô hình Rutherford – Bohr và mô hình hiện đại về nguyên tử.
Hướng dẫn trả lời câu hỏi
a) Vì mô hình biểu diễn electron quay xung quanh hạt nhân theo những quỹ đạo giống như
các hành tinh quay xung quanh Mặt Trời nên được gọi là mô hình hành tinh nguyên tử.
b) Xác suất tìm thấy electron ở mỗi thùy của orbital p là khoảng 90%.
Giống nhau: Cả hai đều mô tả sự chuyển động của electron xung quanh hạt nhân. Khác nhau:
Mô hình Rutherford - Bohr.: Electron chuyển động theo quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời
Mô hình hiện đại về nguyên tử: Electron chuyển động không theo quỹ đạo cố định.