



Preview text:
Giải Hóa 9 Bài 12: Mối quan hệ giữa các loại chất vô cơ
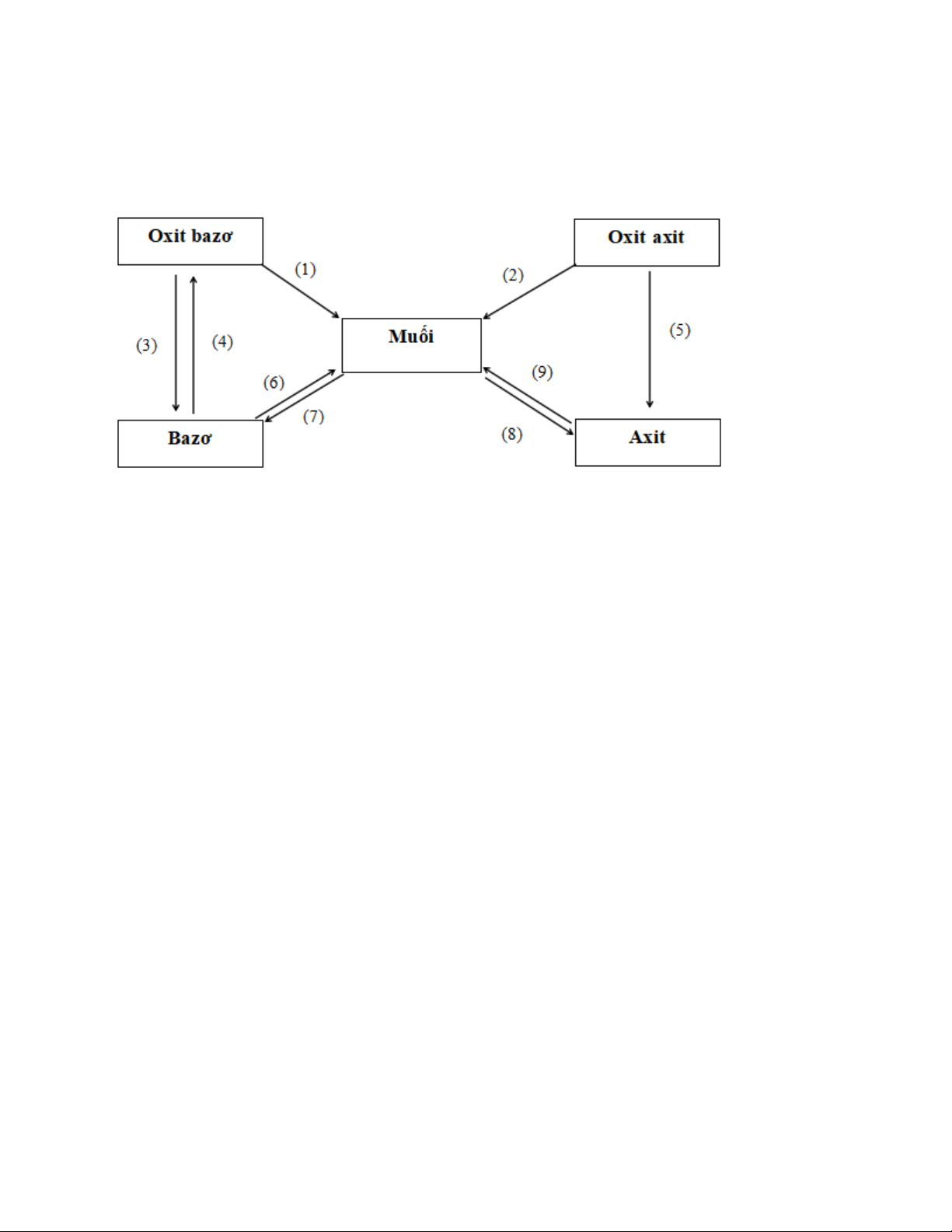
A. Mối quan hệ giữa các loại hợp chất vô cơ
B. Giải bài tập sách giáo khoa Hóa 9 trang 41
Bài 1 trang 41 sgk hóa 9 bài 12
Chất nào trong những thuốc thử sau đây có thể dùng để phân biệt dung dịch natri
sunfat và dung dịch natri cacbonat? a) Dung dịch bari clorua.
b) Dung dịch axit clohiđric. c) Dung dịch chì nitrat. d) Dung dịch bạc nitrat.
e) Dung dịch natri hiđroxit.
Hướng dẫn giải bài 1
Thuốc thử phải chọn sao cho khi cho vào Na2SO4 và Na2CO3 phải gây ra hiện tượng
khác biệt, dễ nhận thấy.
Không dùng BaCl2 và Pb(NO3)2 vì đều xảy ra phản ứng và tạo kết tủa có màu giống nhau.
Không dùng AgNO3, vì đều xảy ra phản ứng, hiện tượng không khác nhau rõ rệt;
Ag2CO3 không tan, Ag2SO4 ít tan và có màu giống nhau.
Không dùng NaOH, vì đều không phản ứng, không có hiện tượng gì. Thuốc thử
dùng được là dung dịch HCl ví HCl tác dụng với Na2CO3 có xuất hiện bọt khí và
không tác dụng với Na2SO4.
2HCl + Na2CO3 → 2NaCl + CO2↑ H2O.
Bài 2 trang 41 sgk hóa 9 bài 12
a) Cho các dung dịch sau đây lần lượt phản ứng với nhau từng đôi một, hãy ghi
dấu (x) nếu có phản ứng xảy ra, số 0 nếu không có phản ứng. NaOH HCl H2SO4 CuSO4 HCl Ba(OH)2
b) Viết các phương trình hóa học (nếu có).
Hướng dẫn giải bài 2
a) Phản ứng giữa các dung dịch trên đều thuộc loại phản ứng trao đổi, muốn xảy ra
được sản phẩm phải có chất không tan, chất khí hoặc H2O. NaOH HCl H2SO4 CuSO4 x 0 0 HCl x 0 0 Ba(OH)2 0 x x
b) Các phương trình hóa học:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓ HCl + NaOH → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
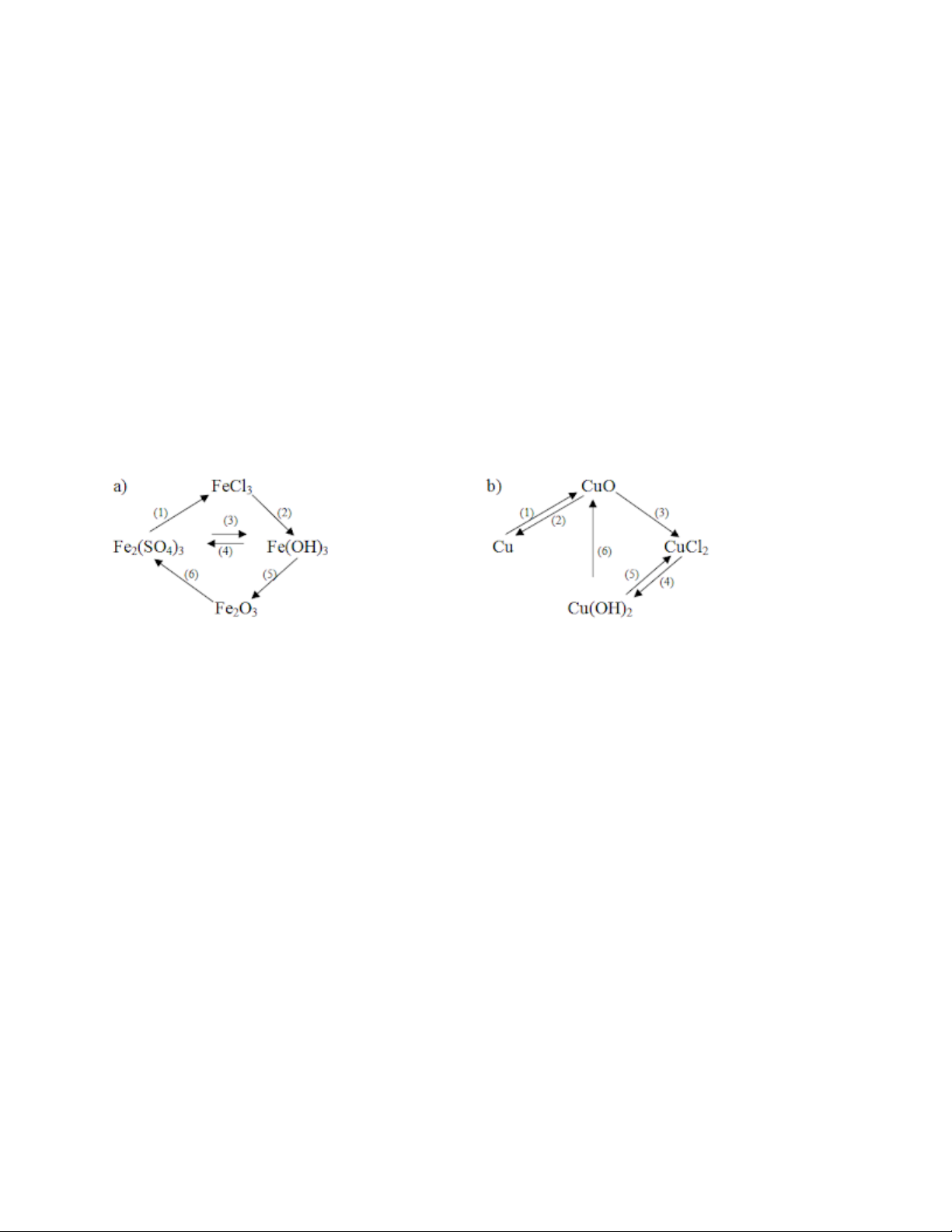
Bài 3 trang 41 sgk hóa 9 bài 12
Viết phương trình hóa học cho những chuyển đổi hóa học sau:
Hướng dẫn giải bài 3
a) (1) Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4↓
(2) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
(3) Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
(4) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O (5) 2Fe(OH)3 → Fe2O3 + 3H2O
(6) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O b) (1) 2Cu + O2 → 2CuO (2) CuO + H2 → Cu+ H2O
(3) CuO + 2HCl → CuCl2 + H2O
(4) CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
(5) Cu(OH)2 + 2HCl → CuCl2 + 2H2O (6) Cu(OH)2 → CuO + H2O
Bài 4 trang 41 sgk hóa 9 bài 12
Có những chất: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl.
a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển đổi hóa học.
b) Viết các phương trình hóa học cho dãy chuyển đổi hóa học ở câu a.
Hướng dẫn giải bài 4
a) Dãy chuyển hóa trên có thể là:
b) Các phương trình hóa học: 4Na + O2 → 2Na2O Na2O + H2O → 2NaOH 2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Na2CO3 + BaCl2 → 2NaCl + BaSO4↓
C. Trắc nghiệm Hóa 9 bài 12
Câu 1. Dãy chất nào dưới đây không phản ứng được với H2SO4 loãng A. NaHCO3, NaCl, BaCl2, SO2 B. CuCl2, NaOH, Na2CO3, BaO C. Na2CO3, BaCl2, BaO, NaOH D. SO2, CuO, NaOH, BaCl2
Câu 2. Cho sơ đồ chuyển hóa sau: MgO HCl X → Y → Z → MgO
X, Y, Z có thể lần lượt là:
A. MgCl2, Mg(NO3)2 và Mg(OH)2 B. MgCl2, Mg(OH)2 và MgCO3 C. MgCl2, MgCO3 và Mg(OH)2 D. MgCl2, Mg(OH)2 và Mg
Câu 3. Cho 12,6 gam Na2SO3 tác dụng với H2SO4 dư. Thể tích SO2 thu được (đktc) là: A. 1.12 lít B. 2,24 lít C. 4,48 lít D. 3,36 lít
Câu 4. Có thể dùng dung dịch nào sau đây để phân biệt được 3 chất bột: CaO, CaCO3 và BaSO4 A. HCl B. NaOH C. KCl D. BaCl2
Câu 5. Cho các chất: Na2CO3, NaOH, NaHCO3, H2SO4, Ca(HCO3)2, NH4Cl, CaO A. 4 B. 3 C. 5 D. 2
Câu 6. NaOH không được tạo thành trong thí nghiệm nào sau đây?
A. Cho kim loại Na tác dụng với H2O
B. Cho oxit kim loại Na2O tác dụng với H2O
C. Cho Na2O tác dụng với dung dịch HCl
D. Cho Na2SO4 tác dụng với Ba(OH)2
Câu 7. Cho các chất: SO2, NaOH, MgCO3, CaO và HCl. Số cặp chất phản ứng được với nhau là: A. 2 B. 4 C. 3 D. 5
Câu 8. Thí nghiệm nào dưới đây không tạo ra muối
A. Cho bột CuO tác dụng với dung dịch HCl
B. Cho Fe tác dụng với dung dịch HCl
C. Cho muối NaCl tác dụng với AgNO3
D. Cho Ag tác dụng với H2SO4 loãng




