



Preview text:
GIẢI BÀI TẬP SGK TRANG 21 HÓA HỌC 9
BÀI 5: LUYỆN TẬP TÍNH CHẤT HÓA HỌC OXIT VÀ AXIT
A. Tóm tắt nội dung kiến thức trọng tâm
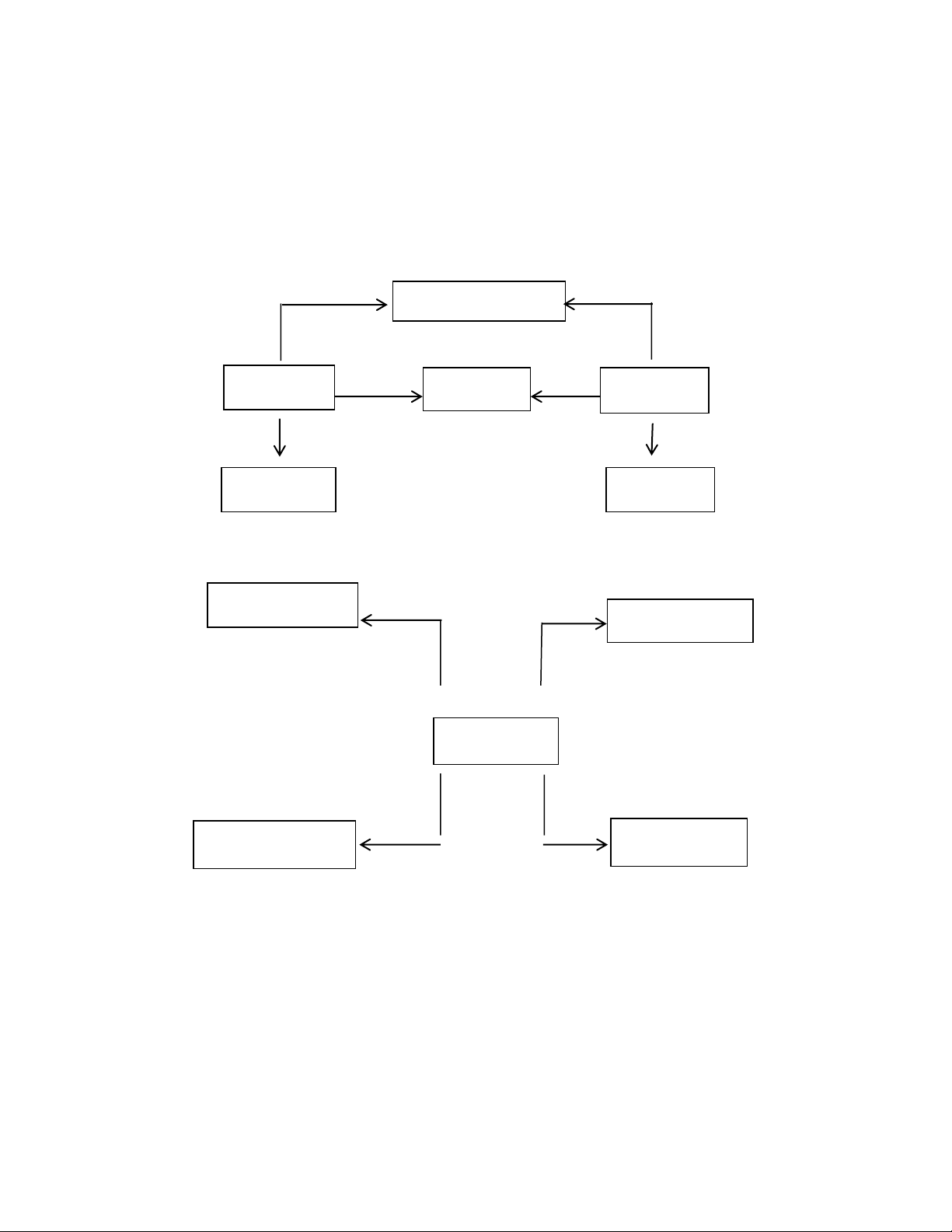
1. Tính chất hóa học của oxit + Axit + Bazơ (dd) Muối + nước Oxit bazơ Muối Oxit axit
(4) + Nước + nước (5) Bazơ (dd) Axit (dd)
2. Tính chất hóa học của axit Muối + hidro
+ Kim loại + quỳ tím Màu đỏ (1) Axit (2) (3) Muối + nước Muối + nước
+ oxit bazơ + Bazơ
Lưu ý: H2SO4 có những tính chất hóa học riêng
- Tác dụng với kim loại không giải phóng khí hidro
2H2SO4 (đặc) + Cu → CuSO4 + 2H2O + SO2
- Tính háo nước, hút ẩm: C H SO d 12H22O11 2 4 12C + 11H2O
B. Giải bài tập Hóa 9 bài 5 SGK trang 21
Bài 1: (Trang 21 SGK Chương 1 – Hóa học lớp 9)
Có những oxit sau: SO2, CuO, CaO, Na2O, CO2. Hãy cho biết những oxit
nào tác dụng được với a) Nước b) Axit clohiđric c) Natri hiđroxit
Viết các phương trình hóa học.
Hướng dẫn giải bài 1
a) Những oxit tác dụng với nước là: SO2, Na2O, CO2 SO2 + H2O → H2SO3 Na2O + H2O → 2NaOH CO2 + H2O → H2CO3
b) Những oxit tác dụng với HCl là CuO, Na2O,CaO CuO + 2HCl → CuCl2 + H2O Na2O + 2HCl → 2NaCl + H2O CaO + 2HCl → CaCl2 + H2O
c) Những oxit tác dụng với natri hiđroxit là SO2 và CO2 SO2 + 2NaOH → Na2SO3 + H2O CO2 + 2NaOH → Na2CO3 + H2O
Bài 2: (Trang 21 SGK Chương 1 – Hóa học lớp 9)
Những oxit nào dưới đây có thể điều chế bằng
a) Phản ứng hóa hợp? Viết phương trình hóa học
b) Phản ứng hóa hợp và phản ứng phân hủy? Viết phương trình hóa học.
(1) H2O; (2) CuO; (3) Na2O; (4) CO2; (5) P2O5
Hướng dẫn giải bài 2
Cả 5 oxit đã cho đều có thể điều chế bằng phản ứng hóa hợp, vì các nguyên
tố H, Cu, Na, P đều tác dụng được với oxi 2H2 + O2 o t 2H2O 2Cu + O2 o t 2CuO 4Na + O2 o t 2Na2O 4P + 5O2 o t 2P2O5 C + O2 o t CO2
b) Các oxit CuO, CO2 có thể được điều chế bằng phản ứng phân hủy Thí dụ: Cu(OH) o t 2 CuO + H2O CaCO3 o t CaO + CO2
Bài 3: (Trang 21 SGK Chương 1 – Hóa học lớp 9)
Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các
khí SO2 và CO2. Làm thế nào có thể loại bỏ được những tạp chất ra khỏi CO
bằng hóa chất rẻ tiền nhất?
Viết các phương trình hóa học
Hướng dẫn giải bài 3
Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ. Dung dịch bazơ rẻ tiền nhất
là dung dịch nước vôi trong Ca(OH)2. Dẫn hỗn hợp khí đi qua dung dịch
Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết xảy ra phản ứng hóa học sau: CO2 + Ca(OH)2 → CaCO3 + H2O SO2 + Ca(OH)2 → CaSO3 + H2O
Khí CO không phản ứng, thoát ra, ta thu được khí CO
Bài 4: (Trang 21 SGK Chương 1 – Hóa học lớp 9)
Cần phải điều chế một lượng muối đồng (II) sunfat. Phương pháp nào sau
đây tiết kiệm được axit sunfuric?
a) Axit sunfuric tác dụng với đồng (II) oxit
b) Axit sunfuric đặc tác dụng với kim loại đồng.
Giải thích các câu trả lời.
Hướng dẫn giải bài 4
Gọi số mol của H2SO4 ở cả 2 phản ứng có lượng như nhau là a mol
a) H2SO4 + CuO → CuSO4 + H2O a a
b) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2 a a/2
Nhìn vào tỉ lệ số mol ở 2 phương trình a) và b) ta nhận thấy khối lượng
đồng sunfat sinh ra ở phương trình a) sẽ nhiều hơn. Chính vì vậy sử dụng
phương pháp ở ý a sẽ tiết kiệm H2SO4.
Bài 5: (Trang 21 SGK Chương 1 – Hóa học lớp 9)
Hướng dẫn một số phản ứng hóa học (1) S + O2 o t SO2 (2) SO o t 2 + O2 SO3
(3) SO2 + NaOH (dd) → Na2SO3 + H2O (4) SO3 + H2O → H2SO4
(5) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O (6) SO2 + H2O → H2SO3
(7) H2SO3 + Na2CO3 → Na2SO3 + CO2 + H2O
(8) Na2SO3 + H2SO4 loãng → Na2SO4 + SO2 + H2O
(9) H2SO4 + 2NaOH → Na2SO4 + H2O
(10) Na2SO4 + BaCl2 → 2NaCl + BaSO4




