



Preview text:
Khoa học tự nhiên 8 Chân trời sáng tạo bài 6
Mở đầu trang 32 Khoa học tự nhiên 8: Khi sản xuất một lượng chất nào đó trong công
nghiệp, người ta có thể tính được lượng các chất cần dùng (nguyên liệu). Ngược lại, nếu
biết lượng chất tham gia, người ta có thể tính được lượng sản phẩm tạo thành. Làm thế
nào để tính được lượng chất đã tham gia hay sản phẩm tạo thành theo phương trình hóa học? Trả lời:
Để tính theo phương trình hoá học cần tiến hành theo các bước sau:
- Viết phương trình hoá học và xác định tỉ lệ số mol các chất trong phản ứng.
- Xác định số mol chất phản ứng hoặc chất tạo thành theo dữ kiện đề bài.
- Dựa vào phương trình hóa học và lượng chất đã biết tìm số mol chất còn lại.
- Chuyển đổi số mol chất thành khối lượng hoặc thể tích (đối với chất khí ở đkc) theo yêu cầu của đề bài.
1. Tính theo phương trình hóa học
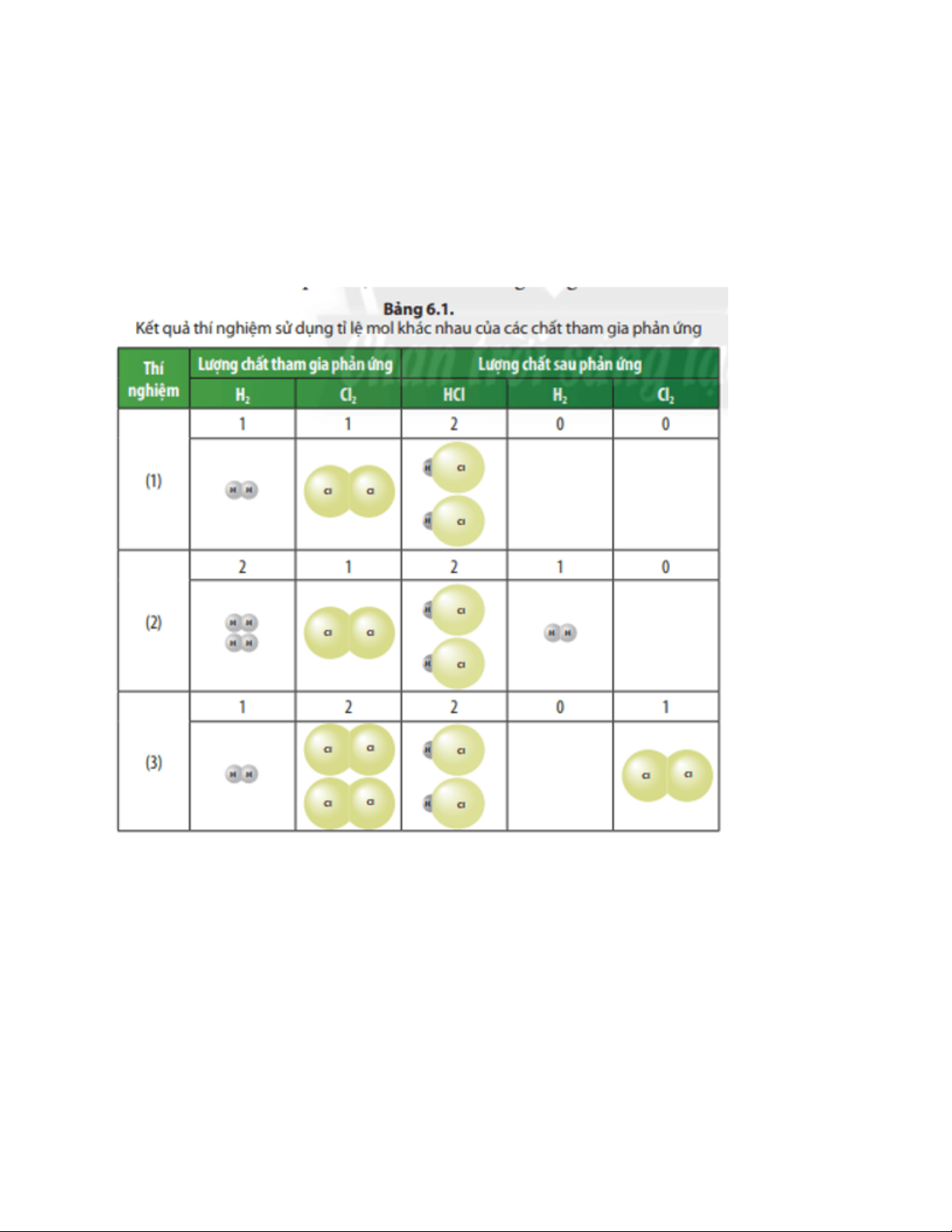
Câu hỏi thảo luận 1 trang 32 Khoa học tự nhiên 8: Các chất sau phản ứng trong các thí
nghiệm (1), (2) và (3) gồm những chất nào? Trả lời:
Chất sau phản ứng trong thí nghiệm (1) là: HCl;
Chất sau phản ứng trong thí nghiệm (2) là: HCl; H2.
Chất sau phản ứng trong thí nghiệm (3) là: HCl; Cl2.
Câu hỏi thảo luận 2 trang 32 Khoa học tự nhiên 8: Trong Thí nghiệm (2) và (3), chất
nào là chất thiếu và chất nào là chất dư? Trả lời:
Trong thí nghiệm (2): Cl2 thiếu, H2 dư;
Trong thí nghiệm (3): H2 thiếu; Cl2 dư.
Câu hỏi thảo luận 3 trang 32 Khoa học tự nhiên 8: Phản ứng nào xảy ra vừa đủ trong
các thí nghiệm (1), (2) và (3)? Trả lời:
Phản ứng trong thí nghiệm (1) xảy ra vừa đủ.
Câu hỏi thảo luận 4 trang 32 Khoa học tự nhiên 8: Sản phẩm tạo thành trong 3 thí
nghiệm (Bảng 6.1) là chất nào? Để xác định lượng sản phẩm tạo thành cần dựa vào lượng
chất thiếu hay chất dư? Trả lời:
Sản phẩm tạo thành trong 3 thí nghiệm là: HCl;
Để xác định lượng sản phẩm tạo thành cần dựa vào lượng chất thiếu.
Câu hỏi thảo luận 5 trang 33 Khoa học tự nhiên 8: Để tính được khối lượng vôi sống
sau khi nung ta thực hiện như thế nào? Trả lời:
Để tính được khối lượng vôi sống sau khi nung ta thực hiện theo các bước sau:
Bước 1: Viết phương trình hoá học và xác định tỉ lệ mol các chất trong phản ứng. CaCO3 → CaO + CO2 1 : 1 : 1
Bước 2: Tìm số mol CaCO3 phản ứng.
Bước 3: Dựa vào phương trình hoá học tìm số mol CaO tạo thành.
Theo phản ứng, tỉ lệ mol giữa các chất bằng nhau nên số mol các chất cũng bằng nhau: nCaO=nCaCO3=0,25 (mol).
Bước 4: Chuyển đổi số mol chất thành khối lượng:
mCaO = nCaO × MCaO = 0,25 × 56 = 14 (gam).
Câu hỏi thảo luận 6 trang 33 Khoa học tự nhiên 8: Hãy trình bày cách tính thể tích khí
chlorine đã tham gia phản ứng ở Ví dụ 2. Trả lời:
Cách tính thể tích khí chlorine:
Bước 1: Viết phương trình hoá học và xác định tỉ lệ các chất trong phản ứng. 2Al + 3Cl2 → 2AlCl3 2 : 3 : 2
Bước 2: Tìm số mol AlCl3 tạo thành sau phản ứng:
Bước 3: Dựa vào phương trình hoá học tìm số mol khí chlorine tham gia:
Theo tỉ lệ mol của phản ứng, ta có:
Bước 4: Chuyển đổi số mol chất thành thể tích:
Luyện tập trang 33 Khoa học tự nhiên 8: Đốt cháy hoàn toàn 6,2 gam phosphorus
trong khí oxygen. Hãy tính thể tích khí oxygen (đkc) và khối lượng sản phẩm tạo thành
theo phản ứng: 4P + 5O2 → 2P2O5. Trả lời:
Phương trình hoá học: 4P + 5O2 → 2P2O5
Tỉ lệ các chất: 4 : 5 : 2
Số mol phosphorus đã bị đốt cháy:
Theo tỉ lệ mol của phản ứng, ta có:
2. Hiệu suất phản ứng
Câu hỏi thảo luận 7 trang 34 Khoa học tự nhiên 8: Em có nhận xét gì về khối lượng
thực tế và khối lượng lí thuyết thu được của ammonia. Trả lời:
Khối lượng ammonia thực tế bằng ¼ khối lượng ammonia lý thuyết.
Câu hỏi thảo luận 8 trang 34 Khoa học tự nhiên 8: Để tính được hiệu suất phản ứng ta
cần biết những thông tin gì? Trả lời:
Để tính được hiệu suất phản ứng ta cần biết lượng sản phẩm thực tế và lượng sản phẩm lí
thuyết. Trong đó, lượng lí thuyết và lượng thực tế lấy cùng đơn vị đo.
Luyện tập trang 34 Khoa học tự nhiên 8: Cho 0,50 mol khí hydrogen tác dụng với 0,45
mol hơi iodine thu được 0,60 mol khí hydrogen iodide. Tính hiệu suất phản ứng. Trả lời:
Phương trình hoá học: H2 + I2 → 2HI
Tỉ lệ các chất: 1 : 1 : 2
Giả sử hiệu suất đạt 100% thì I2 hết, H2 dư, vậy lượng HI thu được theo lí thuyết tính
theo I2. Theo tỉ lệ mol của phản ứng, ta có:
nHI lý thuyết = 2×nI2=2×0,45=0,9(mol)
Hiệu suất của phản ứng là: Áp dụng:
Vận dụng trang 34 Khoa học tự nhiên 8: Ban đầu nhà sản xuất dự tính thu được 80 tấn
vôi sống CaO từ đá vôi (thành phần chính là CaCO3), tuy nhiên khối lượng thu được chỉ
đạt 25 tấn CaO. Phản ứng đã cho đạt hiệu suất là bao nhiêu? Trả lời:
Hiệu suất của phản ứng là: Áp dụng:




