




Preview text:
Giải Sách bài tập Hóa học 9 bài 19: Sắt
Bài 19.1 trang 23 Sách bài tập Hóa học 9: Muối Fe (III) được tạo thành khi
cho Fe tác dụng với dung dịch
A. HNO3 (loãng, dư); B. H2SO4 loãng; C. HCl; D. CuSO4 Lời giải: Đáp án A.
Bài 19.2 trang 23 Sách bài tập Hóa học 9: Cho các kim loại: Ni, Fe, Cu, Zn;
số kim loại tác dụng được với dung dịch Pb(NO3)2 là A. 1; B. 2; C. 3; D. 4. Lời giải: Đáp án C.
Bài 19.3 trang 24 Sách bài tập Hóa học 9: Dung dịch FeSO4 và dung dịch
CuSO4 đều tác dụng được với kim loại A. Ag; B. Fe; C. Cu; D. Zn. Lời giải: Đáp án D.
Bài 19.4 trang 24 Sách bài tập Hóa học 9: a) Tại sao những kim loại như sắt,
nhôm không có ở dạng đơn chất trong vỏ Trái Đất?
b) Hãy nêu phương pháp hoá học để nhận biết ba kim loại: sắt, nhôm và đồng.
Viết các phương trình hoá học. Lời giải:
a) Al, Fe là kim loại hoạt động hoá học mạnh nên chúng chỉ tồn tại dưới dạng hợp chất.
b) Dùng dung dịch kiềm (thí dụ NaOH):
- Cho 3 kim loại tác dụng với dung dịch NaOH, kim loại nào tác dụng với
NaOH cho khí H2 bay ra là Al.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Cho 2 kim loại còn lại tác dụng với dung dịch HCl, kim loại nào cho khí H2
bay ra là Fe, còn Cu không phản ứng. Fe + 2HCl → FeCl2 + H2
Bài 19.5 trang 24 Sách bài tập Hóa học 9: Ở Việt Nam có những loại quặng
sắt nào? Viết công thức hoá học và cho biết địa điểm của những loại quặng đó. Lời giải:
Ở Việt Nam có loại quặng hematit (Fe2O3) ở Trại Cau, tỉnh Thái Nguyên.. Vì
vậy, nước ta đã xây dựng khu công nghiệp gang - thép ở Thái Nguyên...
Bài 19.6 trang 24 Sách bài tập Hóa học 9: Viết các phương trình hoá học
thực hiện dãy chuyển đổi hoá học sau : Lời giải: (1) 2Fe + 3Cl2 to→ 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl (3) 2Fe(OH)3 → Fe2O3 + 3H2O
(4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O (5) Fe + 2HCl → FeCl2 + H2
(6) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
(7) Fe(OH)2 + H2SO4 → FeSO4 + 2H2O (8) FeSO4 + Zn → ZnSO4 + Fe
Bài 19.7 trang 24 Sách bài tập Hóa học 9: Có hỗn hợp bột kim loại gồm sắt
và đồng. Trình bày phương pháp tách riêng mỗi kim loại. Lời giải:
Cho hỗn hợp bột kim loại sắt và đồng vào dung dịch HCl, đồng không tác dụng.
Đem lọc hỗn hợp sau phản ứng, ta được đồng và dung dịch nước lọc.
Cu + HCl → không phản ứng. Fe + 2HCl → FeCl2 + H2.
Cho Zn vào dung dịch nước lọc, sau phản ứng thu được Fe: Zn + FeCl2 → ZnCl2 + Fe
Bài 19.8 trang 24 Sách bài tập Hóa học 9: Cho các kim loại sau: đồng, sắt,
nhôm, bạc. Cho biết các kim loại thoả mãn những trường hợp sau:
a) Không tan trong dung dịch axit clohiđric và dung dịch axit suníuric loãng.
b) Tác dụng được với dung dịch axit và dung dịch kiềm.
c) Đẩy được đồng ra khỏi dung dịch muối đồng. Lời giải:
Bài 19.8 trang 24 Sách bài tập Hóa học 9: Cho các kim loại sau: đồng, sắt,
nhôm, bạc. Cho biết các kim loại thoả mãn những trường hợp sau:
a) Không tan trong dung dịch axit clohiđric và dung dịch axit suníuric loãng.
b) Tác dụng được với dung dịch axit và dung dịch kiềm.
c) Đẩy được đồng ra khỏi dung dịch muối đồng. Lời giải:
a) Đồng, bạc không tan trong dung dịch HCl và dung dịch H2SO4 loãng.
b) Nhôm tan được trong dung dịch axit và dung dịch kiềm. 2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H20 → 2NaAlO2 + 3H2
c) Sắt và nhôm đẩy được đồng ra khỏi dung dịch muối đồng: Fe + CuSO4 → FeSO4 + Cu
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Bài 19.9 trang 24 Sách bài tập Hóa học 9: Cho 7,2 gam một oxit sắt tác dụng
với dung dịch axit HCl có dư. Sau phản ứng thu được 12,7 gam một muối khan.
Tim công thức oxit sắt đó. Lời giải:
FexOy + 2yHCl → xFeCl2y/x + yH20
Theo phương trình: (56x + 16y) gam cho (56x + 71y) gam muối
Theo đề bài: 7,2 gam cho 12,7 gam
Giải ra, ta có: x/y = 1/1. Công thức oxit sắt là FeO.
Bài 19.10 trang 24 Sách bài tập Hóa học 9: Hoà tan hoàn toàn 0,56 gam sắt
bằng dung dịch H2SO4 loãng 19,6% vừa đủ.
a) Viết phương trình hoá học
b) Tính khối lượng muối tạo thành và thể tích khí hiđro sinh ra (đktc).
c) Cần bao nhiêu gam dung dịch H2SO4 loãng nói trên để hoà tan sắt? Lời giải: nFe = 0,56/56 = 0,01 mol a) Fe + H2SO4 → FeSO4 + H2 = nFe = 0,01
b) Khối lượng muối FeSO4 tạo thành là: 0,01 x 152 = 1,52 (gam).
Thể tích khí hiđro sinh ra: 0,01 x 22,4 = 0,224 (lít).
c) Khối lượng H2SO4 cần dùng: 100 gam dd có 19,6 gam H2SO4 nguyên chất
Bài 19.11 trang 24 Sách bài tập Hóa học 9: Cho lá sắt có khối lượng 5,6 gam
vào dung dịch đồng sunfat. Sau một thời gian, nhấc lá sắt ra, rửa nhẹ, làm khô
và cân thấy khối lượng lá sắt là 6,4 gam. Khối lượng muối sắt được tạo thành là
A. 30,4 gam; B. 15,2 gam; C. 12,5 gam; D. 14,6 gam. Lời giải: Đáp án B. Fe + CuSO4 → FeSO4 + Cu
1 mol Fe sau phản ứng tạo 1 mol Cu khối lượng tăng lên 8g
0,1 mol Fe sau phản ứng tạo 0,1 mol Cu khối lượng tăng lên 0,8g = 0,1 x 152 = 15,2g
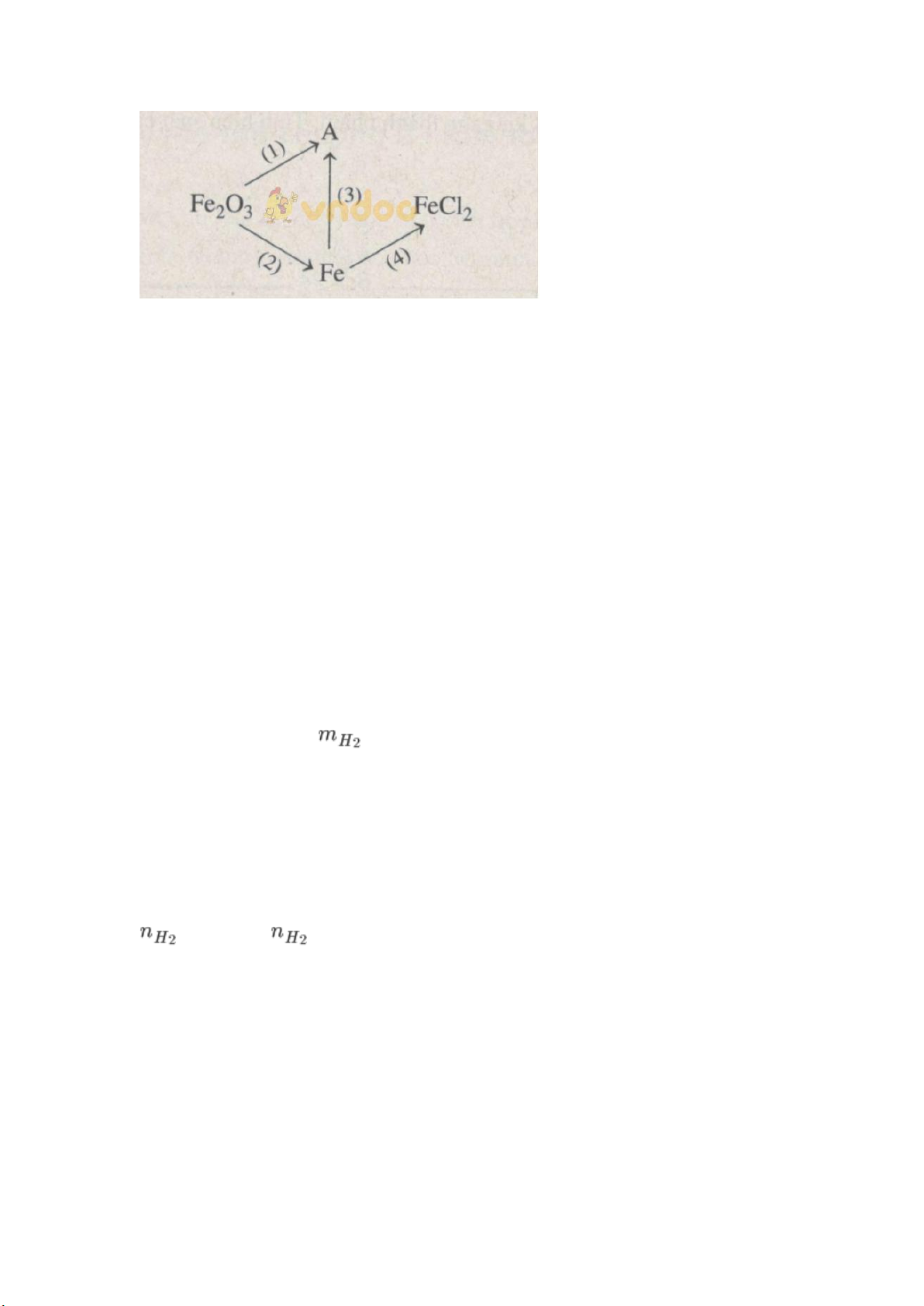
Bài 19.12 trang 25 Sách bài tập Hóa học 9: Hoàn thành sơ đồ phản ứng sau; Lời giải:
(1) Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2) Fe2O3 + H2 → 2Fe + 3H2O (3) 2Fe + 3Cl2 → 2FeCl3 (4) Fe + 2HCl → FeCl2 + H2
Bài 19.13 trang 25 Sách bài tập Hóa học 9: Cho m gam hỗn hợp Fe và Zn tác
dụng vừa hết với 1 lít dung dịch HCl 2,5M (D = 1,19 g/ml) thấy thoát ra một
chất khí và thu được 1200 gam dung dịch. Xác định giá trị của m. Lời giải: mdd HCl = 1000.1,19 = 1190 g
Áp dụng định luật bảo toàn khối lượng ta có: mhh + 1190 = 1200 +
Phương trình hóa học của phản ứng: Zn + 2HCl → ZnCl2 + H2 Fe + 2HCl → FeCl2 + H2
Qua phương trình hóa học trên, ta nhận thấy: = 1/2nHCl; = 2,5/2 = 1,25 mol
mhh = 1200 - 1190 +(1,25x2) = 12,5g
Bài 19.14 trang 25 Sách bài tập Hóa học 9: Cho hai mẩu Fe có khối lượng
bằng nhau. Cho một mẩu hoà tan hoàn toàn trong dung dịch HCl tạo 19,05 gam
muối. Cho mẩu còn lại tan hoàn toàn trong dung dịch H2SO4 loãng thì khối
lượng muối sunfat tạo ra là bao nhiêu? Lời giải:
Phương trình hóa học của phản ứng: Fe + 2HCl → FeCl2 + H2 Fe + H2SO4 → FeSO4 + H2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có: = 19,05/127 = 0,15 mol = nFe = 0,15 x 152 = 22,8g



