















Preview text:
BÀI 4: CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ
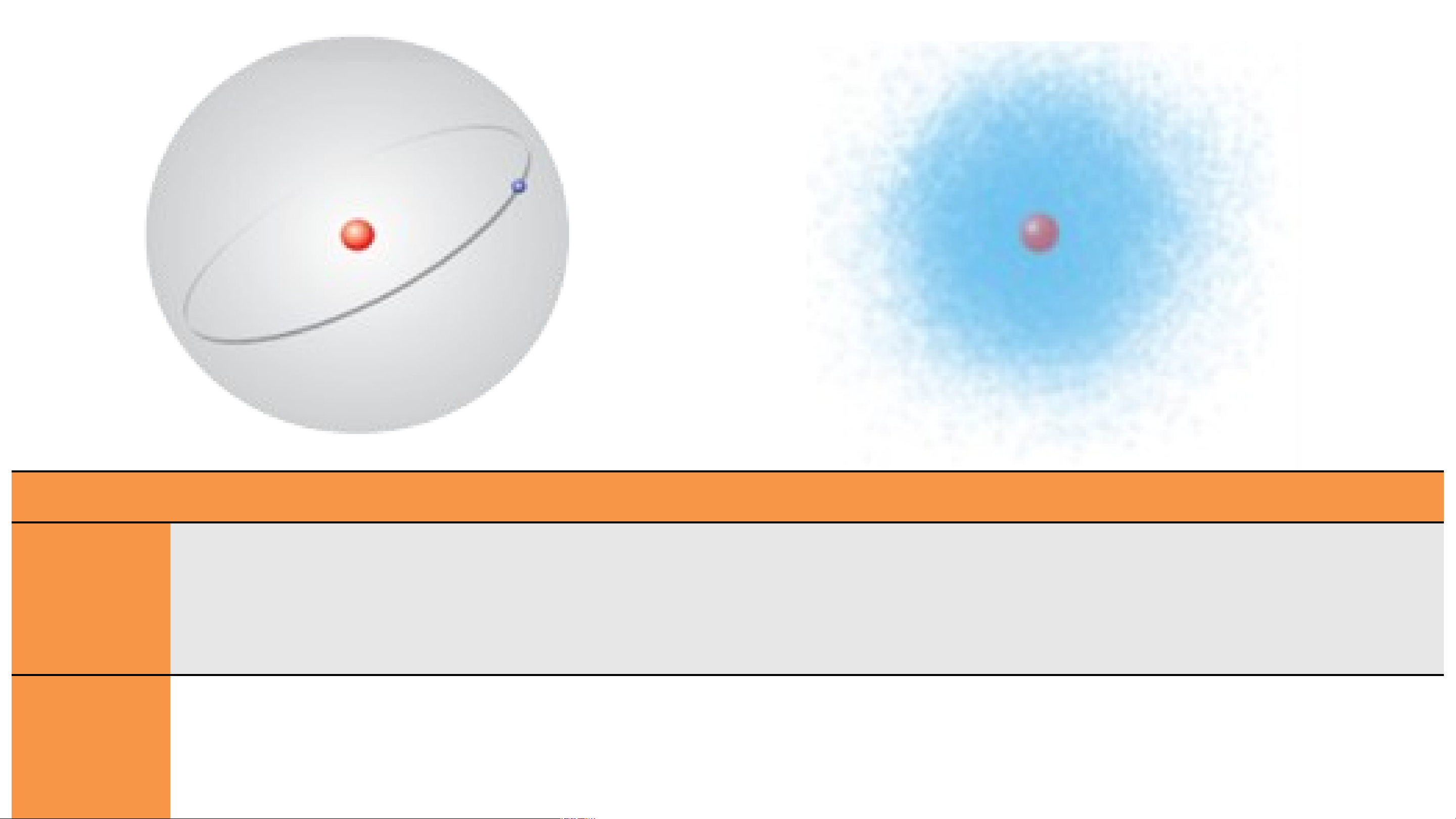
Nếu xem một nguyên tử như hệ mặt trời và các hành tinh chuyển động xung quanh
mặt trời là các electron và mặt trời là hạt nhân có được không?
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
Hình nào thể hiện mô hình hành tinh nguyên tử?
Hình nào thể hiện mô hình hiện đại của nguyên tử?
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
Hình 4.1. Mô hình nguyên tử theo Rutherford Hình 4.2. Mô hình nguyên tử hiện đại Mô hình Nội dung Điểm g – Bohr iống nhau: - Chưa tìm ra hạt neutron. Rutherfo N - Cá guyê c electro n tử n q guay xung q ồm h uanh hạt n ạt nhhân t
ânheo từng quỹ đạo tròn ổ mang điệnn định, tro tích n g đó mỗi rd - So sánh
Bohr quỹ đạ điểm g
o có một mức năng iống v
lượng xác đị à khác nh nh. au giữa mô
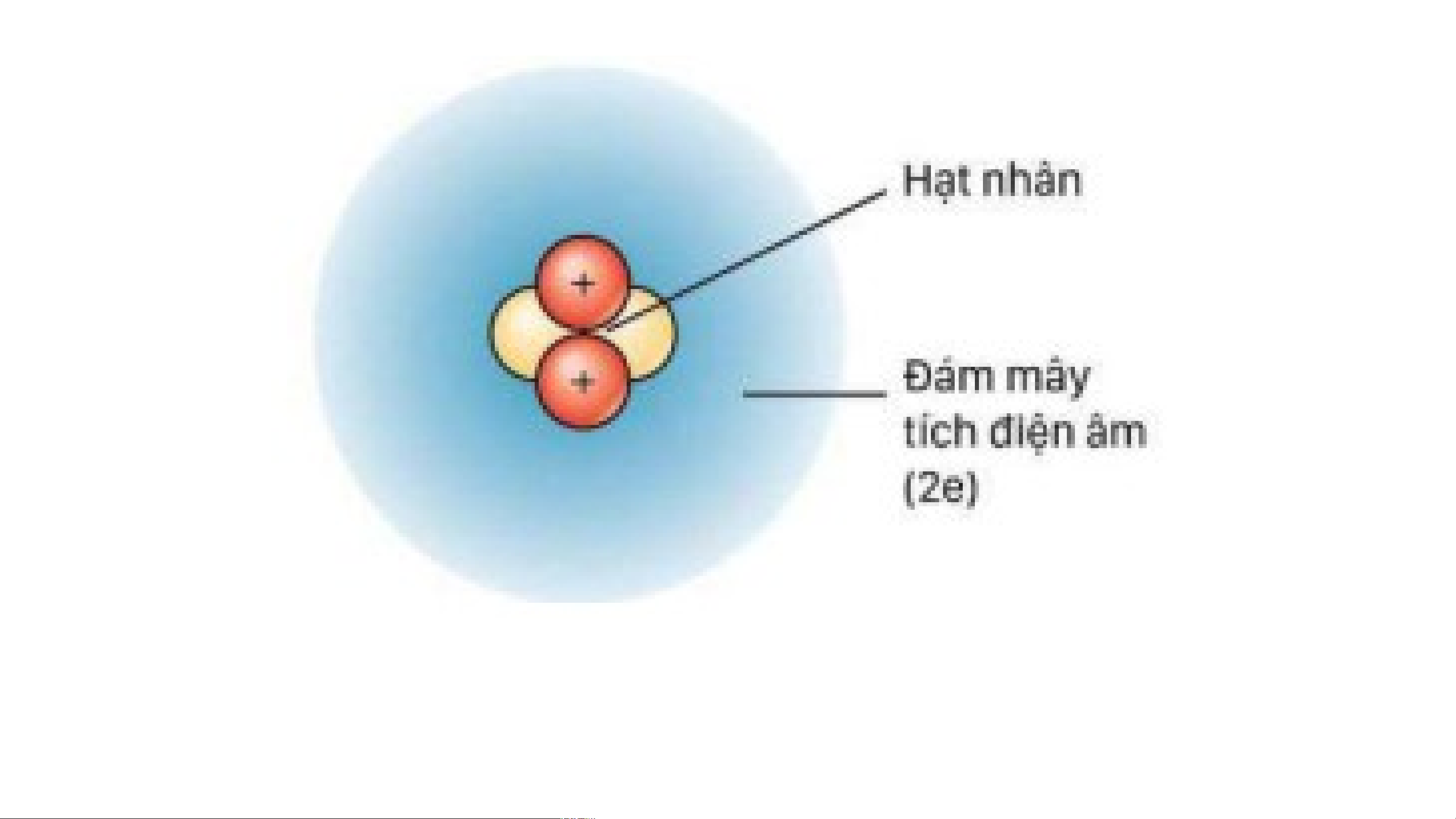
dương và vỏ nguyên tử chứa electron mang
Hiện đại - Đã tìm ra hạt neutron. điện tích âm. (Đám
hình hiện đại với mô hình nguyên tử
- Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một mây
Electron chuyển động xung quanh hạt nhân.
quỹ đạo xác định và tạo thành một đám mây electron mang điện tích âm. electron) Rutherford - Bohr.
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ Xác suất t Xá ìm t c suấ hấy ele t tìm ctr th on ấ trong y ele toàn ctr phần on tro không ng
gian bên ngoài đám mây khoảng bao nhiêu phần
đám mây electron là khoảng 90%. trăm?
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG Giống NGUYÊNnha TỬ u: Là khu vực Phân biệt khái niệm không gian xung quanh hạt đám mâ nhân c y e hứa el l e ec ctr tron on và nguyên tử.orbi tal nguyên tử. Khác nhau: Orbital là khu vực không gian xung quanh
hạt nhân mà tại đó xác
suất có mặt (xác suất tìm thấy) electron khoảng 90%.
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
Quan sát hình trên và cho biết các quả tảo chín rơi xuống
Quả táo sẽ rơi nhiều ở khu vực gần gốc
tập trung ở khu vực nào? Kh c u â v y ực
. nào ở gốc cây sẽ không tìm thấy các quả táo rơi xuống?
Khu vực không thấy trái táo chín rơi là xa cây.
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ
Giống nhau: Đều có hình số 8 nổi. Tìm điểm giố Khác nhau: Các ng và orbital k địnhác nhau h hướng khác nhau trong không gian.
giữa các orbital p (p , p , p ). x y z
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN TỬ Một số dạng AO d
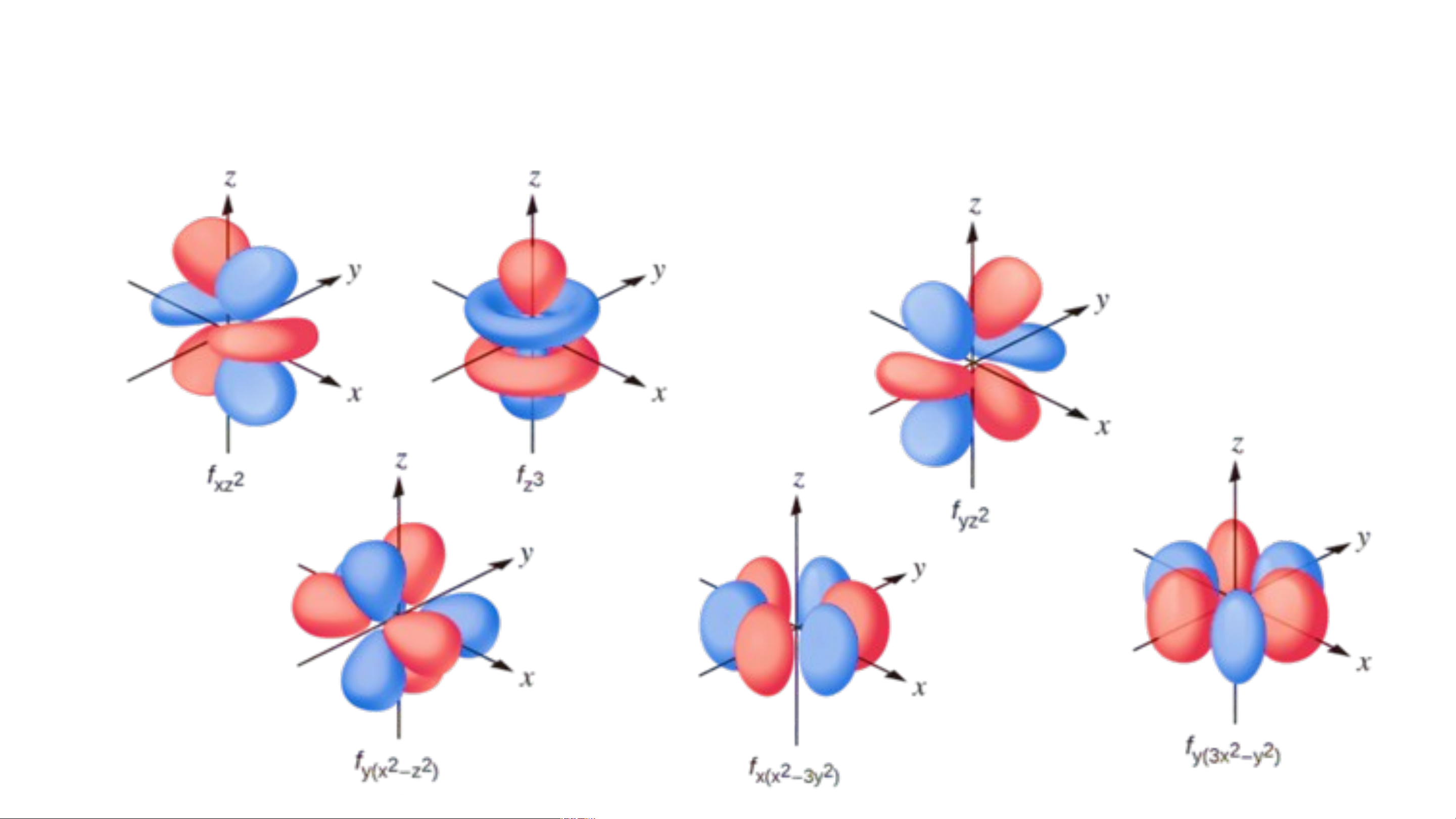
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG NGUYÊN T M Ử ột số dạng AO f.
I. SỰ CHUYỂN ĐỘNG CỦA CÁC ELECTRON TRONG - Theo NGU mô YÊN hì T nh Ử
nguyên tử của Rutherford - Bohr, các electron
chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
- Theo mô hình hiện đại, trong nguyên tử, các electron chuyển
động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác
định, tạo thành đám mây electron.
- Orbital nguyên tử (kí hiệu: AO) là khu vực không gian xung quanh
hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó
là lớn nhất (khoảng 90%).
- Một số AO thường gặp: s, p, d, f; và chúng có hình dạng khác nhau.
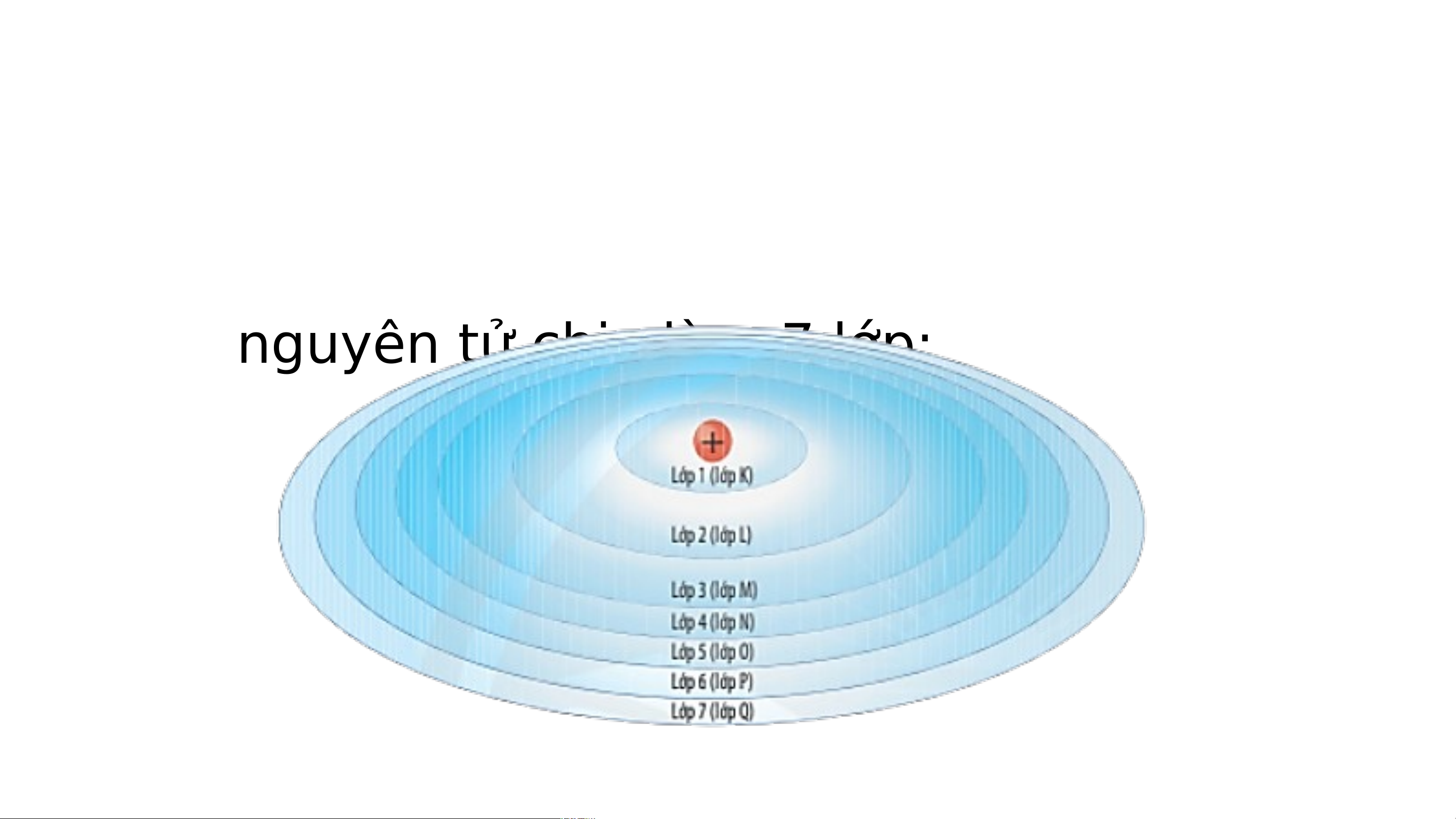
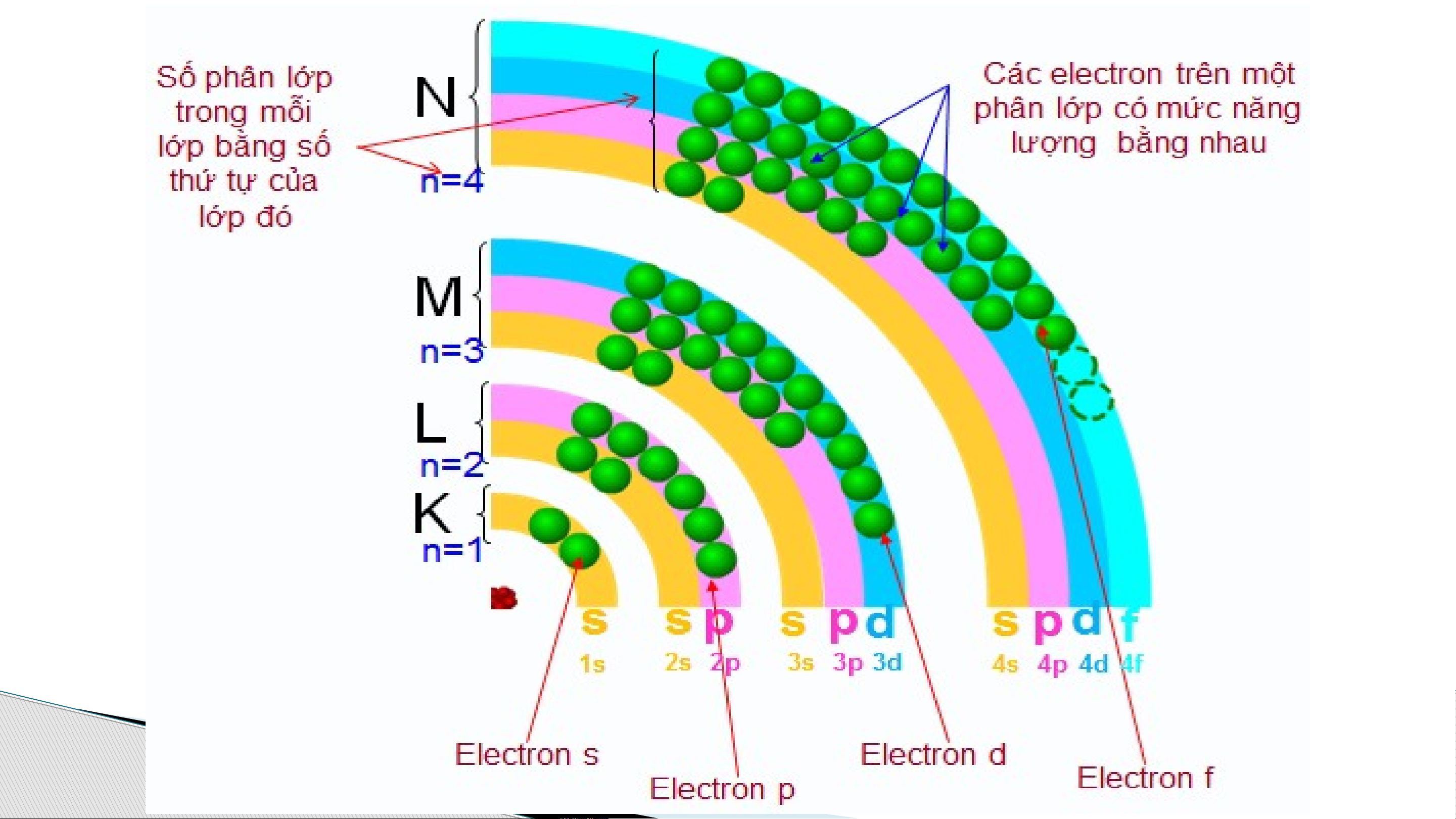
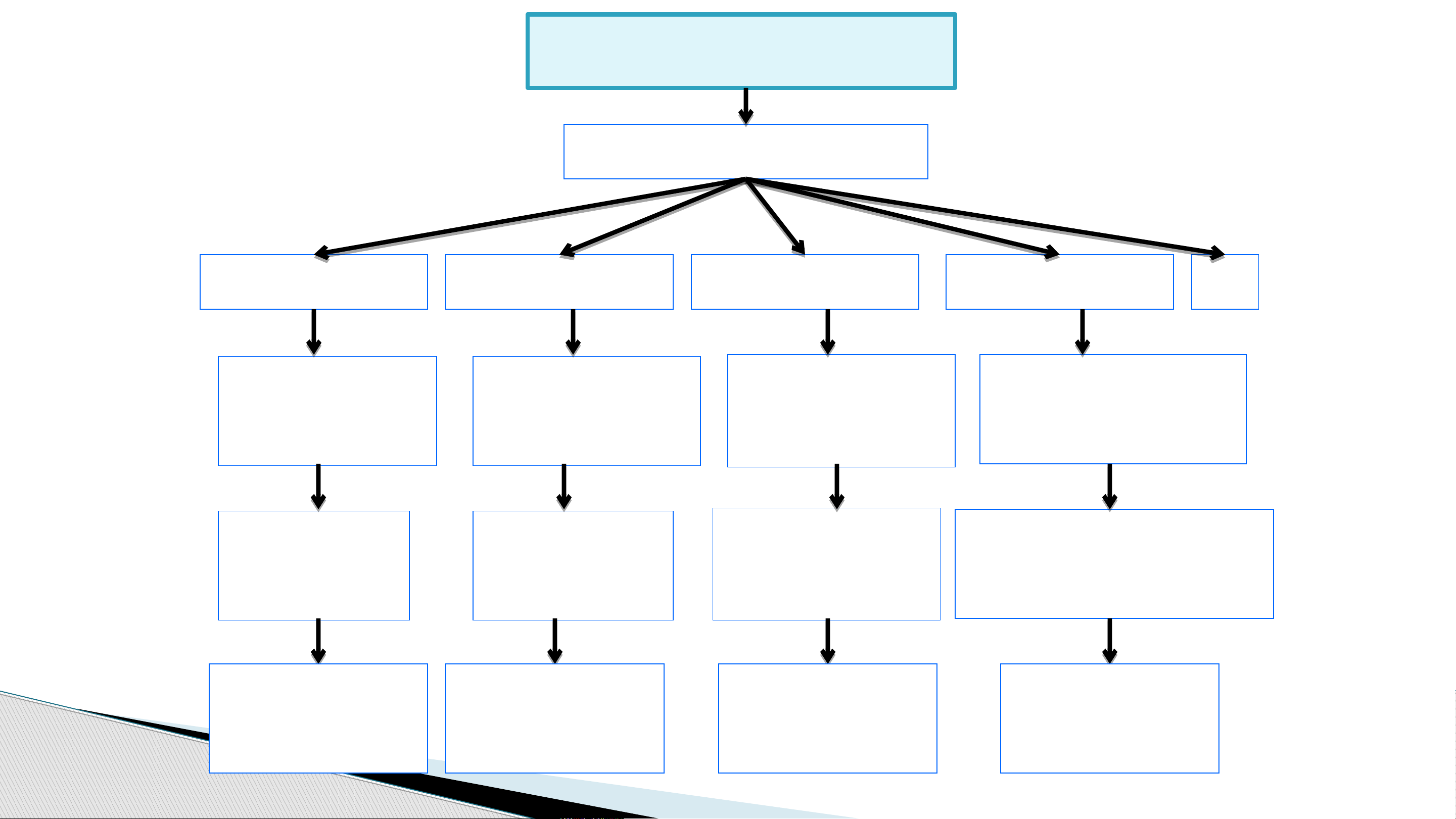
II. LỚP ELECTRON VÀ PHÂN LỚP ELECTRON
Trong nguyên tử, các electron được sắp xếp thành từng
lớp và phân lớp theo năng lượng từ thấp đến cao.
- Lớp electron là tập hợp các e có mức năng lượng gần bằng nhau.
- Vỏ nguyên tử chia làm 7 lớp:
II. LỚP VÀ PHÂN LỚP ELECTRON
- Mỗi lớp chia thành nhiều phân lớp.
- Các electron trên cùng 1 phân lớp có mức năng lượng bằng nhau
- Kí hiệu phân lớp: s – p – d – f Lớp K Lớp L Lớp M Lớp N (n=1) (n=2) (n =3) (n=4) Số phân lớp 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
II. LỚP VÀ PHÂN LỚP ELECTRON
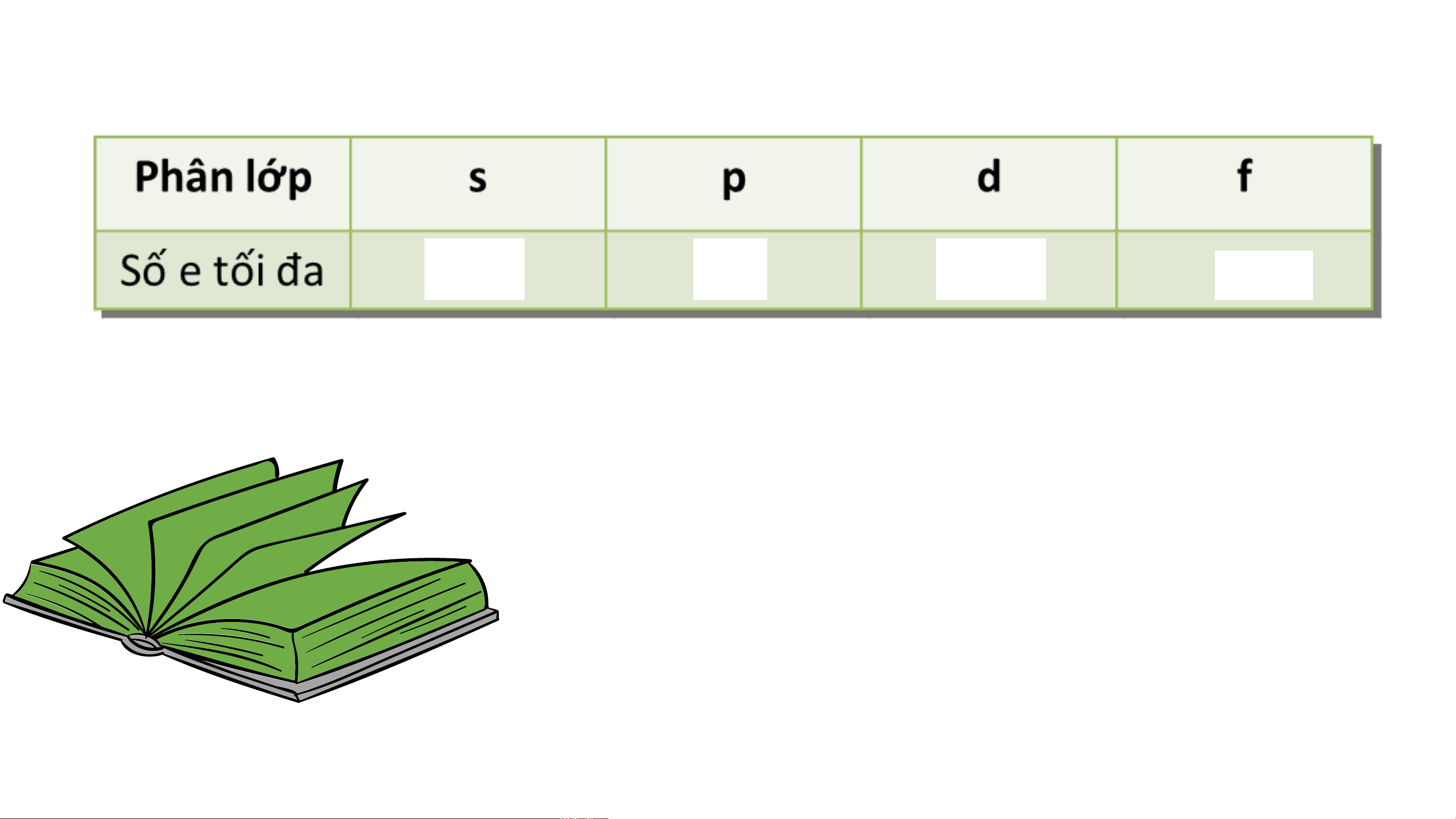
II. LỚP VÀ PHÂN LỚP ELECTRON K L M Lớp n=1 n=2 n=3 Phân lớp 1s 2s 2p 3s 3p 3d
Số e tối đa trong phân lớp 2 2 6 2 6 10
Số e tối đa trong lớp 2 8 18
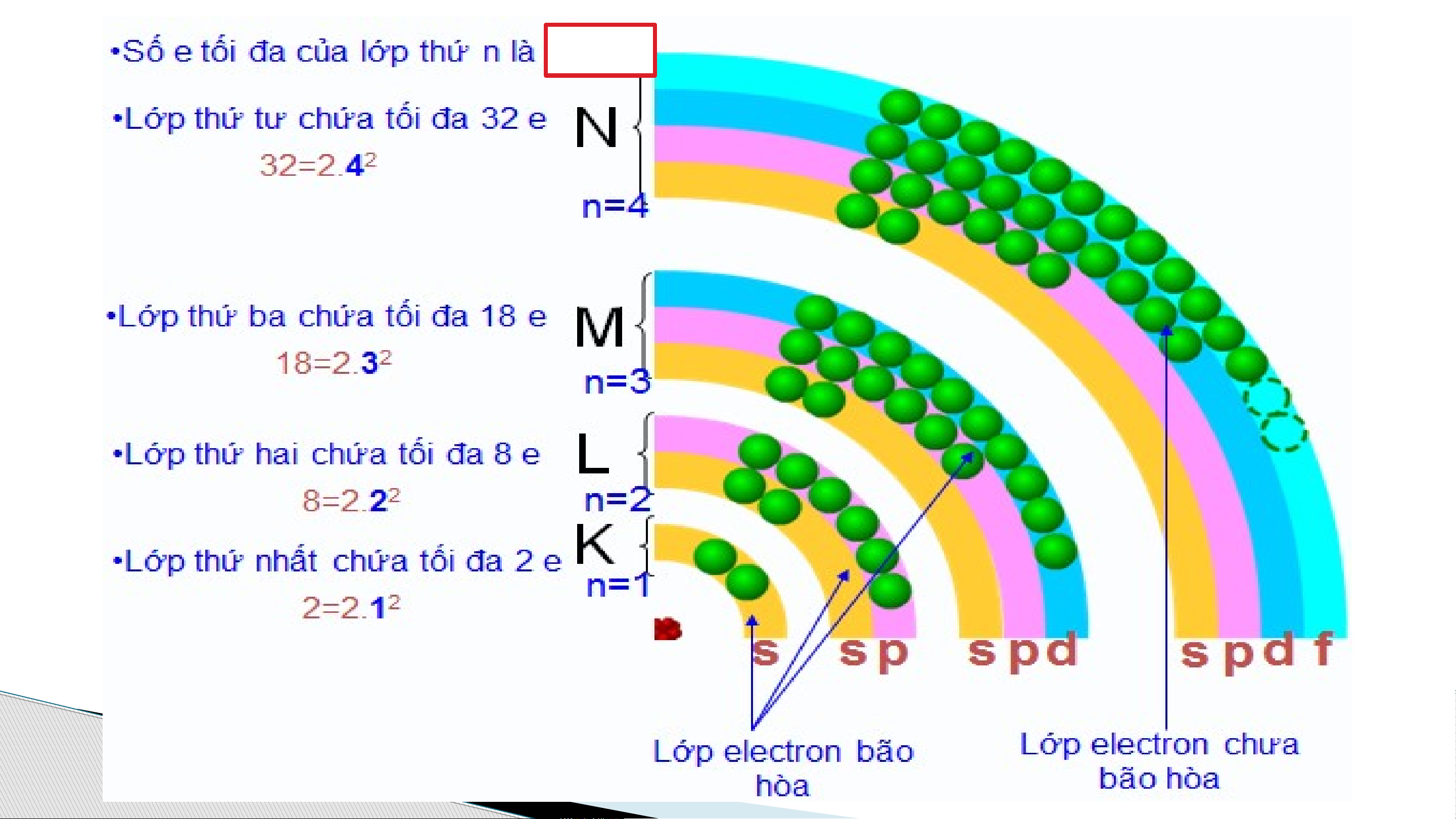
Số e tối đa lớp n: 2n2 → lớp thứ 4: 2.42 = 32 e tối Lớ đa
p e đủ số e tối đa gọi là lớp e bão hòa. 2n2
Cấu trúc vỏ nguyên tử Lớp electron (n) Lớp 1 (K) Lớp 2(L) Lớp 3 (M) Lớp 4(N) … 1 Phân lớp 2 Phân lớp 3 Phân lớp 4 Phân lớp 1s 2s,2p 3s,3p,3d 4s,4p,4d,4f 1s2 2s2,2p6 3s2,3p6,3d10 4s2, 4p6, 4d10, 4f14 2e 8e 18e 2n2
1. Nguyên lí vững bền II - I. N Tro G n UY g nÊN gu LÍ yê V n À Q tử, UY cá c TẮ el C B ectr IỂU on DI tr ỄN ên ELECTRON VÀO Ô ORBI mỗi T A A O L .
có một mức năng lượng xác
định. Người ta gọi mức năng lượng
này là mức năng lượng AO nguyên tử.
- Nguyên lí vững bền: Ở trạng thái
cơ bản, các electron trong nguyên tử
chiếm lần lượt những orbital có mức
năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 4p 5s 4d 5p …
- Các electron trên các AO khác nhau
của cùng một phân lớp có năng lượng như nhau.
Ví dụ: Phân lớp 3p có 3 AO 3p , 3p , x y
3p ; các electron của các AO p trong z
phân lớp này tuy có sự định hướng
trong không gian khác nhau nhưng
chúng có cùng mức năng lượng AO. 2. Nguyên lí Pauli
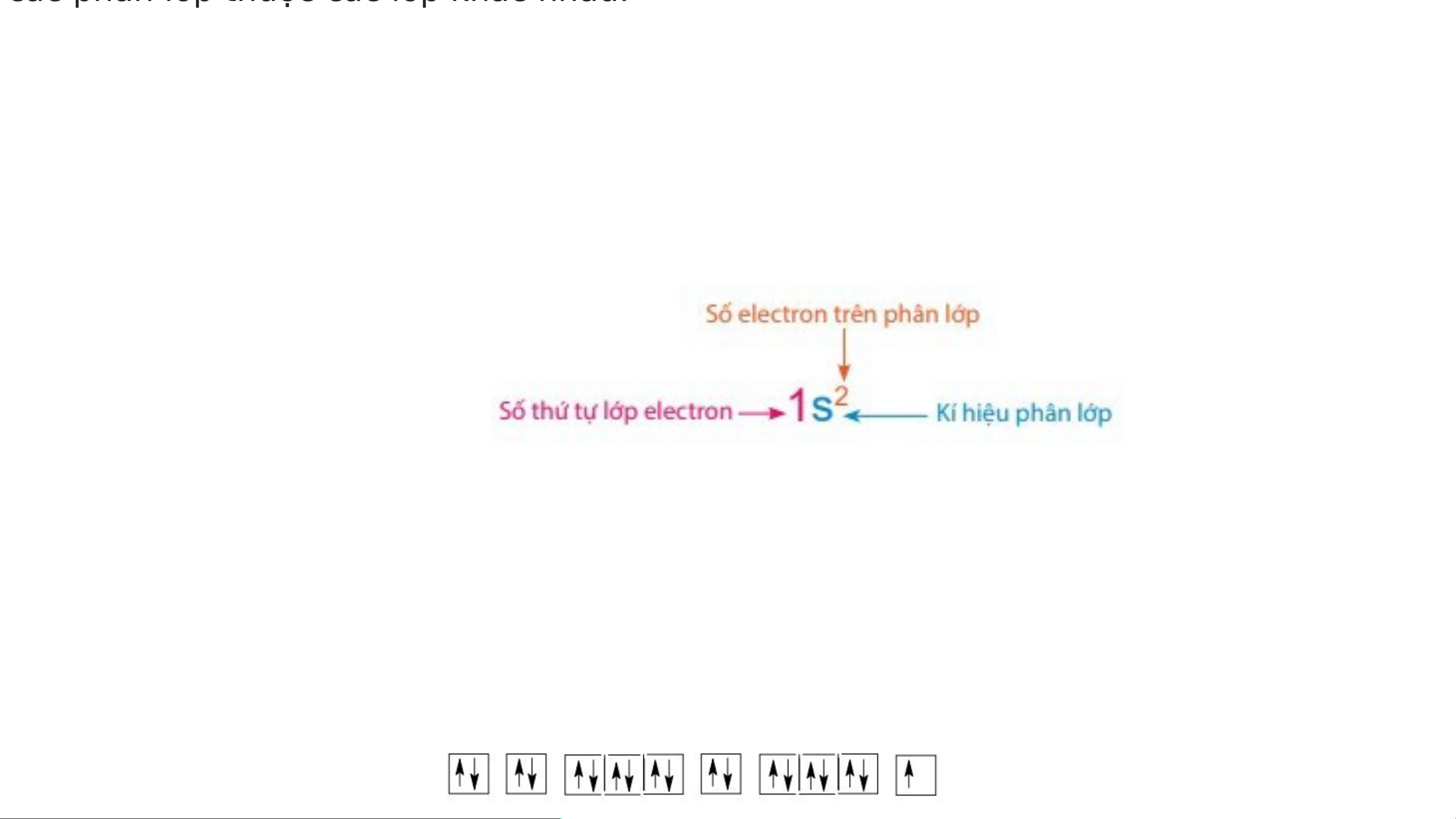
- Để biểu diễn orbital nguyên tử, người ta
sử dụng các ô vuông, gọi là ô lượng tử. Mỗi
ô lượng tử ứng với một AO. Mỗi AO chứa tối đa 2 electron.
+ Nếu trong AO chỉ chứa 1 electron thì
electron đó gọi là electron độc thân (kí
hiệu bởi 1 mũi tên hướng lên ↑).
+ Nếu AO chứa đủ 2 electron thì các
electron đó gọi là electron ghép đôi (kí
hiệu bởi hai mũi tên ngược chiều nhau ↑↓).
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối
đa 2 electron và có chiều tự quay ngược nhau.
- Dựa vào nguyên lí Pauli, ta dễ dàng xác
định được số AO và số electron tối đa trong mỗi lớp và phân lớp:
+ Số AO tối đa trong lớp n là n2 (n ≤ 4).
+ Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
Ví dụ: Số AO tối đa trong lớp thứ 2 là 22 = 4
Số electron tối đa trong lớp thứ 2 là 2.22 = 8 electron. 3. Quy tắc Hund
- Các phân lớp: s2; p6; d10; f14 chứa đủ số electron tối đa gọi là phân lớp bão hòa.
- Các phân lớp: s1; p3; d5; f7 chứa một nửa số electron tối đa gọi
là phân lớp nửa(bán) bão hòa.
- Các phân lớp chưa đủ số electron tối đa gọi là phân lớp chưa bão hòa.
- Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron
sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
4. Cách viết cấu hình electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trong vỏ nguyên tử trên
các phân lớp thuộc các lớp khác nhau.
- Cấu hình electron nguyên tử phải được viết theo thứ tự các lớp electron và phân
lớp trong mỗi lớp. Trong đó:
+ Số thứ tự lớp electron được viết bằng các số tự nhiên (n = 1, 2, 3, …)
+ Phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f.
+ Số electron của từng phân lớp được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp.
- Quy ước cách biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp như sau:
- Cách viết cấu hình electron:
+ Bước 1: Xác định số electron của nguyên tử.
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng
dần, theo các nguyên lí và quy tắc phân bố electron trong nguyên tử.
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ
tự của các lớp electron. Ví dụ:
K (Z = 19): Thứ tự mức năng lượng orbital: 1s22s22p63s23p64s1.
Cấu hình electron: 1s22s22p63s23p64s1 hoặc viết gọn là: [Ar]4s1.
[Ar] là kí hiệu cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước K.
Cấu hình electron theo orbital:
5. Đặc điểm electron lớp ngoài cùng của nguyên tử
- Dựa vào số lượng electron lớp ngoài cùng của nguyên tử nguyên tố, có thể
dự đoán một nguyên tố là kim loại, phi kim hay khí hiếm.
+ Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của
nguyên tố kim loại (trừ H, He, B).
+ Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim.
+ Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của
nguyên tố kim loại hoặc phi kim.
+ Các nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố
khí hiếm (trừ He có 2 electron ở lớp ngoài cùng). Z Kí hiệu Cấu hình hóa học electron Z Kí hiệu Cấu hình electron hóa học 1 H 1s1 11 Na 1s2 2s2 2p6 3s1 2 He 1s2 12 Mg 1s2 2s2 2p6 3s2 3 Li 1s2 2s1 13 Al 1s22s22p63s23p1 4 Be 1s2 2s2 14 Si 1s22s22p63s23p2 5 B 1s2 2s2 2p1 15 P 1s22s22p63s23p3 6 C 1s2 2s2 2p2 16 S 1s22s22p63s23p4 7 N 1s2 2s2 2p3 17 Cl 1s22s22p63s23p5 8 O 1s2 2s2 2p4 18 Ar 1s22s22p63s23p6 9 F 1s2 2s2 2p5 19 K 1s22s22p63s23p64s1 10 Ne 1s2 2s2 2p6 20 Ca 1s22s22p63s23p64s2 LUYỆN
Bài 1: Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phâ TẬP
n lớp s và 1 phân lớp p.
Các phân lớp s đều chứa số electron tố đa, còn phân lớp p chỉ chứa một nửa số electron
tối đa. Nguyên tử nitrogen có bao nhiêu electron. Hướng dẫn giải
Số electron tối đa trong phân lớp p là 6.
Phân lớp 2p chỉ chứa một nửa số electron tối đa 2p ⇒ 3
Nguyên tử nitrogen có 2 lớp electron trong đó có 2 phân lớp s và 1 phân lớp p
⇒ Cấu hình electron của nguyên tử nitrogen là: 1s22s22p3
Nguyên tử nitrogen có 7 electron.
Bài 2: Cho nguyên tố X có 2 lớp eletron,
lớp thứ 2 có 6 electron. Xác định số hiệu nguyên tử của X. Hướng dẫn giải
Ta xác định được nguyên tử nguyên tố X lớp thứ nhất có 2
electron, lớp thứ hai có 6 electron nên số electron của
nguyên tử của X là 2 + 6 = 8 electron = 8 proton.
Do đó số hiệu nguyên tử của X là 8.
Bài 3: Viết cấu hình electron nguyên tử của các nguyên tố: carbon (Z = 6), sodium
(Z = 11) và oxygen (Z = 8). Cho biết số electron lớp ngoài cùng trong nguyên tử
các các nguyên tố trên. Chúng là kim loại, phi kim hay khí hiếm? Hướng dẫn giải
Carbon (Z = 6): 1s22s22p2
Từ cấu hình electron Nguyên t ⇒
ử carbon có 4 electron lớp ngoài cùng Là ⇒ phi kim.
Sodium (Z = 11): 1s22s22p63s1
Từ cấu hình electron Nguyên t ⇒
ử sodium có 1 electron lớp ngoài cùng ⇒ Là kim loại.
Oxygen (Z = 8): 1s22s22p4
Từ cấu hình electron Nguyên t ⇒
ử oxygen có 6 electron lớp ngoài cùng ⇒ Là phi kim.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27




